零模波导原理、制备及其在单分子荧光检测中的应用
魏清泉, 李运涛, 任鲁风, 周晓光, 俞育德
1.中国科学院半导体研究所, 集成光电子学国家联合重点实验室, 北京 100083;2.中国科学院北京基因组研究所, DNA序列测定技术研究开发中心, 北京 100029;3.中国科学院半导体研究所/中国科学院北京基因组研究所-生物信息获取与传感技术联合实验室, 北京 100083
零模波导原理、制备及其在单分子荧光检测中的应用
魏清泉1,3, 李运涛1,3, 任鲁风2,3, 周晓光1,3, 俞育德1,3
1.中国科学院半导体研究所, 集成光电子学国家联合重点实验室, 北京 100083;2.中国科学院北京基因组研究所, DNA序列测定技术研究开发中心, 北京 100029;3.中国科学院半导体研究所/中国科学院北京基因组研究所-生物信息获取与传感技术联合实验室, 北京 100083
单分子荧光检测作为一种能够表征分子个体性质及行为的分析方法,有助于揭示利用传统荧光检测方法无法得到的信息,在近年来受到人们的广泛关注。利用传统光学检测设备进行单分子荧光检测时,由于受到衍射极限的限制,同时为了保证在观测体积内只有单个荧光分子,仅能采用无限稀释溶液的方法实现单分子荧光检测。虽然这种方法可以满足单分子检测的要求,但是由于大部分酶分子正常工作时底物的生理浓度都非常高,底物浓度的大幅度降低会对酶分子的反应机制等方面造成影响。零模波导作为一种新型的单分子检测器件,通过纳米微孔结构突破了光学衍射极限的限制将观测体积降至仄升量级(10-21L),使得在生理浓度范围内检测单分子荧光成为可能,在单分子荧光检测领域得到了广泛应用。因此,就零模波导的原理、制备工艺及其在单分子DNA测序、生物膜、生物大分子之间的相互作用及单分子反应动力学方面的具体应用进行综述。
零模波导;单分子;纳米微结构器件
20世纪90年代以来,物理学家们发明了许多新型的观测和操控技术,例如单分子荧光、光镊、磁镊等,将分子生物学与物理学的交叉领域推进到了单分子水平。单分子分析技术在分子生物学领域的应用可以揭示掩盖在集群研究方法平均效应中的个体行为,因此在单分子水平研究分子间相互作用、单分子酶动力学,并揭示细胞信号传导的分子机制等具有重要意义[1~3]。
在传统的单分子荧光研究中,普通的光学设备都受到光学衍射极限的限制,观测体积大约为飞升(10-15L)量级,为了在观测体积内只有一个荧光分子,需要将溶液稀释到纳摩尔至皮摩尔每升量级的浓度[4]。但是在生物体系中,大多数酶在正常工作时配体浓度都远远高于普通衍射极限光学设备能够检测的范围,一般在微摩尔至毫摩尔每升量级[5]。当配体的浓度低于正常浓度范围时,酶的动力学机制及其催化反应过程可能受到影响[6]。因此,为了保证在正常浓度的生物环境中观测单个分子,光学观测体积至少要减小3~6个数量级。同时,观测体积的减小可以有效缩短分子在观测体积内的扩散时间,对于改善单分子检测时的时间分辨率具有积极作用[7]。
鉴于减小光学检测设备观测体积的重要性,人们积极开发新的检测技术和方法,并取得了很好的成果,例如,全内反射荧光显微镜(total internal reflection fluorescence microscopy,TIRFM)通过入射光全反射后在介质表面产生消逝波的特性将观测体积减小10倍左右[8]。虽然TIRFM对总的观测体积减小的不是很多,但是由于消逝波的存在将有效观测范围仅限制在观测界面约200 nm以下范围,大大降低了背景光噪声干扰,由于其便于与其他技术联用进一步提高检测灵敏度,在单分子检测领域得到了广泛应用[9~11];近场光学扫描显微镜(near-field scanning optical microscope, NSOM)利用光通过变芯径光纤末端的纳米孔将观测体积限制在横向距离50 nm左右,观测体积大约为一个阿升(10-18升),早在20世纪90年代初,就有人利用其在支持物表面上实现了单分子检测[12,13];近些年,利用纳米通道(nanochannels)限制光学观测体积实现单分子检测的方法被大量报道[14~17],该方法主要是利用微小通道的深度限制了观测体积的深度,照射在通道上的光斑形状限制了观测面积,从而形成了三维观测体积,据报道纳米通道的高度最低可达到5 nm[18,19],因此观测体积非常小,但是这种方法的不足之处是器件制备工艺复杂,价格昂贵,较难实现高通量检测。
零模波导(zero-mode waveguides,ZMWs)作为一种新型的单分子检测器件,在减小光学设备的观测体积及提高检测通量方面均有极好的效果,并在近些年被人们逐渐用于生物体系的研究当中。本文就ZMWs原理、加工技术及其在单分子检测中的应用进行总结和分析。
1 ZMWs原理
早在1944年,Bethe[20]发表了关于光在微孔中衍射理论的文章,并发现当微孔的直径小于光的波长时,光强会急剧衰减,这一独特的光学现象奠定了ZMWs的理论基础。2003年,Levene等[7]采用ZMWs技术在高浓度溶液中成功检测了单分子,开创了ZMWs应用雏形。ZMWs结构主要是由石英玻璃衬底及表面带有纳米级别直径通孔的金属层构成,大量的微孔可以同时制备在同一个芯片上有效地提高ZMWs的检测通量,如图1所示。入射光从石英玻璃衬底开始照射,由于ZMWs存在一个截止波长λc,大于该波长的光不能在波导中传输,而是在微孔入口处产生消逝波。截止波长与ZMWs结构的形状及尺寸相关,对于给定的圆孔波导结构(孔直径为 d),截止波长可以通过关系式λc=1.7d计算得到。消逝波的能量l(z)随着消逝波的传输深度(z)呈现指数衰减形式,如公式1所示[7, 21]:
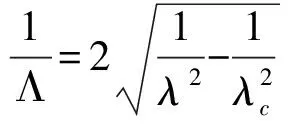
(1)
其中,Λ为衰减指数,λ是入射光波长。
在入射光波长大于λ时,微孔中没有光传输模式,因此将这种波导模式称为“零模波导”(ZMWs)。由于入射光的光斑远大于纳米微孔直径,可以近似将入射光在微孔上的照射轮廓视为恒定不变,并且在微孔中轴线方向呈现指数衰减形式。如果将耦合效率及荧光基团的发光效率视为与入射光在在微孔上的照射轮廓相关,则在ZMWs结构中的观测轮廓可以由公式2计算得到,有效观测体积可由公式3得到[7,22,23]。
S(z)=e-z/l=e-3z/Λ
(2)
(3)
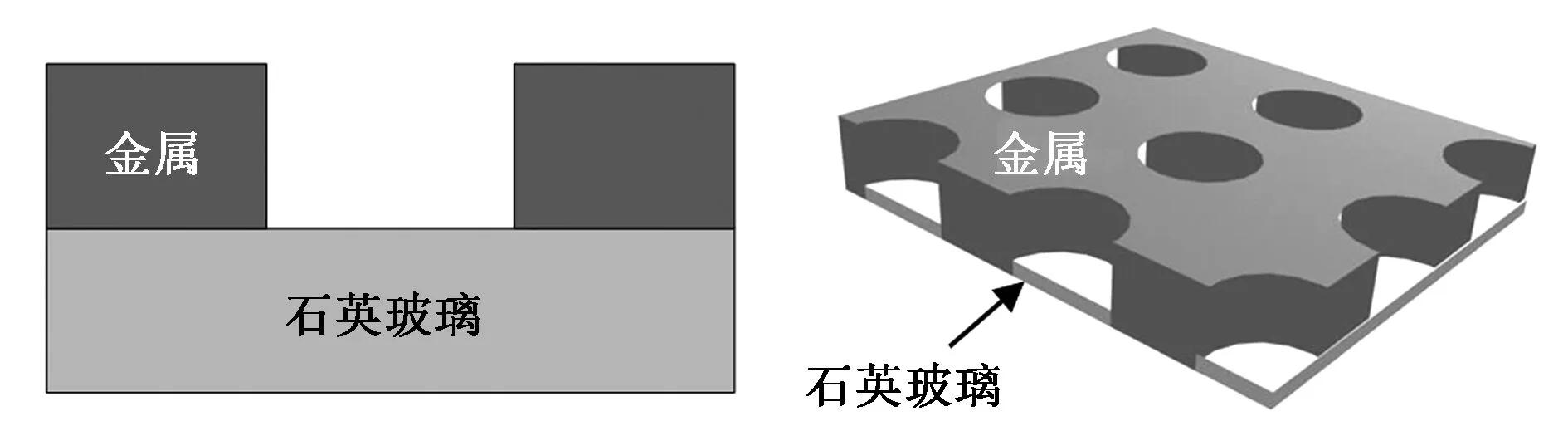
图1 ZMWs二维及三维结构示意图Fig.1 Dimensional and three-dimensional structure schematic diagrams of ZMWs.
在单分子检测过程中,将单个目标分子通过一定的方式固定在ZMWs微孔底床,然后在含有荧光标记的目标分子配体溶液中进行检测,入射光从石英玻璃的底部照射,并从同一侧观测发射荧光,如图2所示。在荧光信号检测过程中,由于ZMWs的尺寸非常小,大约在100 nm以内,同时由于消逝波在微孔中的传播深度有限,限制了有效观测体积,减小了在观测体积中游离荧光标记配体的数目,从而更加容易区分目标荧光信号与背景噪声。以直径为100 nm的圆形微孔型ZMWs为例,用波长为488 nm的入射光照射,有效观测体积约为125仄升(125×10-21L),相当于浓度为10 μmol/L的溶液中单个分子占据的体积,因此ZMWs能够在生理环境相关浓度溶液中观测单个分子。

图2 ZMWs单分子检测装置示意图Fig.2 Schematic diagram of ZMWs single molecule detection device.
2 ZMWs器件制备
2003年Levene等[7]提出ZMWs在单分子检测中的应用后,人们陆续对ZMWs器件的制备工艺及结构进行了研究和改进。ZMWs结构中广泛采用的金属层是铝,这是由于铝具有短的光学趋肤深度及高的反射特性。但是铝的化学性质不稳定,因此出现了用金代替铝的研究[24]。金的优点是化学性质稳定不易氧化,同时由于金表面自组装修饰方法发展非常成熟,金表面修饰化学更加容易[25,26]。在金属膜表面上制备几十至几百纳米级别的微孔可以通过电子束曝光,随后以干法刻蚀的方法[7,23]或直接在金属层上利用聚焦离子束进行微孔制备[27,28]。
人们还提出利用金属剥离的方法进行ZMWs器件制备[29~33],工艺流程如图3A所示,在清洁的衬底表面旋涂电子束光刻胶,经过电子束光刻后,在衬底上形成尺度与要制备的ZMWs相当的胶柱,沉积金属以后再剥离,在胶柱的位置就形成了ZMWs微孔。虽然通过电子束光刻与金属剥离相结合的方法能够有效预防金属碎渣的存在,但是电子束光刻技术的成本太高,且产出量很低,因此不适合规模化生产ZMWs器件。2011年,Wada等[34]提出利用紫外纳米压印与金属剥离相结合的方法制备ZMWs器件,工艺流程如图3B所示。与电子束光刻—金属剥离工艺相比,这种方法利用了一种能够在紫外光下固化同时能够溶解在有机溶剂四氢呋喃中的胶NIAC707,胶柱的形成过程省去了价格昂贵的电子束光刻过程,只需要在掩模板下较短时间光照即可形成胶柱,随后进行清洗、金属蒸镀及剥离即可形成ZMWs器件,应用该方法已成功制备了孔直径在30~150 nm的ZMWs器件,并通过实际的单分子荧光检测实验验证了器件的可行性。
最近,Teng等[35]还提出一种相对廉价的工艺方法制备零模波导器件(图4),主要分为两步,首先通过传统的光刻、金属沉积及金属剥离等方法制备微米级的金属微孔,然后通过电镀的方式将微米级的微孔缩小至零模波导所要求的尺寸。通过这种工艺,可将770 nm的微孔通过电镀的方式缩小至70 nm,深度为450 nm,并成功实现了单分子荧光检测。这种新工艺将成熟的微光刻与电镀技术相结合达到了制备纳米级别小孔的目的,与直接利用聚焦离子束或电子束光刻等技术制备纳米级微孔相比,价格低廉、制备通量高,但是受到金属晶粒大小的影响,电镀后小孔的形状由电镀前的圆形变为椭圆形,同时如何精确控制最终缩小后的纳米级小孔的尺寸有待进一步考证。
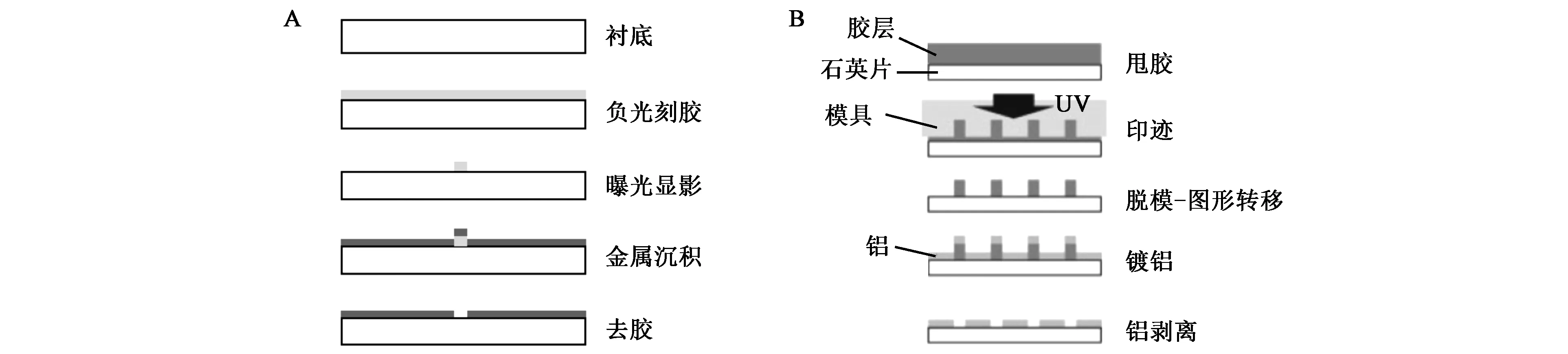
图3 电子束光刻-金属剥离(A) [32]及紫外纳米压印-金属剥离工艺流程图(B)[34]Fig.3 Process flow diagram of electron beam lithography-metal peeling (A) [32] and UV nanoimprint-metal peeling (B)[34].
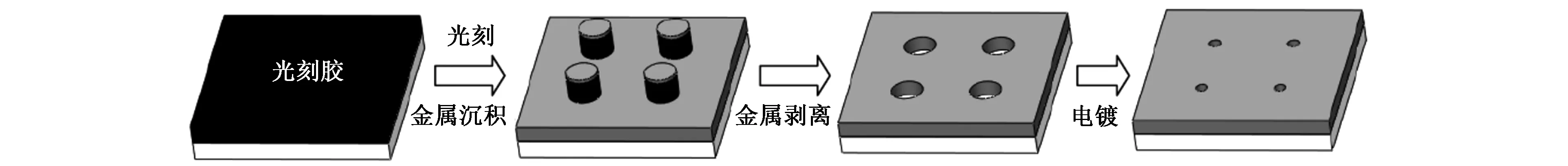
图4 光刻与电镀技术相结合制备零模波导器件工艺示意图[35]Fig.4 Process scheme of zero-mode waveguide devices preparation by lithography combined with electroplating technology[35].
传统的ZMWs结构中的微孔只是在衬底表面金属上形成,这种结构在实际应用中,单分子荧光信号会受到溶液中背景信号的干扰,为了进一步提高ZMWs的信噪比,Miyake等[36,37]提出了一种改进型ZMWs结构(见图5),主要是在传统ZMWs结构微孔底部的石英玻璃衬底进一步刻蚀形成一定深度的微孔。在这种结构中,石英玻璃衬底上的纳米孔部分不是近场的有效体积部分,但是属于观测体积部分。由于金属层的存在,光强在金属层与石英玻璃的交界面处开始消失,同时由于激发光的最大强度值位于微孔深度的四分之一波长处,因此微孔底部的荧光染料分子受到的激发光和传统ZMWs相比更强,同时发射荧光由于没有金属层的阻挡更加容易传输到目镜。通过实验,Miyake等还证明当石英玻璃上的纳米微孔刻蚀深度为60 nm时,荧光强度值大约是传统ZMWs结构的2倍,2013年该小组通过理论计算说明这种改进型ZMWs信噪比能够较传统结构提高6倍,信噪比的提高将有助于增强在生理浓度溶液中单分子荧光成像的时间分辨率[38],因此这种改进型ZMWs结构对于提高ZMWs信噪比具有重要意义。
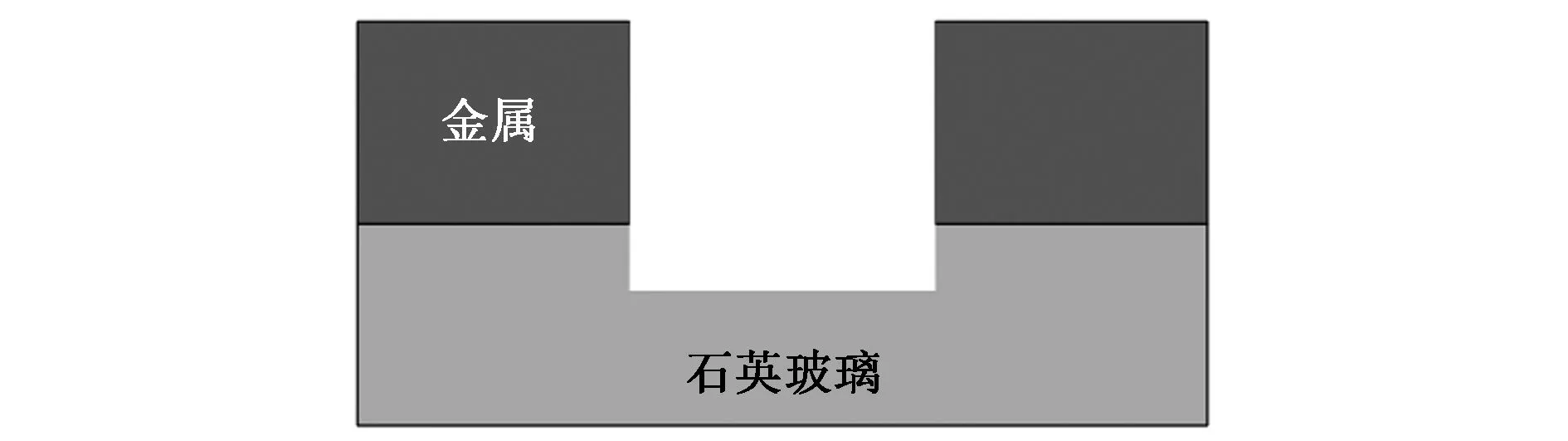
图5 改进型ZMWs结构示意图Fig.5 Schematic diagram of improved ZMWs.
如上所述,大部分ZMWs的掩盖层都是金属,金属层会对单分子荧光的寿命造成影响[39],这可能是由于金属的导电性导致电子泄露,进而对荧光分子造成非辐射性的损伤,同时金属对光的吸收导致温度升高也会对荧光寿命或信号质量造成影响。为了克服金属层的不足之处, Ono等[40]尝试用全氟聚合物Cytop制备了ZMWs器件(见图6)。这种新型聚合物ZMWs器件有望减少电子泄露及热效应对单分子检测的影响,但是具体应用效果有待进一步验证。
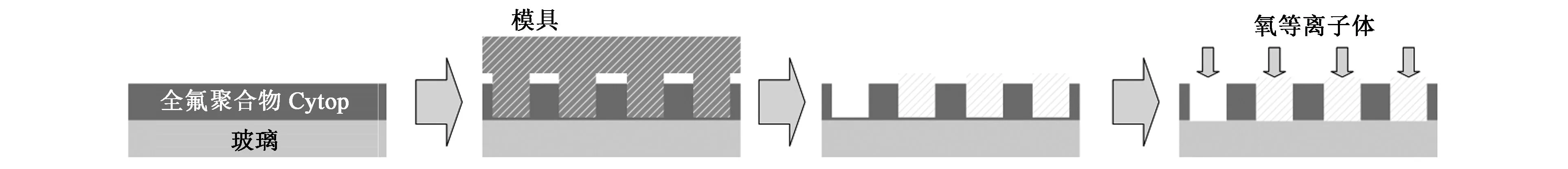
图6 全氟聚合物Cytop制备ZMWs工艺流程示意图[40]Fig.6 Flow chart of ZMWs preparation using perfluoropolymers Cytop[40].
3 ZMWs在单分子检测中的应用
3.1 单分子DNA测序
DNA测序技术经过几十年的发展,经过了第一代、第二代及目前兴起的第三代测序技术的发展历程[41~43]。第一代测序技术即为统治了测序市场30年之久的特定克隆测序技术,由于这种技术可以对相对少量的特定位点、克隆产物和PCR产物的序列进行测定,目前在实际工作中仍有应用。2005年出现的第二代高通量测序技术彻底改变了测序的规模化进程,使得以前遥不可及的基因组测序工作简单到一个常规实验室都可以进行,本研究小组也成功自主研制了基于焦磷酸测序原理的第二代基因测序仪,并进行了Glaciecolamesophilasp. nov.的全基因组测序和组装[44]。虽然第二代测序技术在广泛应用,但是其本身也有难以克服的技术瓶颈,例如需要经过模板扩增,并且读长较短。鉴于二代测序技术的不足,不经过扩增、读长长及通量高的第三代测序技术成为了新的挑战,基于微纳制造技术的纳米微结构器件则是第三代测序技术的的核心和技术难点[45]。
ZMWs作为一种能够在生理浓度溶液中检测单分子荧光的技术在第三代测序中受到了广泛的关注。将ZMWs首次应用于单分子DNA测序[7]研究前,研究人员比较了在直径43 nm ZMWs中获得的荧光信号与在浓度为4 nmol/L的荧光染料分子溶液中采集的传统衍射极限荧光相关光谱,结果显示,ZMWs可以接受的溶液浓度大约比传统衍射极限荧光相关光谱提高了3个数量级。同时,ZMWs具有很好的时间分辨率,在直径分别为43 nm和66 nm的微孔中,荧光染料分子的滞留时间仅为几个微秒,要比传统衍射极限荧光相关光谱检测过程中的滞留时间缩短了一个数量级,同时还比大多数酶反应速率快3个数量级,因此在ZMWs检测单分子荧光过程中很容易区分自由扩散至观测体积内的染料分子与吸附在酶分子上的染料分子所发出的荧光。因此,在验证了ZMWs可以在高浓度溶液中高时间分辨率识别单分子荧光信号的能力后,Levene等[7]利用ZMWs观测了聚合酶合成DNA双链的过程,首先将单个T7 DNA聚合酶通过物理吸附的方式固定在纳米孔底部,然后注入能够保证M13DNA进行有效连续合成反应的各种试剂,其中以香豆素-dCTP代替dCTP。随后单个ZMWs纳米孔中的荧光持续时间被观测到,全部聚合反应时间大约30 min,每秒钟大约有1~3次的光闪烁,代表每秒约有1~3个dCTP结合至模板上,这一结果与在本体溶液中的合成速率一致的(每秒约为10~15 bp),同时与模板上平均含有约20%的鸟嘌呤的含量是一致的。虽然以上实验结果在实际测序过程中有待进一步的优化,但是已经为ZMWs在单分子DNA测序的应用开创了先例。
Pacific Biosiences公司在以上研究成果的基础上对ZMWs应用于单分子DNA测序的技术进行了进一步研究[46~48],并推出了商品化单分子DNA测序仪(single molecule real time,SMRT)。SMRT技术的具体原理如图7(彩图见图版二)所示:在测序过程中,由固定的酶根据单链DNA模板合成双链。每次加入一个碱基,聚合酶捕获具有荧光标记的dNTP,并将其带到检测区间,产生荧光光曝,光曝的荧光颜色就揭示了模板上的互补碱基。通过连续实时监控每个波导孔的荧光光曝,就快速测定了每一个孔内DNA模板的序列。这种利用ZMW进行的单分子实时检测技术在高速测序、长序列产出和低成本方面有着巨大的潜力。不过与其他单分子测序平台一样,实时检测单个分子对于提高原始数据准确率是一个挑战,并可能成为一个障碍,还需要更进一步的改进。
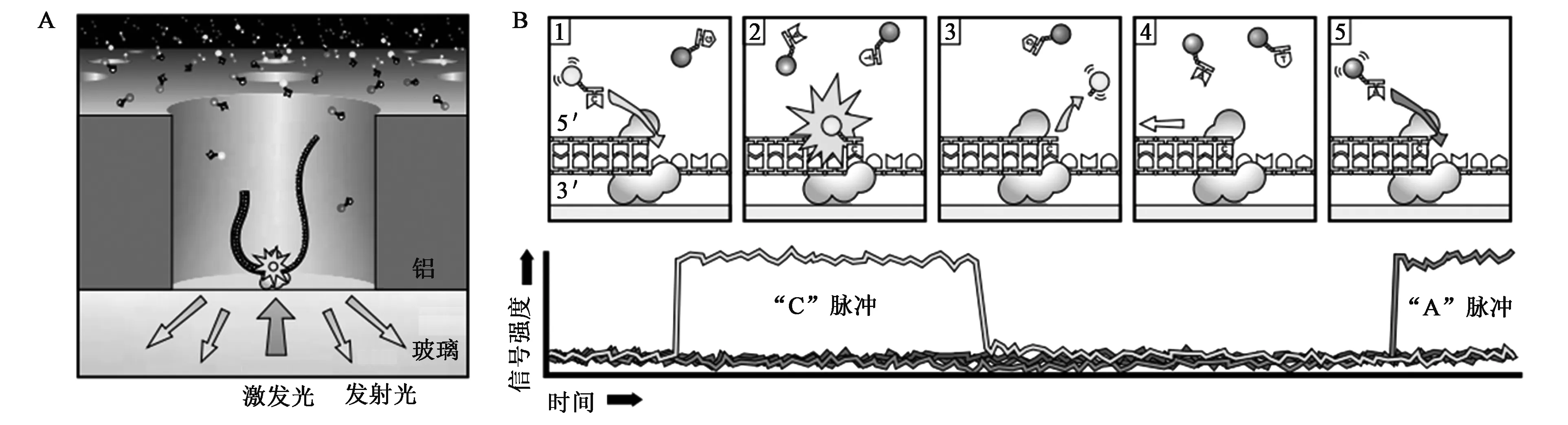
图7 Pacific Biosiences公司单分子DNA测序技术(SMRT)原理示意图[47].Fig.7 Schematic diagram of single molecule real time (SMRT) sequencing technology principle from Pacific Biosiences company[47].(彩图见图版二)
2014年,Stanford大学的Chen等[49]联合Pacific Biosiences公司对单分子DNA测序设备进行了改进,主要是进行单分子荧光的相关研究。Pacific Biosiences公司开发的基于ZMWs器件的单分子DNA测序设备在测序过程中试剂及芯片准备过程大约耗时1.5 h,同时芯片和激光的对准过程大约需要15 min,其中在图像获取之前试剂要暴露在激光照射下大约2 min,这一过程并不适合单分子荧光研究,因为2 min的激光照射将会漂白大部分固定在ZMWs底床的单分子荧光,针对这些问题, Chen等将设备进行了改进,将单分子荧光的前期准备过程由原来的1.5 h改进为60 s,利用新的芯片与激光对准方法大大减少了激光对于荧光基团的漂白作用,同时对设备的软件进行了修改,使其更加适合单分子荧光实验过程中的操作和分析。经过以上改进,将基于ZMWs的单分子DNA测序设备改为能够广泛使用的单分子荧光分析系统,具有便于使用、高时间灵敏度、高光谱分辨率、高信号灵敏度以及高的荧光染料分子光稳定性的特性,能够进行单分子之间的瞬态结合及解离过程表征,能够长时间观测微弱荧光能量转移引起的分子构象变化等,必将会有力促进高通量研究生物单分子的相关研究工作进展。
3.2 生物膜研究
ZMWs在生物研究体系中的一个重要应用是研究生物膜,例如脂质膜与细胞膜,这两种膜在活细胞与其所在环境的相互作用过程中扮演着非常重要的角色[50],其工作机理的研究和分析对于人们进一步理解细胞的功能具有重要意义。传统研究脂质膜及细胞膜的光学方法是利用荧光相关光谱[51,52]、全内反射荧光显微镜[53,54]和荧光光致漂白恢复[55]等技术,但是这些技术都受到光学衍射极限的限制不能在生理浓度环境中进行单分子水平研究。ZMWs作为一种能够在生物体系相等浓度的溶液体系中进行单分子检测的技术,在提出不久后就被人们用于生物膜的相关研究工作中。
2005年,Edel等[56]研究了带有荧光标记细胞膜的大鼠嗜碱性粒细胞性白血病细胞(Basophilleukemiacells of rats,RBL)在ZMWs器件表面的扩散行为(图8A)。由于RBL具有很好的黏附性,因此不需要任何外界作用即可黏附在ZMWs结构的金属层表面,通过荧光强度的变化发现,当细胞刚刚进入ZMWs微孔时,20 s内只能捕获到约两次发光,1.5 h后20 s内发光次数增加至22次,这一结果证明细胞不仅可以依照ZMWs微孔的形状进入到微孔而且进入的深度足以使细胞膜上的荧光基团受到激发。这一结果的发现为进一步利用ZMWs研究细胞膜内蛋白质的动力学过程及细胞内的抗体受体结合过程等奠定了基础。2006年,该小组又通过囊泡融合的方法在ZMWs纳米结构上制备了脂质膜[29](图8B),在实验中发现凝胶态的脂质膜很难进入ZMWs纳米微孔,而在液相中的脂质膜则能够顺利进入ZMWs纳米微孔的观测体积中。随后他们利用ZMWs在高浓度破伤风毒素C碎片的溶液中测定了破伤风毒素C碎片与神经节苷脂GT1b的平衡结合常数。传统的测定平衡常数的生化技术包括离心、平衡渗析及荧光检测等步骤,一般需要几小时至几天时间完成。相比之下,利用ZMW技术需要的试剂量更少,同时实验步骤更加简单,几分钟之内即可完成实验。这项对ZMWs结构上形成的脂质膜进行的系统表征和理论分析的研究对于利用ZMWs研究生物膜的硬度及抗弯模数等特征具有重要指导意义,同时也为在生理浓度中研究单个膜蛋白分子提供了一种新的思路。
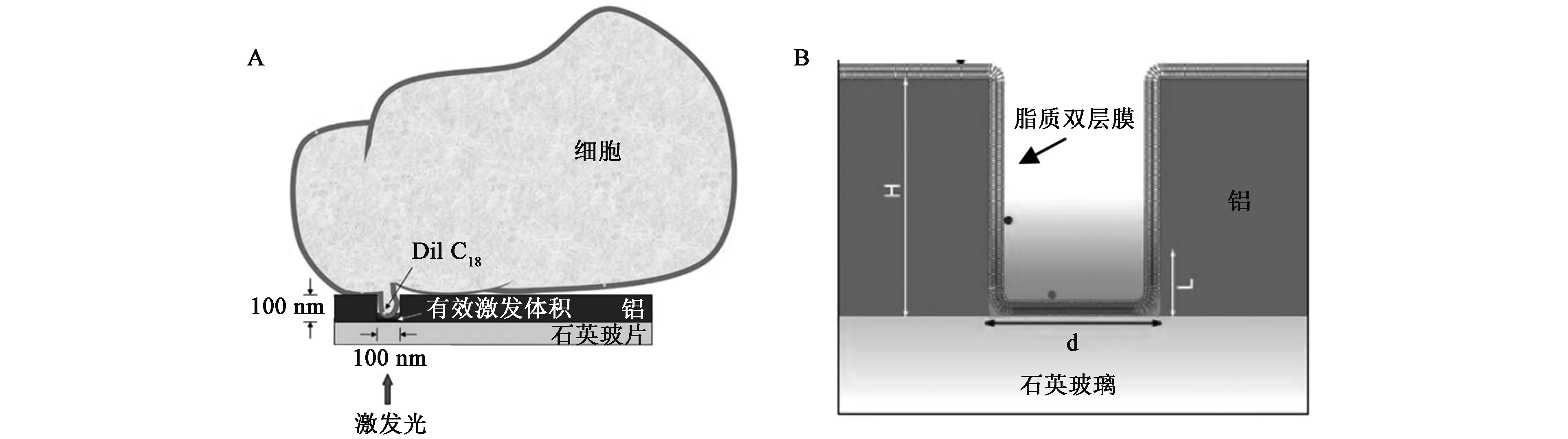
图8 大鼠嗜碱性粒细胞性白血病细胞在ZMWs器件表面的扩散行为[29,56]Fig.8 Dispersal behavior of RBL cell on ZMWs device surface[29,56].A.利用ZMWs器件检测DiI-C18标记大鼠嗜碱性粒细胞性白血病细胞(RBL)的结构示意图,RBL细胞约为15 μm;B. ZMWs器件表面覆盖双脂膜示意图
几乎同期,Wenger等[57]也在ZMWs上制备了脂质膜,并发现荧光基团的扩散时间与ZMWs结构上纳米微孔的面积具有一定的线性关系,这一结果表明扩散行为主要是在二维空间进行的,并受到微孔尺寸的限制。通过改变ZMWs纳米微孔的直径大小发现直径为150 nm的微孔的荧光发光效率是直径范围在250~400 nm的微孔的2倍,这一荧光增加现象与Rigneault等[27]报道的在150 nm的ZMWs微孔中荧光素罗丹明-6G分子的荧光强度得到了6.5倍的增强实验现象是一致的,脂质膜进入纳米孔可能是造成这一现象的原因。
细胞质膜是一种复杂溶液的交界面,富含了众多的脂类物质、蛋白质等,不仅是细胞的天然包膜,同时还是细胞与外界环境相互作用的聚集地[50]。因此研究活细胞内细胞质膜中分子间的相互作用成为了生物学研究的重大课题。Jose等[58]利用电镜和ZMWs荧光光谱研究了细胞质膜在ZMWs结构上的扩散行为,细胞质膜可能完全凹陷到ZMWs的纳米孔中,也可能横跨在纳米孔上方,为了评估细胞质膜进入微孔的概率,他们对细胞进行荧光标记,然后将细胞黏附在ZMWs器件表面,最后获取ZMWs芯片的荧光照片,同时以直径为500 nm的荧光乳胶微球在ZMWs器件表面进行参照实验,如图9所示。细胞对于芯片的表面覆盖度约为50%±10%,实验中发出荧光的纳米孔个数比例为20%~25%,结果说明不是所有覆盖在芯片表面的细胞都能够与纳米孔底部接触,细胞质膜进入纳米孔的几率大约50%左右。进一步研究证明细胞质膜能够通过膜的扩张作用进入到ZMWs微孔中,通过分析认为膜的进孔过程主要是受到细胞支架成分的驱动,类似于丝状物质的扩展过程。这一结果为人们认识细胞之间及细胞与表面之间的相互作用提供了一种新的思路。同时还从单分子分辨率水平分析了细胞膜内组分的动力学过程。

图9 细胞质膜进入ZMWs器件微孔的概率[58]Fig.9 Probability of the cell membrane into the pores of the ZMWs device[58].A. 在实验中充当未进入微孔底部的荧光物质参照;B. ZMWs器件顶部微球荧光图片;C. 细胞膜进入ZMWs器件底部示意图;D. ZMWs器件底部由激发光消逝场激发的细胞膜荧光图片,该荧光强度是微球在ZMWs器件底部的荧光强度值的100倍。
同期,Wenger等[59]也利用ZMWs研究了COS-7细胞的细胞质膜中的荧光脂质膜类似物Bodipy-PC、Bodipy-GM1、荧光蛋白GPI-GFP及转铁蛋白受体(TfR)的扩散行为。通过实验发现,Bodipy-PC在微孔中的扩散时间与微孔的面积成正比,没有受到阻挡,而Bodipy-GM1、GPI-GFP及TfR的扩散受到了阻挡,对GPI-GFP及TfR的受阻原因进行了分析说明,认为GPI-GFP的受阻主要是细胞质膜中的胆固醇成分造成,他们将胆固醇转化为胆甾烯酮,之后发现GPI-GFP的扩散时间与微孔面积成线性关系,说明GPI-GFP的扩散行为与细胞质膜中的胆固醇成分有很大关系,这一结论在其他论文中也得到了证实[60~62]。而对于TfR,主要是由于细胞质膜的细胞骨架形成的网状结构阻碍了其扩散过程。
通过以上的研究工作,人们已经证实细胞膜能够扩散至ZMWs微孔中,同时利用ZMWs可以对细胞膜上的蛋白质分子的扩散行为进行研究。在此基础上,Richards等[62]提出了ZMWs在细胞膜内新的应用方向,即在细胞膜内测定单个受体分子的化学计量比,同时还可以用来测定药理学作用对受体分子化学计量比的影响。在实验中通过利用ZMWs纳米微孔孤立了细胞膜上的单个受体分子(图10),然后利用一步荧光猝灭法识别受体分子的荧光分子数量,并对乙酰胆碱受体(nicotinic acetylcholine receptors,nAChRs)的化学计量比进行了分析。nAChRs是其构成单元α1~α10与β2~β4的五聚物组合体,Richards等主要对其中α4与β4的化学计量比进行了分析,分别对绿色荧光蛋白(green fluorescent protein,GFP)标记的α4与未标记的β4形成的组合体α4-(GFP)+β4,及未标记的α4与荧光标记的β4形成的组合体α4+ β4-(GFP)进行荧光检测。结果发现在α4-(GFP)+β4体系中约80%的受体分子荧光分子是分三步猝灭,代表的化学计量比是(α4)3(β4)2,约20%的荧光受体分子是分两步猝灭,代表的化学计量比是(α4)2(β4)3。在α4+ β4-(GFP)体系中,小于30%的荧光是三步猝灭,70%的荧光是两步猝灭,因此说明大部分α4与β4的五聚体化学计量比是(α4)3(β4)2,而(α4)2(β4)3大约占20%~30%。在以上两个系统中,得到的α4与β4的五聚体的化学计量比结果基本相同,说明了利用ZMWs能够有效测定部分生物分子的化学组成。利用ZMWs还分析测定了药理作用对α4β2型nAChRs化学计量比的影响,首先对α4β2型nAChRs的化学计量比进行了测定,发现(α4)2(β2)3和(α4)3(β2)2所占比例几乎相等,然后将其分别置于浓度为500 nmol/L的尼古丁及金雀花碱溶液中持续24 h,之后再对其进行化学计量比测定发现,置于尼古丁溶液中的nAChRs含有60%的(α4)2(β2)3,而置于金雀花碱溶液中的nAChRs只含有38%的(α4)2(β2)3,这一结果表明不同的溶液环境对于细胞膜中的nAChRs成分含量具有重大影响,同时也说明ZMWs能够用来测定药理学作用对受体分子化学计量比的影响。
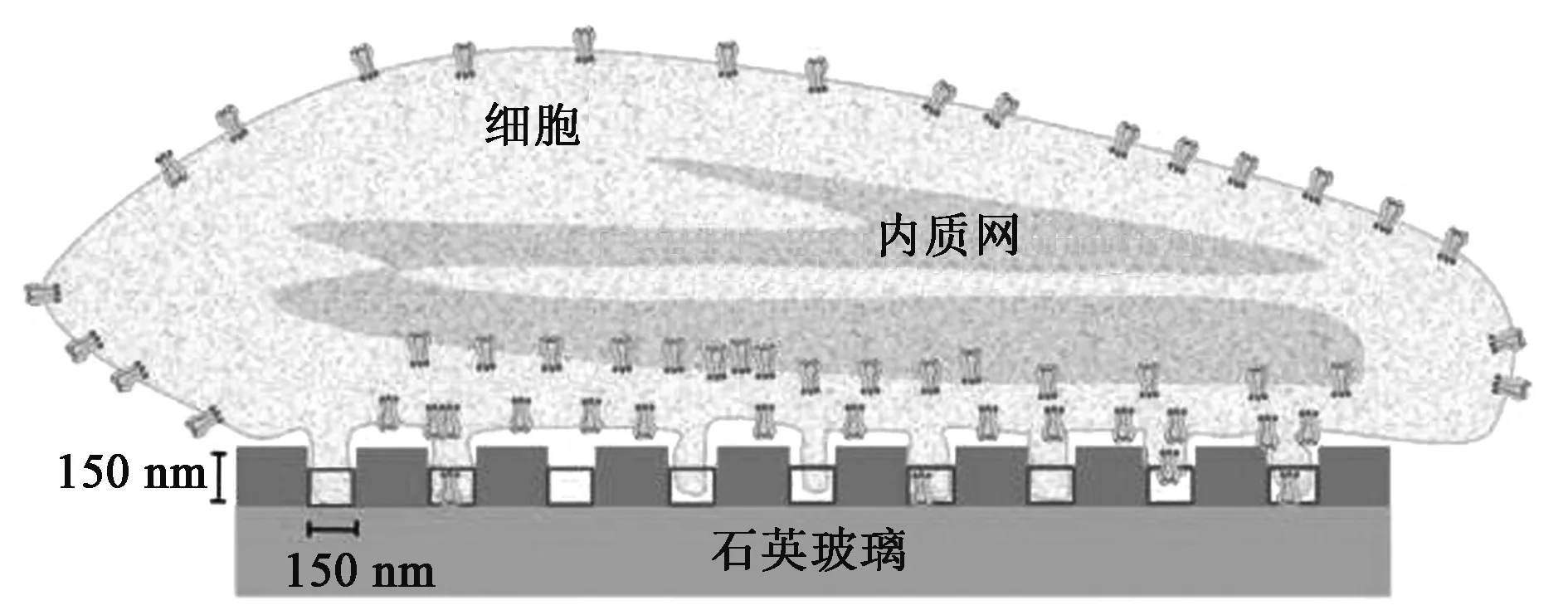
图10 细胞膜上单个nAChR受体分子进入ZMWs器件示意图[62]Fig.10 Schematic diagram of the single nAChR molecules on cell membrane into the ZMWs device[62].注:整个细胞着床在ZMWs器件表面,细胞膜的一小部分进入到ZMWs器件纳米孔中。
3.3 生物大分子之间的相互作用
传统研究生物大分子之间相互作用的方法主要是用到落射荧光显微镜、全内反射荧光显微镜和荧光共振能量转移[2,63,64],近些年表面等离子体共振传感器作为一种在单分子层水平分析生物分子之间相互作用的工具也得到了广泛的应用[65~67]。但是以上技术均无法有效地在高浓度溶液中观测单个生物分子与其结合体的相互作用,测得的结果是生物分子相互作用的集群效应。自从Levene等[7]证实可以利用ZMWs在高浓度的溶液中观测单个分子的荧光后,对于ZMWs体系用于生物大分子之间相互作用的研究工作也开始进行尝试。为了能够利用ZMWs高信噪比观测单分子蛋白质之间的相互作用,Miyake等[36]提出了一种新型的ZMWs结构,如图4所示,并利用其实时观测了分子伴侣素GroEL与其辅助分子GroES之间的相互作用。在实验过程中,首先将分子伴侣素GroEL固定在ZMWs结构微孔底床,通过分析认为固定在微孔中的分子伴侣素GroEL 90%是单个分子,然后在浓度为5 μmol/L的Cy3标记的辅助分子GroES的溶液中,且溶液中混有ATP,进行了单分子荧光观测,从荧光强度与时间的曲线图看出GroES的结合—释放过程能够得到非常清楚的区分。通过分析认为GroEL释放GroES的过程存在一个动力学过渡态,即整个释放过程应该是分两步进行的。为了验证利用ZMWs所获得的荧光亮暗过程持续时间确实是代表了GroES的结合—释放过程以及GroEL释放GroES的过程是否存在两个动力学常数,在浓度为50 nmol/L的Cy3标记的辅助分子GroES的溶液中进行了实验,50 nmol/L的浓度相当于单纯利用全内反射荧光显微镜能够观测到单分子GroES荧光信号的浓度,结果证明利用全内反射荧光显微镜与ZMWs得到的结果得到了很好的吻合。随后该小组还利用ZMWs详细分析了GroEL的C-末端区对GroEL功能的作用,及GroEL-GroES结合体的衰变过程[37,68]。以上结果充分说明,利用ZMWs可以直接在微摩尔每升量级浓度的溶液中观测和分析单分子蛋白质间的相互作用,同时为在单分子水平分析生物大分子的工作机制提供了很好的研究思路。
3.4 单分子反应动力学
从单分子水平研究酶分子反应动力学过程可以获得单个酶分子的内在行为信息,而不是众多酶分子行为的平均效应,因此对于人们进一步认识和理解酶分子的工作机理具有重要基础意义。研究单分子酶动力学过程中的关键是维持其检测环境浓度与其生理浓度尽量接近,这样才能有效保证酶分子的动力学机制不受到破坏,得到的结果才有可能更接近生物体内酶分子的实际工作机理。由于ZMWs能够在高浓度溶液中有效检测单分子,因此是研究单分子酶反应动力学的有力工具。Zhao等[24]利用以金为金属层的ZMWs对单分子单体肌氨酸氧化酶(monomeric sarcosine oxidase)的动力学过程进行了研究。在实验过程中,首先通过自组装的方式在纳米孔的金表面修饰巯基聚乙二醇,单个酶分子选择性地固定在ZMWs的二氧化硅底床上。肌氨酸氧化酶的活性位点含有黄素腺嘌呤二核苷酸辅因子,因此氧化态酶会自发荧光,而还原态酶则不发光,随着黄素在氧化还原过程中的变化,单分子荧光随之进行明暗交替,每一个明暗过程的循环对应一次酶翻转过程。基于此原理,分别采用底物肌氨酸和左旋脯氨酸进行了酶动力学反应过程,结果显示左旋脯氨酸浓度为500 μmol/L时,荧光平均持续时间为0.23 s,与50 μmol/L的肌氨酸相当,说明酶与两种底物形成的复合体结构是不同的,因而造成相同浓度底物时荧光持续的时间不同。对酶反应动力学过程的的分析显示, 23个单体肌氨酸氧化酶的催化反应速率常数之间的差距最大能够达到20多倍,协方差参数为随机分布,因此可以认为该酶反应动力学过程具有静态异质性,存在动态无序性,原因可能是单个酶分子在ZMWs微孔中的空间取向分布不同,也可能是酶分子在微孔底床上的固定位置不同造成的。
还有人利用ZMWs对生物聚合反应动力学过程进行了研究,如Samiee等[23]利用荧光相关光谱在ZMWs中研究了噬菌体λ抑制蛋白质CI的动力学过程。对于CI的齐聚反应动力学过程在Samiee等之前就有人进行了充分的研究[69],并证明当CI浓度为100 nmol/L时主要是以二聚体的形式存在,当浓度高于1 μmol/L时,四聚体急剧增多,当浓度再高时四聚体迅速变为八聚体。从CI的聚合过程可以看出,当CI四聚体及八聚体出现时,反应液的浓度已经远远高于单纯的荧光相关光谱能够检测的浓度范围(一般为纳摩尔每升浓度量级),因此Samiee等利用ZMWs在浓度约为1 μmol/L的溶液中对CI的齐聚反应中决定四聚体形成过程的结合常数KD2进行了计算和分析,并认为该常数与温度具有一定的关系,同时表明CI八聚体形成过程的速率限定步骤是四聚体的形成。以上结论与Pray等[67]之前利用传统工具获得的结论是一致的,因此说明ZMWs是研究高浓度环境中生物聚合反应过程的有力手段。
RNA是自然界最忙碌的分子之一,其功能一度被认为只是贮存与传送遗传信息而已,不过现在已知它能完成其他多样化的功能,从调控基因表达与其他维系生命所需的细胞程序到作为一种感应器。这个多才多艺的分子其中一项重要的功能就是蛋白质翻译过程,自20世纪以来,蛋白质翻译过程就已经出现了许多重要的成果,一些已经进行到了单分子水平[70]。但是由于受限于光学衍射极限,以往利用单分子荧光研究RNA反应动力学过程都是在荧光标记配体浓度为纳摩尔每升量级的环境中,无法达到生理浓度范围水平。2010年Uemura等[71]成功利用ZMWs在生理浓度水平实时观测了单个核糖体将氨基酸串联起来的动力学过程。这种方法不仅可以解析tRNA在翻译过程中的具体结构变化,而且还可以用来研究药物对蛋白翻译过程的影响。在实验过程中首先将核糖体复合物固定在ZMWs微孔底床,核糖体复合物作为70S起始复合物包含有荧光标记的fMet-(Cy3)tRNAfMet,并且还添加了另外两个利用不同染料标记的tRNA-Phe-(Cy5)tRNAPhe及Lys-(Cy2)tRNALys,这些tRNA与被检测的mRNA编码的氨基酸苯丙氨酸和赖氨酸同源。在实验过程中,首先通过检测fMet-(Cy3)tRNAfMet确定起始复合物,随后通过特定颜色的荧光信号实时观测Phe-(Cy5)tRNAPhe及Lys-(Cy2)tRNALys与核糖体的结合过程,这个过程受mRNA编码的4种氨基酸(MFFF或MFKF)调控。利用这种方法可以在密码子分辨率水平分析核糖体的翻译动力学过程,也可以分析mRNA的基本序列,从而解析依赖于序列的翻译行为。另外这个系统也可以被用来分析系列过程,从起始到框架转换,以及包括真核生物的核糖体在内的不同物种的核糖体。
大部分的ZMWs结构均为圆形纳米孔阵列,直径在100 nm左右,但是这种结构也限制了一些实验的开展,例如分子马达的反应过程观测。直径在100 nm左右的圆形纳米孔仅仅能够容纳蛋白纤维丝,但是由于空间的限制无法进一步观测其运动状态。因此Elting等[72]开发了一种新型线性ZMWs,对肌球蛋白在蛋白纤维丝上的运动进行了单分子荧光检测。线性ZMWs结构就像一个窄长形的沟道,长度大约几个微米,以偏振光为激发光源,仍能将激发光限制在ZMWs结构底部,如图11所示。在实验过程中首先将肌球蛋白纤维固定在线性ZMWs底床,然后加入荧光标记的肌动蛋白V和ATP,从荧光图片上可以看出肌球蛋白的移动距离大于1 μm,肌球蛋白的长度为36 nm,1 μm的距离相当于肌球蛋白沿着蛋白纤维移动了至少30步。这种新型线性ZMWs结构突破了传统ZMWs体积对生物分子的限制,同时给分子马达的研究提供了一种新的思路和方法。
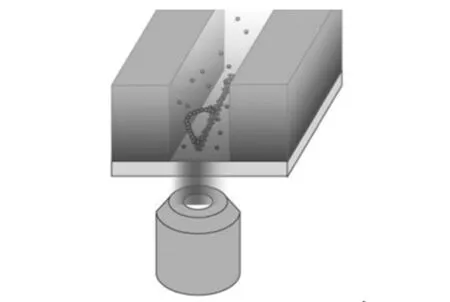
图11 线性ZMWs结构示意图,肌球蛋白沿着蛋白纤维在ZMWs线性纳米通道移动[72]。Fig.11 Diagram of linear ZMWs structure,myosin move along protein fibers in linear ZMWs nanochannel[72].注:由于纳米通道的宽度小于激光光波长,偏振激发光体积在垂直和通道的长度方向均受到限制。
4 展望
ZMWs作为一种单分子检测工具,通过纳米孔结构将观测体积减小至仄升量级,突破了光学衍射极限的限制,能够在生理浓度水平溶液中有效观测单分子荧光,可以检测的溶液浓度范围比传统光学设备提高了3~6个数量级。该方法自2003年被提出之后,在短短的9年之内,从制备工艺到具体应用都受到了人们的极大关注,并在分子生物学领域得到了科研工作者的青睐和广泛使用。目前基于ZMWs原理研发的单分子测序系统已经进入市场,ZMWs在生物膜、生物大分子间相互作用及酶动力学等方面的研究成果表明ZMWs可以应用于更多的生物体系研究中。有理由相信ZMWs在日益活跃的单分子研究领域必将发挥更大的作用,成为人们在单分子水平进一步研究和认识生物分子工作机制的有力研究工具。
[1] Xie X S,Trautman J K. Single-molecule optical studies at room temperature[J]. Annu. Rev. Phys. Chem.,1998,49:441-480.
[2] Tinnefeld P,Sauer M. Branching out of single-molecule fluorescence spectroscopy:Challenges for chemistry and influence on biology[J].Angew. Chem. Int. Ed. Engl.,2005,44:2642-2671.
[3] Verena R,Markus A,Stefan W. What can we learn from single molecule trajectories[J]? Curr.Protein Pept.Sci.,2011,12(8):714-724.
[4] Meyer-Almes F J,Auer M. Enzyme inhibition assays using fluorescence correlation spectroscopy: A new algorithm for the derivation of kcat/KM and Ki values at substrate concentrations much lower than the michaelis constant[J].Biochemistry, 2000,39(43): 13261-13268.
[5] Schomburg D,Schomburg I. Springer Handbook of Enzymes[M]. (2nd edn). New York: Springer,2001.
[6] Lerch H P,Mikhailov A S,Hess B. Conformational-relaxation models of single enzyme kinetics[J]. Proc. Natl. Acad. Sci. USA,2002, 99:15410-15415.
[7] Levene M J,Korlach J,Turner S W,etal.. Zero-mode waveguides for single-molecule analysis at high concentrations[J]. Science,2003,299:682-686.
[8] Starr T E,Thompson N L. Total internal reflection with fluorescence correlation spectroscopy:Combined surface reaction and solution diffusion[J]. Biophys. J.,2001,80:1575-1584.
[9] Mashanov G I,Tacon D, Knight A E,etal.. Visualizing single molecules inside living cells using total internal reflection fluorescence microscopy[J]. Methods,2003,29:142-152.
[10] Chan H M,Chan L S,Wong R N S. Direct quantification of single-molecules of microRNA by total internal reflection fluorescence microscopy[J]. Anal. Chem., 2010,82(16):6911-6918.
[11] Satomi M,Yukihiro M,Toshio Y. Single-molecule imaging of stochastic signaling events in living cells[J]. Cold Spring Harb. Protoc.,2012,(3):267-278.
[12] Betzig E,Chichester R J. Single molecules observed by near-field scanning optical microscopy[J]. Science,1993,262:1422-1425.
[13] Trautman J K,Macklin J J,Brus L E,etal.. Near-field spectroscopy of single molecules at room temperature[J]. Nature,1994,369:40-42.
[14] Hoang H T,Segers-Nolten I M,Berenschot J W,etal.. Fabrication and interfacing of nanochannel devices for single-molecule studies[J]. J. Micromech. Microeng.,2009,19:065017.
[15] Mannion J T,Reccius C H,Cross J D,etal.. Conformational analysis of single DNA molecules undergoing entropically induced motion in nanochannels[J]. Biophys. J., 2006, 90:4538-4545.
[16] Stavis S M,Edel J B,Li Y G,etal.. Detection and identification of nucleic acid engineered fluorescent labels in submicrometre fluidic channels[J]. Nanotechnology,2005,16: S314-S323.
[17] Stavis S M,Edel J B,Samiee K T,etal.. Single molecule studies of quantum dot conjugates in a submicrometer fluidic channel[J]. Lab Chip,2005,5(3):337-343.
[18] Persson F,Thamdrup L H,Mikkelsen M B L,etal.. Double thermal oxidation scheme for the fabrication of SiO2nanochannels[J]. Nanotechnology,2007,18:245301.
[19] Haneveld J,Tas N R,Brunets N,etal.. Capillary filling of sub-10 nm nanochannels[J]. J. Appl. Phys.,2008,104:014309.
[20] Bethe H A. Theory of diffraction by small holes[J]. Phys. Rev., 1944, 66:163-182.
[21] Jackson J D. Classical Electrodynamics[M]. (3rd edn). New York:John Wiley &Sons,Inc.,1999.
[22] Moran-Mirabal J M,Craighead H G. Zero-mode waveguides:Sub-wavelength nanostructures for single molecule studies at high concentrations[J]. Methods,2008,46:11-17.
[23] Samiee K T,Foquet M,Guo L,etal.. λ-Repressor oligomerization kinetics at high concentrations using fluorescence correlation spectroscopy in zero-mode waveguides[J]. Biophys. J.,2005,88:2145-2153.
[24] Zhao J,Branagan S P,Bohn P W. Single-molecule enzyme dynamics of monomeric sarcosine oxidase in a gold-based zero-mode waveguide[J]. Appl. Spectrosc.,2012,66(2):163-169.
[25] Castner D G,Ratner B D. Biomedical surface science:Foundations to frontiers[J]. Surf. Sci.,2002,500:28-60.
[26] Peterlinz K A,Georgiadis R.Insitukinetics of self-assembly by surface plasmon resonance spectroscopy[J]. Langmuir,1996,12:4731-4740.
[27] Rigneault H,Capoulade J,Dintinger J,etal.. Enhancement of single-molecule fluorescence detection in subwavelength apertures[J]. Phys. Rev. Lett.,2005, 95:117401-117404.
[28] Fore S,Yuen Y,Hesselink L,etal.. Pulsed-interleaved excitation FRET measurements on single duplex DNA molecules inside C-shaped nanoapertures[J]. Nano Lett.,2007,7(6):1749-1756.
[29] Samiee K T,Moran-Mirabal J M,Cheung Y K,etal.. Zero mode waveguides for single-molecule spectroscopy on lipid membranes[J]. Biophys. J.,2006,90:3288-3299.
[30] Perentes A,Utke I,Dwir B,etal.. Fabrication of arrays of sub-wavelength nano-apertures in an optically thick gold layer on glass slides for optical studies[J]. Nanotechnology, 2005,16:S273-S277.
[31] Leutenegger M,Gosch M,Perentes A,etal.. Confining the sampling volume for fluorescence correlation spectroscopy using a sub-wavelength sized aperture[J]. Opt. Express,2006,14:956-969.
[32] Foquet M,Samiee K T,Kong X,etal.. Improved fabrication of zero-mode waveguides for single-molecule detection[J]. J. Appl. Phys.,2008,103:034301.
[33] Hsieh C F,Lai S C,Chen C T. Improved fabrication of zero-mode waveguides for monitoring specific molecular dynamics in living cells[A]. In:Cartwright A N,Nicolau D V. Nanoscale Imaging,Sensing,and Actuation for Biomedical Applications VIII[C]. San Francisco,USA,Proc. SPIE 8231,2012.
[34] Wada J,Ryu S,Asano Y,etal.. Fabrication of zero-mode waveguide by ultraviolet nanoimprint lithography lift-off process[J]. Jpn. J. Appl. Phys., 2011,50:06GK07.
[35] Teng C H,Lionberger T A,Zhang J,etal.. Fabrication of nanoscale zero-mode waveguides using microlithography for single molecule sensing[J]. Nanotechnology,2012,23:455301.
[36] Miyake T,Tanii T,Sonobe H,etal.. Real-time imaging of single-molecule fluorescence with a zero-mode waveguide for the analysis of protein-protein interaction[J]. Anal. Chem.,2008,80:6018-6022.
[37] Suzuki M,Ueno T,Iizuka R,etal.. Effect of the c-terminal truncation on the functional cycle of chaperonin groel[J]. J. Biol. Chem.,2008, 283 (35): 23931-23939.
[38] Tanii T,Akahori R,Higano S,etal.. Improving zero-mode waveguide structure for enhancing signal-to-noise ratio of real-time single-molecule fluorescence imaging:A computational study[J]. Phys. Rev.,2013,E88:012727.
[39] Ambrose W P,Goodwin P M,Keller R A. Alterations of single molecule fluorescence lifetimes in near-field optical microscopy[J]. Science,1994,265:364-367.
[40] Ono T,Iizuka R,Akagi T,etal.. Nanofabrication of polymeric aperture array for localized illumination beyond diffraction limit[A]. In:Landers J.Proceedings of 15th International Conference on Miniaturized Systems for Chemistry and Life Sciences[C]. Seattle: Chemical and Biological Microsystems Society,2011, 1801-1803.
[41] Zhou X G,Ren L F,Meng Q S,etal.. The next-generation sequencing technology and application[J]. Protein Cell,2010,1(6):520-536.
[42] Zhou X G,Ren L F,Li Y T,etal.. The next-generation sequencing technology:A technology review and future perspective[J]. Sci. China Life Sci.,2010, 53:44-47.
[43] 任鲁风,于 军. 解读生命密码的基本手段——DNA测序技术的前世今生[J]. 生命科学. 2012,24(12):1-6.
[44] Yuan L N,Ren L F,Li Y T,etal.. A complete genome assembly ofGlaciecolamesophilasp. nov. sequenced by BIGIS-4 sequencer system[J]. Sci. China Life Sci., 2011,54(9):835-840.
[45] 李运涛,任鲁风,周晓光,等. 应用于单分子测序的纳米微结构器件[J]. 物理, 2012,41(7):467-471.
[46] Korlach J,Marks P J,Cicero R L,etal.. Selective aluminum passivation for targeted immobilization of single DNA polymerase molecules in zero-mode waveguide nanostructures[J]. Proc. Natl. Acad. Sci. USA,2008,105:1176-1181.
[47] Eid J,Fehr A,Gray J,etal.. Real-Time DNA sequencing from single polymerase molecules[J]. Science,2009,323:133-138.
[48] Flusberg B A,Webster D R,Lee J H,etal.. Direct detection of DNA methylation during single-molecule, real-time sequencing[J]. Nat. Methods,2010,7(6):461-467.
[49] Chen J,Dalal R V,Petrov A N,etal.. High-throughput platform for real-time monitoring of biological processes by multicolor single-molecule fluorescence[J]. Proc. Natl. Acad. Sci. USA,2014,111(2):664-669.
[50] McMahon H T,Gallop J L. Membrane curvature and mechanisms of dynamic cell membrane remodeling[J]. Nature,2005,438:590-596.
[51] Larson D R,Gosse J A,Holowka D A,etal.. Temporally resolved interactions between antigen-stimulated IgE receptors and Lyn kinase on living cells[J]. J. Cell Biol., 2005,171:527-536.
[52] Kahya N. Targeting membrane proteins to liquid-ordered phases:Molecular self-organization explored by fluorescence correlation spectroscopy[J]. Chem. Phys. Lipids,2006,141:158-168.
[53] Moran-Mirabal J M,Edel J B,Meyer G D,etal.. Micrometer-sized supported lipid bilayer arrays for bacterial toxin binding studies through total internal reflection fluorescence microscopy[J]. Biophys. J.,2005,89:296-305.
[54] Pero J K,Haas E M,Thompson N L. Size dependence of protein diffusion very close to membrane surfaces:Measurement by total internal reflection with fluorescence correlation spectroscopy[J]. J. Phys. Chem. B,2006,110: 10910-10918.
[55] Tocanne J F,Dupoucezanne L,Lopez A. Lateral diffusion of lipids in model and natural membranes[J]. Prog. Lipid Res.,1994,33:203-237.
[56] Edel J B,Wu M,Baird B,etal.. High spatial resolution observation of single-molecule dynamics in living cell membranes[J]. Biophys. J.,2005,88:L43-L45.
[57] Wenger J,Rigneault H,Dintinger J,etal.. Single-fluorophore diffusion in a lipid membrane over a subwavelength aperture[J]. J. Biol. Phys.,2006,32:SN1-SN4.
[58] Moran-Mirabal J M,Torres A J,Samiee K T,etal.. Cell investigation of nanostructures:Zero-mode waveguides for plasma membrane studies with single molecule resolution[J]. Nanotechnology,2007,18:195101.
[59] Wenger J,Conchonaud F,Dintinger J,etal.. Diffusion analysis within single nanometric apertures reveals the ultrafine cell membrane organization[J]. Biophys. J.,2007,92:913-919.
[60] Lenne P F,Wawrezinieck L F,Conchonaud O W,etal.. Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork[J]. EMBO J.,2006,25:3245-3256.
[61] Brown D A,London E. Functions of lipid rafts in biological membranes[J]. Annu. Rev. Cell Dev. Biol.,1998,14:111-136.
[62] Richards C I,Luong K,Srinivasan R,etal.. Live-cell imaging of single receptor composition using zero-mode waveguide nanostructures[J]. Nano Lett.,2012,12(7): 3690-3694.
[63] Mehta A D,Rief M,Spudich J A,etal.. Single-molecule biomechanics with optical methods[J]. Science,1999,283:1689-1695.
[64] Masi A,Riccardo C,Adolfo C. Optical methods in the study of protein-protein interactions[A]. In: Becchetti A, Arcangeli A. Integrins and ion channels:Molecular complexes and signaling[M]. NewYork: Springer, 2010,674:33-42.
[65] Jung S O,Ro H S,Kho B H,etal.. Surface plasmon resonance imaging-based protein arrays for high-throughput screening of protein-protein interaction inhibitors[J]. Proteomics,2005, 5(17):4427-4431.
[66] Karlsson R. SPR for molecular interaction analysis:A review of emerging application areas[J]. J. Mol. Recognit.,2004,17:151-161.
[67] Jeon S D,Lee J E,Kim S J,etal.. Analysis of selective,high protein-protein binding interaction of cohesin-dockerin complex using biosensing methods[J]. Biosens. Bioelectron.,2012,35:382-389.
[68] Sameshima T,Iizuka R,Ueno T,etal.. Single-molecule study on the decay process of the football-shaped groel-groes complex using zero-mode waveguides[J]. J. Biol. Chem.,2010,285(30):23159-23164.
[69] Pray T R,Burz D S,Ackers G K. Cooperative non-specific DNA binding by octamerizing lambda cI repressors:A site-specific thermodynamic analysis[J]. J. Mol. Biol.,1998,282:947-958.
[70] Marshall R A,Aitken C E,Dorywalska M,etal.. Translation at the single-molecule level[J]. Annu. Rev. Biochem.,2008,77:177-203.
[71] Uemura S,Aitken C E,Korlach J,etal.. Real-time tRNA transit on single translating ribosomes at codon resolution[J]. Nature,2010,464(7291):1012-1018.
[72] Elting M W,Leslie S R,ChurchmanL S,etal.. Single-molecule fluorescence imaging of processive myosin with enhanced background suppression using linear zero-mode waveguides (ZMWs) and convex lens induced confinement (CLIC)[J]. Opt. Express,2014,21(1):1189-1202.
Zero-Mode Waveguides: the Principle, Fabrication and Application in Detection of Single Fluorescent Molecules
WEI Qing-quan1,3, LI Yun-tao1,3, REN Lu-feng2,3, ZHOU Xiao-guang1,3, YU Yu-de1,3
1.StatekeylaboratoryofIntegratedOptoelectronics,InstituteofSemiconductors,ChineseAcademyofSciences,Beijing100083,China;2.TheDNASequencingTechnologiesR&Dcenter,BeijingInstituteofGenomics,ChineseAcademyofSciences,Beijing100029,China;3.TheJointLaboratoryofBioinformationAcquisitionandSensingTechnology,InstituteofSemiconductors,BeijingInstituteofGenomics,ChineseAcademyofSciences,Beijing100083,China
Techniques for single fluorescent molecules detection have garnered a great amount of interests from science community in recent years largely due to their ability to reveal the individual molecular properties and behaviors which were often obscured by techniques based on ensemble average. In order to overcome diffraction-limit of optical observation, fluorescent molecules must be diluted to a very low concentration-way below normal physiological concentration. However, this may adversely impact the kinetics for the chemical or biochemical reaction under study. Zero-mode waveguides(ZMWs), as a new kind of single fluorescent molecule detection device, effectively reduce the observation volume to the level of zeptoliter (10-21L), which is much lower than optical diffraction-limited volume, by utilizing of a nanoaperture structure. The zeptoliter-observation volume provides an environment where a single fluorescent molecule can be observed at normal physiological concentration. The ZMWs have been extensively used in the field of single fluorescent molecule detection due to its outstanding performance than diffraction-limited optics.Therefore we provided an overview of ZMWs, including discussions on its principle, fabrication techniques, and applications in DNA sequencing, biomembrane structure elucidation, biomacromolecule interaction studies and kinetics study of single-molecule reaction.
zero-mode waveguides;single molecule;nano microstructure devices
2014-11-25; 接受日期:2014-12-04
国家自然科学基金项目(31200643,61275064)资助。
魏清泉,副研究员,博士,主要从事基因测序、单分子荧光检测及生物传感器研究。Tel:010-82304482;E-mail:qingquanwei@semi.ac.cn
10.3969/j.issn.2095-2341.2015.01.02

