糖蛋白激素研究进展
常 亮, 李晨辉, 马志珺, 赵 静, 高 健
华北制药集团新药研究开发有限责任公司, 抗体药物研制国家重点实验室, 石家庄 050015
糖蛋白激素研究进展
常 亮, 李晨辉, 马志珺, 赵 静, 高 健*
华北制药集团新药研究开发有限责任公司, 抗体药物研制国家重点实验室, 石家庄 050015
糖蛋白激素是人体内一类重要激素家族,由4个成员构成—促卵泡激素(FSH)、促黄体素(LH)、促甲状腺激素(TSH)和绒毛膜促性腺激素(CG)。这些激素结构相似,但功能各异。主要从结构方面对糖蛋白激素的亚基装配、受体识别及长效化改造进行分析综述。
糖蛋白激素;结构;受体识别;长效化改造
糖蛋白激素(glycoprotein hormones,GPH)是一类结构相似的激素家族,主要包括由垂体前叶释放的促卵泡激素(follicle-stimulatinghormone,FSH)、促黄体素(luteinizing hormone,LH)和促甲状腺激素(thyroid stimulating hormone, TSH),以及由胎盘合成的绒毛膜促性腺激素(chorionic gonadotropin,CG)。前3种几乎存在于所有脊椎动物中,而CG仅在灵长类和马胎盘中发现。糖蛋白激素是由两个不同的糖基化亚基(α和β亚基)通过非共价作用形成的异二聚体,1994年确定的hCG X-射线晶体结构显示,α和β亚基均含有半胱氨酸结(Cys-knot)核心结构,表明糖蛋白激素属于一类具有典型半胱氨酸结结构花样的蛋白超家族,超家族成员及其受体见图1[1]。像家族其他成员一样,糖蛋白激素具有特异膜受体,受体结合依赖于形成完整的α/β异二聚体。其亚基具有较高的序列及结构相似性,同物种GPH的α亚基完全相同,甚至在所有哺乳动物中α亚基的氨基酸序列都相当保守,而β亚基具有激素特异性和种间特异性,这种特异性与受体的特异识别机制密切相关,决定了激素的生物活性和免疫活性。
1 糖蛋白激素功能
GPH可作用于特定调节腺体、组织或器官,与相应G蛋白偶联受体结合,激活cAMP和磷脂酰肌醇二磷酸等二级信使途径,促进腺体的释放,对生长发育起重要的调节作用[2~5]。促卵泡激素FSH可促进雌性动物子宫内膜生长、排卵、刺激多卵泡发育,与卵泡刺激素受体(follicle stimulating hormone receptor,FSHR)结合后,通过G蛋白偶联机制激活腺苷酸环化酶,使细胞内cAMP增加或引起钙离子内流,从而对细胞的代谢或功能活动产生影响,一方面活化芳香化酶,另一方面诱导LH受体形成。雌激素与FSH协同促进细胞增生和分化、卵泡液形成、卵泡腔扩大,从而使卵泡生长和发育。促黄体生成素LH具有刺激睾丸间质细胞内分泌的作用,在FSH作用基础上,促进卵泡成熟排卵,排卵后使颗粒细胞转变为黄体细胞,并能刺激黄体形成和分泌孕酮;LH还可刺激睾丸间质细胞合成和分泌睾酮,这对副性腺的发育和精子最后形成起决定作用。绒毛膜促性腺激素CG与LH结合同一受体,作用也与之相似,能促使卵泡成熟及排卵,并使破裂卵泡转变为黄体,促使其分泌孕激素。促甲状腺激素TSH与受体(the thyrotropin receptor,TSHR)结合后,经G蛋白介导,通过cAMP或二磷酸肌醇(IP2)途径产生效应,cAMP途径主要促进甲状腺激素分泌,二磷酸肌醇途径可刺激蛋白质碘化,促进甲状腺激素合成。
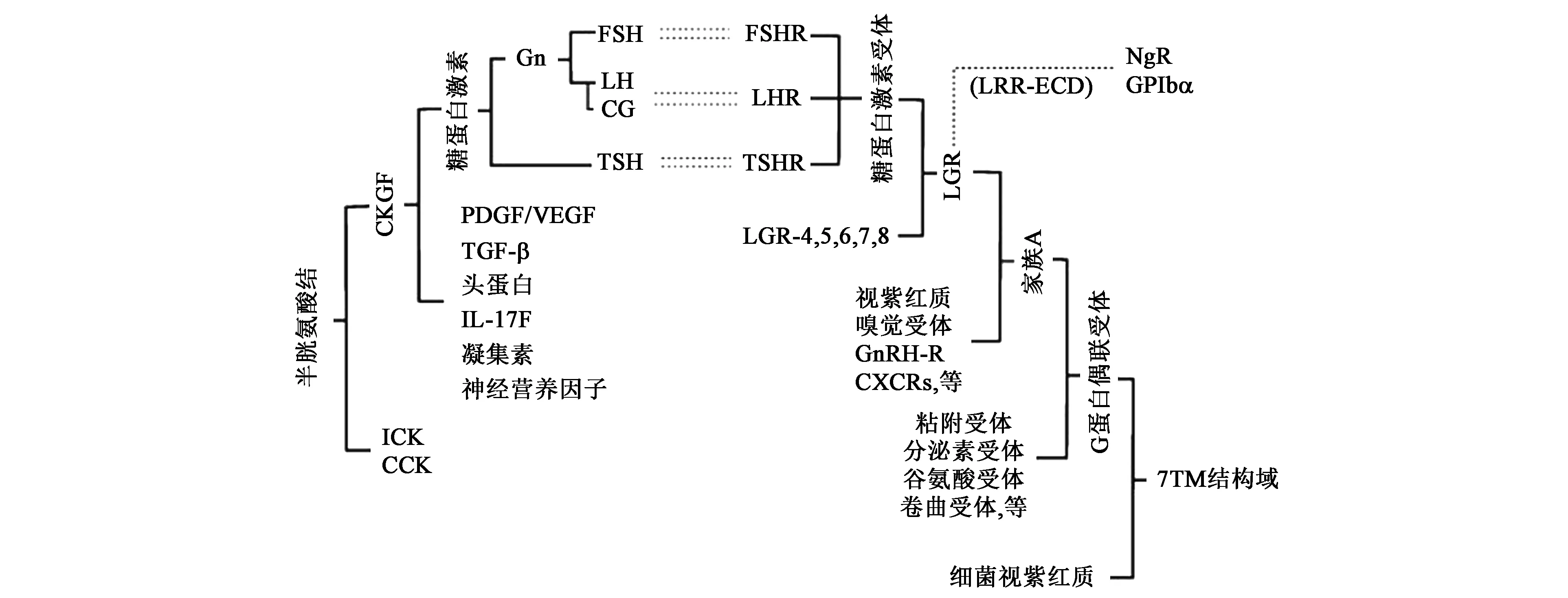
图1 糖蛋白激素及其受体的亲缘关系[1]Fig.1 Phylogenetic relationship of glycoprotein hormones and their receptors[1].该图中使用的缩写如下: Gn,促性腺激素;PDGF,血小板衍生的生长因子;TGF-β,转化生长因子β;IL-17,白细胞介素-17;CKGF,半胱氨酸-结生长因子;ICK,抑制剂胱氨酸结;CCK,循环胱氨酸结;LGR,富含亮氨酸的G蛋白偶合受体包含重复序列;GnRH-R,促性腺激素释放激素受体;CXCR,趋化因子受体;NgR,Nogo受体;GPIbα:血小板糖蛋白Ibα;LRR-ECD:仅就胞外结构域而言,LGRs与Nogo受体和血小板糖蛋白Ibα密切相关。注:实线描绘系统发育分支。单虚线仅涉及胞外结构域。双点划线表示配体-受体的关系。
2 糖蛋白激素结构
2.1 亚基结构
尽管糖蛋白激素家族功能各异,但其结构却极为相似,均由α亚基和β亚基所组成。α亚基的长度较为固定,人的α亚基由92个氨基酸组成,其他哺乳动物多为96个氨基酸;β亚基的长度随物种不同差异较大,TSH-β含112~118个氨基酸,LH-β的氨基酸数目为117~121,FSH-β的为110~111,hCG-β的为145,而马的CG-β/LH-β为149。
GPH的α亚基保守性较高[6],物种间同源性在76%以上,其中57个氨基酸完全保守,10个氨基酸为相似替换,近80%的替换氨基酸仅发生单一编码碱基突变。α亚基均为同一基因编码,含4个外显子区域,含3个不连续结构域α1~10、α11~71、α72~96,序列对比结果表明,不同物种间N端α1~10结构域存在大量变异,人α亚基中该结构域存在4个氨基酸的缺失突变,因此推测该结构域一般不参与受体结合及亚基相互作用。其他两个结构域则高度保守,仅在α68~72和α77~81区域内存在一定突变,此外这两个结构域中存在大量半胱氨酸残基,因此α11~71、α72~96结构域对于受体结合、亚基及激素整体的稳定性、保守性具有重要意义。
β亚基的序列保守性也比较高。不同激素β亚基的物种间同源性与α亚基的相似[7],而不同激素β亚基的序列差异显著,同源性仅为40%~60%,在12个Cys及其附近的氨基酸(β35~37、β70~71和β99)完全保守,其中马的LH-β和CG-β完全相同,β亚基氨基酸序列的这种差异与激素特异活性直接相关。尽管序列同源性不高,但由于β亚基中的半胱氨酸完全保守,所以其空间结构却具有一定相似性。
晶体结构表明糖蛋白激素家族成员具有相似的空间结构[8],两亚基均形成伸长结构(α:60 Å×25 Å×15 Å,β:65 Å×25 Å×20 Å),该结构导致其缺乏疏水核心,α中包埋面积达90%的残基只有4个疏水残基,而β亚基的7个包埋残基中只有2个疏水残基。α、β沿其长轴头尾相接,通过链间氢键等非共价相互作用组装成异二聚体,形成由7个β片层组成的β筒核心结构。与半胱氨酸结家族其他蛋白相似[9],α、β含3个Loop结构(L1、L2和L3),L1、L3位于半胱氨酸结的同侧,L2位于结的另一侧。β亚基C末端的21个氨基酸通过二硫键βCys26-βCys110与L1、L3一同构成的一种称为“安全带”的结构,该结构包裹α亚基的L2组装成为完整激素。此外“安全带”中的一段“决定loop”区对于信号转导具有重要作用。
2.2 Cys-knot结构域
α、β亚基中存在大量Cys,且位置完全保守,这表明所有激素的二硫键结构完全相同[10]。X射线晶体衍射结果显示,亚基内的二硫键分布为:α亚基有5对内二硫键,β亚基有6对内二硫键,α、β均含有半胱氨酸结结构花样(α:Cys10~Cys60、Cys28~Cys82、Cys32~Cys84;β:Cys9~Cys57、Cys34~Cys88、Cys38~Cys90)。研究表明,半胱氨酸结对于激素的正确折叠和异二聚化起着至关重要的作用:β亚基中的6个Cys均与激素功能密切相关;hCG-α亚基Cys32位点突变对于激素分泌和二聚化没有影响,仅降低了受体的结合活性,而其他Cys突变则直接导致α亚基无法分泌。除Cys残基外,α、β中还有许多Pro残基,导致两亚基中形成了许多β折叠,糖蛋白激素中β片层和β折叠结构占60%~80%,而α螺旋的含量仅为5%~8%。二级结构对于激素的生物学活性同样具有重要影响。研究表明,在β43或β48位引入带负电残基会破坏其所在二级结构与受体间的疏水作用,导致受体结合活性下降[11]。
2.3 糖基化类型
糖基化是最常见的蛋白质翻译后修饰,在许多生物过程中发挥了举足轻重的作用,包括蛋白质折叠、细胞间识别、免疫监视、激素活动和炎症反应等。
研究表明,GPH糖链对于激素折叠、胞内分选及储存、受体识别与活化及激素代谢清除等过程具有重要作用[12~14]。GPH糖基化形式非常复杂,其N糖链大小及电荷差异较大,可分为3个类型。第一类为高度甘露糖型,其七糖核心仅与甘露糖和N-乙酰葡萄糖胺链相连;第二类为复杂型,多为戊糖核心,支链类型复杂,通常含岩藻糖及唾液酸-半乳糖-N-乙酰葡萄糖胺的三糖结构;第三类为混合型,综合了第一类和第二类的特点。与N糖链不同,O糖链不存在糖基核心区域。对于同一种激素,唾液酸含量、糖链长度、支链类型存在很大差异,据估计LH与FSH至少存在近百种亚型[15]。
α亚基含两个N连接糖基化位点,分别是Asn 52和Asn 78,这两个位点在脊椎动物中完全保守。β亚基含1~2个N-糖基化位点,动物的LH 与TSH-β亚基上的糖链通常分别位于Asn13与Asn 23,人LH-β亚基糖链则位于Asn 30;hCG与FSH-β亚基有两条糖链,hCG的糖链位于Asn 13与Asn 30,FSH的位于Asn 7与Asn 24。大部分位点的N-糖链缺失对于受体亲和力并没有影响,但α52位点糖基缺失会导致hCG和FSH体外活性的明显降低[16]。此外,糖链末端残基类型也会影响受体识别,hCG和hLH经去唾液酸化和去岩藻糖化处理可略微增强其受体结合活性,这可能是由于这些残基对激素的整体构象有一些影响。hCG-β亚基C末端存在一个29个氨基酸长的序列,该序列具有4个O-糖链连接于丝氨酸残基,称为CTP(carboxyl-terminal peptide)。马LH-β和CG-β的C末端也存在至少4个O-糖基化位点。O-糖链对于GPH的体内活性及半衰期作用显著,但对于其体外活性以及受体结合则没有太大影响。
3 糖蛋白激素与受体识别
糖蛋白激素通过与特异G蛋白偶联受体结合来介导不同的生理反应,GPH受体大致可分为3个结构域:N端胞外区(340~390个氨基酸)、连续7个疏水跨膜区(seven hydrophobic transmembrane domain,7 TM)和C 端胞内区。与激素相同,其受体也具有较高的序列同源性,受体胞外区序列相似性接近40%,且含有大量富含亮氨酸的重复序列[17,18]及糖基化位点。FSHR上有3个N糖链位点,TSHR有5个,LH/CGR有6个。其中Asn 173位点完全保守,Asn 152和Asn 278位点在TSHR和LH/CGR中保守。7 TM跨膜区的序列相似度可达60%~70%,具有G蛋白偶联受体家族的特点——连续7个疏水α螺旋结构,与G蛋白活化相关[19]。胞内区长度变化较大,序列同源性仅为40%,含有大量磷酸化位点和碱性氨基酸,负责G蛋白相互作用和信号转导。
α亚基和β亚基单独都不具有生物活性,当两者结合使空间结构发生改变后才具有生物活性。一般认为,α亚基负责信号传导作用,而β亚基是功能亚基,参与受体结合;后经研究发现α亚基和β亚基均参加受体结合和信号传导作用。Kohn[20]最先提出了“棒球—手套”的激素—受体识别模型,并进行了改进。该模型认为,GPH受体胞外区首先形成一个结合口袋,形成该结合口袋的一些区域在不同受体间具有保守性,另一些具有激素特异性,当与GPH形成复合物后,发生变构将α亚基递呈至受体跨膜区的“外环”exo-loop结构附近,α亚基上“CPEC”基序与跨膜区和G蛋白相互作用触发胞内信号转导。Combarnous等[21]在此基础上提出“负特异”模型,认为高度保守的α亚基负责受体的高亲和力结合,β亚基决定受体结合的特异性,在β亚基上包含许多抑制性位点,可以削弱GPH与非特异受体之间的相互作用。一些免疫学和糖链研究结论则支持“U形受体”模型[22,23],认为GPH受体胞外区形成U或J型结构,GPH结合于受体的弯曲口袋内,不直接与跨膜区exo-loop结构接近,而通过一系列变构作用将信号进行转导,α亚基Asn 52上的糖基对激素受体结合有一定的空间位阻效应,Asn 78的位阻效应则不明显。
晶体学研究更清晰地揭示了亚基结合、受体识别及活化过程中的分子机制[24,25]。α亚基中分别位于α33~51和C末端α81~92的两段不连续区域在受体识别中起主要作用,在哺乳动物中这两个区域同源性分别为92%和70%。点突变实验表明,不同激素该区域中的关键氨基酸具有较大差异。α33~51区域参与β亚基识别、受体结合及活化。hCG的α35~39区域参与β亚基二聚化组装,两端的33~35和44位点,对于受体结合亲和力具有明显影响。FSH和TSH的二聚化区域为α36~39,其中参与受体结合的Pro 38残基在所有GPH中完全保守,其他残基的作用在不同激素中则不尽相同,例如hCG二聚关键位点Ala 36和Lys 45对于TSH、FSH则无明显作用,FSH二聚关键位点为Phe 33和Arg 35。TSH的受体结合区域集中于位点42~44,该区域内的带正电残基介导了与受体之间的相互作用。FSH该区域内大部分残基不直接参与受体结合(34~45),丙氨酸突变实验表明其羧基端3个连续氨基酸(49Val-Gln-Lys51)对于受体结合具有显著影响。此外α33~51还是受体活化的关键区域,实验表明,TSHα的Arg 35、 Ala 36位点虽不参与受体识别,但影响第二信使cAMP的活化。α亚基C末端对于受体结合及活化起重要作用。免疫学研究表明GPH的C末端与受体结合相关,识别hFSH-α亚基C端的单克隆抗体可以抑制其与受体的结合,hCG/LH结果相似,TSH结果则相反。蛋白融合实验也获得了相同的结果,将hCG的β亚基C端融合于α亚基的N端或C端,N端融合蛋白具有与野生型相似的受体亲和力,而C端融合蛋白的受体亲和力则明显下降。其中Tyr 88和Tyr 89对于hCG受体的结合和活化作用显著,90~92区段对于FSH受体识别的作用显著,对于hCG的影响则不明显,而对于两者后续第二信使的活化均具有明显作用。尽管TSH-α的C末端对于受体结合影响不大,但TSH-α的90~92位点对于激素的生物学活性却具有直接的影响。
β亚基中多个区域参与受体的结合,包括1~15、“CAGY”区、38~57、76~80、93~100和101~119。许多实验证实β亚基N端参与受体识别,如TSH-β的1~25和FSH-β的1~15。LH/CG-β的N端也具有相同功能,其中β2位点的碱性氨基酸(K/R)起关键作用,该位点氨基酸置换为带负电氨基酸会使激素的受体结合活性和生物学活性明显降低;β8和β15位点氨基酸类型对于激素活性也具有一定的作用。位于第2、第3 Cys之间的“35AGY37”序列在哺乳动物GPH中完全保守,其中Gly36对于“Cys knot”的结构稳定性起关键作用,Tyr37对于亚基间的相互作用具有一定影响。β38~57区域不同激素间序列同源性较低,被认为参与介导与受体的特异结合,其中一些连续4肽与激素的受体识别有一定相关性。TSH-β76~80(LH/CG-β81~85)空间上与受体结合区α33~51接近,具有较高的序列保守性(基序为T/S-Y/F-P/A-V-A),76、80位点上引入的突变会使激素受体亲和力降低,推测可能是通过影响亚基间相互作用而导致的。hCGβ的C端“决定区loop”(93~100)参与hCGR的结合,不同激素该区域具有不同的电荷特性(LH/CG为0或1,TSH为-2,FSH为-3),然而实验表明该区域中的带电残基与受体的特异结合没有直接关系,此外TSH中该区域对于受体结合作用也不明显。Campbell等[26]发现,将FSHβ的C端(94~114)与hCG1~93相连构建的嵌合激素具有完全的FSH活性,进一步研究发现FSHβ95~100、TSHβ101~112以及LH/CG的C端区域均与受体结合直接相关,这表明激素β亚基C末端对于GPH与受体结合的特异性具有直接决定作用。
4 长效糖蛋白激素药物的研发
目前4种GPH均已应用于临床治疗[27]。FSH临床上常用于不孕症治疗及辅助生殖技术,可刺激女性卵泡发育及促进男性性腺功能,LH常与FSH协同使用。经FSH治疗后,使用CG可促进排卵及提高精子数量。TSH主要用于甲状腺癌患者的术后治疗,便于监测癌变组织,并对其具有一定抑制作用。其中,FSH的临床应用最为广泛。最早通过脑垂体提取FSH,随后尿液作为了提取FSH的广泛原料,现今利用基因工程技术开发的重组人促卵泡激素(recombinant human follicle-stimulating hormone,rhFSH)逐渐取代了尿源FSH制品。然而尿源FSH和rFSH体内半衰期较短、患者依从性差,因此高活性、长效性FSH突变体成为了研究开发的关注点。已报道的主要抗体改造方法包括多肽融合、定点突变、Fc融合及聚乙二醇化等,通过增加GPH糖基化水平、与Fc段融合或进行聚乙二醇化等修饰来延长其体内半衰期[28]。
融合多肽及点突变以增加GPH糖基化水平的方法研究较为深入。研究发现,hCGβ亚基C末端CTP序列对于激素亚基组装、受体结合没有影响,但对于激素分泌、体内活性及半衰期影响显著[29]。CTP上存在4个O-糖基化位点,O-糖链的位阻效应及末端唾液酸有利于降低激素体内清除率和蛋白酶降解。将CTP融合于GPH可显著提高其活性及体内半衰期,但融合位点对效果影响较大。由于α亚基C端参与激素组装,因此CTP融合于α亚基C端的αC糖基化水平及半衰期明显低于融合于N端的Cα[30]。将CTP序列融合至FSH-β亚基的C末端,或进一步融合α亚基形成βαC单链FSH[31],可提高激素的分泌水平及体内半衰期。2010年上市的Corifollitropin alfa就是通过FSHβ亚基C末端融合CTP序列获得的长效rhFSH,该产品每周注射一次,相比每日一次的rhFSH,顺从性得到了极大改善,并且在安全性和有效性方面没有明显差异[32]。通过点突变引入N-糖基化位点也可以改善GPH体内半衰期。通过在亚基N端引入含有N糖链的序列[33],或提高单链GPH连接linker的N糖基化水平[34],改造后的GPH糖基化程度和半衰期均有明显提高,但两者之间不存在线性关系。
Fc融合及聚乙二醇化是延长药物体内半衰期的常用方法,对于GPH也同样适用。将FSH两个亚基分别与免疫球蛋白Fc片段进行融合形成异源二聚体FSH-Fc,或将单链FSH与Fc进行融合,均可以提供更长的半衰期及更高的体内活性,由于存在长度适合的Linker,融合于C端的Fc并没有对α亚基结构产生影响[35]。而聚乙二醇化等修饰也可使FSH半衰期大大提高[36]。
5 展望
糖蛋白激素是人体内一类重要的激素蛋白,在进化及结构方面均具有其特殊性,通过与特异G蛋白偶联受体作用调控多种腺体分泌,对生长发育具有重要调节作用,在临床治疗及畜牧业生产等多方面具有重要的应用价值。随着生物技术的发展和结构研究的深入,人们对糖蛋白激素及其受体的认识逐步提高,对其表达装配、受体识别及信号转导的研究达到了分子水平。在此基础上,对GPH进行的长效化等工程化改造进一步提高了其应用价值。然而由于与功能密切相关的GPH糖基化的程度差异较大、结构复杂,所以对于其糖基化水平的分析技术及均一化改造还需进一步深入研究。
[1] Jiang X,Dias J A,He X. Structural biology of glycoprotein hormones and their receptors:Insights to signaling[J]. Mol. Cell Endocrinol.,2014,382(1):424-451.
[2] Raz T,Amorim M D,Stover B C,etal.. Ovulation,pregnancy rate and early embryonic development in vernal transitional mares treated with equine- or porcine-FSH[J]. Reprod. Domest. Anim.,2010,45(2):287-294.
[3] Thackray V G,Mellon P L,Coss D. Hormones in synergy:Regulation of the pituitary gonadotropin genes[J]. Mol. Cell Endocrinol.,2010,314(2):192-203.
[4] Cole L A. Hyperglycosylated hCG, a review[J]. Placenta,2010,31(8):653-664.
[5] Molinaro E,Viola D,Passannanti P,etal.. Recombinant human TSH (rhTSH) in 2009:New perspectives in diagnosis and therapy[J]. Q. J. Nucl. Med. Mol. Imaging,2009,53(5):490-502.
[6] Roch G J,Sherwood N M. Glycoprotein hormones and their receptors emerged at the origin of metazoans[J]. Genome Biol. Evol.,2014,6(6):1466-1479.
[7] Bousfield G R,Dias J A. Synthesis and secretion of gonadotropins including structure-function correlates[J]. Rev. Endocr. Metab. Disord.,2011,12(4):289-302.
[8] Wu H,Lustbader J W,Liu Y,etal.. Structure of human chorionic gonadotrophin at 2.6 Å resolution from MAD analysis of the selenomethionyl protein[J]. Structure,1994,2(6):545-558.
[9] Shim A H,Liu H,Focia P J,etal.. Structures of a plateletderived growth factor/propeptide complex and a platelet-derived growth factor/receptor complex[J]. Proc. Natl. Acad. Sci. USA,2010,107(25):11307-11312.
[10] Chen P H,Chen X,He X. Platelet-derived growth factors and their receptors:Structural and functional perspectives[J]. Biochim. Biophys. Acta., 2013,1834(10):2176-2186.
[11] Roth K E,Dias J A. Follitropin conformational stability mediated by loop 2β effects follitropin-receptor interaction[J]. Biochemistry,1996,35:7928-7935.
[12] Dalpathado D S,Irungu J,Go E P,etal.. Comparative glycomics of the glycoprotein follicle stimulating hormone:Glycopeptide analysis of isolates from two mammalian species[J]. Biochemistry,2006,45(28):8665-8673.
[13] Wehbi V,Tranchant T,Durand G,etal.. Partially deglycosylated equine LH preferentially activates beta-arrestin-dependent signaling at the follicle-stimulating hormone receptor[J]. Mol. Endocrinol.,2010,24(3):561-573.
[14] Bousfield G R,Butnev V Y,Butnev V Y,etal.. Hypo-glycosylated human follicle-stimulating hormone (hFSH(21/18)) is much more activeinvitrothan fully-glycosylated hFSH (hFSH(24)) [J]. Mol. Cell Endocrinol.,2014,382(2):989-997.
[15] Bousfield G R,Baker V L,Gotschall R R,etal.. Carbohydrate analysis of glycoprotein hormones[J]. Methods,2000,21(1):15-39.
[16] Fares F. The role of O-linked and N-linked oligosaccharides on the structurefunction of glycoprotein hormones:Development of agonists and antagonists[J]. Biochim. Biophys. Acta,2006,1760:560-567.
[17] Chen P H,Chen X,Lin Z,etal.. The structural basis of R-spondin recognition by LGR5 and RNF43[J]. Genes,2013,27:1345-1350.
[18] Wang D, Huang B, Zhang S,etal.. Structural basis for R-spondin recognition by LGR4/5/6 receptors[J]. Genes, 2013, 27:1339-1344.
[19] Pierce K L,Premont R T,Lefkowitz R J. Seven-transmembrane receptors[J]. Nat. Rev. Mol. Cell Biol.,2002,3(9):639-650.
[20] Kohn L D. Relationships in the structure and function of receptors for glycoprotein hormones,bacterial toxins,and interferon[A]. In:Cuatrecasas P, Greaves M F. Receptors and Recognition[M]. London: Chapman & Hall,1978,5:133-212.
[21] Combarnous Y,Guillou F,Martinat N. Comparison ofinvitrofollicle stimulating hormone (FSH) activity of equinegonadotropins (luteinizing hormone, FSH,and chorionic gonadotropin) in male and female rats[J]. Endocrinology,1984,115:1821-1827.
[22] Cosowsky L,Rao S N V,MacDonald G J,etal.. The groove between the a- and b-subunits of hormones with lutropin (LH) activity appears to contact the LH receptor, and its conformation is changed during hormone binding[J]. J. Biol. Chem.,1995,270:20011-20019.
[23] Moyle W R,Campbell R K,Rao S N V,etal.. Model of human chorionic gonadotropin and lutropin receptor interaction that explains signal transduction of the glycoprotein hormones[J]. J. Biol. Chem.,1995,270(34):20020-20031.
[24] Dias J A. Endocrinology:Fertility hormone in repose[J]. Nature, 2005,433:203-204.
[25] Fan Q R,Hendrickson W A. Structure of human follicle-stimulating hormone in complex with its receptor[J]. Nature,2005,433:269-277.
[26] Campbell R K,Dean-Emig D M,Moyle W R. Conversion of human choriogonadotropin into a follitropin by protein engineering[J]. Proc. Natl. Acad. Sci. USA,1991, 88:760-764.
[27] PDR. Physicians’ Desk Reference 2013[M]. (2013 edn).New Jersey:PDR Network,2012.
[28] Diao Y,Lin J S. The molecular design and drug development of recombinant long-acting follicle stimulating hormone[J]. Yao Xue Xue Bao,2012,47(4):421-426.
[29]Ben-Menahem D,Grotjan H E. Strategies for construction of luteinizing hormone beta subunit analogs with carboxylterminal extensions in non-primate, non-equid mammalianspecies[J]. Mol. Cell Endocrinol.,2007,260-262: 205-211.
[30] Furuhashi M,Suganuma N. Processing of O-linked glycosylation in the chimera consisting of alpha-subunit and carboxylterminal peptide of the human chorionic gonadotropin betasubunit is affected by dimer formation with follicle-stimulating hormone beta-subunit[J]. Endocr. J.,2004,51(1):53-59.
[31] Klein J,Lobel L,Pollak S,etal.. Pharmacokinetics and pharmacodynamics of single-chain recombinant human follicle-stimulating hormone containing the human chorionic gonadotropin carboxyterminal peptide in the rhesus monkey[J]. Fertil. Steril.,2002,77:1248-1255.
[32] Pouwer A W,Farquhar C,Kremer J A. Long-acting FSH versus daily FSH for women undergoing assisted reproduction[J]. Cochrane Database Syst. Rev.,2012, 6:CD009577.
[33] Perlman S,van den Hazel B,Christiansen J,etal.. Glycosylation of an N-terminal extension prolongs the half-life and increases theinvivoactivity of follicle stimulating hormone[J]. J. Clin. Endocrinol. Metab.,2003,88:3227-3235.
[34] Klein J,Lobel L,Pollak S,etal.. Development and characterization of a long-acting recombinant hFSH agonist[J]. Hum. Reprod.,2003,18(1):50-56.
[35] Low S C,Nunes S L,Bitonti A J,etal.. Oral and pulmonary delivery of FSH-Fc fusion proteins via neonatal Fc receptormediated transcytosis[J]. Hum. Reprod.,2005,20:1805-1813.
[36] Uchiyama Y,Hosoe M,Sato T,etal.. Biological and immunological characteristics of porcine follicle-stimulating hormone chemically modified with a polyethylene glycol derivative[J]. Vet. J.,2010,184(2):208-211.
Progress on Glycoprotein Hormones
CHANG Liang, LI Chen-hui, MA Zhi-jun, ZHAO Jing, GAO Jian*
StateKeyLaboratoryofAntibodyResearchandDevelopment,NewDrugResearchandDevelopmentCo.Lt.,NorthChinaPharmaceuticalCorporation,Shijiazhuang050051,China
Glycoprotein hormone (GPH) is a kind of important human hormones family, which consist of four members of—FSH, LH, CG and TSH. The structures of these GPHs are similar, but the functions are different. This paper mainly reviewed on the structure, subunits assembly, receptors recognition, and long-acting engineering of glycoprotein hormones.
glycoprotein hormone; structure; receptor recognition; long-acting engineering
2014-10-09; 接受日期:2014-10-24
国家863计划项目(2012AA02A306)资助。
常亮,工程师,主要从事蛋白药物研究。E-mail:15511802735@163.com。*通信作者:高健,高级工程师,主要从事蛋白药物研究。E-mail:gaojian1972@aliyun.cn
10.3969/j.issn.2095-2341.2015.01.03

