生物标志化合物在湖泊环境的应用研究
杨帆 (油气资源与探测国家重点实验室(中国石油大学);中国石油大学地球科学学院,北京 102249)
冯一璟 (中国石油大学机械与储运工程学院,北京 102249)
张琪琛 (西南石油大学地球科学与技术学院,四川 成都 610500)
生物标志化合物在湖泊环境的应用研究
杨帆(油气资源与探测国家重点实验室(中国石油大学);中国石油大学地球科学学院,北京 102249)
冯一璟(中国石油大学机械与储运工程学院,北京 102249)
张琪琛(西南石油大学地球科学与技术学院,四川 成都 610500)
[摘要]陆相烃源岩发育在湖盆内,古时湖泊的水体性质及沉积环境是影响烃源岩发育质量的重要因素,分子化石(生物标志物)作为历史遗存下的产物,更能准确科学地表现古湖泊环境的变化。通过介绍姥鲛烷与植烷、C35升藿烷、重排甾烷/甾烷和伽马蜡烷4个具有环境指示意义的生物标志物参数,确定其都与湖泊沉积环境相关,可以反映古湖泊水体的化学性质,对它们的生物来源,成岩过程、与古环境的关系进行了研究述评。
[关键词]生物标志物;姥鲛烷与植烷;C35升藿烷比值;重排甾烷/甾烷;伽马蜡烷;古湖泊沉积环境
生物标志物又称分子化石,是古代生物在地层中除了实体化石、铸模化石和遗迹化石外另一种重要的赋存形式[1]。生物标志化合物是曾经有过生命的生物体中的生物化学物质演变成岩而成的[2]。因原油和烃源岩的抽提物中都能检测到这些物质,所以通常用于鉴别油-源关系。可应用生物标志化合物的分布特征、结构演化模式及其参数变化判识地质体中有机质的沉积古环境,进而来说明湖泊的古环境变化[3]。对于烃源岩发育模式的研究具有基础指导意义。
目前,大部分具有环境指示意义的生物标志物与环境的关系已经有了清楚的解释,但前驱物确定和生物体向地质体演化过程中环境的具体影响作用机理仍有待深入研究。下面,笔者针对其中4种研究已经非常深入的生物标志物参数来评述其与沉积环境的关系并提出应用时需要考虑的一些问题。
1姥鲛烷与植烷
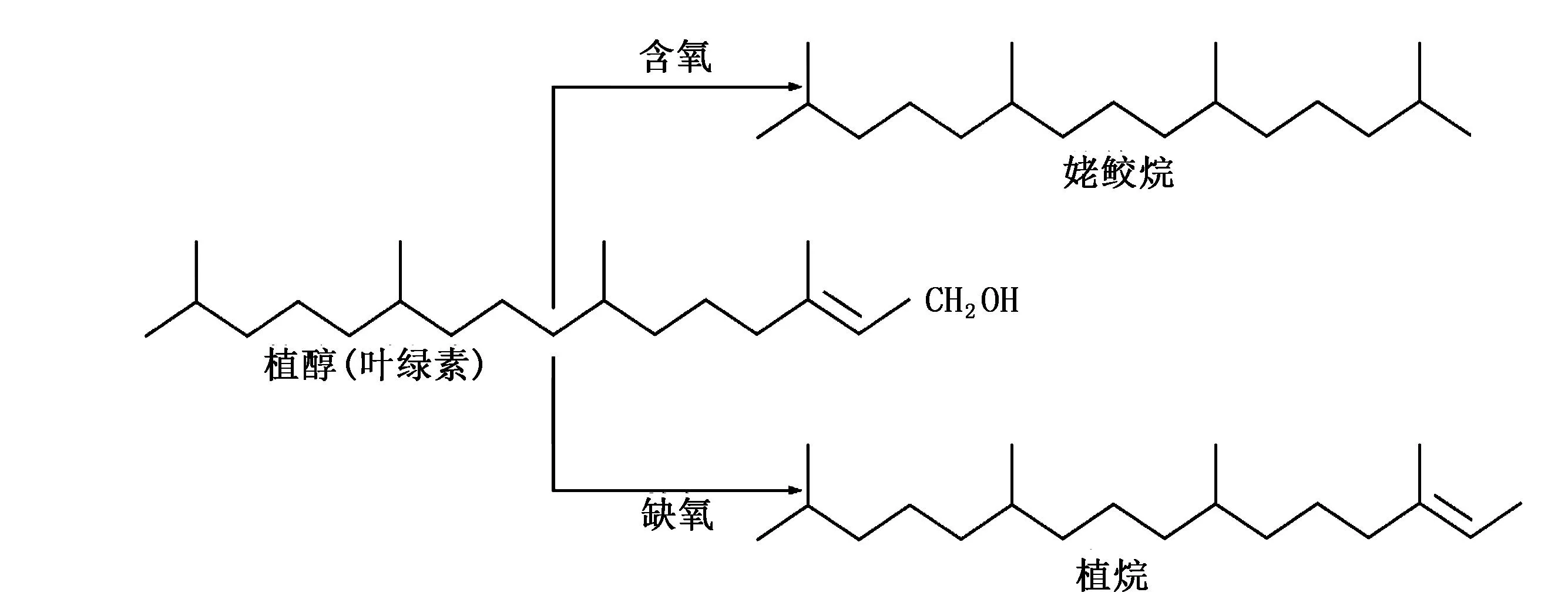
图1 植醇向姥鲛烷和植烷转化过程图
姥鲛烷、植烷及其比值Pr/Ph常作为判断湖泊氧化-还原性的指标。姥鲛烷和植烷都是无环类规则异戊二烯,它们最主要的来源是光合生物中叶绿素a以及紫硫细菌中细菌叶绿素a和b的植基侧链[4]。沉积物经微生物作用,植基侧链易于发生断裂生成植醇,植醇在还原环境进一步加氢、脱水还原形成植烷。而在氧化条件下则促使植醇先被氧化,形成植酸,植酸脱羧基形成姥鲛烯,最后加氢成姥鲛烷[2]。根据姥鲛烷和植烷形成的过程(见图1)可以看出,还原环境会形成更多的植烷,弱氧化-氧化环境则更易形成姥鲛烷。在高盐度强还原环境下,通常出现强烈的植烷优势,是嗜盐菌或者产甲烷菌成为沉积有机质后经过降解释放大量植烷造成的。高的Pr/Ph指示氧化环境,低的Pr/Ph指示有机质形成于还原环境[5]。一般认为,Pr/Ph<3为还原环境,Pr/Ph>3为弱氧化-氧化环境。
然而,对于姥鲛烷和植烷及其比值的应用还存在一些值得注意的问题,这些问题也将影响姥鲛烷和植烷的分布特征:
1)姥鲛烷和植烷的生物来源多样,除了叶绿素,很多生物体内分子也能经成岩演化形成姥鲛烷或植烷,如浮游动物中的不饱和类异戊二烯[6]、古细菌醚类脂物[7]。姥鲛烷、植烷的前身二氢植醇也是干酪根的组分之一。多源性意味着其存在地质体中的数量不只是受到沉积环境的控制。
2)刘宝泉等[8]对饶阳凹陷的烃源岩研究发现,在热演化早期(镜质体反射率Ro在0.34%~0.5%),Pr/Ph、Pr/nC17和Ph/nC18比值增大,之后(Ro在0.5%~1.0%)比值减小并趋于稳定。陈海树[9]对四川盆地古生界至中生界的烃源岩进行研究,发现在过熟到生干气阶段(Pr/Ph)比值减小,Pr/nC17和Ph/nC18比值增加。这些现象都反映Pr、Ph的含量受到成熟度影响。在低热成熟阶段,因为干酪根的裂解产生大量类异戊二烯烃,Pr/nC17和Ph/nC18比值增大,随着成熟度增大,到了过成熟阶段,长链的正构烷烃(nC17、nC18等)裂解成短链,Pr/nC17和Ph/nC18比值增加。Pr/Ph的大小与有机质成熟度也存在一定联系,随成熟度的增加,Pr/Ph会先上升,在生油门限附近到达最高值,之后下降并趋于稳定。在四川盆地的研究中发现过成熟阶段Pr/Ph会略微增大。Burnham等[10,11]认为这种Pr/Ph比值变化是由干酪根中姥鲛烷前驱物和植烷前驱物释放顺序的先后造成的。
由此可以看出,姥鲛烷和植烷存在于地质体中的数量不仅受到沉积环境的控制,还受到其他先驱物输入和成熟度的影响。因此,利用Pr/Ph大小来判识沉积环境时,需要考虑到上述因素对于比值的影响。
2C35升藿烷比值
C31-C35升藿烷主要来自细菌藿四醇和其他常见于微生物体中的多官能团藿烷类化合物[12]。强还原环境下C35升藿烷会较高,可能在该环境下更利于C35以上长链藿烷的富集和保存。综合来说,C35升藿烷在强还原或者高盐度环境下数量更多,对于湖泊沉积环境也有一定指示意义,能够利用C35升藿烷比值(C35/∑(C31-C35)或C35/C34)来反映古湖泊环境的氧化还原性。
升藿烷与环境的相关性,具体演化过程还未研究清楚。因此,应用时需要考虑多种因素。当环境中存在氧时,会将生物前驱物细菌霍四醇氧化形成一种带羧基的C32化合物或者继续氧化脱羧形成C31升藿烷,C33、C34、C35含量微少。因此,当存在高碳数升藿烷同系物时,水体内应该存在不含氧或者少量氧的环境。这种高碳数升藿数优势也可能受前驱物输入数量差别的影响。另外,升藿烷比值受成熟度变化的影响,随成熟度增大,升藿烷比值会降低。Köster等[13]认为C31-C35藿烷类同系化合物以C—S键与芳香结构连接的数量随碳数增加而增加, C35藿烷以C—S键与芳香结构相连的数量在升藿烷同系物中最多。藿烷低熟时C—S的优先断裂使C35升藿烷数量相对多。而低碳数升藿烷多是通过C—C键与芳香结构相连并且后生作用下C—C键断裂形成低碳数升藿烷优势。所以可能形成C35升藿烷比值随成熟度增大而降低的现象。
陈中红、金强等[14]在对东营凹陷升藿烷演变规律的研究中发现,在高盐强还原环境下,C31-C35升藿烷数量都出现不同程度的“逆转”下降。他们认为高盐环境中盐类矿物的抑制作用和迟缓效应可能造成了这种“逆转”现象。还有类似的盐类矿物富集造成源岩有机质热演化和石油形成的滞后现象在一些文章中提到[15,16~18]。该“逆转”现象并没有影响在高盐环境下C35/∑(C31-C35)比值的升高。此外,通常认为22S异构体是由22R异构体在后生作用中演变形成的,结构更稳定,所以大多使用22S的异构体来计算升藿烷比值,但实验发现升藿烷比值C35/∑(C31-C35)在高盐环境的变化趋势更接近C35R/∑(C31R-C35R),并且C35R/∑(C31R-C35R)对环境反应比C35S/∑(C31S-C35S)更明显。据陈中红研究,异构体之间的关系不仅在构型转化,不同异构体的丰度随环境变化减少和增加的速率也存在差异。
3重排甾烷/甾烷
黏土矿物中的酸性矿物如蒙脱石或伊利石在成岩作用阶段可以催化甾醇碳骨架重排形成重排甾烯[19,20]。Bebbett和Olsen(2007)[21]将C27重排甾烷/C27规则甾烷(以下简写为C27Dia/C27ST)作为判别烃源岩岩性的指标,碳酸盐岩这种贫黏土烃源岩C27Dia/C27ST显示低值。重排甾烷的相对高值被认为是烃源岩富黏土的证据。Moldowan,Brincat等[22,23]认为酸性和氧化条件下会加强成岩过程中重排甾烯的生成,最终还原成重排甾烷。因此C27Dia/C27ST值可以反映沉积环境氧化还原性,其值越高,代表沉积水体是氧化的;其值较低,则代表还原的。
一般认为,黏土中的酸性矿物在成岩阶段会促进重排甾烷的形成。但弗罗里达州贫黏土灰岩[24]和BlackCreek盆地蒸发岩[25]发现较高含量的重排甾烷都与黏土论相悖。朱扬明等[26]研究陆东凹陷上侏罗统烃源岩样品发现重排甾烷的分布与黏土矿物的组成关系不密切。van Kaam-Peters H M E等[27]认为这种与黏土的不相关现象是因为酸性催化过程不受岩石中黏土的绝对含量控制,而主要受到黏土占岩石中总有机碳的比例控制。也就是说重排甾烷的含量与黏土/总有机碳(clay/TOC)具有相关性。黏土矿物的酸性催化作用是重排甾烷形成的一方面影响因素,另一方面沉积环境的氧化还原性对这种酸性催化过程存在控制作用,在缺氧强还原环境下对催化过程有抑制作用,在有氧弱氧化-氧化环境中加强催化作用。重排甾烷抗氧化能力更强,氧化环境下重排甾烷保留的量更大,使得C27Dia/C27ST会更大。另外在高热演化阶段,地层中的水为重排过程提供氢原子,使得碳骨架上的重排成为可能[27],成熟度同样影响重排甾烷的数量。
4伽马蜡烷
伽马蜡烷是C30的非藿烷五环三萜类,其经常出现在高盐度的沉积物中[28]。因此非海相的湖泊沉积物中发现高含量的伽马蜡烷一般认为是具有高盐度水体,并且其含量可以反映沉积盆地水体古盐度的变化[29]。另有研究指出伽马蜡烷与水体分层相关,高盐环境通常存在稳定的密度分层,所以高盐环境会伴随高的伽马蜡烷含量。伽马蜡烷前身物四膜虫醇经过脱水和加氢作用形成伽马蜡烷[30]。四膜虫醇分布的非常广泛,在高山条蕨[31]、原生动物[32]、光合硫细菌[33]、淡水纤毛虫[34]中都有发现,因此伽马蜡烷在淡水和咸水都有保存,但如今发现多在高盐度的水体中。伽马蜡烷的前身物四膜虫醇还来源于一些厌氧的食菌纤毛虫,这些纤毛虫主要以绿硫细菌、紫硫细菌为食,黑海的化跃面及其底部分层水体中的食菌纤毛虫主要以硫氧化细菌为食。在Priest pot缺氧的分层湖中,厌氧纤毛虫以光合紫硫细菌为食[35]。当食物源缺少甾醇,主要以细菌为主时,纤毛虫便会生物合成四膜虫醇来取代生物体细胞膜中的某些甾醇[36]。而这种以细菌为主,不含甾醇的沉积物的环境只出现在化跃面及底部的缺氧环境,底部缺氧环境又指示了水体分层的现象。Sinninghe Damste等[37]研究蒸发环境下的沉积的泥灰岩发现其中伽马蜡烷和异海绵烷的碳同位素比来自藻类和细菌的甾烷、藿烷的碳同位素值更重,主要原因是绿硫细菌等通过逆-TCA旋回固定CO2,使其生物体常富集13C,导致绿硫细菌色素的成岩产物异海绵烷的碳同位素较重,以绿硫细菌为食的食菌纤毛虫的类脂化合物四膜虫醇也会富集重碳同位素,这也证实了伽马蜡烷更多来自食菌纤毛虫的观点。
松辽盆地是淡水-微咸水湖盆,但其原油样品伽马蜡烷也较高,伽马蜡烷指数(伽马蜡烷/C30藿烷)在0.15~0.30,该数值甚至比一些海相页岩来源的油和蒸发环境沉积的源岩来源的原油更高,这就与高含量伽马蜡烷是高盐度环境的特征的观点相悖。松辽盆地沉积湖盆青山口组沉积时气候潮湿,陆地水流供应充足,但东面的伊蓝伊通地堑与海相连通,盐度较高的海水流入湖盆,使得湖盆出现稳定的密度分层,但因为陆地水流充足,使得湖盆水体盐度并不高。来源于松辽盆地微咸水沉积环境下的烃源岩的原油却有较高的伽马蜡烷指数,这也说明伽马蜡烷与高盐度沉积环境没有必然联系,主要保存在出现过水体分层的沉积环境中[28]。
综上所述,伽马蜡烷的出现与高盐度没有绝对关系,通过微生物学和碳同位素的现象说明主要是来源水体分层产生的前驱物(即食菌纤毛虫的四膜虫醇)。因此,伽马蜡烷的出现更应该被认作一种水体分层现象的标志。
5认识及展望
1)姥鲛烷与植烷、C35升藿烷、重排甾烷/甾烷和伽马蜡烷4个生物标志物参数都与湖泊沉积环境相关,可以反映古湖泊水体的化学性质,包括氧化还原性、古水体盐度和水体分层情况等,但生物标志物的演化形成又同时受到其他因素(如其他生物前驱物来源和热演化过程)的综合影响。应用时需要结合多参数进行综合分析判定。
2)一个生物标志物常存在多种异构体,可能是不同成岩演变过程中同时产生,也可能是原有的生物构型经地质演化形成新的地质构型异构体。目前对于不同化合物异构体之间的差异研究还不深入,应用时就很难筛选出对环境更敏感的异构体来计算参数并表征环境。
3)除上述4个主要生物标志物参数外,长链三环萜皖比值(ETR)、孕(升孕)甾烷、脱羟基维生素E(MTTC)和芴系列等其他生物标志物参数同样对古湖泊环境具有一定的指示意义,但存在不确定因素,不能有效或者普遍适用于古湖泊环境研究中。针对这些未深入了解的参数,可以重点研究其演化过程与环境的关系,期待应用更丰富的参数配合来综合解释古湖泊环境。
4)深入研究不同生物标志物的生物来源、演化过程,影响因素的定量化有助研究人员挖掘生物标志物蕴含的地质意义,可以丰富生物标志物解释古环境的角度、方法,细化古环境解释的结论。
[参考文献]
[1]何心一,徐桂荣.古生物学教程[M].第2版.北京:地质出版社,1993:1~6.
[2]彼得斯 K E,沃尔特斯 C C,莫尔多万 J M. 生物标志化合物指南[M].第2版.张水昌等译.北京:石油工业出版社,2011.
[3]傅家谟,盛国英. 分子有机地球化学与古气候,古环境研究[J]. 第四纪研究,1992,12(4): 306~320.
[4] Brooks J D,Gould K,Smith J W. Isoprenoid hydrocarbons in coal and petroleum[J]. Nature,1969,222:257~259.
[5] 李守军,正烷烃.姥鲛烷与植烷对沉积环境的指示意义——以山东济阳坳陷下第三系为例[J]. 石油大学学报:自然科学版,1999,23(5):14~16.
[6] Blumer M,Snyder W D. Isoprenoid hydrocarbons in recent sediments:presence of pristane and probable absence of phytane[J]. Science,1965,150(3703):1588~1589.
[7] Risatti J B,Rowland S J,Yon D A,et al. Stereochemical studies of acyclic isoprenoids-Ⅻ. Lipids of methanogenic bacteria and possible contributions to sediments[J]. Organic Geochemistry,1984,6:93~104.
[8] 刘宝泉. 类异戊二烯烷烃的演化特征及植醇生成类异戊二烯烃的又一新模式[A]. 有机地球化学论文集[C]. 北京:科学出版社,1986:90~100.
[9] 陈海树,傅家谟. 沉积岩有机物中姥鲛烷,植烷比值在过成熟阶段的变化特征[Z].中田地质学会石油地质专业委员会-有机地球化学论文集,1986:101~106.
[10] Burnham A K,Clarkson J E,Singleton M F,et al. Biological markers from Green River kerogen decomposition[J]. Geochimica et cosmochimica acta,1982,46(7):1243~1251.
[11]Koopmans M P,Rijpstra W I C,Klapwijk M M,et al. A thermal and chemical degradation approach to decipher pristane and phytane precursors in sedimentary organic matter[J]. Organic Geochemistry,1999, 30(9):1089~1104.
[12] Ourisson G,Albrecht P,Rohmer M. The hopanoids: palaeochemistry and biochemistry of a group of natural products[J]. Pure and Applied Chemistry,1979,51(4):709~729.
[13] Köster J,Van Kaam-Peters H M E,Koopmans M P,et al. Sulphurisation of homohopanoids:Effects on carbon number distribution,speciation,and 22S22R epimer ratios[J]. Geochimica et Cosmochimica Acta, 1997,61(12):2431~2452.
[14] 陈中红,查明,金强,等. 东营凹陷古近系升藿烷生物标志物参数分布及演变规律[J].沉积学报,2011, 29(1):173~183.
[15] 王广利,王铁冠,张林晔,等. 济阳坳陷古近系烃源岩分子成熟度参数的异常分布[J].地球化学,2006, 35(5):560~566.
[16] 妥进才,马万怡. 碳酸盐岩中石油形成的滞后现象[J]. 石油勘探与开发,1994,21(6):1~5.
[17]卞良樵,童箴言.碳酸盐岩与泥 (页) 岩有机质演化的差异及成因探讨[J].石油勘探与开发,1989,16(2): 7~15.
[18] 解启来,陆明勇.碳酸盐矿物结合有机质——一种重要的成烃物质[J].矿物学报,2000,20(1):59~62.
[19] De Leeuw J W,Cox H C,Van Graas G,et al. Limited double bond isomerisation and selective hydrogenation of sterenes during early diagenesis[J]. Geochimica et Cosmochimica Acta,1989,53(4):903~909.
[20] Rubinstein I,Sieskind O,Albrecht P. Rearranged sterenes in a shale:occurrence and simulated formation[J]. Journal of the Chemical Society,Perkin Transactions 1,1975 (19):1833~1836.
[21] Bennett B,Olsen S D. The influence of source depositional conditions on the hydrocarbon and nitrogen compounds in petroleum from central Montana,USA[J]. Organic geochemistry,2007,38(6):935~956.
[22] Moldowan J M,Sundararaman P,Schoell M. Sensitivity of biomarker properties to depositional environment and/or source input in the Lower Toarcian of SW-Germany[J]. Organic Geochemistry,1986,10(4):915~926.
[23]Brincat D,Abbott G D. Some aspects of the molecular biogeochemistry of laminated and massive rocks from the Naples Beach Section (Santa Barbara-Ventura Basin)[J]. The Monterey Formation:From Rocks to Molecules. Columbia University Press,New York,2001:140~149.
[24] Palacas J G,Anders D E,King J D. South Florida Basina prime example of carbonate source rocks in petroleum.In:Petroleum Geochemistry and Source Rock Potential of Carbonate Rocks[J].American Association of Petroleum Geologists,1984:71~96.
[25]Clark J P, Philp R P. Geochemical characterization of evaporite and carbonate depositional environments and correlation of associated crude oils in the Black Creek Basin,Alberta[J]. Bulletin of Canadian Petroleum Geology,1989,37(4):401~416.
[26] 朱扬明,张春明,张敏,等.沉积环境的氧化还原性对重排甾烷形成的作用[J].沉积学报,1997,15(4): 104~108.
[27] Van Kaam-Peters H M E, Köster J,Van Der Gaast S J, et al. The effect of clay minerals on diasterane/sterane ratios[J]. Geochimica et Cosmochimica Acta,1998,62(17):2923~2929.
[28] 张立平,黄第藩,廖志勤. 伽马蜡烷——水体分层的地球化学标志[J]. 沉积学报,1999,17(1):136~140.
[29] 李任伟. 伽马蜡烷的地质产状及古环境意义[J].科学通报,1988,33(20):1574~1576.
[30] Ten Haven H L,Rohmer M, Rullkötter J,et al. Tetrahymanol, the most likely precursor of gammacerane, occurs ubiquitously in marine sediments[J]. Geochimica et Cosmochimica Acta,1989,53(11):3073~3079.
[31] Zander J M,Caspi E,Pandey G N,et al. The presence of tetrahymanol in Oleandra wallichii[J]. Phytochemistry,1969,8(11):2265~2267.
[32] Ourisson G,Rohmer M,Poralla K. Prokaryotic hopanoids and other polyterpenoid sterol surrogates[J]. Annual Reviews in Microbiology,1987,41(1):301~333.
[33] Kleemann G,Poralla K,Englert G,et al. Tetrahymanol from the phototrophic bacterium Rhodopseudomonas palustris:first report of a gammacerane triterpene from a prokaryote[J]. Journal of General Microbiology, 1990,136(12):2551~2553.
[34] Mallory F B,Gordon J T,Conner R L. The isolation of a pentacyclic triterpenoid alcohol from a protozoan[J]. Journal of the American Chemical Society,1963,85(9):1362~1363.
[35] Damsté J S S,Kenig F,Koopmans M P,et al. Evidence for gammacerane as an indicator of water column stratification[J]. Geochimica et Cosmochimica Acta,1995,59(9):1895~1900.
[36] Harvey H R,Mcmanus G B. Marine ciliates as a widespread source of tetrahymanol and hopan-3β-ol in sediments[J]. Geochimica et Cosmochimica Acta,1991,55(11):3387~3390.
[37] Quandt L,Gottschalk G,Ziegler H,et al. Isotope discrimination by photosynthetic bacteria[J]. FEMS Microbiology Letters,1977,1(3):125~128.
[编辑]辛长静
[引著格式]杨帆,冯一璟,张琪琛.生物标志化合物在湖泊环境的应用研究[J].长江大学学报(自科版),2015,12(28):56~60.
[中图分类号]TE122.1
[文献标志码]A
[文章编号]1673-1409(2015)28-0056-05
[作者简介]杨帆(1993-),男,硕士生,现主要从事油气成藏理论方面的研究工作;E-mail:chinaofjz@163.com。
[收稿日期]2015-06-13
——以银额盆地查干凹陷为例
——基于北部湾盆地勘探实践

