千年笛鲷早期发育及视蛋白基因表达规律分析
谢子强 王中铎 郭昱嵩 刘楚吾
(广东海洋大学水产学院, 南海水产经济动物增养殖广东普通高校重点实验室, 湛江 524025)
千年笛鲷早期发育及视蛋白基因表达规律分析
谢子强 王中铎 郭昱嵩 刘楚吾
(广东海洋大学水产学院, 南海水产经济动物增养殖广东普通高校重点实验室, 湛江 524025)
初步观察千年笛鲷早期发育各个时期的形态特征, 同时使用实时荧光定量 PCR方法对 4种视蛋白基因在早期发育中的表达规律进行分析。研究观察到千年笛鲷卵为圆球形, 属浮性卵, 中心有一明显的油球。在水温(24.5±0.5)℃的条件下, 千年笛鲷胚胎发育共经历6个发育阶段18个时期, 从受精卵到孵化一共经历24h。仔鱼经历12—15d发育为稚鱼, 30d—35d发育为幼鱼。同时对7个胚胎发育时期和2个仔鱼发育时期4种视蛋白(LWS、SWS1、SWS2、RH)基因的表达情况进行检测, 在下包1/2、胚孔封闭、视囊这3个时期有显著性表达(P<0.05), 尤其在胚孔封闭时期, 表达量达到最高。其余时期 4种基因的表达水平显著下降, 但在2个仔鱼时期表达量比孵化期略有增加。结果表明千年笛鲷4种视蛋白基因在早期表达过程中与神经胚的形成有密切的联系。
千年笛鲷; 早期发育; 视蛋白基因; 实时荧光定量PCR
千年笛鲷(Lutjanus sebae)隶属鲈形目(Perciformes)笛鲷科(Lutjanidae)笛鲷属(Lutjanus), 属于暖水性近岸岩礁鱼类, 主要分布于红海、印度洋和印度尼西亚、中国、菲律宾、澳大利亚海域[1]。千年笛鲷的繁殖周期长、出苗率高、生长迅速、营养丰富、养殖收益高, 近几年已成为福建、广东、海南等沿海地区重要的海水养殖品种[2]。研究鱼类的繁殖与早期胚胎发育不仅能为许多养殖品种的人工繁育提供理论上的支持, 也是鱼类学研究的一个重要基础。国内外对模式生物斑马鱼(Danio rerio)的早期发育已经进行深入的研究, 并对其进行了详细的分期和形态学特征描述[2]。而一些重要的海水养殖经济品种, 如金头鲷(Sparus aurata)、大西洋鳕(Gadus morhua)、斜带石斑鱼(Epinephelus coioides)、红鳍笛鲷(L. erythopterus)等都有相关的早期发育的研究报道[3—7]。千年笛鲷的繁殖与早期发育有其鲜明的特点, 但国内外对其早期发育的报道比较少, 特别是胚胎时期的发育还未见相关的学术报道。
鱼类视蛋白基因的研究近几年来成为人们研究其与环境适应的一个热点, 但往往都集中在其分子机制和系统进化方面的研究, 对其早期发育中表达差异的研究相对较少。视蛋白(Opsin)是一种由视觉细胞产生的跨膜蛋白, 具有七个跨膜结构域的G蛋白耦联受体的超家族。生活在水中的鱼类由于受水深和水质的影响, 在长期进化的过程中其视蛋白基因比其他的陆生脊椎动物具有更高的分化程度[8]。目前, 国内外对斑马鱼、丽鱼(Poecilia reticulata)、太平洋蓝鳍金枪鱼(Thunnus orientalis)、金鱼(Carassius auratus)等鱼类视蛋白基因都有较为深入的研究,从分子角度上揭示了其进化与环境适应之间的密切联系[9—12]。而在这些研究中, 尤以介导明视觉的LWS (长波长敏感性视蛋白Long wavelength wavelength-sensitive)、SWS1(短波长敏感性视蛋白1类家族 Short wavelength- or blue-sensitive pigments)、SWS2 (短波长敏感性视蛋白 2类家族 SWS1-like pigments)视蛋白基因和介导暗视觉的RH (视杆蛋白, Rhodopsin)视蛋白基因研究报道最多。笛鲷属鱼类作为热带珊瑚礁地区的鱼类因其生长环境特殊、体色艳丽可成为研究视蛋白与海水环境相适应的一个优势种属。国内外对笛鲷属鱼类视蛋白的吸收光谱、分子结构以及系统进化都进行了较为深入的研究, 从而探讨了笛鲷属鱼类视觉进化与环境适应之间的密切关系[13—15]。在早期发育水平上, 模式生物斑马鱼视觉相关的基因方面已经有较多的研究报道[16—18]。同时, 在日本鳗(Anguilla japonica)、条石鲷 (Oplegnathus fasciatus)、中华鲟(Acipenser sinensis)等一些鱼类中也有相关的早期视觉发育的报道[19—21]。
本研究对千年笛鲷的早期发育各个阶段形态特征进行观察和描述, 同时结合实时荧光定量PCR的技术手段对千年笛鲷4种主要的视蛋白在早期发育阶段的表达规律进行研究, 为笛鲷属鱼类视蛋白和视觉系统研究提供可靠的理论依据。
1 材料与方法
1.1 试验材料
本研究使用的千年笛鲷的胚胎样本为 2013年11月采自海南省三亚市蜈支洲岛附近海域的人工海水养殖基地。仔鱼、稚鱼和幼鱼采自海南省陵水县新村镇海南青利水产繁殖有限公司(鱼卵及仔、稚、幼鱼均来自同一批亲鱼的人工繁育后代)。使用尼康YS100显微镜和佳能SX170 IS数码相机对胚胎发育各个时期进行观察和摄像, 使用 RNA-later (sigma)对每个时期的胚胎进行保存。
1.2 引物设计合成
根据GenBank上所收录的红鳍笛鲷的LWS (登录号: FJ824750)和千年笛鲷RH (登录号: EU637974)两种视蛋白基因部分片段cds区序列。SWS1、SWS2 和β-actin序列来自本研究室对红鳍笛鲷视蛋白基因研究的结果, 使用Beacon Designeer 8.0软件进行荧光定量引物设计(表1), 由上海生工生物工程有限公司合成。
1.3 各时期样品总RNA提取和反转录
采用TRIzol®Reagent试剂盒(公司)提取各个时期样品总RNA, 每个时期样品富集20—30个胚胎,使用 Nanodrop2000核酸定量仪对其浓度和纯度进行检测, 浓度在100—500 ng/µL之间, 纯度A260/280为1.8—2.0。凝胶电泳检测显示28S和18S条带清晰可见。采用M-MLV反转录酶(Promega公司)将提取的总RNA反转录cDNA第一链, 每个时期样品在反转录体系中使用1 µL随机六聚引物和1000 ng总RNA。
1.4 荧光定量引物适用性分析
随机选取若干个时期cDNA样品对5对荧光定量引物进行适用性筛选。PCR扩增体系为10.0 µL, 其中PCR Buffer (10×) 1 µL, dNTPs (2 mmol/L) 1 µL,正、反向引物(10 µmol/L)各0.5 µL, Taq DNA聚合酶(5 U/µL) 0.15 µL, cDNA模板0.5 µL, 无菌去离子水6.3 µL。反应程序: 95℃预变性30s; 95℃变性5s, 55.4℃退火5s, 72℃延伸10s, 共进行40个循环。PCR产物采用1%琼脂糖凝胶电泳检测。
1.5 实时荧光定量PCR
采用SYBR Green I 荧光实时定量PCR法对各个样品中的4种视蛋白基因表达量进行检测, 使用Thermo公司的Master Mix (2×)试剂盒, qPCR反应在Bio-Rad CFX 96实时荧光定量PCR仪进行。qPCR扩增体系为10.0 µL, 其中Master Mix (2×) 5 µL, 正、反向引物(10 µmol/L)各0.5 µL, nuclease-free water 3.5 µL, cDNA模版0.5µL。反应程序: 50 UDG℃ 预处理2min, 95 ℃预变性10min; 95℃变性15s, 退火温度30s, 72℃延伸30s并检测荧光信号, 共进行45个循环;反应结束后进行熔解曲线的制作, 熔解曲线的温度设为60—95 , ℃ 每隔5s升温0.5 , ℃ 检测是否有非特异扩增。先用若干样品进行温度梯度筛选, 筛选出5个基因最适的退火温度(55.4 ), ℃ 再进行定量实验。每个时期的定量检测都进行3个不同样品的平行对照。
1.6 数据统计与分析
根据Bio Rad CFX Manager软件的定量结果(Ct 值), 以 2–△△Ct法计算各目的基因的相对表达水平[22],试验数据均以M±SD表示(其中M为平均值, SD为标准差), 使用SPSS 19.0统计软件对数据进行单因素方差统计分析, 所得数据用Microsft Office Excel 2010软件作图。
2 结果
2.1 千年笛鲷早期发育阶段
采集的千年笛鲷受精卵是在同一时间受精, 并在相同的孵化条件下进行孵化, 所以显微镜下观察到的所有胚胎发育进程基本同步。千年笛鲷受精卵为浮性卵, 通体透明, 呈球形, 中间有一颗明显的油球。在水温(24.5±0.5) , ℃ 盐度28—33, pH 7.5—8.5的海水中, 千年笛鲷胚胎经历 24h完成胚胎发育孵化出膜。胚胎与仔稚幼鱼时期的划分主要参考金头鲷(Sparus aurata)[4]、斜带石斑鱼(Epinephelus coioides)[6]和红鳍笛鲷(Lutjanus erythopterus)[7]3种鲈形目海水鱼类的早期发育分期。胚胎发育经历卵裂、囊胚、原肠、神经胚、器官形成、孵化6个阶段共18个时期。出膜后初孵仔鱼约2 mm左右, 孵化后 3—5d开口摄食。12—15d后胸鳍、背鳍、臀鳍形成进入稚鱼期, 稚鱼全长约 4.0—7.0 mm。30—35d以后进入幼鱼期, 各鳍发育完整, 躯干部出现三条明显的“川”字形黑斑, 全长约25—40 mm,与成鱼相似。其早期发育进程如表2和图版Ⅰ所示。
2.2 四种视蛋白基因在千年笛鲷早期发育的表达情况
使用54—60℃ 11个退火温度对五对荧光定量引物进行适应性筛选, 结果显示 5对引物都能特异性扩增出目的条带, 目的条带与理论预计相符。通过实时荧光定量 PCR检测了千年笛鲷四种视蛋白(LWS、SWS1、SWS2、RH)基因在早期发育中9个不同时期(多细胞期、下包1/2期、胚孔封闭期、视囊期、晶体出现期、心脏跳动期、孵化期、1d仔鱼、5d仔鱼)中的表达情况。分析LWS、SWS1、SWS2、RH和β-actin的熔解曲线, 其分别在76℃、77℃、79℃、78.5℃和 80℃出现单一产物峰。采用 2–△△Ct法对比不同时期基因的表达差异, 首先求出每个样品的目的基因Ct值和内参基因的Ct值的差值并进行单因素分差分析(表3), 差值的结果能反应出该基因表达水平, 再找出差值最大的时期设为对照组,计算出不同时期之间的相对表达量(图1)。实验结果显示在千年笛鲷早期发育的过程中, 4种视蛋白基因在下包1/2期、胚孔封闭、视囊这3个时期有较为显著的表达, 尤其在胚孔封闭时期达量最大, 之后表达量显著降低(P<0.05), 孵化期表达量最低。孵化出膜后4种基因的表达量比孵化期的表达量略有回升, 尤其在SWS1基因上, 孵化出膜后的表达量较为显著。

表2 千年笛鲷早期发育过程Tab. 2 The early development of Lutjanus sebae
3 讨论
鱼类早期发育生物学的研究是鱼类种质保护和水产养殖的基础, 20世纪60年代以后国内外许多学者就对鱼类的早期发育生物学进行了广泛的研究,无论从形态学观察, 发育阶段的时期划分、早期生活史都积累很多宝贵的经验和研究报道。随着分子生物学技术的发展, 越来越多的学者对各种功能基因和早期发育之间的相互关系进行了深入的研究。虽然海洋硬骨鱼类胚胎与仔鱼发育机制大致相同,但由于其早期发育阶段形态复杂[23], 至今在学术界仍对其发育阶段的划分有许多争论。本研究将千年笛鲷胚胎发育分为卵裂、囊胚、原肠、神经胚、器官形成、孵化6个发育阶段, 总共分18个时期, 发育过程与金头鲷、斜带石斑鱼、红鳍笛鲷、紫红笛鲷等鲈形目海水鱼类基本相似[4, 6, 7, 24]。千年笛鲷为热带、亚热带岩礁暖水性鱼类, 水温条件是影响其生长发育的一个重要因素。钟建兴等[25]在对千年笛鲷人工育苗的研究中发现, 当水温保高于 20℃时其生长迅速, 发育良好, 而水温在 16—17℃时其摄食量会减半, 当水温在 13℃时其摄食活动将会停止,活力变弱, 5d后便全部死亡。由此可见千年笛鲷是一种不耐低温的海水鱼类。在千年笛鲷鱼卵孵化的过程中, 水温也是影响孵化时间快慢的一个重要条件。国内有学者对笛鲷属另外两个养殖品种紫红笛鲷和红鳍笛鲷的胚胎发育过程进行研究。在水温26—30℃条件下, 紫红笛鲷和红鳍笛鲷从受精到孵化只需15—17h[7, 24]。此次观察时间为 11月份, 水温只有 24—25 ,℃ 千年笛鲷从受精到孵化需要20—24h左右的时间, 较慢于其他两种鱼。在仔鱼、稚鱼和幼鱼的发育进程方面, 仔鱼在孵化后 3—5d开口摄食轮虫, 在15d左右发育为稚鱼, 30d后发育为幼鱼。仔稚幼鱼在发育时间进程和形态转变特征上与钟建兴研究结果基本相似。而国内尹绍武等[2]则对仔鱼发育进入稚鱼期的时间有不同的描述, 其记录进入稚鱼的时间为孵化后 22d。经形态学描述对比发现其报道只是在对稚鱼时期划分上与本研究的划分不同导致。因此, 对于鱼类形态学分类尤其是早期发育时期的划分仍需进行更深入的研究, 为鱼类养殖生产提供更为可靠的理论依据。
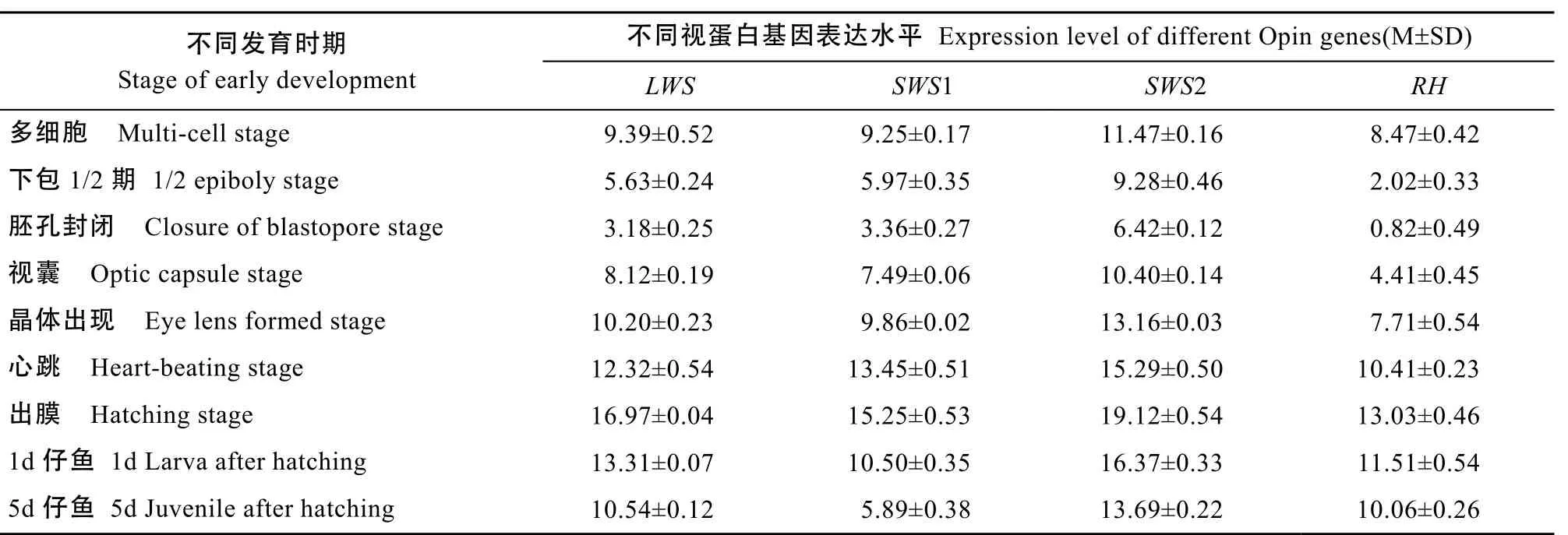
表3 千年笛鲷4种视蛋白早期发育表达水平Tab. 3 The expression of four opsin genes in the early development of L. sebae
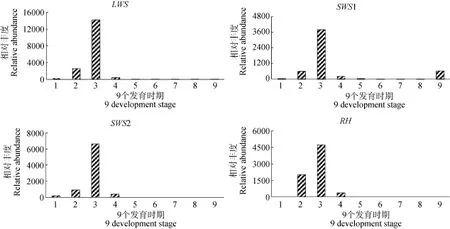
图1 四种视蛋白基因在千年笛鲷不同发育时期的表达水平Fig. 1 The expression of four opsin genes at different development stage of L. sebae
参考文献:
[1] Zhu Y D, Zhang C L, Cheng Q T. The South China Sea fishes [M]. Beijing: Science Press. 1962, 196 [朱元鼎,张春霖, 成庆泰. 南海鱼类志. 北京: 科学出版社. 1962, 196]
[2] Yin S W, Chen G H, Zhang B, et al. Technique of artificial rearing Lutjanus sebae in pund [J]. China Fisheries, 2005, 2005(8): 22—24 [尹绍武, 陈国华, 张本, 等. 海水养殖优良品种—千年笛鲷池塘人工育苗技术. 中国水产, 2005, 2005(8): 22—24]
[3] Charles B K, William W B, Seth R. K, et al. Schilling. Stages of embryonic development of the zebrafish [J]. Developmental Dynamics, 1995, 203: 253—310
[4] Wang Y H, Tao B C, Liang W G, et al. Preliminary studies on embryo development of Sparus aurata [J]. Marine Fisheries Research, 2006, 27(6): 14—18 [王彦怀, 陶秉春,梁伟光, 等. 金头鲷胚胎发育的初步观察. 海洋水产研究, 2006, 27(6): 14—18]
[5] Hall T E, Smith P, Johnston I A. Stages of embryonic development in the Atlantic cod Gadus morhua [J]. Journal of Morphology, 2004, 259(3): 255—270
[6] Zhang H F, Liu X C, Liufu Y Z, et al. Embryonic development, morphological development of larvajuvenile and young fish of Epinephelus coioides [J]. Journal of Fishery Sciences of China, 2004, 13(5): 689—699 [张海发,刘晓春, 刘付永忠, 等. 斜带石斑鱼胚胎及仔稚幼鱼形态发育. 中国水产科学, 2004, 13(5): 689—699]
德国殖民者以胶澳总督府为核心建设城市行政中心,设计“三支道”[注]三支道:Spiro Kostof将以3条街道为一组形成的放射状道路称为三支道系统.中央的那条是轴线,旁边两条支道与它的关系是均等或近乎均等对称状,同时总有一个广场作为这3条路的空间起源.青岛行政中心“三支道”以青岛路为轴线,日照路和莒县路属支道. 壮丽风格城市形态.总督府建筑、叶什克纪念碑和琴岛灯塔组成了这一区域的对景.几何对称构图和精致的城市轴线极尽奢华地宣扬统治的权威[5](图2).
[7] She Z M, Zhang J S, Yang H S, et al. Studies on Artificial Propagation and Larval-rearing of Lutjanus erychopterus (Bloch) [J]. Journal of Fujian Fisheries, 2005, 107: 31—35[佘忠明, 张建生, 杨火盛, 等. 红鳍笛鲷人工繁殖及育苗技术研究. 福建水产, 2005, 107: 31—35]
[8] Yokoyama S. Molecular evolution of color vision in vertebrates [J]. Gene, 2002, 300: 69—78
[9] Vihtelic T S, Doro C J, Hyde D R. Cloning and characterization of six zebrafish photoreceptor opsin cDNAs and immunolocalization of their corresponding proteins [J]. Visual Neuroscience, 1999, 16(3): 571—585
[10] Weadick C J, Chang B S W. Long-wavelength sensitive visual pigments of the guppy (Poecilia reticulata): six opsins expressed in a single individual [J]. BMC Evolutionary Biology, 2007, 7: S11
[11] Nakamura Y, Mori K, Saitoh K, et al. Evolutionary changes of multiple visual pigment genes in the complete genome of Pacific blue fin tuna [J]. Proceedings of the National Academy of Sciences, 2013, 110(27): 11061—11066
[12] Li Z Q, He S P. Progress on molecular evolution of vertebrate Opsin genes [J]. Acta Hydrobiologica Sinica, 2009, 33(6): 1193—1197 [李志强, 何舜平. 脊椎动物视蛋白基因分子进化的研究进展. 水生物学报, 2009, 33(6): 1193—1197] [13] Lythgoe J N, Muntz W R A, Partridge J C, et al. The ecology of the visual pigments of snappers (Lutjanidae) on the Great Barrier Reef [J]. Journal of Comparative Physiology A, 1994, 174(4): 461—467
[14] Wang Z D. The Molecular Phylogenetics of the Genus Lutjanus from China [D]. Hunan Normal University, Changsha. 2009 [王中铎. 中国笛鲷属鱼类的分子系统学.湖南师范大学, 长沙. 2009]
[15] Liu X M. The Evolution and Expression of Opsin Genes in Genus Lutjanus fishes [D]. Guangdong Ocean University, Zhanjiang. 2013 [刘雪媚. 笛鲷属鱼类视蛋白基因进化与表达分析. 广东海洋大学, 湛江. 2013]
[16] Chinen A, Hamaoka T, Yamada Y, et al. Gene duplication and spectral diversification of cone visual pigments of zebrafish [J]. Genetics, 2003, 163(2): 663—675
[17] Stephen S E, Gregory N N. The development of vision in the Zebrafish (Danio rerio) [J]. Developmental Biology, 1996, 180(2): 646—663
[18] Zhang Y Q, Wang Y X, Jiang Q, et al. Development of retinal photoreceptors and expression of opsin in the zebrafish [J]. Chinese Journal of Ophthalmology and Otorhinolaryngology, 2008, 8(2): 84—86 [张艳琼, 王跃祥, 璆蒋 , 等. 斑马鱼视网膜感光细胞的发育及视蛋白的表达.中国眼耳鼻喉科杂, 2008, 8(2): 84—86]
[19] Zhang T, Zhang J M, Guo F, et al. Characteristics of phototaxy and optical development of Japanese eel (Anguilla japonica) larva [J]. Freshwater Fisheries, 2009, 3(4): 18—25 [张涛, 张洁明, 郭峰, 等. 日本鳗鲡早期幼苗趋光性及视觉发育特征. 淡水渔业, 2009, 3(4): 18—25]
[20] He T, Xiao Z Z, Liu Q H, et al. Developmental characters at the early stayes of the Japanese Parrotfish (Oplegnathus fasciatus) [J]. Marine Sciences, 2012, 3(18): 49—53 [何滔,肖志忠, 刘清华, 等. 条石鲷视觉器官早期发育的组织学观察. 海洋科学, 2012, 3(18): 49—53]
[21] Cai Y, Xie C X. Development of eyeball during Chinese sturgeon (Acipenser sinensis) ontogeny [J]. Journal of Hydroecology, 2009, 2(6): 124—126 [柴毅, 谢从新. 中华鲟眼球的早期发育. 水生态学杂志, 2009, 2(6): 124—126]
[22] Kenneth J L, Thomas D S. Analysis of relative gene expression data using real-time quantitative PCR and the 2–△△Ctmethod [J]. Methods, 2001, 25: 402–408
[23] Howell B R, Day O J, Ellis T, et al. Early Life Stages of Farmed Fish [M]. In: Black C M, Pickering A D (Eds.), Biology of Farmed Fish. Sheffield Academic Press. 1998, 27—66
[24] Chen Y M, Xu D S, Huang M Z, et al. Research on artficial propagationand fish seeding technology of Lutjanus argentimaculatus [J]. Journal of Fujian Fisheries, 2001, 4: 32—38 [陈有铭, 许鼎盛, 黄美珍, 等. 紫红笛鲷人工繁殖及育苗技术研究报告. 福建水产, 2001, 4: 32—38]
[25] Zhong J X, Zheng H D, Chen Y M. Artificial breeding andpreliminary observation on growth of Lutianus sebae [J]. Journal of Fujian Fisheries, 2005, 2005(4): 44—46 [钟建兴,郑惠东, 陈有铭. 川纹笛鲷人工育苗及生长的初步观察.福建水产, 2005, 2005(4): 44—46]
[26] Zhang H W, Wang Z R, Zhang S C. Developmental Biology [M]. Beijing: Higher Education Press. 2001 [张红卫, 王子仁, 张士璀. 发育生物学第 2版. 北京: 高等教育出版社. 2001]
[27] Masaki T, Shoji K. Temporal and spatial changes in the expression pattern of multiple red and green subtype opsin genes during zebrafish development [J]. The Journal of Experimental Biology, 2005, 208(7): 1337—1345
PRELIMINARY STUDIES ON THE EARLY DEVELOPMENT AND THE EXPRESSION PATTERN OF OPSIN GENES OF EMPEROR RED SNAPPER(LUTJANUS SEBAE)
XIE Zi-Qiang, WANG Zhong-Duo, GUO Yu-Song and LIU Chu-Wu
(Key Laboratory of Aquaculture in South China Sea for Aquatic Economic Animal of Guangdong Higher Education Institutes, Fisheries College, Guangdong Ocean University, Zhanjiang 524025, China)
In this study, we observed the morphological characteristics and used qRT-PCR to analyze the expression pattern of four opsin genes during the early development of Emperor red snapper. The eggs of Emperor red snapper were a type of buoyancy that had spherical shape and one oil globule. Fertilized eggs hatched in 24 hours at the temperature of (24.5±0.5)℃, and there were 6 phases and 18 stages in the development of the embryo. After 12—15 days, the larvae developed into juvenile. After 30—35 days, the juvenile developed into young fish. We detected the expression of four opsin genes (LWS, SWS1, SWS2 and RH) at 7 embryo stages and 2 larvae stages. All four genes were markedly expressed at the 1/2 epiboly stage, the closure of blastopore stage and the optic capsule stage (P<0.05). The expression level of the four genes was the highest at the closure of blastopore stage. At other stages the expression was largely decreased. However, the expression was slightly increased at 2 larvae stages compared to the hatching stage. Our results suggested that the expression of the four opsin genes in the early development was closely associated with the formation of the neural embryo of Emperor red snapper.
Lutjanus sebae; Early development; Opsin genes; qRT-PCR
Q344+.1
A
1000-3207(2015)04-0758-08

图版Ⅰ 千年笛鲷个体发育过程
Plate Ⅰ The early development of Lutjanus sebae
1. 胚盘隆起期; 2. 2细胞期; 3. 4细胞期; 4. 8细胞期; 5. 多细胞期; 6. 桑葚胚期; 7. 高囊胚期; 8. 低囊胚期; 9. 下包1/4期; 10. 下包1/2 期; 11. 下包3/4期; 12. 胚孔封闭期; 13. 视囊形成期; 14. 晶体出现期; 15. 心脏形成期; 16. 心脏跳动期; 17. 孵化期; 18. 初孵化仔鱼; 19. 2d仔鱼; 20. 15d稚鱼; 21. 35d幼鱼; 22. 65d幼鱼
1. Blastodisc formation; 2. 2-cell stage; 3. 4-cell stage; 4. 8-cell stage; 5. Multi-cell stage; 6. Morul stage; 7. High blastula stage; 8. Low blastula stage; 9. 1/4 epiboly stage; 10. 1/2 epiboly stage; 11. 3/4 epiboly stage; 12. Closure of blastopore stage; 13. Optic capsule stage; 14. Eye lens formed stage; 15. Heart stage; 16. Heart-beating stage; 17. Hatching stage; 18. Newly hatched larvae; 19. 2d Larva after hatching; 20. 15d Juvenile; 21. 35d Young fish; 22. 65d Young fish
10.7541/2015.99
2014-10-14;
2015-04-12
国家自然科学基金青年基金(31101904); 广东省高等学校优秀青年教师培养计划项目(Yq2013091)资助
谢子强(1987—), 男, 广东汕头人; 硕士研究生; 研究方向为海洋生物学。E-mail: xieziqiang1987@163.com
郭昱嵩(1980—), 女, 湖南郴州人; 副教授; 研究方向为海洋生物学。E-mail: gysrabbit@163.com

