N-苯基-2-萘胺对拟柱胞藻生长、抗氧化酶及光合系统Ⅱ的影响
刘 瑞 白 芳 冉小飞 杨燕君 杨宋琪 施军琼 吴忠兴
(西南大学生命科学学院, 三峡库区生态环境教育部重点实验室, 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715)
N-苯基-2-萘胺对拟柱胞藻生长、抗氧化酶及光合系统Ⅱ的影响
刘 瑞 白 芳 冉小飞 杨燕君 杨宋琪 施军琼 吴忠兴
(西南大学生命科学学院, 三峡库区生态环境教育部重点实验室, 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715)
为探究化感物质对入侵水华蓝藻-拟柱胞藻(Cylindrospermopsis raciborskii)的影响, 研究对不同浓度(0、0.05、0.10、0.50、1.00和2.00 mg/L)N-苯基-2-萘胺处理下拟柱胞藻的生长、抗氧化酶活性及叶绿素荧光诱导动力学进行了测定。结果表明, 藻叶绿素 a含量随 N-苯基-2-萘胺浓度升高而显著降低, 浓度大于0.50 mg/L时, 拟柱胞藻叶绿素a含量显著低于对照。72h, N-苯基-2-萘胺对拟柱胞藻的EC50为1.02 mg/L。叶绿素荧光诱导动力学参数表明, 浓度小于0.50 mg/L时, 拟柱胞藻的最大光化学效率(φP0)、单位面积上有活性的反应中心(RC/CS0)、以吸收光能为基础的性能指数(PIABS)及以单位面积为基础的性能指数(PICS)均显著高于对照, 而反映2ms时有活性的反应中心的开放程度的ψ0则显著低于对照组。当N-苯基-2-萘胺浓度大于0.50 mg/L时, 以上参数均呈现相反趋势。这表明低浓度N-苯基-2-萘胺能提高拟柱胞藻的光合效率, 而在高浓度时, 拟柱胞藻PSⅡ有活性的反应中心减少, 电子传递受到阻碍, 光合效率下降。与对照相比, 在浓度高于0.50 mg/L条件下, 拟柱胞藻的过氧化氢酶(CAT)、过氧化物酶(SOD)及谷胱甘肽过氧化物酶(GPX)的活性显著增加, 表明拟柱胞藻能产生大量的抗氧化酶来减少 N-苯基-2-萘胺的损伤。这些结果表明 N-苯基-2-萘胺可能通过抑制PSⅡ的电子传递和减少其有活性的反应中心来影响拟柱胞藻的生长, 也暗示了N-苯基-2-萘胺能作为潜在的抑藻物质来控制拟柱胞藻水华。
光合作用; 拟柱胞藻; 抗氧化体系; 化感物质
近年来, 蓝藻水华在许多富营养化湖泊和水库中频繁暴发[1, 2]。蓝藻水华的暴发, 造成湖泊水质恶化、透明度下降、厌氧程度提高、生物多样性下降和优势物种改变, 从而破坏了水体生态系统结构和功能, 对人类健康、生态安全造成巨大的破坏[3]。据统计, 在世界范围内大约有40个蓝藻属, 其中包括最常见的微囊藻 Microcystis Kützing、鱼腥藻Anabaena Bory、束丝藻Aphanizomenon Morren等均可以形成水华[4]。然而, 自1979年澳大利亚北昆士兰帕门岛 148人中毒物质-拟柱胞藻毒素(Cylindrospermopsin)被揭示出来后, 拟柱胞藻(Cylindrospermopsis Seenaya et Subba Raju)的研究才开始引起藻类学者、生态学者和管理部门的关注[5]。
拟柱胞藻属于蓝藻门(Cyanophyta)、念珠藻目(Nostocales)、念珠藻科(Nostocaceae), 以拉氏拟柱胞藻(C. raciborskii)为模式种。由于拟柱胞藻已经由热带地区扩张到温带地区, 甚至北纬 53°—54°, 因此其被认为是一种入侵的水华蓝藻[6]。近年来的研究表明拟柱胞藻不仅已在我国水体分布, 而且呈现出明显的增加趋势, 甚至在一些大型水库、湖泊中已成为优势种类并产生水华[7, 8]。此外, 拟柱胞藻能够产生肝毒素以及贝类麻痹毒素等多种毒素[9, 10], 对鱼类、牲畜甚至是人类的健康都有巨大的威胁。因此,预防和控制拟柱胞藻水华具有十分重要的意义。
藻类水华控制的方法主要包括物理法、化学法以及生物法。前两种方法比较费时、费钱, 甚至对环境造成二次污染, 因此, 均不被推荐广泛使用[11, 12]。生物源抑藻物质在抑藻方面的作用相对于前两种方法具有安全和对水环境生态系统危害小等优点, 已引起各国学者的高度重视[13, 14]。1969 年Fitzgerald[15]发现水生植物的代谢产物可以控制藻类的生长, 水生植物通过化感作用抑制藻类的生长繁殖引起人们的广泛兴趣, 并希望通过对化感物质的研究开发高效专一的除藻剂, 进而为湖泊富营养化的生态治理探索切实可行的方法。
N-苯基-2-萘胺是高等植物凤眼莲(Eichhornia crassipes)和小花地不容(Stephania micrantha)等产生的一种次生代谢产物[16, 17]。N-苯基-2-萘胺代谢产物2-萘胺为致癌物质, 但其在人体内代谢为 2-萘胺的转化率低于 1%[18]。美国政府工业卫生学家会议(ACGIH)指出, N-苯基-2-萘胺本身不被定义为人类致癌物质[19]。而藻类细胞对该化合物的敏感性极高,微剂量就能显著抑制藻类细胞的生长[20, 21]。
本实验通过分析不同浓度下 N-苯基-2-萘胺对拟柱胞藻生长, 抗氧化酶及光合系统Ⅱ荧光动力学参数的影响, 旨在探究N-苯基-2-萘胺对拟柱胞藻抑藻机理, 为拟柱胞藻等蓝藻水华的预防和治理提供依据。
1 材料与方法
1.1 藻体培养
拟柱胞藻FACHB-1096由中国科学院水生生物研究所淡水藻种库提供。藻种扩大培养至对数期,取对数期藻液, 离心后分别接入含不同浓度 N-苯基-2-萘胺(0、0.05、0.10、0.50、1.00和2.00 mg/L)的200 mL MA (pH 8.6)[22]培养基中, 于光照培养箱中培养, 每个浓度设 3个重复。培养条件为: 温度(25±0.1)℃ , 25 µmol photons /(m2·s)、光暗比为12h︰12h。为避免培养过程中藻体成团, 每天定时摇动锥形瓶几次。
1.2 叶绿素及EC50测定
取5 mL的藻液, 4000×g离心力下离心10min,去掉上层培养液, 藻体加入 90%的丙酮, 根据Nusch的方法进行提取[23]。采用概率单位法(Probit method), 利用SPSS 16.0 中Probit 程序对拟柱胞藻在N-苯基-2-萘胺暴露72h后的EC50值进行计算[24, 25]。
1.3 叶绿素a荧光动力学曲线
取5 mL藻液暗适应20min, 用便携式植物效率分析仪(Handy-PEA,英国汉莎公司)测定不同浓度N-苯基-2-萘胺处理后的拟柱胞藻多相叶绿素荧光变化。测定时光化光为3000 µmol quanta/(m2·s), 收集10μs至2s的荧光信号。测定的JIP参数, 参照Strasser 和Strasser[29]的方法选取了表1中参数进行分析。
1.4 抗氧化酶SOD、CAT、GPX活性测定
取30 mL在不同浓度N-苯基-2-萘胺中培养的藻液, 4000×g离心 5min, 弃上清, 下层藻液用蒸馏水洗涤后液氮研磨, 加入4℃预冷的4 mL PBS (PBS的浓度为0.05 mol/L、pH为7.8)缓冲液提取粗酶液。过氧化氢酶(CAT)以及超氧化物歧化酶(SOD)活性的测定分别参照Choo等[26]和Wu等[27]的方法。谷胱甘肽过氧化物酶 GPX活性采用谷胱甘肽过氧化物酶(GSH-PX)试剂盒(南京建成生物工程研究所)测定。可溶性蛋白采用考马斯亮蓝法测定[28]。酶活性单位以单位蛋白浓度(U/mg 蛋白)表示。

表1 选取的JIP-测定参数及其意义Tab. 1 The selected JIP test parameters and there meaning
1.5 数据分析
实验数据处理使用统计软件SPSS 16.0, 所有数据均采用单因素方差分析(one-way ANOVA)。用LSD (P<0.05)检验处理组与对照组之间的差异, 当P <0.05时, 差异显著, P<0.01时, 差异极显著。
2 结果
2.1 叶绿素a含量及EC50值
随着浓度的增加, 高浓度处理组(>0.50 mg/L)叶绿素a含量显著低于对照(图1)。相比之下, 低浓度处理组(<0.50 mg/L)叶绿素 a含量显著上升(P<0.05)。随时间变化, 浓度为0.10 mg/L的处理组,叶绿素a含量与对照组相比呈现轻微降低(P>0.05)。通过SPSS中Probit程序计算, 获得N-苯基-2-萘胺对拟柱胞藻的72h EC50值为1.02 mg/L。
2.2 叶绿素荧光动力学曲线O-J段
在不同浓度 N-苯基-2-萘胺处理后, 低浓度(<0.50 mg/L)处理组曲线与对照组无明显差异(P>0.05, 图2)。N-苯基-2-萘胺浓度高于0.50 mg/L 时, 曲线发生较大变化, J点几乎消失, 但各浓度在曲线O点至J点间均未出现明显拐点。

图1 N-苯基-2-萘胺浓度对拟柱胞藻叶绿素a含量的影响Fig. 1 Effect of N-phenyl-2-naphthylamine concentration on the Chl. a content of C. raciborskii
2.3 叶绿素荧光动力学参数
结果表明单位面积上有活性的反应中心(RC/ CS0), 最大光化学效率(φP0), 以吸收光能为基础的性能指数(PIABS)及以单位面积为基础的性能指数(PICS)表现出相同的趋势, 即低浓度处理(<0.50 mg/L)显著高于对照, 而高浓度时显著低于对照(P<0.01, 图3)。与对照组相比, φP0在0.05、0.10、0.50、1.00 和 2.00 mg/L五个浓度时, 分别是对照组的 1.08、1.05、0.34、0.22和 0.13倍, 而 PIABS与 PICS则分别为1.23、1.08、0.02、0.04、0.01和1.24、1.08、0.02、0.05和0.01倍。反映反应中心捕获的激子中,用来推动电子传递到电子传递链中超过 QA的其他
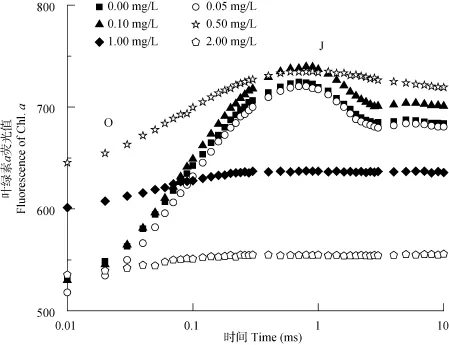
图2 不同浓度N-苯基-2-萘胺处理后拟柱胞藻快速叶绿素荧光曲线O-J段变化Fig. 2 Fast fluorescence transient curves from O to J of C. raciborskii treated with different concentrations of N-phenyl-2-naphthylamine
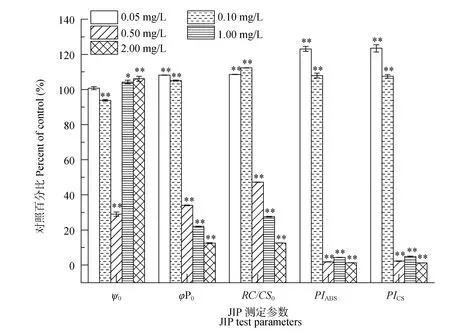
图3 不同浓度N-苯基-2-萘胺处理后拟柱胞藻JIP 测定参数的变化(与对照相比百分数)Fig. 3 Changes in the JIP-test parameters expressed as a percentage of the control when C. raciborskii were exposed for 48h to various concentrations of N-phenyl-2-naphthylamine
电子受体的激子占用来推动QA还原激子的比率, 即照光 2ms 时有活性的反应中心的开放程度的参数 ψ0则表现出相反的趋势, 即低浓度处理时(0.10和0.50 mg/L), ψ0显著低于对照, 分别降低了 6.19%、71.01%, 而高浓度(1.00和2.00 mg/L)处理组则显著高于对照, 分别增加了4.26%和6.12% (P<0.01)。
2.4 抗氧化酶SOD、CAT及GPX活性
与对照相比, SOD和GPX活性随N-苯基-2-萘胺浓度的升高显著的上升(P<0.01), 而 CAT活性只在高浓度的 N-苯基-2-萘胺处理下呈显著上调(P<0.01, 图4)。在2.00 mg/L处理下, CAT、SOD及GPX活性分别为对照的2.78、1.58、2.57倍。
3 讨论
先前的研究已经表明, N-苯基-2-萘胺一种对藻类作用极强的化感物质[21, 30—32]。本研究发现随 N-苯基-2-萘胺浓度的升高, 叶绿素a含量明显下降(图1), 这与Qian等[21, 32]研究结果一致, 表明N-苯基-2-萘胺抑制了拟柱胞藻叶绿素的合成。Björkman[33]研究表明叶绿素浓度降低反映了光合反应中心复合体天线色素减少, 说明N-苯基-2萘胺处理后, 拟柱胞藻光合系统可能发生损伤。在 72h, N-苯基-2萘胺处理下, 拟柱胞藻EC50为1.02 mg/L。相比一些已鉴定出的化感物质, 如 β-紫罗兰酮、芦竹碱、儿茶酸和鞣花酸, 其EC50值分别为(21.23 ± 1.87) mg/L[34]、2.10 mg/L[35]、5.00和5.10 mg/L[36]。因此, N-苯基-2-萘胺具有较强的抑制能力, 可作为一种潜在的拟柱胞藻水华抑制剂。
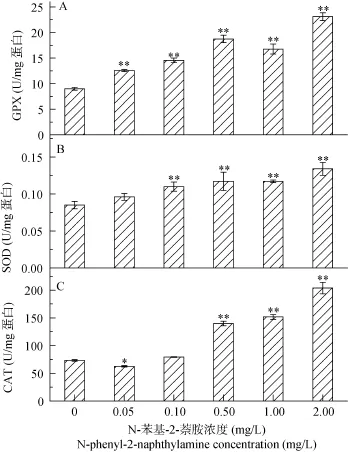
图4 不同浓度N-苯基-2-萘胺处理后拟柱胞藻GPX(A)、SOD(B)、CAT(C)及活性Fig. 4 GPX(A), SOD (B) and CAT(C) activity in C. raciborskii following exposure to different concentrations of N-phenyl-2-naphthylamine for 48h
研究表明, 当 PSⅡ的供体侧受到伤害时, 水裂解系统被抑制, 放氧复合体(OEC)受损, 导致经过极短的时间(在J点之前), 叶绿素荧光产量就会上升,出现K点(照光后大约 300 μs处的特征位点), 多相荧光O-J 变为O-K-J[37, 38]。在本研究中, 未出现K 点(图 2), 说明不同浓度 N-苯基-2-萘胺处理后, 拟柱胞藻PSⅡ供体侧均未受到损伤。研究发现, 在正常条件下, 有活性的PSⅡ反应中心将捕获的光能转化为激发能, 并将其中的一部分转化为化学能, 推动碳同化反应, 其余部分耗散掉。然而, 在受到某些胁迫时, 反应中心可能失活, 不能将吸收的光能传递给电子传递链。这种失活的反应中心可能是作为防止电子传递受到光损伤的一种保护机制[39]。本研究发现, 单位面积上有活性的反应中心在低浓度N-苯基-2-萘胺处理时(<0.50 mg/L), 显著高于对照, 而高浓度时显著低于对照组(图 3), 表明高浓度的 N-苯基-2-萘胺导致了拟柱胞藻 PSⅡ反应中心的失活或降解, 也暗示了拟柱胞藻的受体侧可能受到了抑制, 进而导致吸收的光能不能被有效地利用。
φP0表征电子传递的能量占有活性的反应中心捕获的能量的比率, 也反映了 PSⅡ最大光化学效率。在高浓度N-苯基-2-萘胺(>0.50 mg/L)处理下, 拟柱胞藻φP0显著低于对照(图3), 这一结论支持了前人关于化感物质能抑制藻类电子传递链能量传递[34], 表明高浓度的 N-苯基-2-萘胺降低了拟柱胞藻 PSⅡ用于电子传递的能量。与对照相比, 高浓度N-苯基-2-萘胺处理时, ψo值显著增加(图3), 表明光照2 ms时, PSⅡ反应中心的开放程度增加, 即用于电子传递的能量与用于 QA还原的能量的比例增加[29, 40]。这表明 N-苯基-2-萘胺可能对拟柱胞藻光合系统 II电子传递链受体侧产生了影响。当浓度高于 0.50 mg/L 时, 拟柱胞藻光合结构遭到损伤, PSⅡ受体侧电子传递受阻, 光合效率下降, 且有活性的反应中心减少, 最终导致整个细胞光合作用受到强烈的抑制,这与刘彦彦等[41]关于白屈菜红碱主要影响铜绿微囊藻光合系统反应中心电子供体侧电子传递的结论不同, 说明不同化感物质对藻类光合系统的影响有所差异。另外, 在低浓度的N-苯基-2-萘胺(<0.50 mg/L)处理下, 拟柱胞藻 RC/CS0、φP0与对照相比均有显著上升, 说明低剂量的N-苯基-2-萘胺对拟柱胞藻生长有一定的促进作用, 支持了前人关于化感物质对藻类影响的结果[42—44]。
PIABS及 PICS均在一定程度上反映出胁迫对光合结构的破坏, PIABS与PICS比φP0更加敏感。已有的研究表明高等植物在受到某些胁迫时, 光合机构遭到破坏, PIABS与 PICS会显著下降[45—47]。本研究发现拟柱胞藻在高浓度 N-苯基-2-萘胺处理下也表现出下降的趋势(图3), 表明拟柱胞藻的光合结构受到了极大的破坏, 光合效率大幅度下降。
在N-苯基-2-萘胺处理下, 拟柱胞藻细胞内自由基(ROS)升高, 随 N-苯基-2-萘胺的浓度增大, 为维持机体平衡, 一系列抗氧化酶如清除过氧化氢的CAT[48], 催化 O2–歧化反应的 SOD以及能够清除过氧化氢和有机氢过氧化物的 GPX[49]活性均升高(图4), 这一结论与 Qian等研究结果是一致的[21], 进一步说明 N-苯基-2-萘胺处理导致拟柱胞藻产生了氧化损伤。
综上所述, 在高浓度N-苯基-2-萘胺处理下, 拟柱胞藻的光合结构遭到损伤, PSⅡ电子传递受阻,光合效率下降, 且有活性的反应中心减少, 抑制整个细胞光合作用, 导致了拟柱胞藻生长受到阻碍。研究已经表明 N-苯基-2-萘胺对小鼠的 LD50超过了1000 mg/kg[50], 而本研究及其他研究表明微剂量能显著抑制藻类细胞的生长[20, 21], 因此, N-苯基-2-萘胺可以作为一个潜在的抑藻物质来控制拟柱胞藻水华。然而, 应用N-苯基-2-萘胺作为抑藻物质仍需大量的野外研究, 特别是N-苯基-2-萘胺剂量及时间效应上仍需大量的工作及数据支撑。
[1] O’Neil J M, Davis T W, Burford M A, et al. The rise of harmful cyanobacteria blooms: The potential roles of eutrophication and climate change [J]. Harmful Algae, 2012, 14: 313—334
[2] Zhao S, Chen W, Jia Y L, et al. Characteristics of microcystin-degrading bacterium isolated from sedimentations ponds for the treatments of cyanobacterial blooms [J]. Acta Hydrobiologica Sinica, 2013, 37(3): 522—523 [赵爽,陈伟, 贾云璐, 等. 蓝藻水华堆积处理池中微囊藻毒素降解细菌的分离及降解特性. 水生生物学报, 2013, 37(3): 522—523]
[3] Carmichael W W. Health Effects of Toxin Producing Cyanobacteria: “The Cyano HABs” [J]. Human and Ecological Risk Assessment, 2001, 7(5): 1393—1407
[4] Paerl H W, Fulton R S, Moisander P H, et al. Harmful freshwater algal blooms, with an emphasis on cyanobacteria [J]. The Scientific World Journal, 2001, 1: 76—113
[5] Byth S. Palm Island mistery disease [J]. The Medical Journal of Australia, 1980, 2(1): 40—42
[6] Briand J F, Leboulanger C, Humbert J F. Cylindrospermopsis raciborskii (Cyanobacteria) invasion at mid-latitudes: selection, wide physiological tolerance, or global warming [J]? Journal of Phycology, 2004, 40(2): 231—238
[7] Wu Z X, Shi J Q, Li R H. Phylogenetic analysis of two cyanobacterial genera Cylindrospermopsis and Raphidiopsis based on multi-gene sequences [J]. Harmful Algae, 2011, 10: 419—425
[8] Lei L M, Peng L, Huang X H, et al. Occurrence and dominance of Cylindrospermopsis raciborskii and dissolved cylindrospermopsin in urban reservoirs used for drinking water supply, South China [J]. Environmental Monitoring and Assessment, 2014, 186(5): 3079—3090
[9] Ohtani I, Moore R E, Runnegar M T C. Cylindrospermopsin: a potent hepatotoxin from the blue-green alga Cylindrospermopsis raciborskii [J]. Journal of the American Chemical Society, 1992, 114(20): 7941—7942
[10] de Souza R C R, Carvalho M C, Truzzi A C. Cylindrospermopsis raciborskii (Wolosz.) Seenaya and Subba Raju (Cyanophyceae) dominance and a contribution to the knowledge of Rio Pequeno arm, Billings Reservoir, Brazil [J]. Environmental Toxicology and Water Quality, 1998, 13(1): 73—81
[11] Yang Q H. Technical advances of eutrophic water restoration in china [J]. Journal of Liaodong University (Natural Science), 2008, 2(15): 26—30 [杨清海. 中国富营养化水体修复技术进展. 辽东学院学报(自然科学版), 2008, 2(15): 26—30]
[12] Hu G J, Zhang W H. Research advance of prevention and control of water bloom in lake by biological technology [J]. Safety and Environmental Engineering, 2008, 15(3): 36—40[胡光济, 张维昊. 湖泊水华生物防治技术研究进展. 安全与环境工程, 2008, 15(3): 36—40]
[13] Li F M, Hu H Y. Allelopathy and inhibitory effect of extracts from macrophytes on algae growth [J]. China Water& Wastewater, 2004, 20(11): 18—21 [李锋民, 胡洪营. 大型水生植物浸出液对藻类的化感抑制作用. 中国给水排水, 2004, 20(11): 18—21]
[14] Yang P, Zhang S L, Dong Y. Advances in Inhibitory effects of alkaloids on growth of algae [J]. Fisheries Science, 2012, 31(12): 754—755 [杨攀, 张树林, 董阳. 生物碱类化合物对藻类生长抑制作用的研究进展. 水产科学, 2012, 31(12): 754—755]
[15] Fitzgerald G P. Some factors in the competition or antagonism among bacteria, algae and aquatic weeds [J]. Journal of Phycology, 1969, 5(4): 351—359
[16] Sultankhodzhaev M N, Tadzhibaev M M. N-phenyl-b-naphthylamine from three species of plants [J]. Chemistry of Natural Compounds, 1976, 12(3): 406—407
[17] Sun W H, Yu S W, Yang S Y, et al. Allelochemicals from root exudates of water hyacinth (Eichhornis crassipes) [J]. Acta Phytophysiologica Sinica, 1993, 19(1): 92—96 [孙文浩,余叔文, 杨善元, 等. 凤眼莲根系分泌物中的克藻化合物.植物生理学报, 1993, 19(1): 92—96]
[18] Weiss T, Brüning T, Bolt H M. Dephenylation of the rubber chemical N-phenyl-2-naphthylamine to carcinogenic 2-Naphthylamine: a classical problem revisited [J]. Critical Reviews in Toxicology, 2007, 37(7): 553—566
[19] ACGIH (American Conference of Governmental Industrial Hygienists), N-phenyl-beta-naphthylamine: TLVs chemical substances 7th edition documentation. In: American Conference of Governmental Industrial Hygienists, Cincinnati, OH. ACGIH Publication 7 DOC—453. 2001
[20] Altenburger R, Brack W, Greco W R, et al. On the mode of action of N-phenyl-2-naphthylamine in plants [J]. Environmental Science and Technology, 2006, 40(19): 6163—6169
[21] Qian H F, Xu X Y, Chen W, et al. Allelochemical stress causes oxidative damage and inhibition of photosynthesis in Chlorella vulgaris [J]. Chemosphere, 2009, 75(3): 368—375 [22] Ichimura T, Isolation and culture methods of algae (Sôrui no bunri to baiyô hô . 2.5.B. Tansui sôrui) [A]. In: Nishizawa K, Chihara M (Eds.), Methods in phycological studies (Sôrui Kenkyü hô) [C]. Tokyo: Kyoritu Shuppan. 1979, 294—305 [23] Nusch E A. Comparison of different methods for chlorophyll and phaeopigment determination [J]. Archiv für Hydrobiologie-Beiheft Ergebnisse der Limnologie, 1980, 14: 14—36
[24] SPSS Inc. SPSS 10.0 Syntax Reference Guide[M]. Chicago: SPSS Inc. 1999
[25] Zhao J S, Yu S X. Estimation of probit methods on EC50 [J]. Asian Journal of Ecotoxicology, 2010, 5(3): 420—425 [赵劲松, 于书霞. 利用概率单位法估算 EC50的研究. 生态毒理学报, 2010, 5(3): 420—425]
[26] Choo K S, Snoeijs P, Pedersén M. Oxidative stress tolerance in the filamentous green algae Cladophora glomerata and Enteromorpha ahlneriana [J]. Journal of Experimental Marine Biology and Ecology, 2004, 298(1): 111—123
[27] Wu Z, Gan N, Huang Q, et al. Response of Microcystis to copper stress—do phenotypes of Microcystis make a difference in stress tolerance [J]? Environmental Pollution, 2007, 147(2): 324—330
[28] Bradford M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizingthe principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(1—2): 248—254
[29] Strasser R J, Srivastava A, Govindjee. Polyphasic chlorophyll a fluorescence transients in plants and cyanobacteria [J]. Photochemistry and Photobiology, 1995, 61(1): 32—42
[30] Dwivedi P C, Rao K. Electron donor—acceptor complexes of N-phenyl-2-naphthylamine with quinones [J]. Indian Journal of Chemistry, 1972, 10: 944—945
[31] Leonova N M, Zhukova E E, Evstigneeva R P. A model of the quinone-binding site of photosystem I: Investigation of charge transfer complexes of phylloquinone and its derivatives with tryptophan [J]. Biofizika, 2004, 49(6): 970—978
[32] Qian H, Yu S, Sun Z, et al. Effects of copper sulfate, hydrogen peroxide and N-phenyl-2-naphthylamine on oxidative stress and the expression of genes involved photosynthesis and microcystin disposition in Microcystis aeruginosa [J]. Aquatic Toxicology, 2010, 99(3): 405—412
[33] Björkman O. Response to different quantum flux densities [A]. In: Lange O L, Nobel P S, Osmond C B, et al (Eds.), Physiological Plant Ecology I [C]. Berlin: Springer-Verlag. 1981, 57—107
[34] Shao J, Xu Y, Wang Z, et al. Elucidating the toxicity targets of β-ionone on photosynthetic system of Microcystis aeruginosa NIES-843 (Cyanobacteria) [J]. Aquatic Toxicology, 2011, 104(1—2): 48—55
[35] Hong Y, Hu H Y, Xie X, et al. Gramine-induced growth inhibition, oxidative damage and antioxidant responses in freshwater cyanobacterium Microcystis aeruginosa [J]. Aquatic Toxicology, 2009, 91(3): 262—269
[36] Nakai S, Inoue Y, Hosomi M, et al. Myriophyllum spicatum-released allelopathic polyphenols inhibiting growth of blue-Green algae Microcystis Aeruginosa [J]. Water Research, 2000, 34(1): 3026—3032
[37] Strivastava A, Strasser R J. Stress and stress management of land plants during a regular day [J]. Journal of Plant Physiology, 1996, 148(3—4): 445—455
[38] Chen H X, Li W J, An S Z, et al. Characterization of PS Ⅱphotochemistry and thermostability in salt-treated Rumex leaves [J]. Journal of Plant Physiology, 2004, 161(3): 257—264
[39] Lee H Y, Hong Y N, Chow W S. Photoinactivation of phtosystem
complexes and photoprotection by non-functional neighbours in Capsicum annuum L. leaves [J]. Planta, 2001, 212(3): 332—342
[40] Li P M, Gao H Y, Strasser R J. Application of the chlorophyll fluorescence induction dynamics in photosynthesis study [J]. Journal of Plant Physiology and MolecularⅡ Biology, 2005, 31(6): 559—566 [李鹏民, 高辉远, R J Strasser. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用, 植物生理学与分子生物学学报, 2005, 31(6): 559—566]
[41] Liu Y Y, Shao J H, Liu D M, et al. Effect of chelerythrine on the growth and photosynthetic system of Microcystis aeruginosa [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 149—154 [刘彦彦, 邵继海, 刘德明, 等. 白屈菜红碱对铜绿微囊藻生长和光合系统的影响, 水生生物学报, 2015, 39(1): 149—154]
[42] Mulderij G, Mau B, Donk E, et al. Allelopathic activity of Stratiotes aloides on phytoplankton-towards identification of allelopathic substances [J]. Hydrobiologia, 2007, 584(1): 89—100
[43] Zhang T T, Zheng C Y, Hu W. The allelopathy and allelopathic mechanism of phenolic acids on toxic Microcystis aeruginosa [J]. Journal of Applied Phycology, 2010, 22(1): 71—77
[44] Liu G T, Zhou C F, Sun L F, et al. Effects of eichhornia crassipes allelochemicals on the growth of two mono-and co-cultured algae Microcystis aeruginosa and Scenedesmus obliquus [J]. Acta Scientiae Circumstantiae, 2011, 31(10): 2303—2311 [刘光涛, 周长芳, 孙利芳, 等. 凤眼莲化感物质对铜绿微囊藻、斜生栅藻生长及细胞数相对比例的影响.环境科学学报, 2011, 31(10): 2303—2311]
[45] Platt T, Gallegos C L, Harrison W G. Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton [J]. Journal of Marine Research, 1980, 38(4): 687—701 [46] Appenroth K J, Stöckel J, Srivastava A, et al. Multiple effects of chromate on the photosynthetic apparatus of Spirodela polyrhiza as probed by OJIP chlorophyll a fluorescence measurements [J]. Environmental Pollution, 2001, 115(1): 49—64
[47] Van Heerden P D R, Strasser R J, Krüger G H J. Reduction of dark chilling stress in N2-fixing soybean by nitrate as indicated by chlorophyll a fluorescence kinetics [J]. Physiologia Plantarum, 2004, 121(2): 239—249
[48] Asada K. Ascorbate peroxidase—a hydrogen peroxidescavenging enzyme in plants [J]. Physiologia Plantarum, 1992, 85(2): 235—241
[49] Drotar A, Phelps P, Fall R. Evidence for glutathione peroxidase activities in cultured plant cells [J]. Plant Science, 1985, 42(1): 35—40
[50] ACGIH (American Conference of Governmental Industrial Hygienists), Documentation of the TLVs and BEIs with other worldwide occupational exposure values. N-phenyl-beta- naphthylamine. ACGIH Worldwide, Cincinnati (CD-ROM). 2006
EFFECT OF N-PHENYL-2-NAPHTHYLAMINE ON THE GROWTH, ANTIOXIDATIVE ENZYME AND PSIN Ⅱ CYLINDROSPERMOPSIS RACIBORSKII
LIU Rui, BAI Fang, RAN Xiao-Fei, YANG Yan-Jun, YANG Song-Qi, SHI Jun-Qiong and WU Zhong-Xing
(Key Laboratory of Eco-environments in Three Gorges Reservoir Region (Ministry of Education), Chongqing Key Laboratory of Plant Ecology and Resources Research in Three Gorges Reservoir Region, School of Life Science, Southwest University, Chongqing 400715, China)
In this study, we investigated the effects of N-phenyl-2-naphthylamine, a type of allelochemical, on the invasive cyanobacteria Cylindrospermopsis raciborskii. We measured the growth, the activities of antioxidative enzymes, and polyphasic Chl. a fluorescence transients of Cylindrospermopsis raciborskii that was cultured in the presence of N-phenyl-2-naphthylamine at different concentrations (0, 0.05, 0.10, 0.50, 1.00 and 2.00 mg/L). When the concentration of N-phenyl-2-naphthylamine was higher than 0.50 mg/L, the Chl. a content was significantly lower than the control. This indicated that the level of Chl. a could be reduced by the increase in N-phenyl-2-naphthylamine. The EC50of N-phenyl-2-naphthylamine on C. raciborskii was 1.02 mg/L after a 72h exposure. At the concentration lower than 0.50 mg/L, N-phenyl-2-naphthylamine caused a significant increase in a variety of parameters of polyphasic Chl. a fluorescence transients, including the maximum quantum yield of primary photochemistry (φPo), the density of RCs(RC/CSo), the performance index on absorption basis (PIABS), and the performance index on cross section basis (PICS). One exception was ψothat declined in the presence of low concentration of N-phenyl-2-naphthylamine. On the other hand, φPo, RC/CSo, PIABS, PICS, and ψowere all reduced when the concentration of N-phenyl-2-naphthylamine was higher than 0.50 mg/L (eg. 1.00 mg/L and 2.00 mg/L). These data suggested that low dose of N-phenyl-2-naphthylamine might promote the photosynthetic efficiency of C. raciborskii, while high dose could reduce density of RCs and harm the PS Ⅱ and electron transfer, and thus result in the inhibition of photosynthetic efficiency in C. raciborskii. Compared to the control, the activities of superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPX) were all obviously elevated along with the increase in N-phenyl-2-naphthylamine concentration. This implied that C. raciborskii might counter the damage of N-phenyl-2-naphthylamine with enhanced antioxidant enzymatic activities. In conclusion, N-phenyl-2-naphthylamine could inhibit the growth of C. raciborskii by disrupting the electron transfer of PS Ⅱ and lowering the density of RCs, and therefore it could be considered as a potential compound for the control of Cylindrospermopsis blooming.
Photosynthesis; Cylindrospermopsis raciborskii; Antioxidative system; Allelochemical compound
Q948.11
A
1000-3207(2015)04-0774-08
10.7541/2015.101
2014-06-30;
2014-09-18
中央高校基本科研业务费专项资金项目(XDJK2014D015); 西南大学博士基金(SWU110065); 国家自然科学基金(31170372)资助
刘瑞, (1989—), 男, 湖北建始人; 硕士研究生; 主要从事藻类生态学研究。E-mail: 20081989liurui@163.com
吴忠兴(1975— ), 男, 教授; 主要从事藻类生理生态及分子系统学研究。E-mail: wuzhx@swu.edu.cn

