小立碗藓GPX家族的功能分化与催化特性研究
王 炜,杨志灵,杨海灵
(北京林业大学 生物科学与技术学院,北京 100083)
小立碗藓GPX家族的功能分化与催化特性研究
王炜,杨志灵,杨海灵*
(北京林业大学 生物科学与技术学院,北京 100083)
摘要:谷胱甘肽过氧化物酶(GPX)在植物抵抗氧化胁迫中发挥重要作用。该研究从小立碗藓(Physcomitrellapatens)基因组中挖掘到3个GPX基因,分别命名为PpGPX1、PpGPX2和PpGPX3。其中PpGPX1和PpGPX3只含有1个外显子,而PpGPX2含有6个外显子。表达模式分析发现PpGPX1和PpGPX2在检测的所有条件下均表达,而PpGPX3在检测的所有条件下均不表达。蛋白亚细胞定位分析发现,PpGPX1蛋白定位在细胞质,而PpGPX2蛋白定位在叶绿体。在大肠杆菌中表达并纯化了PpGPX1和PpGPX2蛋白,酶学性质分析发现,PpGPX1和PpGPX2蛋白均只能利用Trx电子供体系统,而不能利用GSH电子供体系统;PpGPX2蛋白对过氧化物底物的催化活性和催化效率均高于PpGPX1。基因结构、表达模式、亚细胞定位和蛋白酶学性质的差异预示小立碗藓GPX基因家族成员发生了功能分化,将PpGPX2蛋白的Pro158、Phe167和Phe172氨基酸残基均突变为Ala,发现突变体蛋白对底物催化活性降低,说明这3个氨基酸位点对PpGPX2蛋白具有重要催化活性。
关键词:谷胱甘肽过氧化物酶;小立碗藓;功能分化;亚细胞定位;酶学性质分析
植物在受到干旱、低温、高盐、除草剂、病菌侵害等生物及非生物胁迫时,体内的活性氧(reactive oxygen species,ROS)含量会明显上升,过多的活性氧积累会对植物的核酸、脂质、蛋白等生物大分子造成损伤[1]。植物在长期进化过程中,产生了一系列的酶促及非酶促机制来清除体内过剩的活性氧,例如抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)等酶促反应系统,及谷胱甘肽、类胡萝卜素、维生素E等非酶促反应系统[2]。谷胱甘肽过氧化物酶作为一种重要的活性氧清除剂,能够直接与过氧化氢(H2O2)、叔丁基过氧化氢(tBOOH)和枯烯氢过氧化物(COOH)等发生反应,从而清除体内多余的活性氧,在植物抵御生物及非生物胁迫过程中发挥重要的作用[3]。例如,拟南芥AtGPX3基因的缺失突变体表现出活性氧清除能力和耐旱能力降低等表型[4];敲除AtGPX8基因后,在paraquat(一种除草剂)的处理下,拟南芥幼苗根部生长慢于野生型,而过表达植株根部生长快于野生型[5]。
以往对植物GPX的研究主要集中在拟南芥[4-5]、水稻[6-7]、杨树[8]、胡杨[9]、番茄[10]、甘蓝型油菜[11]、百脉根[12]、盐芥[13]、香蕉[14]等被子植物,而对植物中另一大类群-苔藓植物的研究相对较少。小立碗藓是目前完成全基因组测序的唯一苔藓类植物,在分类上属于葫芦藓科小立碗藓属,是典型的早期陆地苔藓植物[15],作为植物分子生物学研究极具前景的模式植物已日益受到人们的重视。本研究以小立碗藓为研究材料,从小立碗藓基因组中挖掘到3个GPX基因,并对其序列特征、基因结构、表达模式、蛋白亚细胞定位、蛋白结构、蛋白生化性质及关键氨基酸位点进行了详细的比较研究,揭示了小立碗藓GPX基因家族的功能分化和分子特征。
1材料和方法
1.1实验材料
实验材料小立碗藓(Physcomitrellapatens)由北京大学郭红卫教授惠赠。
1.2小立碗藓GPX基因的鉴定
以拟南芥(Arabidopsisthaliana)GPX蛋白序列(GenBank登录号NP_198297.2)为模板,在Phytozome网站(http://www.phytozome.org)中,应用Blast工具检索小立碗藓全基因组数据库,搜索得到小立碗藓GPX基因,将其所编码的蛋白在NCBI网站进行保守结构域分析(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),以确定其含有GPX结构域。
1.3小立碗藓GPX的系统发生分析
将搜索得到的小立碗藓GPX蛋白序列与其他陆地植物GPX蛋白序列通过Muscle(http://www.ebi.ac.uk/Tools/msa/muscle)进行序列比对,并进行手工校对,将比对结果导入MEGA5.05软件,使用Neighbour-joining模型构建系统进化树,Bootstrap设为1 000。
1.4小立碗藓GPX基因的克隆
在BCDATG固体培养基培养小立碗藓[16],培养条件为18 h光照、6 h暗培养,培养温度25 ℃。培养60 d后,用Aurum Total RNA Kits(Bio-Rad Laboratories)提取植株总RNA。将提取的RNA用无RNase的DNase I(Promega)处理后,用RNA PCR Kit(AMV) version 3.0 (TaKaRa)反转录成cDNA。根据小立碗藓PpGPX1、PpGPX2和PpGPX3基因序列分别设计引物对PpGPX1-EX1/2、PpGPX2-EX1/2和PpGPX3-EX1/2(表1),引物均由Invitrogen公司合成,以小立碗藓cDNA为模板分别进行PCR扩增。PCR反应程序为94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸1 min,35个循环;最后72 ℃延伸3 min。PCR产物经1%琼脂糖凝胶电泳检测并用DNA纯化回收试剂盒(北京鼎国昌盛生物技术有限公司)回收目的条带,将纯化产物连接入pEASY-T3载体(北京全式金生物),将连接产物转化大肠杆菌Trans-T1感受态细胞,在含有X-gal/IPTG/Amp的LB平板上挑取多个阳性克隆进行双向测序。最终得到测序正确的PpGPX/pEASY-T3重组质粒。
1.5小立碗藓GPX基因的表达模式分析
选择培养60 d后生长状况良好的小立碗藓,分别用0.5% H2O2、150 mmol/L NaCl、1 mmol/L水杨酸、0.1%莠去津和1 mmol/L CDNB喷洒。H2O2和莠去津处理12 h,其余方式每种处理24 h,每种处理设置3个重复。处理后的植株提取总RNA,用无RNase的DNaseI处理后反转录成cDNA。根据小立碗藓基因序列设计3对引物(PpGPX1-SP1/2、PpGPX2-SP1/2和PpGPX3-SP1/2,表1),进行PCR扩增,以小立碗藓Actin基因为内标(GenBank登录号XM_001783849)。PCR反应程序为94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火40 s,72 ℃延伸1 min,循环数分别设置24、26、28和30;最后72 ℃延伸3 min。PCR产物经1%琼脂糖凝胶电泳检测并测序确定。
1.6小立碗藓GPX蛋白的亚细胞定位分析
以小立碗藓cDNA为模板,利用引物PpGPX1-SL1/2和PpGPX2-SL1/2分别进行PCR扩增。PCR产物经1%琼脂糖凝胶电泳检测,并用DNA纯化回收试剂盒(北京鼎国昌盛生物技术有限公司)回收目的条带,将纯化产物连接入pEASY-T3载体(北京全式金生物),将构建好的重组质粒转化大肠杆菌Trans-T1感受态细胞,挑选多个阳性克隆进行测序。将测序正确的重组质粒用限制性内切酶BamHⅠ和MluⅠ(NEB)酶切,将酶切后的DNA片段分别连接到pPSN转基因载体[17],并将转基因重组质粒转入事先制备好的拟南芥原生质体。原生质体的制备及转化参考Sang-Dong Yoo等[18]的方法。转化1 d后,用激光共聚焦显微镜(Olympus FV1000 MPE)进行观察。GFP激发光波长为488 nm,叶绿体激发光波长为543 nm。
1.7小立碗藓PpGPX1和PpGPX2蛋白结构模拟
目前,在植物中只有杨树PtGPX5蛋白的X射线衍射晶体结构得到解析,因此我们以PtGPX5蛋白的晶体结构为模板,使用InsightII软件中的Homology模块对PpGPX1和PpGPX2的蛋白结构进行模拟。首先用Align 2D程序进行序列比对,然后使用Modeler程序进行蛋白质三维结构的模拟,利用profile-3D程序对所有模拟的结构进行校验,选择校验值最高的蛋白结构。
1.8小立碗藓PpGPX1和PpGPX2蛋白的表达和纯化
将PpGPX1/pEASY-T3和PpGPX2/pEASY-T3重组质粒用限制性内切酶BamHⅠ和NotⅠ(NEB)酶切,目的片段经DNA纯化回收试剂盒回收后连接到改造过的pET30a蛋白表达载体中[19],使表达蛋白在N端含有6×His标签。将构建好的重组质粒转化大肠杆菌Tuner(DE3)感受态细胞,测序确定菌中质粒序列的正确性。在定点突变实验中,PpGPX2的Pro159、Phe167和Phe172残基分别用Ala替换,通过DNA测序确定所需要的位点进行了正确的突变,然后将突变后的PpGPX2基因克隆到改造后的pET30a蛋白表达载体中并转化Tuner(DE3)感受态细胞。挑取阳性克隆菌在LB液体培养基中过夜培养,将菌体1:100稀释后,继续培养至OD600≈0.5。加入终浓度为0.05 mmol/L IPTG诱导GPX蛋白表达。37 ℃诱导过夜后,离心收集菌体(1 000 r/min,3 min,4 ℃)。用缓冲液A(20 mmol/L磷酸钠、0.5 mol/L NaCl和20 mmol/L咪唑,pH 7.4)重悬菌体,冰上超声破碎裂解。将破碎液(10 000 r/min,10 min,4 ℃)离心,离心后上清和沉淀各取50 μL进行SDS-PAGE检测(SDS-PAGE检测采用12%分离胶和5%浓缩胶),剩余上清置于缓冲液A预平衡后的镍离子亲和层析柱(GE Healthcare Bio-Sciences)进行纯化。杂蛋白用缓冲液A洗涤,目的蛋白用缓冲液B(20 mmol/L磷酸钠、0.5 mol/L NaCl和500 mmol/L咪唑,pH 7.4)洗脱。

表1 本研究中使用的引物
1.9小立碗藓PpGPX1和PpGPX2蛋白酶学性质测定及动力学分析
小立碗藓GPX蛋白的生化性质测定参照Zhao等[3]的方法,通过检测340 nm波长处NADPH吸光度(A340)的降低来测定过氧化物酶活性,所有的反应都在25 ℃进行。反应体系包括:150 mmol/L Tris-HCl,pH 8.0,7.5 mmol/L EDTA,1 mmol/L H2O2,不同浓度的GPX蛋白及电子供体系统。电子供体系统包括Trx电子供体系统(0.2 mmol/L NADPH,9 μmol/LE.coliTrx,0.5 μmol/LE.coliTrx reductase)和GSH电子供体系统(0.2 mmol/L NADPH,2 mmol/L GSH和1.5 U谷胱甘肽过氧化物酶)。当测定GPX蛋白对tBOOH或COOH的活性时,将反应体系中的H2O2替换为叔丁基过氧化氢(tBOOH)或异丙基苯过氧化氢(COOH)。对照反应用等量的缓冲液B来替代GPX蛋白溶液,其他成分不变,每个反应设3次独立重复实验。
动力学分析通过测量GPX蛋白在不同浓度的Trx和H2O2条件下的催化活性进行分析。在分析GPX蛋白对Trx的动力学时,固定H2O2的浓度为1.0 mmol/L,通过测量Trx浓度范围为0.5~25 μmol/L时,GPX蛋白在不同Trx浓度下的催化活性获得。在分析GPX蛋白对H2O2的动力学时,固定Trx浓度为5.0 μmol/L,通过测量Trx浓度范围为0.005~1.0 mmol/L时,GPX蛋白在不同Trx浓度下的催化活性获得。检测的结果通过Hyper32程序(http://homepage.ntlworld.com/john.easterby/hyper32.html.)进行非线性回归分析。
2结果与分析
2.1小立碗藓GPX基因家族的挖掘和系统发育分析
从小立碗藓基因组中挖掘到3个可能的GPX基因,分别命名为PpGPX1、PpGPX2和PpGPX3,通过CDD保守结构域分析发现,3个基因编码的蛋白均具有GPX蛋白结构域,证明得到的基因为GPX基因。PpGPX1基因编码170个氨基酸的蛋白,预测分子量为19.1 kD;PpGPX2基因编码247个氨基酸的蛋白,预测分子量为26.8 kD;PpGPX3基因编码184个氨基酸的蛋白,预测分子量为20.8 kD。将3个基因的cDNA序列和基因组序列进行比较以鉴定其基因结构,发现PpGPX1和PpGPX3基因都只含有1个外显子,而PpGPX2基因有6个外显子(图1)。
将小立碗藓和蕨类植物江南卷柏(Selaginellamoellendorffii)、裸子植物油松(Pinustabuliformis)、单子叶植物水稻(Oryzasativa)、双子叶植物毛果杨(Populustrichocarpa)和拟南芥(Arabidopsisthaliana)的GPX蛋白序列进行序列相似性分析(图2),结果发现,这些GPX间具有比较高的序列相似性,蛋白序列相似性范围为39.6%~99.3%。将小立碗藓与其他陆地植物的GPX进行系统发生关系分析,发现小立碗藓GPX在最基部聚成一枝(图4),说明小立碗藓GPX基因家族在陆地植物分化的早期就产生了。
2.2小立碗藓GPX基因表达模式分析
通过半定量RT-PCR检测小立碗藓GPX基因在正常生长以及H2O2、NaCl、水杨酸、莠去津和CDNB等胁迫下的表达模式,发现PpGPX1和PpGPX2在24~30个PCR扩增循环时,在不同生长条件下均表达,而PpGPX3在检测的所有样品中均不表达(图3)。为了进一步确认PpGPX3基因的表达模式,用PpGPX3基因序列检索NCBI中的小立碗藓EST数据库(含有382 587条小立碗藓EST序列),未搜到任何匹配的EST序列,因此推测PpGPX3基因可能不表达,或可能在特定的发育时期或诱导条件下表达。

图1 小立碗藓GPX基因的基因结构

图2 植物GPX蛋白序列比对

图3 小立碗藓GPX基因在不同胁迫条件下的表达
2.3小立碗藓PpGPX1和PpGPX2蛋白的亚细胞定位分析
为了研究小立碗藓PpGPX1和PpGPX2蛋白的亚细胞定位,构建了PpGPX1和PpGPX2的C末端与绿色荧光蛋白eGFP相连的融合蛋白表达质粒,在拟南芥原生质体中瞬时表达后,用激光共聚焦显微镜进行观察。结果发现,PpGPX2-eGFP融合蛋白的绿色荧光与叶绿体自发荧光重叠,表明PpGPX2蛋白能够定位到叶绿体。而PpGPX1-eGFP融合蛋白则与单独表达eGFP时的荧光定位相似,说明PpGPX1定位到细胞质(图5)。

图4 植物GPX基因的系统发育分析

图6 小立碗藓PpGPX1和PpGPX2蛋白三维结构的模拟

图5 小立碗藓GPX蛋白在拟南芥原生质体中的亚细胞定位
2.4小立碗藓PpGPX1和PpGPX2蛋白结构模拟
目前,在植物中只有杨树PtGPX5蛋白的X射线衍射晶体结构得到解析,因此我们以PtGPX5蛋白的晶体结构为模板,使用InsightⅡ软件对小立碗藓PpGPX1和PpGPX2的蛋白结构进行模拟(图6,A),以profile-3D程序对模拟得到的结构进行校验,校验后得到的2个蛋白所有位点的校验值均为正值,表明模拟所得到的结果具有较高的可信度(图6,B)。PpGPX1和PpGPX2都含有4个α螺旋和6个β折叠,其中4个β折叠构成反向平行的β片层结构,将2个蛋白结构进行叠加,发现2个蛋白结构十分保守,除了loop区域有一些差异外,其余部分几乎完全重叠。
2.5小立碗藓PpGPX1和PpGPX2蛋白的表达纯化及酶学性质分析
PpGPX2定位到叶绿体,其在N端含有一段信号肽,在植物细胞中加工成为成熟蛋白时,信号肽会被切除。为研究PpGPX1和PpGPX2蛋白的性质,将PpGPX1和去掉信号肽的PpGPX2在大肠杆菌中进行原核表达。在37 ℃诱导条件下,2个蛋白均能以可溶性蛋白的形式表达。经过镍离子亲和层析纯化后得到纯度较高的蛋白,SDS-PAGE检测结果显示,纯化蛋白的分子量大小与预测相一致(图7)。
先前的研究发现,植物GPX能够利用Trx和GSH还原系统还原过氧化物[8,20]。本研究分别以Trx和GSH作为还原剂检测PpGPX1和PpGPX2蛋白对H2O2、tBOOH和COOH的催化活性。当用GSH电子供体系统时,PpGPX1和PpGPX2对3种底物均没有催化活性,而应用Trx电子供体系统时,2个蛋白对3种底物均有催化活性(表2)。同一蛋白对3种底物的活性没有明显的差别,而2个蛋白之间的催化活性不同,PpGPX2蛋白对3种过氧化物底物的活性均高于PpGPX1蛋白,说明小立碗藓GPX家族不同成员的活性产生了分化。
分别以Trx和H2O2作为电子供体和过氧化物底物对PpGPX1和PpGPX2进行酶促动力学分析(表3)。结果表明,小立碗藓GPX蛋白对Trx的Km值大于对H2O2的Km值,说明小立碗藓GPX蛋白对H2O2的亲和力高于对Trx的亲和力(亲和力越大Km值越小)。PpGPX2对Trx的亲和力是PpGPX1的5.5倍,而对H2O2的亲和力PpGPX1高于PpGPX2,PpGPX2对Trx和H2O2的催化效率均高于PpGPX1。
2.6小立碗藓GPX蛋白关键氨基酸位点功能分析
根据先前的分子对接实验[21],杨树PtGPX5的Pro81、Phe90和Phe95氨基酸残基可能在PtGPX5与Trx的互作中发挥作用。通过序列比对发现,这3个氨基酸在小立碗藓中分别为Pro159、Phe167和Phe172氨基酸残基(图2)。由于PpGPX2蛋白的催化活性和对Trx的亲和力都高于PpGPX1蛋白,所以选择PpGPX2蛋白研究这3个位点在小立碗藓GPX中的作用。根据序列比对结果,在PpGPX2中这3个位点分别对应Pro158、Phe167和Phe172。将这3个氨基酸残基分别突变为Ala后发现,与野生型PpGPX2蛋白相比,3个突变体蛋白对3种过氧化物底物的活性均发生了不同程度的降低,其中PpGPX2(F172A)突变体蛋白对3种底物的催化活性下降最多,对H2O2、tBOOH和COOH的活性分别下降了84.8%、87.3%和88.3%。动力学分析得出PpGPX2(F172A)突变体蛋白对Trx和H2O2的kcat/Km值降低至野生型的15.80%和4.69%。这些结果说明Pro158、Phe167和Phe172氨基酸位点对于PpGPX2的催化具有重要作用。

图7 纯化的小立碗藓GPX蛋白SDS-PAGE电泳

蛋白名称ProteinnameKmTrx/(mmol·L-1)kcatTrx/(S-1)(kcat/Km)Trx/(L·mmol-1·S-1)KmH2O2/(mmol·L-1)kcatH2O2/(S-1)(kcat/Km)H2O2/(L·mmol-1·S-1)PpGPX112.140±0.5801.3310.1100.003±0.0010.13644.445PpGPX22.189±0.1750.7100.3240.005±0.0010.24654.348PpGPX2(F167A)0.411±0.1680.1160.3010.002±0.0000.10555.095PpGPX2(F172A)0.668±0.3070.0340.0510.007±0.0010.0152.548PpGPX2(P158A)2.911±0.7700.4030.1390.010±0.0010.10710.637
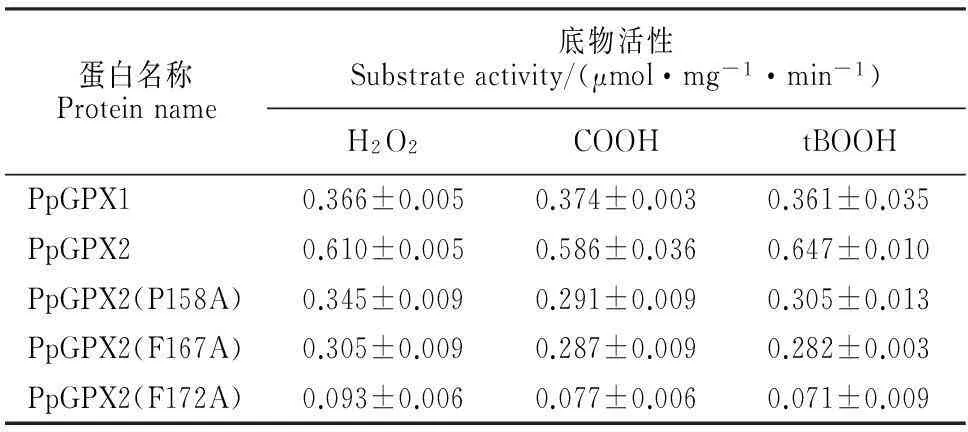
表2 小立碗藓GPX蛋白对不同底物的催化活性
3讨论
GPX作为一种清除活性氧的关键酶,在植物抵御外界生物及非生物胁迫的过程中发挥着重要的作用。以往对GPX的研究主要集中于拟南芥、水稻、杨树、胡杨、番茄、甘蓝型油菜、百脉根、盐芥、香蕉等被子植物,而对植物中另一大类群-苔藓植物的研究相对较少,本实验对苔藓植物小立碗藓GPX家族进行了深入的功能分化与分子特性研究,对于了解小立碗藓抗氧化胁迫的机制具有重要的意义。
虽然小立碗藓GPX家族成员间有较高的序列相似性,但它们在基因结构、表达模式、蛋白亚细胞定位和蛋白酶学功能方面均有差异。例如,PpGPX1和PpGPX3都只有1个外显子,而PpGPX2有6个外显子;PpGPX1和PpGPX2在检测的所有生长条件下均表达,而PpGPX3在所有检测的生长条件下均不表达;PpGPX1蛋白定位到细胞质,而PpGPX2蛋白定位到叶绿体;PpGPX2蛋白对H2O2、tBOOH和COOH的催化活性及催化效率均高于PpGPX1蛋白。基因结构、表达模式、蛋白亚细胞定位和蛋白酶学功能方面的差异表明,小立碗藓GPX家族成员间已经发生了广泛的功能分化。
根据先前的研究,在动物和真菌中,GPX蛋白可以利用Trx电子供体系统和GSH电子供体系统进行过氧化物催化反应[22-23];水稻、油松、杨树等高等植物则只能利用Trx电子供体系统,不能使用GSH电子供体系统[20,24-25]。本研究利用Trx电子供体系统和GSH电子供体系统对小立碗藓PpGPX1和PpGPX2蛋白进行酶学性质检测,结果发现,小立碗藓GPX蛋白也只能利用Trx电子供体系统在催化反应中进行电子传递,而不能利用GSH电子供体系统,说明陆地植物GPX是Trx依赖的过氧化物酶。
先前的研究表明,植物GPX蛋白通过两步反应完成一次催化循环,首先GPX蛋白与过氧化物底物反应,将过氧化物还原,自身变为氧化态,然后通过Trx电子供体系统将GPX蛋白还原,在这一反应过程中GPX蛋白和Trx蛋白会发生直接的相互作用[26]。根据先前的分子对接实验[21],杨树PtGPX5的Pro81、Phe90和Phe95氨基酸残基可能在PtGPX5与Trx的互作中发挥作用。将杨树PtGPX5蛋白第90位的Phe突变为Glu后,PtGPX5突变体蛋白对Trx的亲和力明显下降[27]。根据序列比对分析,杨树PtGPX5的Pro81、Phe90和Phe95氨基酸位点分别对应PpGPX2的Pro158、Phe167和Phe172氨基酸位点。通过蛋白的定点突变分析发现,将PpGPX2的Pro158、Phe167和Phe172氨基酸残基均突变为Ala后,3个突变体的催化活性均明显降低,其中PpGPX2(F172A)突变体蛋白对H2O2、tBOOH和COOH的活性分别降低为原来的15.2%、12.7%和11.7%,说明这3个位点,尤其是第172位的Phe对小立碗藓GPX蛋白的催化功能具有重要作用。
本研究通过整合序列分析、基因表达模式分析、蛋白亚细胞定位分析、蛋白质结构模拟、蛋白酶学性质分析及关键氨基酸位点的研究,对苔藓植物小立碗藓GPX家族的功能分化及分子特性进行了深入的研究,为了解小立碗藓抵抗氧化胁迫的机制提供了一定的信息。
参考文献:
[1]MITTLER R,VANDERAUWERA S,GOLLERY M,etal.Reactive oxygen gene network of plants[J].TrendsinPlantScience,2004,9(10):490-498.
[2]APEL K,HIRT H.Reactive oxygen species:Metabolism,oxidative stress,and signal transduction[J].AnnualReviewofPlantBiology,2004,55(1):373-399.
[3]ZHAO L,HAN X M,WANG W,etal.Molecular and catalytic properties of glutathione peroxidase family proteins fromPinustabulaeformis[J].PlantMolecularBiologyReporter,2014,32(3):771-778.
[4]MIAO Y,LV D,WANG P C,etal.AnArabidopsisglutathione peroxidase functions as both a redox transducer and a scavenger in abscisic acid and drought stress responses[J].PlantCell,2006,18(10):2 749-2 766.
[5]GABER A,OGATA T,MARUTA T,etal.The involvement ofArabidopsisglutathione peroxidase 8 in the suppression of oxidative damage in the nucleus and cytosol[J].PlantandCellPhysiology,2012,53(9):1 596-1 606.
[6]LI W J,FENG H,FAN J H,etal.Molecular cloning and expression of a phospholipid hydroperoxide glutathione peroxidase homolog inOryzasativa[J].BiochimicaEtBiophysicaActa-GeneStructureandExpression,2000,1 493(1-2):225-230.
[7]WEI J CH(韦金池),YANG H L(杨海灵),Functional divergence of two glutathione peroxidase genes inOryzasativa[J].PlantScienceJournal(植物科学学报),2013,31(1):64-72(in Chinese).
[8]NAVROT N,COLLIN V,GUALBERTO J,etal.Plant glutathione peroxidases are functional peroxiredoxins distributed in several subcellular compartments and regulated during biotic and abiotic stresses[J].PlantPhysiology,2006,142(4):1 364-1 379.
[9]WANG F F(王菲菲),DING M Q(丁明全),etal.Cloning of glutathione peroxidase genePeGPXfromPopuluseuphraticaand the salt tolerance of the transformed plants[J].GenomicsandAppliedBiology(基因组学与应用生物学),2012,31(3):231-239(in Chinese).
[10]DEPEGE N,DREVET J,BOYER N.Molecular cloning and characterization of tomato cDNAs encoding glutathione peroxidase-like proteins[J].EuropeanJournalofBiochemistry,1998,253(2):445-451.
[11]HU M L(胡茂龙),LONG W H(龙卫华),GAO J Q(高建芹),etal.Glutathione peroxidase geneBnGPX1 cloning from rapeseed and expression under abiotic stress[J].ChineseJournalofOilCropSciences(中国油料作物学报),2011,33(4):331-337(in Chinese).
[12]RAMOS J,MATAMOROS M A,NAYA L,etal.The glutathione peroxidase gene family ofLotusjaponicus:characterization of genomic clones,expression analyses and immunolocalization in legumes[J].NewPhytologist,2009,181(1):103-114.
[13]MA T T(马亭亭),ZHOU Y J(周宜君),GAO F(高飞),etal.Cloning and expression analysis of glutathione peroxidase 6 (ThGPX6) inThellungiellahalophile[J].JournalofPlantGeneticResources(植物遗传资源学报),2012,13(2):252-258(in Chinese).
[14]ZHANG L L(张丽丽),XU B Y(徐碧玉),LIU J H(刘菊华),etal.Isolation and expression analysis of a cDNA encoding glutathione peroxidase from banana[J].ActaHorticulturaeSinica(园艺学报),2012,39(8):1 471-1 481(in Chinese).
[15]ZHAO H(赵奂),ZHA X G(赵晓刚),HE Y K(何奕昆),etal.Physcomitrellapatens,a potential model system in plant molecular biology[J].ChineseBulletinofBotany(植物学通报),2004,21(2):129-138(in Chinese).
[16]NISHIYAMA T,HIWATASHI Y,SAKAKIBARA K,etal.Tagged mutagenesis and gene-trap in the moss,Physcomitrellapatensby shuttle mutagenesis[J].DNAResearch,2000,7(1):9-17.
[17]TANG Z X,YANG H L.Functional divergence and catalytic properties of dehydroascorbate reductase family proteins fromPopulustomentosa[J].MolecularBiologyReports,2013,40(8):5 105-5 114.
[18]YOO S D,CHO Y H,SHEEN J.Arabidopsismesophyll protoplasts:a versatile cell system for transient gene expression analysis[J].NatureProtocols,2007,2(7):1 565-1 572.
[19]YANG X,SUN W,LIU J P,etal.Biochemical and physiological characterization of a tau class glutathione transferase from rice (Oryzasativa)[J].PlantPhysiol.Biochem.,2009,47(11-12):1 061-1 068.
[20]JUNG B G,LEE K O,LEE S S,etal.A Chinese cabbage cDNA with high sequence identity to phospholipid hydroperoxide glutathione peroxidases encodes a novel isoform of thioredoxin-dependent peroxidase[J].JournalofBiologicalChemistry,2002,277(15):12 572-12 578.
[21]KOH C S,DIDIERJEAN C,NAVROT N,etal.Crystal structures of a poplar thioredoxin peroxidase that exhibits the structure of glutathione peroxidases:Insights into redox-driven conformational changes[J].JournalofMolecularBiology,2007,370(3):512-529.
[22]CHANG C,SLESAK I,JORDA L,etal.Arabidopsischloroplastic glutathione peroxidases play a role in cross talk between photooxidative stress and immune responses[J].PlantPhysiology,2009,150(2):670-683.
[23]FU L H,WANG X F,EYAL Y,etal.A selenoprotein in the plant kingdom.Mass spectrometry confirms that an opal codon (UGA) encodes selenocysteine inChlamydomonasreinhardtiiglutathione peroxidase[J].JournalofBiologicalChemistry,2002,277(29):25 983-25 991.
[24]IQBAL A,YABUTA Y,TAKEDA T,etal.Hydroperoxide reduction by thioredoxin-specific glutathione peroxidase isoenzymes ofArabidopsisthaliana[J].FEBS,2006,273(24):5 589-5 597.
[25]WANG Z B,WANG F,DUAN R,etal.Purification and physicochemical characterization of a recombinant phospholipid hydroperoxide glutathione peroxidase fromOryzasativa[J].JournalofBiochemistryandMolecularBiology,2007,40(3):412-418.
[26]DELAUNAY A,PFLIEGER D,BARRAULT M B,etal.A thiol peroxidase is an H2O2receptor and redox-transducer in gene activation[J].Cell,2002,111(4):471-481.
[27]SELLES B,HUGO M,TRUJILLO M,etal.Hydroperoxide and peroxynitrite reductase activity of poplar thioredoxin-dependent glutathione peroxidase 5:kinetics,catalytic mechanism and oxidative inactivation[J].BiochemicalJournal,2012,442(2):369-380.
(编辑:宋亚珍)
Functional Divergence and Catalytic Properties of Glutathione
Peroxidase Family fromPhyscomitrellapatens
WANG Wei,YANG Zhiling,YANG Hailing*
(College of Life Sciences and Biotechnology,Beijing Forestry University,Beijing 100083,China)
Abstract:In plants,glutathione peroxidase (GPX) plays important roles in protecting cells against oxidative stress.In this study,threeGPXs(PpGPX1/2/3) were identified from thePhyscomitrellapatensgenome.PpGPX1 andPpGPX3 only had one exon,whilePpGPX2 had six exons.Semiquantitative RT-PCR analysis revealed thatPpGPX1 andPpGPX2 were expressed in all tested conditions.However,PpGPX3 transcripts were not detected in any tested conditions.By transiently expressing C-terminal eGFP-GPX fusions inArabidopsisprotoplasts,we found that PpGPX1 and PpGPX2 were localized to cytoplasm and chloroplast,respectively.PpGPX1 and PpGPX2 were then over-expressed inE.coliand purified using a Ni Sepharose High Performance column.Enzymatic analysis found thatP.patensGPXs showed enzymatic activity towards peroxide substrates using Trx as electron donor,but not GSH.PpGPX2 showed higher catalytic activity and catalytic efficiency towards peroxide substrates than that of PpGPX1.The differences of gene structures,gene expression,protein subcellular localization and enzymatic characteristics amongP.patensGPXs indicating functional divergence.The function of Pro158,Phe167 and Phe172 of PpGPX2 were examined by site-directed mutagenesis.The mutant proteins showed decreased catalytic activity which indicated that these three residues were important for enzymatic activity.
Key words:glutathione peroxidase;Physcomitrellapatens;functional divergence;subcellular localization;enzymatic characterization
中图分类号:Q786;Q789
文献标志码:A
作者简介:王炜(1989-),男,在读硕士研究生,主要从事蛋白质结构与生化性质研究。E-mail:wangw1989@163.com*通信作者:杨海灵,博士,教授,主要从事植物蛋白质结构与功能研究。E-mail:yhailing77@163.com
基金项目:国家自然科学基金(31270641)
收稿日期:2014-09-02;修改稿收到日期:2014-12-22
文章编号:1000-4025(2015)01-0001-09
doi:10.7606/j.issn.1000-4025.2015.01.0001

