无苞芥NAC转录因子基因OpNAC026的克隆与分析
魏艳玲,黄先忠
(石河子大学 生命科学学院,农业生物技术重点实验室,新疆石河子 832003)
无苞芥NAC转录因子基因OpNAC026的克隆与分析
魏艳玲,黄先忠*
(石河子大学 生命科学学院,农业生物技术重点实验室,新疆石河子 832003)
摘要:在新疆耐逆植物无苞芥幼苗cDNA文库的随机克隆测序结果中,发现1条与拟南芥NAC转录因子基因AtNAC026高度相似的5′端EST序列(GenBank登录号为JZ151854),对该克隆进行3′端测序,拼接得到一条全长1 327 bp的cDNA序列,该序列包含一个906 bp的最大开放阅读框(ORF),推测编码301个氨基酸。根据该ORF序列设计引物,利用RT-PCR技术对其进行克隆,将该基因命名为OpNAC026(GenBank登录号为KM457621)。理化性质分析表明,OpNAC026蛋白是一个无跨膜区域的亲水蛋白,在N端具有一段保守结构域;蛋白质二级结构预测显示,OpNAC026蛋白包含54个α-螺旋和12个β-转角。系统进化树分析表明,OpNAC026基因与拟南芥AtNAC026和AtNAM进化关系最近。实时荧光定量PCR(qRT-PCR)分析显示,OpNAC026基因在无苞芥的各组织中都有表达,在叶中表达量最高;高盐胁迫处理24 h、干旱12 h、ABA 6 h、4 ℃低温8 h处理均可明显诱导OpNAC026基因的表达。研究表明,OpNAC026基因可能参与无苞芥抗逆机制的调控。
关键词:无苞芥;OpNAC026;克隆;抗逆;基因表达
NAC转录因子是植物特有的调控多种生物学过程的转录因子,广泛分布于陆生植物中。NAC家族的命名源于矮牵牛(Petuniahybrida)NAM(no apical meristem)和拟南芥(Arabidopsisthaliana)ATAF1、ATAF2以及CUC2(cup-shaped cotyledon)基因[1-2]。对多种植物的NAC基因进化关系分析表明,NAC基因家族包含7个亚家族,其中6个亚家族为各科植物所共有,而另一个亚家族为茄科所特有,命名为TNACS(tobacco NAC genes)[3]。NAC蛋白的N端高度保守,由大约160个氨基酸残基组成,可分为A、B、C、D和E共5个亚结构域[4],可能负责与DNA及其他蛋白结合[5]。其中,亚结构域B和E保守性不强,A、C、D高度保守,C和D序列中包含核定位信号,可能参与NAC转录因子与特定的启动子元件的识别过程[4]。
目前已发现多个NAC蛋白参与植物对逆境的响应[6-7],并且部分NAC蛋白参与了植物生长发育和环境胁迫应答过程中激素调节相关过程[8]。拟南芥ANAC019、ANAC055和ANAC072的表达均受到干旱、高盐以及脱落酸(ABA)的诱导,它们能显著提高植株的抗逆能力[9]。拟南芥中编码NAC蛋白的AtRD26在ABA信号途径中发挥作用[10]。此外,过量表达OsNAC6基因的水稻虽然生长慢、产量低,但却显示出对干旱、高盐以及枯萎病的较强抗性[11]。基因表达谱显示,小麦的TaNAC2基因表达响应干旱、盐、寒冷和脱落酸处理[12]。分析NAC转录因子在逆境胁迫应答过程中的作用机制是研究NAC基因功能非常重要的一方面,因为很多NAC转录因子在植物对逆境胁迫应答中扮演了非常重要的角色,但目前对其分子机制却知之甚少,因此对NAC转录因子的研究很重要。
无苞芥(Olimarabidopsispumila)为新疆广泛分布的十字花科早春短命植物,俗称小拟南芥,与拟南芥相比,二者形态和生活史极为相似,但无苞芥更能适应新疆特殊的环境[13-14],其基因组大小约为拟南芥的2倍[15]。近年来已从无苞芥克隆了抗逆相关基因OpNHX1[16-17]、OpVP[18]和OpZFP[19]。前期构建了一个无苞芥经高盐胁迫诱导的均一化cDNA文库并进行了测序分析[20-21],在测序结果中发现了多个NAC转录因子基因表达明显受到高盐胁迫诱导。本研究从中选取一个NAC转录因子基因进行克隆,从生物信息学方面对其进行分析,并分析了该基因的表达模式,为该基因功能的后续研究做了铺垫。
1材料和方法
1.1材料
无苞芥种子采自石河子蘑菇湖周边的盐碱地,参照文献[16]中的方法对种子进行灭菌和室内培养。
1.2方法
1.2.1总RNA提取及cDNA合成采用RNA prep pure Plant Kit试剂盒(Tiangen)提取无苞芥幼苗叶片总RNA,将质量完好的RNA置于-80 ℃冰箱中保存备用。利用M-MLV Reverse Transcriptase(Promega)参照说明书的方法合成cDNA第1链。
1.2.2无苞芥OpNAC026基因的克隆利用DNASTAR序列拼接软件将无苞芥文库单克隆5′端正向测序获得的EST序列(GenBank登录号为JZ151854)与3′端反向测序的结果拼接,去除载体序列后获得一条完整的基因序列OpNAC026(GenBank登录号为KM457621)。利用序列分析软件DNAMAN分析该基因的完整开放阅读框(ORF)。根据该ORF设计引物OpNAC026-F和OpNAC026-R1(表1),以无苞芥叶片cDNA为模板进行RT-PCR扩增,PCR体系参照ExTaq(TaKaRa)说明书。反应程序为94 ℃预变性4 min;94 ℃变性45 s,60 ℃退火45 s,72 ℃延伸40 s,35个循环后,72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测并回收后,连接pMD18-T(TaKaRa)载体并转化DH5α感受态细胞,菌落PCR验证后,将鉴定正确的阳性克隆进行测序分析。

表1 本研究所用的PCR引物序列
1.2.3OpNAC026基因生物信息学分析OpNAC026蛋白质氨基酸组成、相对分子质量、等电点、疏水性等理化性质的分析利用ExPASy网站ProtParam工具(http://www.expasy.ch/tools/protparam.html)进行[22]。利用DNAMAN软件预测基因的ORF及其编码的氨基酸序列。利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析该蛋白的跨膜区;蛋白的二级结构利用SOPMA软件分析,蛋白的三级结构通过Swiss model(http://swissmodel.expasy.org/)软件预测。利用NCBI的Blastp程序检索OpNAC026的同源蛋白,氨基酸序列的多重比对采用Clustal W程序完成,用MEGA 4.0软件构建系统进化树[23],其中用Neighbor-Joining方法进行1 000次Boot-strap分析[24]。
1.2.4OpNAC026基因的组织和胁迫表达分析无苞芥幼苗分别用高盐(200 mmol/L NaCl)、干旱(20% PEG-6000)、ABA(100 μmol/L)和低温(4 ℃)处理,处理方法参照文献[19]进行。收集各处理幼苗样品及无苞芥根、茎、叶、花、果荚样品,置于-80 ℃保存备用,总RNA的提取及cDNA模板的合成方法同1.2.1。采用实时荧光定量PCR(qRT-PCR)技术进行基因的组织表达和胁迫表达分析。基因特异引物为OpNAC026-RT-F和OpNAC026-RT-R,内参引物为无苞芥肌动蛋白基因Actin2(JZ151991)的引物Actin2-F和Actin2-R(表1)。
qRT-PCR采用SYBR PremixExTaqTMⅡ(Prefect Real Time)试剂盒(TaKaRa)标记反应产物,利用AB 7500 Fast实时荧光定量PCR仪(Life Technologies,Foster City,CA,USA)进行扩增。在10 μL的反应体系中进行PCR反应,含cDNA模板2 μL,UltraSYBR Mixture 5 μL,10 μmol/L的上下游引物各0.2 μL。反应程序为95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,40个循环,60 ℃读取荧光值。检测每份样品的目的基因和Actin2内参基因Ct值,每份样品3次PCR重复。实验数据采用2-△△Ct法进行相对定量分析[18],以未胁迫处理材料的mRNA水平设定为标准值1。
2结果与分析
2.1无苞芥OpNAC026基因的克隆与分析
在无苞芥幼苗cDNA文库测序结果中,发现1条5′端EST序列(GenBank登录号为JZ151854)与拟南芥转录因子基因AtNAC026的氨基酸序列相似性为94%。将该序列与3′端反向测序的结果拼接,去除载体序列后,获得一条全长1 327 bp的cDNA序列(GenBank登录号为KM457621),将该基因命名为OpNAC026。OpNAC026基因包含1个906 bp的最大ORF,编码蛋白由301个氨基酸组成(图1)。以无苞芥叶片cDNA为模板,通过RT-PCR技术扩增出了该基因的ORF序列。
2.2OpNAC026基因的生物信息学分析
OpNAC026编码蛋白的理化性质分析表明,该蛋白的分子式为C1499H2298N422O453S6,分子量为33 671.6 Da,等电点为8.81,属于稳定蛋白。疏水性预测结果(图2)表明,多肽链第78位的精氨酸R(Arginine)具有最低的分值-2.800,第115位的赖氨酸K(Lysine)具有最高的分值1.456。由于亲水性越强氨基酸分值越低、疏水性越强分值越高,在整条链中,亲水性氨基酸多于疏水性氨基酸,所以无苞芥OpNAC026是亲水性蛋白。跨膜结构分析表明,OpNAC026蛋白无明显的跨膜结构域,因此OpNAC026可能不是膜蛋白。
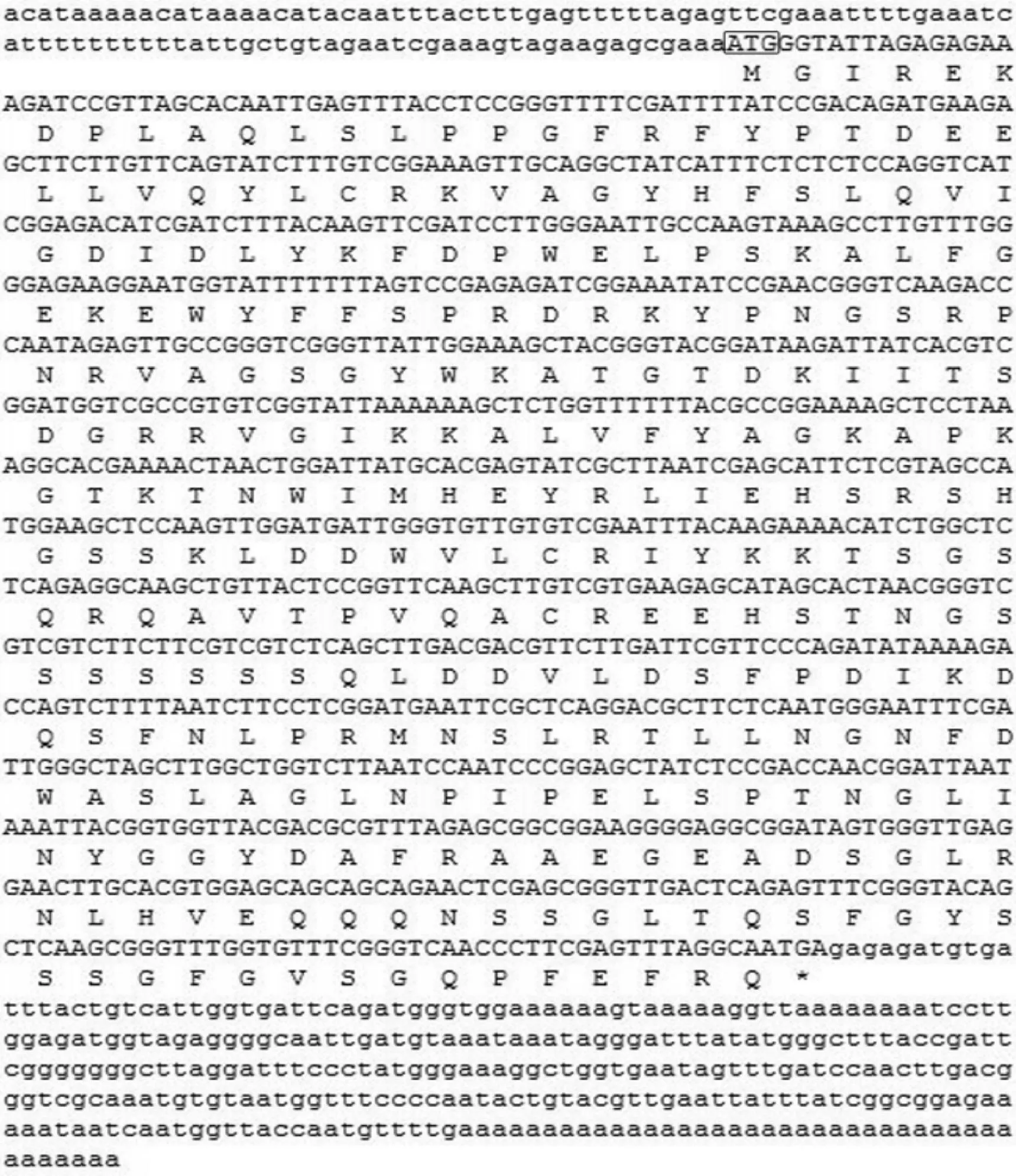
图1 OpNAC026基因核苷酸序列及推测氨基酸序列
二级结构预测表明OpNAC026蛋白的氨基酸序列中共有α-螺旋(Alpha helix)54处,占二级结构的17.94%;延伸链(Extended strand)56处,占二级结构的18.6%;β-转角(Beta turn)12处,占二级结构的3.99%;无规卷曲(Random coil)179处,占二级结构的59.47%(图3,A)。Swiss-model同源建模分析其对应的三级结构(图3,B),结果表明该蛋白与拟南芥的三级结构相似性为85.12%。
将OpNAC026与其他9个物种的NAC蛋白氨基酸序列进行同源比对分析,这9个NAC蛋白分别为:拟南芥AtNAC026(Arabidopsisthaliana,NP_567773.1)、草莓Fv072(Fragariavesca,XP_004291667.1)、桑树MnNAC072(Morusnotabilis,EXB37906.1)、甜橙CsNAC072(Citrussinensis,XP_006464708.1)、葡萄VvNAC072(Vitisvinifera,XP_002284668.1)、番茄SlNAC(Solanumlycopersicum,XP_004244203.1)、黄瓜CsNAC072(Cucumissativus,XP_004147806.1)、大豆GmNAC072(Glycinemax,XP_003540085.1)和菜豆PvNAC072(Phaseolusvulgaris,AGV54694.1)。经Clusta lX 2.0比对表明(图4),在NAC转录因子N端有一段保守的氨基酸序列,约包括170个氨基酸残基,已有报道表明这段保守的氨基酸序列可分为A、B、C、D和E共5个亚结构域[4],可能负责与DNA及其他蛋白结合[5]。而不保守的C端结构决定了各自特定的功能,说明不同物种的NAC转录因子在调控生物过程中既具有保守的功能,也可能具有各自不同的功能。

图2 OpNAC026蛋白的亲水性预测
2.3OpNAC026蛋白的系统进化树分析
通过NCBI数据库检索OpNAC026的同源蛋白序列,利用MEGA 4.0软件构建了OpNAC026与其他植物的NAC家族转录因子的系统进化树(图5)。结果表明OpNAC026与拟南芥AtNAC026、AtNAM的亲缘关系最近,属于同一进化分支。
2.4OpNAC026基因的组织与胁迫表达分析
qRT-PCR实验结果表明,OpNAC026基因在无苞芥的根、茎、叶、花、果荚中均表达,但在叶片的表达量最高,在其它组织中表达量相对较低(图6)。
对2~3片真叶期无苞芥幼苗进行高盐(200mmol/L NaCl)、干旱(20% PEG-6000)、ABA(100 μmol/L)和低温(4 ℃)处理,qRT-PCR实验表明,盐胁迫处理24 h后OpNAC026基因表达明显上升,并且持续72 h一直高表达;干旱(20% PEG-6000)胁迫2~6 h,OpNAC026基因表达呈下降趋势,12 h后表达迅速上升;100 μmol/L ABA胁迫处理至6 h,基因缓慢上调表达,8 h迅速上调达到最高水平,12 h后有所下降;低温(4 ℃)胁迫6 h以内,OpNAC026基因表达呈下降趋势,但8~12 h明显上调表达(图7)。可见高盐、干旱、ABA和低温均能诱导OpNAC026基因的表达。

图3 OpNAC026基因编码蛋白的结构预测

图4 无苞芥OpNAC026同其他物种NAC家族蛋白氨基酸序列的多重比对
3讨论
NAC转录因子在植物的生长发育、器官建成、激素调节和防御抵抗多种生物和非生物胁迫等方面发挥着重要作用。NAC转录因子普遍存在于植物中,并且在不同植物中NAC家族基因的数目和基因的表达是不同的,拟南芥中至少包含107个NAC基因[25],而水稻(Oryzasativa)中含有140个[26]。利用盐溶液处理拟南芥,仅在根中就发现有33个NAC基因的表达受到显著影响[27]。前期我们构建了无苞芥经高盐胁迫诱导的均一化cDNA文库,对文库随机测序,在获得的近2万条EST序列中发现了51条NAC转录因子相关序列(待发表资料)。本研究以NAC026为研究对象,首先从新疆无苞芥中克隆了该基因的完整ORF,编码301个氨基酸。同其他物种的NAC转录因子类似,OpNAC026在N端有一段保守的氨基酸序列,C端的不保守结构说明该转录因子在不同物种中的功能存在一定的差异性。系统进化树分析结果显示,OpNAC026蛋白与拟南芥AtNAC026和AtNAM的亲缘关系最近。

图5 OpNAC026与其他植物NAC家族转录
组织表达分析表明OpNAC026基因虽然在无苞芥各组织中均有表达,但主要在叶片中表达。对拟南芥AtNAC026基因的胁迫表达分析表明,在干旱、高盐和ABA胁迫30 min后基因表达量明显升高,并且直到24 h仍保持着较高的水平[10]。我们的研究表明,OpNAC026基因的表达明显受到干旱、高盐和ABA的诱导,但不像甜土植物拟南芥的AtNAC026基因诱导表达迅速。分析原因,可能由于无苞芥本身生长在逆境环境中,适应了其生存环境,胁迫早期,基因组中可能有其他耐逆相关基因在起作用,随着胁迫时间的延长,NAC家族基因被迅速诱导,和其他逆境诱导表达相关基因协同作用,增强无苞芥的耐逆能力,使其在逆境下生存下来。研究结果也说明了不同植物的NAC家族基因在耐逆性上既有保守的功能,对于不同逆境胁迫的精细调控上又起着不同的作用。
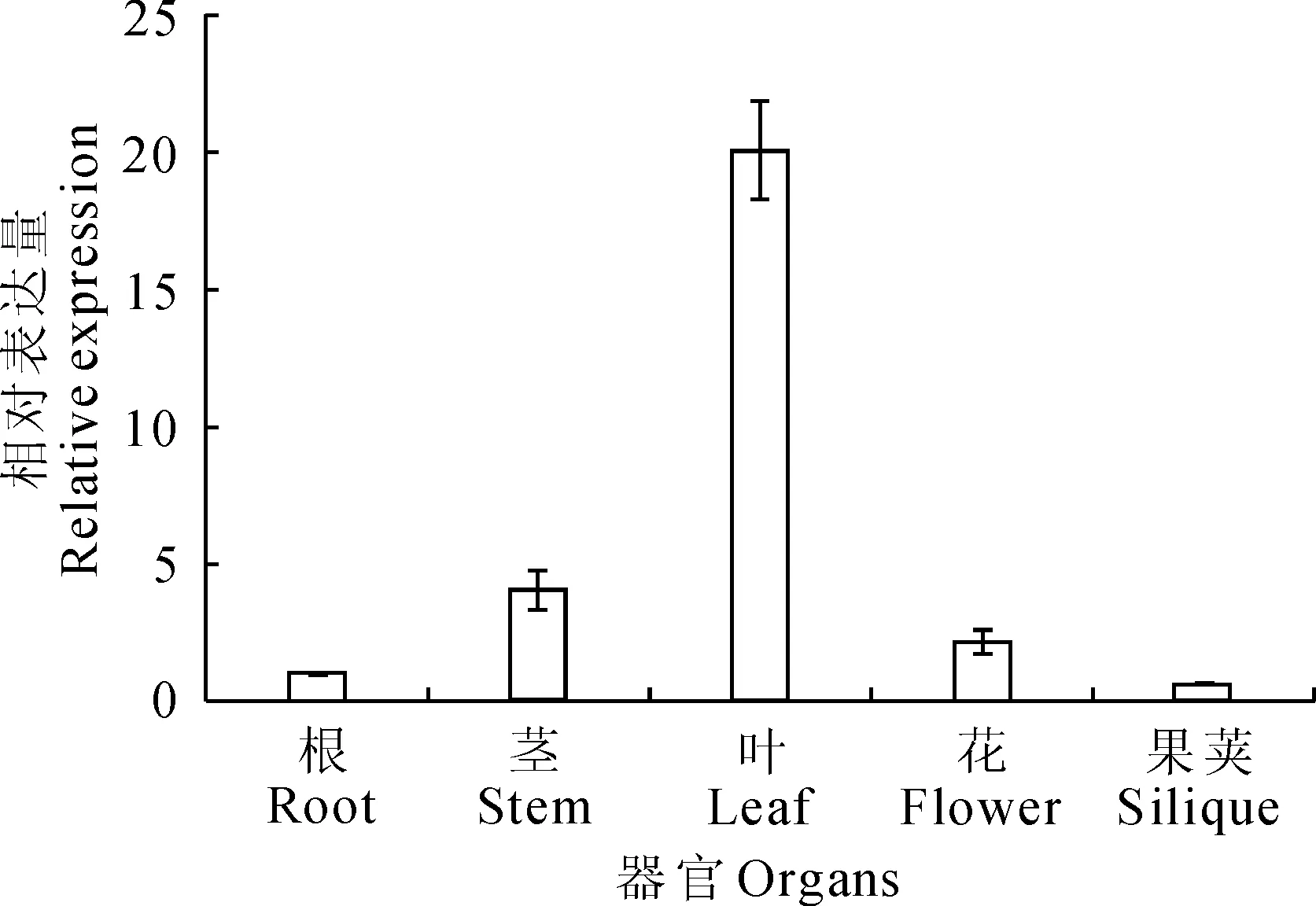
图6 无苞芥OpNAC026基因组织表达模式

图7 不同胁迫下OpNAC026基因的表达分析
转录因子可能同时调控很多其他基因的表达,这样通过操纵一个转录因子就可调控多个功能基因发挥作用,从而达到改良植株性状的效果。目前,我们在进一步分析无苞芥其他50个NAC家族基因,以期了解它们的逆境胁迫表达特征及在无苞芥响应逆境信号生理生态适应机制中的功能。对不同植物NAC转录因子功能的研究,不仅有利于进一步理解NAC家族参与逆境胁迫的分子机制,也对将来利用该类基因提高植物的耐逆性具有重要意义。
参考文献:
[1]SOUER E,VAN H A,KLOOS D,etal.The no apical meristem gene ofPetuniais required for pattern formation in embryos and flowers and is expressed at meristem and primordia boundaries[J].Cell,1996,85(2):159-170.
[2]AIDA M,ISHIDA T,FUKAKI H,etal.Genes involved in organ separation inArabidopsis:an analysis of the cup-shaped cotyledon mutant[J].PlantCell,1997,9(6):841-857.
[3]RUSHTON P J,BOKOWIEC M T,HAN S,etal.Tobacco transcription factors:novel insights into transcriptional regulation in the Solanaceae[J].PlantPhysiology,2008,147(1):280-295.
[4]OOKA H,SATOH K,DOI K,etal.Comprehensive analysis of NAC family genes inOryzasativaandArabidopsisthaliana[J].DNAResearch,2003,10(6):239-247.
[5]ERNST H A,OLSEN A N,LARSEN S,etal.Structure of the conserved domain of ANAC,a member of the NAC family of transcription factors[J].EMBOReports,2004,5(3):297-303.
[6]NAKASHIMA K,TAKASAKI H,MIZOI J,etal.NAC transcription factors in plant abiotic stress responses[J].BiochimicaetBiophysicaActa,2012,1 819(2):97-103.
[7]OLSEN A N,ERNST H A,LO LEGGIO L,etal.Preliminary crystallographic analysis of the NAC domain of ANAC,a member of the plant-specific NAC transcription factor family[J].ActaCrystallogrDBiol.Crystallogr,2004,60(Pt 1):112-115.
[8]JENSEN M K,KJAERSGAARD T,PETERSEN K,etal.NAC genes:time-specific regulators of hormonal signaling inArabidopsis[J].PlantSignal&Behavior,2010,5(7):907-910.
[9]TRAN L S,NAKASHIMA K,etal.Isolation and functional analysis ofArabidopsisstress inducible NAC transcription factors that bind to a drought-responsive cis-element in the early responsive to dehydration stress 1 promoter[J].PlantCell,2004,16(9):2 481-2 498.
[10]FUJITA M,FUJITA Y,MARUYAMA K,etal.A dehydration-induced NAC protein,RD26,is involved in a novel ABA-dependent stress-signaling pathway[J].PlantJournal,2004,39(6):863-876.
[11]NAKASHIMA K,TRAN L S,VAN N D,etal.Functional analysis of a NAC-type transcription factorOsNAC6 involved in abiotic and biotic stress-responsive gene expression in rice[J].PlantJournal,2007,51(4):617-630.
[12]MAO X,ZHANG H,QIAN X,etal.TaNAC2,a NAC-type wheat transcription factor conferring enhanced multiple abiotic stress tolerances inArabidopsis[J].JournalofExperimentalBotany,2012,63(8):2 933-2 946.
[13]ZHANG H B(张海波),LIU P(刘彭),LIU L H(刘立鸿),etal.Preliminary study on salt tolerance of ephemeral plantArabidopsispumilain Xinjiang[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2007,27(2):286-290(in Chinese).
[14]YUAN H Y(院海英),WU X H(吴祥辉),DONG R(东锐),etal.Expression analysis ofGFPgene inOlimarabidopsispumilaandArabidopsisthaliana[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2012,32(5):881-885(in Chinese).
[15]HOFFMANN M H,SCHMUTHS H,KOCH C,etal.Comparative analysis of growth,genome size,chromosome numbers and phylogeny ofArabidopsisthalianaand three cooccurring species of the Brassicaceae from Uzbekistan[J].JournalofBotany,2010,Articl ID 504613.doi:10.1155/2010/504613.
[16]YUAN H Y(院海英),GU CH(顾超),etal.Identification and bioinformatics analysis of a vacuolar Na+/H+antiporter gene inArabidopsispumila[J].JouranalofShiheziUniversity(Nat.Sci.Edi.)(石河子大学学报·自然科学版),2011,29(4):401-407(in Chinese).
[17]ZHAO Y X(赵云霞),GUO D L(郭丹丽),WEI Y L(魏艳玲),etal.Cloning,expressing and functional analysis of Na+/H+antiporter geneOpNHX1 fromOlimarabidopsispumilain Xinjiang[J].BiotechnologyBulletin(生物技术通报),2014,(7):74-80(in Chinese).
[18]XU F,ZHAO Y X,WANG F,etal.Cloning of a vacuolar H+-pryophosphatase gene from emphemeral plantOlimarabidopsispumilawhose overexpression improve salt tolerance in tobacco[J].AfricanJournalofBiotechnology,2013,12(49):6 817-6 825.
[19]GUO D L(郭丹丽),WANG Q Q(王琦琦),WU X Q(吴晓庆),etal.Cloning and expression analysis of zinc finger protein gene fromOlimarabidopsispumila[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2014,34(2):243-250(in Chinese).
[20]YUAN H Y(院海英),XU F(徐 芳),etal.Construction and sequencing analysis of cDNA library induced by high salt stress inOlimarabidopsispumila[J].JournalofShiheziUniversity(Nat.Sci.Edi.)(石河子大学学报·自然科学版),2012,30(1):1-3(in Chinese).
[21]ZHAO Y X,WEI Y L,ZHAO P,etal.Construction of a cDNA library from the ephemeral plantOlimarabidopsispumilaand preliminary analysis of expressed sequence tags[J].ZeitschriftfürNaturforschung.C,2013,68(11/12):499-508.
[22]HUTCHINSON E G,THORNTON J M.PROMOTIF-A program to identify and analyze structural motifs in proteins[J].ProteinScience,1996,5(2):212-220.
[23]TAMURA K,DUDLEY J,NEI M,etal.MEGA4:molecular evolutionary genetics analysis(MEGA) software version 4.0[J].MolecularBiologyEvolution,2007,24(8):1 596-1 599.
[24]KUMAR S,NEI M,DUDLEY J,etal.MEGA:a biologist-centric software for evolutionary analysis of DNA and protein sequences[J].BriefingsinBioninformatics,2008,9(4):299-306.
[25]RIECHMANN J L,HEARD J,MARTIN G,etal.Arabidopsistranscription factors:genome-wide comparative analysis among eukaryotes[J].Science,2000,290(5 499):2 105-2 110.
[26]FANG Y,YOU J,XIE K,etal.Systematic sequence analysis and identification of tissue-specific or stress-responsive genes of NAC transcription factor family in rice[J].Mol.GenetGenomics,2008,280(6):547-563.
[27]JIANG Y,DEYHOLOS M K.Comprehensive transcriptional profiling of NaCl-stressedArabidopsisroots reveals novel classes of responsive genes[J].BMCPlantBiology,2006,6:25.
(编辑:宋亚珍)
Clone and Expression of NAC Transcription Factor Gene
OpNAC026 fromOlimarabidopsispumila
WEI Yanling,HUANG Xianzhong*
(Key Laboratory of Agrobiotechnology,College of Life Sciences,Shihezi University,Shihezi,Xinjiang 832003,China)
Abstract:An expressed sequence tag(GenBank accession number:JZ151854) from the 5′ end which was highly similar to NAC transcription factorAtNAC026 ofArabidopsisthalaniawas obtained,through sequencing of clones randomly selected from the previously constructed cDNA library ofOlimarabidopsispumilaleaves.This clone was sequenced from the 3′ end,and a full-length cDNA of 1 327 bp was obtained after sequence assembly.Its open reading frame (ORF) was 906 bp,and encodes 301 amino acids.The primers were designed according to the ORF and this gene was cloned fromO.pumilaby RT-PCR technique,which was designated asOpNAC026 (GenBank accession number:KM457621).Physicochemical property analysis showed that OpNAC026 is a hydrophilic protein with a conserved domain at its N-terminal region,and OpNAC026 has no transmembrane domain,indicating that it is not a transmembrane protein.The secondary structural analysis showed that OpNAC026 contains 54 α-helixes and 12 β-turns.The phylogenetic analysis revealed thatOpNAC026 showed the closest genetic kinship withA.thalianaAtNAC026 andAtNAM,indicating that they belonged to the same evolutionary branch.Quantitative real-time PCR (qRT-PCR) revealed thatOpNAC026 displayed a much broader expression range atO.pumiladifferent tissues,with a maximum expression in leaves.The transcriptional level ofOpNAC026 was up-regulated as 24 h of NaCl treatment,12 h of 20 % PEG-6000 treatment,6 h of ABA treatment and 8 h of 4 ℃ treatment,respectively.Our research indicated thatOpNAC026 might control the mechanism of resistance inO.pumila.
Key words:Olimarabidopsispumila;OpNAC026;cloning;stress tolerance;gene expression
中图分类号:Q785;Q786
文献标志码:A
作者简介:魏艳玲(1989-),女,在读硕士研究生,主要从事生物化学与分子生物学研究。E-mail:yanlingw143@163.com*通信作者:黄先忠,教授,主要从事植物分子遗传研究。E-mail:xianzhongh106@163.com
基金项目:国家自然科学基金(U1303302;31060149);石河子大学高层次人才启动项目(RCZX200902)
收稿日期:2014-09-05;修改稿收到日期:2014-12-01
文章编号:1000-4025(2015)01-0037-07
doi:10.7606/j.issn.1000-4025.2015.01.0037

