黄芪多糖对阿尔茨海默病小鼠海马组织的影响
费洪新 高 音 孙丽慧 廉 洁 李 林(齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
黄芪多糖对阿尔茨海默病小鼠海马组织的影响
费洪新高音孙丽慧廉洁李林
(齐齐哈尔医学院,黑龙江齐齐哈尔161006)
〔摘要〕目的探讨黄芪多糖(APS)对阿尔茨海默病(AD)模型小鼠的影响。方法小鼠随机分成对照组、模型组、吡拉西坦组、APS高、中、低剂量组(800、600、200 mg·kg-1·d-1)。采用Aβ1~42双侧脑室注射小鼠诱导AD模型。灌胃时各组给予等体积的药物或生理盐水,持续28 d。采用Morris水迷宫测试行为学指标并观察小鼠学习记忆能力,观察小鼠海马组织的镜下形态结构、脑和脾脏的脏器指数,检测小鼠脑组织含水量和伊文氏蓝(EB)含量,采用双抗体夹心法测定海马组织β-淀粉样蛋白(Aβ)和白介素(IL) -6水平。结果与模型组比较,APS高、中、低剂量组能明显改善AD模型小鼠学习记忆能力(P<0.05),明显改善海马神经元细胞形态,升高脑和脾脏脏器指数(P<0.05),降低脑组织含水量和EB含量(P<0.05),降低海马Aβ和IL-6水平(P<0.05)。结论APS能改善AD模型小鼠的学习记忆功能及海马神经元形态结构,降低AD模型小鼠血脑屏障破坏程度。APS通过抑制Aβ和IL-6蛋白水平而在AD治疗中发挥作用。
〔关键词〕黄芪多糖;阿尔茨海默病;海马组织
第一作者:费洪新(1978-),男,在读博士,讲师,主要从事老年性痴呆、痛风、肿瘤研究。
Effect of astragalus polysaccharides on the hippocampal tissue in Alzheimer's disease mouse
FEI Hong-Xin,GAO Yin,SUN Li-Hui,et al.
Qiqihar Medical University,Qiqihar 161006,Heilongjiang,China
【Abstract】Objective To explore the effect of astragalus polysaccharides (APS) on the hippocampal tissue in Alzheimer's disease (AD) model mouse.Methods Mouse were randomly divided into control,model,piracetam,APS high-dose(800 mg·kg-1·d-1),middledose(400 mg·kg-1·d-1),low-dose (200 mg·kg-1·d-1) groups.Aβ1~42was injected into the bilateral hippocampus to induce AD models.The Morris water maze was used to observe the learning and memory ability.After the treatment,all animals were sacrificed,morphology of hippocampus was observed,the calculated the organ coefficients of brain and splenic organ were measured,water content and EB level were observed.Biochemical methods were used to determine the contents of Aβ and IL-6 in hippocampal tissue.Results Compared with those of model group,the learning and memory abilitise of APS groups were significantly improved(P<0.05),the number of nerve cells was significantly increased,the organ coefficients of brain and splenic organ were significantly increased(P<0.05),the water content and EB level were significantly decreased(P<0.05),the contents of Aβ and IL-6 were significantly decreased(P<0.05).Conclusions APS could improve the abilities of learning and memory of AD model mouse.APS could maintain normal morphological structure of nerve cells of AD mice.APS should depress the damage of blood brain barrier in AD mouse.APS plays a certain role in the treatment of AD through inhibiting Aβ and IL-6.
【Key words】Astragalus polysaccharides; Alzheimer's disease; Hippocampal tissue
阿尔茨海默病(AD)是一种常见的中枢神经系统退行性疾病,其主要病理变化是海马组织出现神经元数目减少及面部老年斑(SP)的形成〔1〕。SP的核心成分是β-淀粉样蛋白(Aβ),Aβ大量沉积后在海马区出现Aβ的物质团块,同时出现小胶质细胞炎症反应,产生白介素(IL) -6等炎症因子,进一步刺激Aβ产生,导致Aβ含量剧增,引发AD〔2〕。黄芪是一种常用的中药,黄芪多糖(APS)是黄芪的主要成分之一,作用十分广泛,包括提高小鼠的学习记忆能力〔3〕、降低老年早期糖尿病肾病肿瘤坏死因子(TNF) -α及IL-6的水平〔4〕、降低肾小球肾炎大鼠血IL-6的水平〔5〕,还有增强机体免疫、强心降压、抗氧化〔6〕等功能。但APS对AD模型小鼠的实验研究国内外未见报道,基于此,本课题开展APS对AD小鼠行为学、形态学、血脑屏障通透性、Aβ及IL-6影响的研究。
1 材料与方法
1.1实验动物42只雄性8周龄清洁级C57BL/6小鼠,体重(23±2) g,由北京维通利华实验动物技术有限公司提供,动物许可证号: SCXK(京) 2012-0001。在黑龙江中医药大学实验动物中心常温、常湿饲养,动物自由摄取食物和饮用水。
1.2主要药物及其仪器药物:吡拉西坦,批号130325,购于湖南迪诺制药有限公司; Aβ、IL-6酶联免疫试剂盒,批号20140401,南京建成生物工程研究所生产; Aβ1~42购于Sigma公司; APS购于南京泽朗医药科技集团公司;其他试剂均为国产分析纯。仪器: Morris水迷宫,安徽淮北正华生物仪器设备有限公司;电子天平,沈阳龙腾电子称量仪器有限公司; 6100型RT-雷杜酶标仪,美国RT公司; Leica-2135切片机,德国Leica公司; TGL-16G台式离心机,上海安亭科学仪器厂; TCNAI-G2型透射电子显微镜,荷兰公司等。
1.3实验方法
1.3.1动物模型的复制小鼠水合氯醛麻醉后,用微量加样器向双侧脑室一次性注入5 μl凝聚态Aβ1~42(80 pmol/μl),针头留置2 min后包扎。对照组双侧脑室注射等量生理盐水。
1.3.2动物分组及给药小鼠随机分对照组、模型组、吡拉西坦组、APS高、中、低剂量组,每组7只。对照组、模型组小鼠给予生理盐水灌胃、吡拉西坦组给予吡拉西坦620 mg·kg-1·d-1灌胃、APS高、中、低剂量组分别给予APS 800、400、200 mg· kg-1·d-1灌胃,灌胃时间均为28 d。
1.3.3Morris水迷宫检测AD小鼠定位航行能力Morris仪器水深20 cm,水温(23±2)℃,平台放于第四象限,没于水下1 cm,第1~4天为训练时间,每次训练60 s。第5天为测试时间,观察小鼠到达平台位置的潜伏期时间,以此来衡量小鼠的定位航行能力,反映小鼠学习能力指标。
1.3.4Morris水迷宫检测AD小鼠空间探索能力训练过程同上,在第5天时撤去平台,检测在60 s内小鼠找到平台的游泳距离衡量小鼠的空间探索能力,反映小鼠记忆能力。
1.3.5HE染色检测海马组织结构将小鼠用水合氯醛麻醉,迅速开胸,暴露心脏,剪开右心耳,左心室迅速灌注100 ml生理盐水,用4%多聚甲醛缓慢匀速灌注固定,断头取海马组织固定于4%多聚甲醛之中。制备石蜡切片,常规HE染色,光学显微镜下观察海马组织结构。
1.3.6透射电镜检测海马组织结构向各组小鼠心脏灌注戊二醛后,取小鼠海马组织,用戊二醛、四氧化锇固定、脱水、包埋、切片后,用电子显微镜观察海马组织结构。
1.3.7小鼠脏器指数测定实验结束后,各组小鼠迅速断头处死,取小鼠脑、脾脏,用电子天平称取脏器质量,计算脑、脾脏的脏器指数。脏器指数(mg/g) =脏器质量(mg) /体重(g)。
1.3.8脑组织含水量的测定在脑组织称重后,去除小脑和脑干,吸去表面液体,在电子天平上称量脑组织重量计为脑组织湿重;用电热恒温箱(52℃)烘烤3 d,再次称量,此时小鼠脑组织重量为脑组织干重。脑组织含水量(%) = (脑组织湿重-脑组织干重) /脑组织湿重×100%。
1.3.9脑组织伊文氏蓝(EB)含量的测定向小鼠尾静脉注射2%EB,水合氯醛麻醉,心脏灌注生理盐水70 ml,冰台上迅速解剖,取脑组织,放入甲酰胺溶液内浸泡,45℃避光孵育72 h,匀浆,5 000 r/min离心10 min。在酶标仪上630 nm处测定上清液吸光度值(A)。根据EB标准曲线求出EB含量,EB含量(μg/g)用EB浓度/脑湿重来表示。
1.3.10海马组织Aβ和IL-6含量的测定各组小鼠断头后迅速取海马组织,匀浆,静置,离心,取上清液,分装,-20℃保存。按酶联免疫试剂盒说明书进行操作,在450 nm波长处测定各孔吸光度(A),求得海马组织Aβ和IL-6的含量。
2 结果
2.1APS对AD小鼠定位航行能力及空间探索能力的影响与对照组比较,模型组小鼠潜伏期及游泳距离明显增加(P<0.05) ;与模型组比较,吡拉西坦组、APS高、中、低剂量组小鼠潜伏期及游泳距离明显缩短(P<0.05)。见表1。
表1 APS对AD小鼠潜伏期、游泳距离的影响(±s,n=7)

表1 APS对AD小鼠潜伏期、游泳距离的影响(±s,n=7)
与模型组比较: 1) P<0.05;下表同
组别 潜伏期(s) 游泳距离(cm)对照组 15.94±9.031) 538.90±87.221)模型组 41.46±10.16 1257.20±137.59吡拉西坦组 21.49±9.161) 760.96±166.061)APS高剂量组 28.06±6.411) 837.57±59.151)APS中剂量组 26.51±6.221) 802.14±61.131)APS低剂量组 23.04±3.471) 770.11±85.721)
2.2APS对AD小鼠海马组织CA3区HE染色的影响对照组海马组织CA3区神经元分布均匀,细胞4~5层,细胞核清晰,细胞质丰富;模型组神经元2~3层,排列紊乱,细胞质较少;吡拉西坦组神经元萎缩较少,细胞分布均匀,细胞质染色深; APS高、中、低剂量组神经元萎缩较少、细胞3~4层、排列比较规则,细胞形态比较清晰(见图1)。
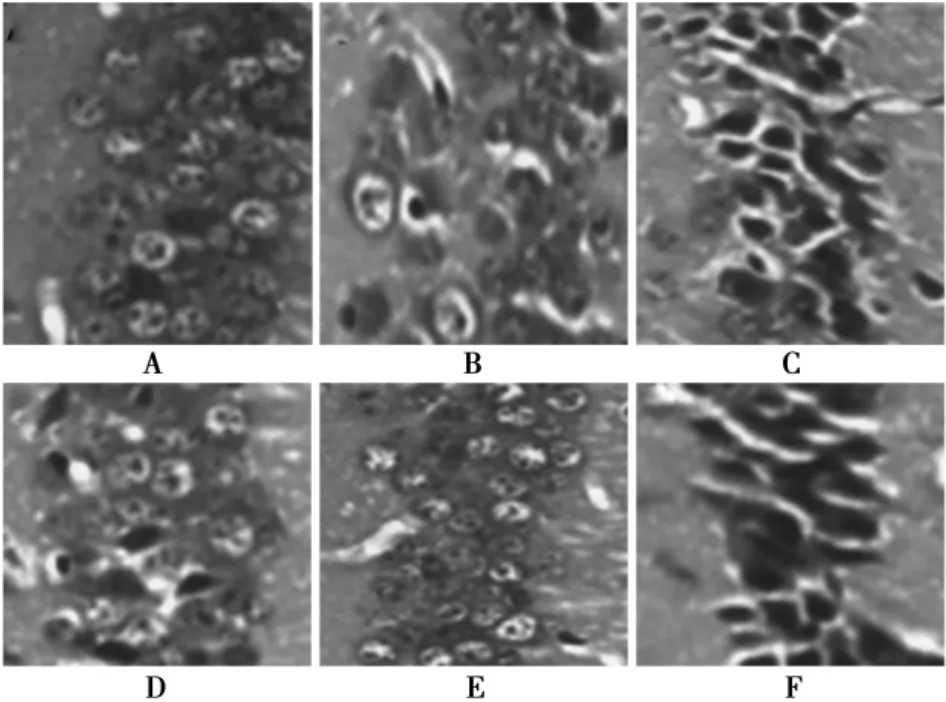
图1 小鼠海马CA3区神经元HE染色(×400)
2.3APS对AD小鼠海马组织CA3区超微结构的影响对照组海马组织CA3区神经元细胞质丰富,线粒体丰富,线粒体结构正常,细胞质内无异常结构;模型组小鼠神经元细胞质中细胞器较少,线粒体肿胀,线粒体呈现圆形或者椭圆形;吡拉西坦组海马神经元细胞器较多,线粒体轻度肿胀,核膜清晰; APS高、中、低剂量组海马神经元细胞器丰富,核膜清晰,粗面内质网轻度肿胀,线粒体形态和结构正常(见图2)。
2.4APS对AD小鼠脑、脾脏脏器指数的影响与对照组比较,模型组小鼠脑、脾脏的脏器指数明显降低(P<0.05) ;与模型组比较,吡拉西坦组、APS高、中、低剂量组小鼠脑、脾脏的脏器指数明显升高(P<0.05)。见表2。
2.5APS对AD小鼠脑组织含水量的影响与对照组〔(72.57±2.07) %〕比较,模型组小鼠脑组织含水量〔(84.14± 2.41) %〕明显升高(P<0.05) ;与模型组比较,吡拉西坦组〔(76.00±2.16) %〕、APS高、中、低剂量组小鼠脑组织含水量〔(74.86±3.02) %、(75.86±3.34) %、(75.00±2.94) %〕明显降低(P<0.05)。

图2 小鼠海马CA3区神经元细胞质超微结构改变(×16 500)
表2 APS对小鼠脑、脾脏脏器指数的影响(±s,n=7,mg/g)

表2 APS对小鼠脑、脾脏脏器指数的影响(±s,n=7,mg/g)
组别 脑 脾脏对照组 8.25±0.191) 3.21±0.251)模型组 7.63±0.23 2.65±0.20吡拉西坦组 8.12±0.181) 3.06±0.161)APS高剂量组 8.07±0.221) 3.01±0.211)APS中剂量组 7.91±0.221) 2.93±0.221)APS低剂量组 7.90±0.191) 3.04±0.211)
2.6APS对AD小鼠脑组织EB含量的影响与对照组〔(0.90±0.14)μg/g〕比较,模型组小鼠脑组织EB含量〔(2.15±0.39)μg/g〕明显升高(P<0.05) ;与模型组比较,吡拉西坦组〔(1.24±0.32)μg/g〕、APS高、中、低剂量组小鼠脑组织EB含量〔(1.32±0.41)μg/g、(1.32±0.17)μg/g、(1.27± 0.19)μg/g〕明显降低(P<0.05)。
2.7APS对AD小鼠海马组织Aβ和IL-6表达的影响与对照组比较,模型组小鼠海马组织Aβ和IL-6含量明显升高(P<0.05) ;与模型组比较,吡拉西坦组、APS高、中、低剂量组海马组织Aβ和IL-6含量明显降低(P<0.05)。见表3。
表3 APS对各组小鼠海马组织Aβ和IL-6表达的影响(±s,n=7)
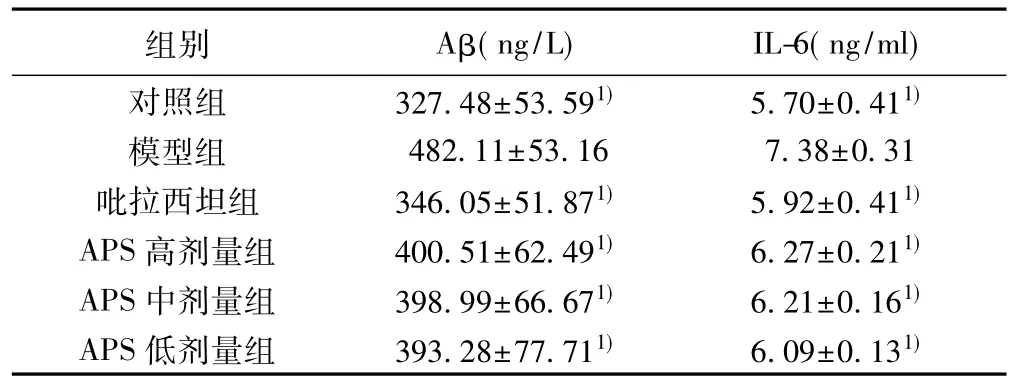
表3 APS对各组小鼠海马组织Aβ和IL-6表达的影响(±s,n=7)
组别 Aβ(ng/L) IL-6(ng/ml)对照组 327.48±53.591) 5.70±0.411)模型组 482.11±53.16 7.38±0.31吡拉西坦组 346.05±51.871) 5.92±0.411)APS高剂量组 400.51±62.491) 6.27±0.211)APS中剂量组 398.99±66.671) 6.21±0.161)APS低剂量组 393.28±77.711) 6.09±0.131)
3 讨论
AD是目前引发痴呆的最常见致病原因之一〔7〕。AD小鼠早期主要表现为学习、记忆能力减退〔8,9〕,因此本实验采用水迷宫检测小鼠的学习、记忆能力,探寻与小鼠学习、记忆能力相关的因子。
AD的发病机制极其复杂,许多蛋白质参与了AD的发生和发展。AD发生的核心成分是Aβ,主要的细胞因子是IL-6、TNF-α、IL-1β等〔10,11〕。AD的研究有很多模型,如快速老化小鼠模型〔12〕、注射Aβ模型〔13〕等,但近年来很多研究者采用小鼠双侧脑室注射Aβ造模,以获得快速准确的结果。
本实验结果显示,模型组AD小鼠学习、记忆能力减退,模型建立成功;小剂量APS对AD小鼠的治疗有明显效果且无剂量依存关系,各剂量均能明显改善AD小鼠学习、记忆能力。文献报道海马CA3区与学习记忆关联很大〔14〕,因此本研究测定海马CA3区结构。形态学观察对照组海马神经元结构正常,无损伤,适宜为对照组。模型组神经元损伤严重,模型建立成功。经过治疗后,APS能明显改善AD小鼠的海马结构,使其损伤减轻,甚至有不同程度的恢复。这些都提示APS对AD小鼠有一定疗效和实用价值,为临床治疗提供了理论基础。而且,APS能明显改善AD小鼠的脑、脾脏相对质量,增强机体的抗感染能力,提示APS可恢复脾脏、脑的部分功能。
模型组小鼠脑组织含水量和EB含量明显升高。当机体水分过多,部分水分进入脑组织后,脑组织容易出现脑水肿,同时脑实质结构的重量就会减轻,脑组织血脑屏障的通透性增加; APS可明显改善脑组织的水肿程度,改善脑组织血脑屏障的通透性,脑组织含水量的变化与脑、脾脏的脏器指数变化一致,提示脑组织炎症反应明显的同时可伴有一定的脑组织水肿及血脑屏障通透性增加。
综上所述,APS能改善AD模型小鼠的学习、记忆功能及海马组织形态学结构,减轻炎症反应,降低血脑屏障的通透性。同时,APS能够通过抑制海马Aβ和IL-6蛋白的水平,可在AD治疗中发挥重要的作用,但具体的机制还待进一步研究。
4 参考文献
1张赓,吴金娟,姜淼,等.中医药治疗阿尔茨海默病的研究进展〔J〕.中国实验方剂学杂志,2014; 20(6) : 217-22.
2Mohandas E,Rajmohan V,Raghunath B.Neurobiology of Alzheimer' s disease〔J〕.Indian J Psychiatry,2009; 51(1) : 55-61.
3万鹏,王师,王军,等.黄芪多糖对小鼠学习记忆能力的影响〔J〕.延边大学医学学报,2011; 34(1) : 23-5.
4邓海鸥,林凯,黎映兰,等.黄芪多糖对老年早期糖尿病肾病者TNF-α、IL-6和免疫功能的影响〔J〕.中药材,2014; 37(3) : 721-4.
5李智军,魏连波,贺丰,等.黄芪多糖治疗大鼠系膜细胞增生性肾炎的实验研究〔J〕.中国中西医结合肾病杂志,2000; 1(4) : 206-8.
6黄家林,张勇.黄芪多糖抗炎免疫作用机制研究进展〔J〕.中西医结合心脑血管病杂志,2013; 11(11) : 1374-5.
7苏芮,韩振蕴,范吉平,等.阿尔茨海默病中医病因病机探讨〔J〕.中华中医药杂志,2010; 25(5) : 743-4.
8余静,楚佳梅,高灵爱,等.麦粒灸对阿尔茨海默病小鼠学习记忆能力及脑内淀粉样蛋白沉积的影响〔J〕.针刺研究,2014; 39(1) : 58-62.
9叶芸,张文均,刘柳,等.APP/PS1双转基因小鼠早期记忆功能障碍与胆碱能系统的关系研究〔J〕.中国神经免疫学和神经病学杂志,2012; 19(2) : 112-5.
10孙京华,钟萍.血管性痴呆炎症细胞因子〔J〕.蚌埠医学院学报,2012; 37(2) : 228-30.
11Wu X,Lu Y,Dong Y,et al.The inhalation anesthetic isoflurane increases levels of proinflammatory TNF-α,IL-6,and IL-1β〔J〕.Neurobiol Aging,2012; 33(7) : 1364-78.
12陶彦谷,黄启辉.海马还丹对快速老化小鼠SAMP/8学习记忆能力及海马APP、Pin1、HMGB1 mRNA表达的影响〔J〕.中国实验方剂学杂志,2013; 19(22) : 259-65.
13张云鹤,张一娜,刘歆,等.Aβ1~42诱导原代海马神经细胞建立阿尔茨海默病细胞模型〔J〕.中国老年学杂志,2011; 31(11) : 2027-9.
14钟炳武,王哲,何明大,等.脑灵汤对阿尔茨海默病模型大鼠行为学及海马CA3区域淀粉样前体蛋白表达的影响〔J〕.中南大学学报(医学版),2010; 35(5) : 431-7.
〔2014-09-19修回〕
(编辑郭菁)
通讯作者:高音(1969-),女,博士,教授,硕士生导师,主要从事老年性痴呆、脑损伤分子机制研究。
基金项目:国家自然科学基金项目(81373777,81173599) ;教育部科学技术重点项目(210068)
〔中图分类号〕R285.5
〔文献标识码〕A
〔文章编号〕1005-9202(2015) 16-4426-04;
doi:10.3969/j.issn.1005-9202.2015.16.004

