高表达微小RNA22对结肠癌细胞HCT-116增殖的影响
李 博 宋 燕 李春生(吉林大学中日联谊医院结直肠肛门外科,吉林 长春 130033)
高表达微小RNA22对结肠癌细胞HCT-116增殖的影响
李博宋燕李春生
(吉林大学中日联谊医院结直肠肛门外科,吉林长春130033)
〔摘要〕目的探讨高表达微小RNA(mir) -22对结肠癌细胞系(HCT-116)增殖的影响及mir-22水平与结肠癌细胞增殖能力的相关性。方法合成mir-22基因序列,构建SD13-hsa-mir-22质粒,质粒提取后完成对大肠癌细胞系HCT-116细胞的转染,确认转染效率后进行Realtime PCR检测,确定高表达模型建立成功。将HCT-116细胞分为高表达mir-22组、空载体转染(NC)组及未经处理的HCT-116组。通过四甲基偶氮唑蓝比色(MTT)法检测细胞生长,将测定结果进行统计学分析。结果MTT实验转染高表达mir-22的HCT116细胞和转染空载体的细胞及未转染的阴性对照组细胞相比,生长速度明显减慢。而转染空载体组及阴性对照组细胞生长速度无明显差距。结论Mir22抑制结肠癌细胞系HCT-116的增殖。
〔关键词〕微小RNA22;结肠癌;增殖
第一作者:李博(1980-),男,博士,主治医师,主要从事结直肠癌基础及临床研究。
大肠癌是导致人类死亡最致命的杀手之一,大肠癌细胞的扩增能力被证明与多种靶基因相关,而微小RNA(mir) -22具有与多个靶点基因相结合从而控制肿瘤进展的能力,已证明它在乳腺癌、肺癌、肝癌中能够抑制肿瘤的进展。本实验拟采取对大肠肿瘤细胞株(HCT-116)转染mir-22,从而建立高表达模型,明确mir-22水平变化对大肠癌细胞扩增能力的影响。国内外文献检索尚未发现mir-22水平与结肠癌细胞增殖能力的相关性报道。
1 材料与方法
1.1细胞株和试剂人类结肠癌细胞系HCT-116购自中国科学院组织标本库,培养在含有10%胎牛血清的MCCOY’S 5A培养基中,补充青霉素100 U/ml,链霉素100 μg/ml。于37℃,5%的CO2条件下进行培养。Lipofectamine 2000购自美国Invitrogen公司,质粒提取试剂盒购自天根生化科技有限公司,miRNA cDNA Synthesis Kit(Perfect Real Time)试剂盒、RNAiso for Small RNA、SYBR Premix Ex TaqTMⅡ(Perfect Real Time)均购自Takara公司。
1.2主要仪器Realtime PCR测定应用Applied Biosystems公司的ABI PRISM®7300 Real-Time PCR System完成,噻唑蓝法(MTT)吸光值测定应用美国BioTek公司的ELx800吸收光酶标仪。
1.3Mir-22载体构建目的基因由miRBase下载人类MicroRNA22基因序列(hsa-miR-22序列5'-AGUUCUUCAGUGGCAAGCUUUA-3')后送invitrogen合成。建立高表达载体,名称为SD13,克隆片段大小233 bp,上游克隆酶切位点BamH I,下游克隆酶切位点CIP,室温下进行退火反应形成双链寡核苷酸,用过T4 DNA链接酶将hsa-miR-22克隆至SD13载体中,目的质粒名称SD13-hsa-mir-22。
用CaCl2转化法制备新鲜的大肠杆菌感受态细胞,将感受态大肠杆菌从-70℃冰箱中取出,在冰上融15 min,融化后轻轻混匀。用移液器吸取50 μl大肠杆菌及5 μl质粒,放入1.5 ml离心管中。混匀后放在冰上30 min。在42℃水浴中热休克细菌45 s,立即转移至湿冰中,放置2 min。加入900 μl LB培养液,放入37℃摇床中摇晃培养1 h。在含有氨苄青霉素的LB琼脂平板上涂上50 μl上述液体,将琼脂面向上盖向下的放在37℃的孵箱中过夜,并在第2天取出并放入4℃冰箱。
SD13-hsa-mir-22质粒构建成功后,将阳性转化子培养并保存为甘油菌,送检测序。
1.4质粒提取mir-22质粒的提取过程严格按照TIANGEN无内毒素质粒大提试剂盒的规定步骤逐步完成。提取出的质粒DNA应用紫外分光光度法进行OD260的测量确定产量,并应用琼脂糖凝胶电泳法进行分析。然后将mir-22质粒DNA放入-20℃冰箱中进行保存。
1.5细胞转染取对数生长期细胞,以4×104个细胞/孔的密度铺于24孔板培养,当细胞生长到70%进行转染,于1.5 ml无菌EP管内,将5 μl转染质粒与45 μl无血清无双抗的MCCOY’S 5A培养基混匀;同样方法将5 μl转染试剂(Lipofectamine 2000美国Invitrogen)与45 μl无血清无双抗的MCCOY’S 5A培养基混匀;将两支EP管静置5 min后将管内溶液移至同一EP管内,混匀后室温放置20 min,最后加入含血清和双抗的MCCOY’S 5A培养液100 μl,混匀后待用。将铺板细胞分为转染mir-22组,空质粒转染组(NC组),第三组为空白对照组(不加转染试剂)。弃去原24孔板培养液,磷酸盐缓冲液(PBS)冲洗3次,缓慢将上述含转染试剂及质粒的培养液200 μl加入24孔板的相应孔内,将24孔板置于37℃,5%CO2培养箱中孵育。4 h后弃去培养液,200 μl PBS冲洗2次,加入含血清、双抗的MCCOY’S 5A新鲜培养液400 μl,37℃,5%CO2培养箱中继续培养。转染48 h后检测荧光素酶活性(奥林巴斯荧光显微镜SZ61GFP/T-S),每组实验重复3次。
1.6Realtime PCR miRNA提取过程取长满细胞的细胞培养瓶,倒出细胞培养液,PBS清洗1次。培养瓶中加入1.0 ml的RNAiso for Small RNA,水平放置,室温孵育8 min,用移液枪吹打细胞使其脱落,并将其转移至1.5 ml的EP管中。加入0.2 ml氯仿,振荡混匀15 s,室温孵育5 min。置于预冷好的离心机中,12 000 r/min 4℃离心15 min。离心后在试管中将出现3个可见的层次,将上层无色的水相转移至一个新的EP管中,并注意不被其他层污染。向上清中加入0.5 ml异丙醇,混合后室温静置10 min,在4℃及12 000 r/min下离心10 min,可见少量沉淀物。移除上清液,并加入75%的乙醇1 ml,4℃、12 000 r/min离心5 min,之后移除乙醇。在室温下使沉淀干燥,蒸发残存乙醇5 min,用碳酸二乙酯(DEPC)水30 μl溶解,并加入RNA酶抑制剂1 μl,至RNA沉淀完全溶解后-80℃保存备用。
miRNA反转录:应用Takara公司生产的SYBR Premix Ex TaqTMⅡ(Perfect Real Time)试剂盒,采取20 μl反应体系进行反转录反应,应用Gene Specific Primer 5 pmol /20 μl,反转录反应条件设置为42℃15 min。将miRNA反转录生成cDNA。
PCR反应液配制:应用Takara公司生产的One Step Prime-Script®miRNA cDNA Synthesis Kit(Perfect Real Time)试剂盒,选用20 μl反应体系进行配制。分别选用micr22及U6进行反应分析,上游及下游引物均购自广州锐博公司,hsa mir-22的PCR产物片段为88 bp,U6的PCR产物片段为96 bp。
应用分光光度计测定cDNA浓度,将加样前的cDNA浓度均进行相当倍数的稀释,使其浓度统一,使20 μl反应液中使用相当于100 ng Total DNA量的cDNA为模板。
进行Real Time PCR反应:应用Applied Biosystems公司生产的ABI PRISM®7300 Real-Time PCR System进行反应,反应结束后应用7300 System SDS Software进行数据分析,确认标准曲线,应用U6制作标准曲线,因miRNA片段较小,应用U6作为内参照。反应最终产物可进行电泳分析。
把cDNA按照10倍稀释,设定6个浓度梯度,分别为1、10-1、10-2、10-3、10-4、10-5进行Realtime PCR扩增,以标准品U6绘制标准曲线。
1.7MTT法检测细胞生长胰酶消化悬浮细胞后行细胞计数,培养液稀释细胞悬液,以每孔10 000个细胞接种到96孔板,每孔体积200 μl。将每个96孔板铺三组细胞,每组铺三个孔,分别进行mir-22、NC转染及空白对照,荧光显微镜下确认转染成功后,37℃,5%CO2培养箱中培养2 d,取一块96孔板,每孔加MTT溶液20 μl,继续孵育4 h,终止培养,小心吸弃孔内培养上清液,每孔加150 μl二甲基亚砜(DMSO),脱色摇床震荡10 min,使结晶物充分溶解。选择490 nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果。每天检测1块96孔板,每组3孔取平均值,连续检测1 w的生长情况,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.8统计学方法应用SPSS13.0软件行t检验和方差分析。
2 结果
2.1质粒测序应用Chromas分析测序结果,可找到人类Mir22基因序列(hsa-miR-22序列5'-AGUUCUUCAGUGGCAAGCUUUA -3'),证实高表达载体建立成功。
2.2转染效率检测转染48 h后检测荧光素酶活性,确定转染效率达到85%。见图1。
2.3Realtime PCR检测标准曲线及溶解曲线扩增效率E= 0.948 9,相关系数r2=0.993 5,标准曲线线性关系良好,在实验浓度范围内能够进行准确定量。无论哪一种浓度的U6都能得到单一的PCR扩增的产物。
2.4定量PCR检测mir-22表达HCT-116细胞的mir-22的表达量较低,转染mir-22组细胞的表达量为(22.12±0.04)。NC组为(26.92±0.07)、未经处理的HCT-116组为(26.65± 0.06) (P<0.05)。且U6分别为11.78±0.09,11.05±0.06,10.39±0.15,已知hsa mir-22的PCR产物片段为88 bp,U6的PCR产物片段为96 bp,电泳结果进一步验证了PCR产物。
2.5MTT检测细胞生长转染高表达mir-22的HCT-116细胞和NC组细胞及HCT-116组细胞相比,生长速度明显减慢。而NC组HCT-116组细胞生长速度无明显差距。见表1。

图1 转染效率荧光素酶检测
表1 高表达mir-22对结肠癌细胞系HCT-116增殖能力的影响(±s)
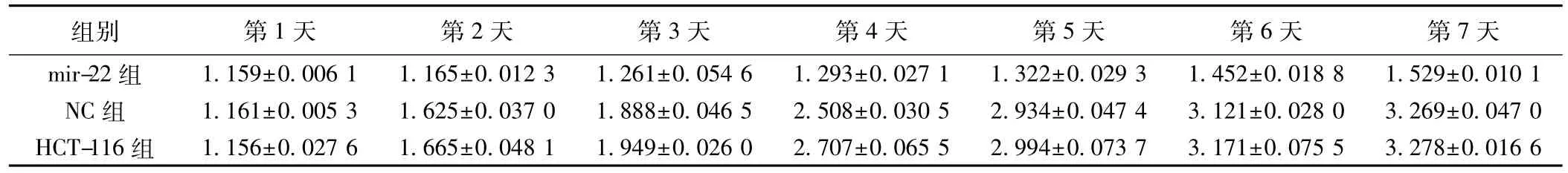
表1 高表达mir-22对结肠癌细胞系HCT-116增殖能力的影响(±s)
组别 第1天 第2天 第3天 第4天 第5天 第6天 第7天mir-22组 1.159±0.006 1 1.165±0.012 3 1.261±0.054 6 1.293±0.027 1 1.322±0.029 3 1.452±0.018 8 1.529±0.010 1 NC组 1.161±0.005 3 1.625±0.037 0 1.888±0.046 5 2.508±0.030 5 2.934±0.047 4 3.121±0.028 0 3.269±0.047 0 HCT-116组 1.156±0.027 6 1.665±0.048 1 1.949±0.026 0 2.707±0.065 5 2.994±0.073 7 3.171±0.075 5 3.278±0.016 6
3 讨论
人类mir22是新近发现的由22个核苷酸组成的非编码蛋白RNA,染色体位置在17p13.3,具有抑癌特性。在传统意义上有三种不同的基因涉及恶性肿瘤的形成过程中:癌基因、抑癌基因和基因组稳定基因。很多学者认为这些基因都是有蛋白编码基因构成。然而,越来越多的证据表明,miRNA在肿瘤的发生、发展过程中起到了重要作用,可以将它们看作是促癌基因或抑癌基因,或者更为复杂的作用方式。与很多miRNA的促癌作用不同,mir22表现出了抑癌基因般的作用效果,对多种肿瘤都展现出了调控能力。而且在胚胎发育、骨骼代谢、心肌细胞发育等方面,miRNA也展现出了极为重要的地位。但其具体的作用途径、作用位置和作用靶点都有待我们进一步探索。
在心血管疾病方面,已经有人通过研究mir22基因区域的rs7223247 SNP,证实了其表达与左心室重量增加存在相关性〔1〕。还有人证明过表达mir22能够显著促进新生的心脏成纤维细胞提前成熟〔2〕。在神经系统方面,Muiños-Gimeno等〔3〕指出miR-22与恐慌症有关,并且调控了一些与焦虑相关的基因。更有人对亨廷顿氏病进行研究,发觉过表达mi22能够阻止神经细胞凋亡并起到神经保护作用,并可能是通过影响亨廷顿氏病的通路产生作用〔4〕。在胚胎发育系统方面,mir22能够降低未分化肝细胞胸腺旁腺素的分泌,也能通过控制Irf8 mRNA来影响鼠类树突细胞的分化〔5〕。
骨骼代谢方面,上调mir22能够通过抑制HDAC6蛋白的表达,促进成骨细胞的分化〔6〕。而在妇科系统中,子宫内膜异位症的患者被证明血浆中的mir-22呈下调表现〔7〕。在研究不断深入的过程中,有人发现了mir-22通过转录后修饰ErbB3,从而抑制了肺癌细胞系A549和H1299的增殖和侵袭能力〔8〕。对于乳腺癌细胞,有人提出mir-22可以直接作用于ERα从而阻止了雌激素信号途径,抑制了肿瘤细胞的生长〔9〕。也有人认为,mir-22通过调控EVI-1癌基因的表达,从而起到了抑制乳腺转移癌的目的〔10〕。在肝癌领域,mir-22的目的基因是HDAC4,能够通过抑制HDAC4达到抑制HCC细胞系扩增的目的〔11〕。同时,也能够通过抑制核转录因子(NF) -κB活化剂的表达,抑制肝癌生成〔12〕。对于卵巢癌的研究更为透彻,mir-22被认为能够在侵袭和迁移层面发挥抑制作用,更进一步是其抑制作用通过Tiam1起效〔13〕。
证据表明,mir-22的表达改变在不同癌症的进展中起着重要作用,然而,mir-22在结肠癌细胞中的确切作用仍不明确。之前有文献报道在缺氧状态下,mir-22可以通过抑制结肠癌细胞翻译缺氧诱导因子(HIF) -1α,从而发挥其抑癌作用〔14〕,然而,本实验是在供氧充分的环境下完成的,用HIF-1似乎无法解释HCT-116细胞所带来的变化。这项研究表明,mir-22的调控机制仍然存在疑点,需要进一步探索。
Mir-22已经被广泛在体内和体外进行不同类型的人类癌症研究。但很少有报道指出它在结肠癌中的作用。mir-22在很多脊椎动物中序列高度保守。早期的研究表明,mir-22在红细胞成熟过程中起到重要作用〔15〕;近期的数据表明,mir-22在不同种类的肿瘤发生过程中都出现了表达水平的变化。因此,它被认为能够作为一种人类肿瘤的抑癌基因。已有研究将结肠癌组织和临近正常肠黏膜组织进行对比分析,发现在结肠癌组织中mir-22的相对表达水平要明显低于临近正常的黏膜组织〔16〕。这又从组织实验的角度证实了mir-22和HCT-116的恶性行为程度呈逆向变化。然而,mir-22在结肠癌中的具体作用机制仍是未知的。由于miRNA的作用特点是可以同时对人体的多个基因位点进行调控,而动物的miRNA和mRNA之间的互补程度比较低,这样就增加了动物的靶基因预测出现假阳性的可能性,研究其作用方式比较困难。因此,只有找到它在结肠癌细胞中所调控的基因位点才能进一步推测它在肿瘤的发生、发展中所起到的作用过程。
总之,miR-22可能在未来能够对结肠癌进展的控制发挥重要作用。
4 参考文献
1 Harper AR,Mayosi BM,Rodriguez A,et al.Common variation neighbouring micro-RNA 22 is associated with increased left ventricular mass〔J〕.PLoS One,2013; 8(1) : e55061.
2 Jazbutyte V,Fiedler J,Kneitz S,et al.MicroRNA-22 increases senescence and activates cardiac fibroblasts in the aging heart〔J〕.Age,2013; 35(3) : 747-62.
3 Muiños-Gimeno M,Espinosa-Parrilla Y,Guidi M,et al.Human microRNAs miR-22,miR-138-2,miR-148a,and miR-488 are associated with panic disorder and regulate several anxiety candidate genes and related pathways〔J〕.Biol Psychiatry,2011; 69(6) : 526-33.
4 Jovicic A,Zaldivar-Jolissaint JF,Moser R,et al.MicroRNA-22(miR-22) overexpression is neuroprotective via general anti-apoptotic effects and may also target specific huntington’s disease-related mechanisms〔J〕.PLoS One,2013; 8(1) : e54222.
5 Chen HL,Huang JY,Chen CM,et al.MicroRNA-22 can reduce parathymosin expression in transdifferentiated hepatocytes〔J〕.PLoS One,2012; 7: e34116.
6 Huang S,Wang SH,Bian CJ,et al.Upregulation of miR-22 promotes osteogenic differentiation and inhibits adipogenic differentiation of human adipose tissue-derived mesenchymal stem cells by repressing HDAC6 protein expression〔J〕.Stem Cells Dev,2012; 21(13) : 2531-40.
7 Jia SZ,Yang Y,Lang J,et al.Plasma miR-17-5p,miR-20a and miR-22 are down-regulated in women with endometriosis〔J〕.Hum Reprod,2013; 28(2) : 322-30.
8 Ling B,Wang GX,Long G,et al.Tumor suppressor miR-22 suppresses lung cancer cell progression through post-transcriptional regulation of ErbB3〔J〕.J Cancer Res Clin Oncol,2012; 138(8) : 1355-61.
9 Pandey DP,Picard D.MIR-22 inhibits estrogen signaling by directly targeting the estrogen receptorαmRNA〔J〕.Mol Cell Biol,2009; 29(13) : 3783-90.
10 Patel JB,Appaiah HN,Burnett RM,et al.Control of EVI-1 oncogene expression in metastatic breast cancer cells through microRNA miR-22〔J〕.Oncogene,2011; 30(11) : 1290-301.
11 Zhang J,Yang Y,Yang T,et al.MicroRNA-22,downregulated in hepatocellular carcinoma and correlated with prognosis,suppresses cell proliferation and tumourigenicity〔J〕.Br J Cancer,2010; 103(8) : 1215-20.
12 Takata A,Otsuka M,Kojima K,et al.MicroRNA-22 and microRNA-140 suppress NF-κB activity by regulating the expression of NF-kB coactivators〔J〕.Biochem Biophys Res Commun,2011; 411(4) : 826-31.
13 Li J,Liang S,Yu H,et al.An inhibitory effect of miR-22 on cell migration and invasion in ovarian cancer〔J〕.Gynecol Oncol,2010; 119(3) : 543-8.
14 Yamakuchi M,Yagi S,Ito T,et al.MicroRNA-22 regulates hypoxia signaling in colon cancer cells〔J〕.PLoS One,2011; 6(5) : e20291.
15 Choong ML,Yang HH,McNiece I.MicroRNA expression profiling during human cord blood-derived CD34 cell erythropoiesis〔J〕.Exp Hematol,2007; 35(4) : 551-64.
16 Zhang G,Xia S,Tian H,et al.Clinical significance of miR-22 expression in patients with colorectal cancer〔J〕.Med Oncol,2012; 29 (5) : 3108-12.
〔2015-02-11修回〕
(编辑袁左鸣/滕欣航)
通讯作者:宋燕(1954-),女,教授,博士生导师,主要从事结直肠癌基础及临床研究。
基金项目:吉林省青年科研基金项目资助课题(No.20150520146JH)
〔中图分类号〕R753.3+5
〔文献标识码〕A
〔文章编号〕1005-9202(2015) 16-4447-03;
doi:10.3969/j.issn.1005-9202.2015.16.012

