高迁移率族蛋白B1及内脂素在心肌梗死中的临床意义
武芬芬 傅晓敏 何昆仑
急性心肌梗死(acute myocardial infarction,AMI)是常见的心血管急症之一[1],致死致残率极高。WHO预测到2020年将成为全球第一大死亡原因[2]。而在我国每年新发心肌梗死患者至少50万人,给家庭及社会均带来严重的经济负担[3]。心力衰竭不仅是AMI常见并发症,有研究证实轻到中度心力衰竭发生率可达40%以上[4],美国NRMI机构发现AMI患者中约20%入院时即出现心力衰竭,而另有9%住院期间发生心力衰竭[5]。相关研究也显示有大部分患者入院前后即以发生心力衰竭[6-8]。另外心力衰竭也是影响AMI的预后的重要因素。AMI合并心力衰竭病死率比无合并心力衰竭患者高,相关多项研究已发现其病死率在20%左右[9-11]。近年来AMI的治疗理念不断更新,有效降低了患者病死率,但由于生存率的不断提高,心力衰竭的患病率逐年增加,5年病死率仍较高,与恶性肿瘤相当。当前AMI的治疗侧重于抑制心室重构的发生、发展,防止心力衰竭发生。心室重构与心肌缺血、坏死及再灌注损伤密切相关,其本质局部炎性反应造成的急慢性心肌损伤[12]。高迁移率族蛋白B1 (high mobility group box 1 protein,HMGB1)及内脂素均是促炎因子,在冠心病的发生发展中起重要作用[13,14]。本文探讨HMGB1、内脂素与AMI后心力衰竭之间的联系,报告如下。
1 资料与方法
1.1 一般资料 选取2013年6月至2014年6月于中国人民解放军总医院心内科诊断为急性心肌梗死患者52例(AMI组),其中入院时或住院期间合并急性心力衰竭患者21例(AMHF组),心功能正常患者31例(AMNHF组);陈旧性心肌梗死后心力衰竭患者18例(OMHF组);冠状动脉造影正常患者15例(NCHD组)。AMI诊断标准参照急性心肌梗死临床诊断与治疗指南[15],急性心力衰竭诊断标准参照2012年欧洲心脏学会《急性和慢性心力衰竭诊断和处理指南》相关诊断标准[16],排除合并其他脏器疾病者。4组年龄、性别比、糖尿病、高血压、吸烟史等方面比较差异无统计学意义(P>0.05)。见表1。

表1 4组一般资料比较 例
1.2 观察指标及方法 所有患者于入院后次日清晨空腹时抽取肘静脉血5 ml,将采集的血液标本置于试管中,4℃ 3 000 r/min离心15 min,搜集血清,-80℃冷藏。待标本集齐后,于检验科检查心肌肌钙蛋白I (cTnI)、心肌酶(CK-MBm)、N末端B型利钠肽原(NT-proBNP)、C反应蛋白(C-reactive protein,CRP)、低密度脂蛋白-C(LDL-C);采用酶联免疫吸附法检测白细胞介素-6(Interleukin-6,IL-6)、HMGB1及内脂素,试剂盒均购于IBL公司。
1.3 统计学分析 应用SPSS 18.0统计软件,计数资料采用χ2检验,计量资料以±s表示,根据实验设计的类型分别采用重复测量数据的方差分析或者独立样本比较t检验,相关性采用 Pearson积矩相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 4组患者生化指标比较 4组cTnI、CK-MBm、NT-proBNP、CRP及IL-6比较差异有统计学意义(P<0.05)。4组间LDL-C比较差异无统计学意义(P>0.05)。见表2。
表2 4组患者生化指标比较±s
指标 AMHF组(n=21) AMNHF组(n=31) OMHF组(n=18) NCHD组(n=15) cTnI(ng/ml) 36.24±24.99 28.89±22.66 0.06±0.11*# 0.07±0.05*# CK-MBm(U/L) 88.51±62.21 81.26±66.49 0.88±0.66*# 0.74±0.59*# NT-proBNP(ng/L) 958.20±501.10 579.30±532.20* 894.60±528.60# 69.20±47.30*#△LDL-C(mmol/L) 3.65±2.24 3.36±2.01 3.52±2.58 2.95±1.05 CRP(mg/L) 11.08±2.58 11.12±3.08 2.72±0.45*# 1.88±0.68*# IL-6(ng/ml) 5.55±1.25 5.24±1.59 3.24±1.11*# 3.05±0.96*#
注:与AMHF组比较,*P<0.05;与AMNHF组比较,#P<0.05;与OMHF组比较,△P<0.05
2.2 4组血清HMGB1及内脂素水平比较 4组血清HMGB1及内脂素浓度比较,差异均有统计学意义(P<0.05)。见表3。
表3 4组血清HMGB1及内脂素水平比较 ±s

表3 4组血清HMGB1及内脂素水平比较 ±s
注:与AMHF组比较,*P<0.05;与AMNHF组比较,#P<0.05;与OMHF组比较,△P<0.05
指标 AMHF组(n=21) AMNHF组(n=31) OMHF组(n=18) NCHD组(n=15) HMGB1(μg/ml) 24.25±21.59 18.71±17.92* 22.36±18.57# 5.61±3.12*#△内脂素(ng/ml) 6.61±0.74 4.58±0.81* 5.94±0.72# 2.44±0.91*#△
2.3 AMHF组与OMHF组血清指标与HMGB1及内脂素水平相关性分析
2.3.1 AMHF组血清检测指标与血清HMGB1及内脂素水平相关性分析:AMHF组血清HMGB1水平与NT-proBNP及IL-6正相关(P<0.05),与cTnI、CKMBm及CRP无明显相关性(P>0.05);内脂素水平与cTnI及CRP正相关(P<0.05),与CK-MBm、NT-proBNP及IL-6无明显相关性(P>0.05)。见表4。

表4 AMHF组血清检测指标与血清HMGB1及内脂素水平相关性分析
2.3.2 OMHF组血清检测指标与血清HMGB1及内脂素水平相关性分析:OMHF组血清HMGB1水平与NT-proBNP正相关(P<0.05),与 cTnI、CK-MBm、CRP及IL-6无明显相关性(P>0.05);内脂素水平与NT-proBNP及CRP正相关(P<0.05),与cTnI、CKMBm及IL-6无明显相关性(P>0.05)。见表5。
2.4 AMHF组、OMHF组血清HMGB1与内脂素水平相关性分析 AMHF组及OMHF组血清HMGB1与内脂素水平均呈正相关(P<0.05)。见表6、7。

表5 OMHF组血清检测指标与血清HMGB1及内脂素水平相关性分析
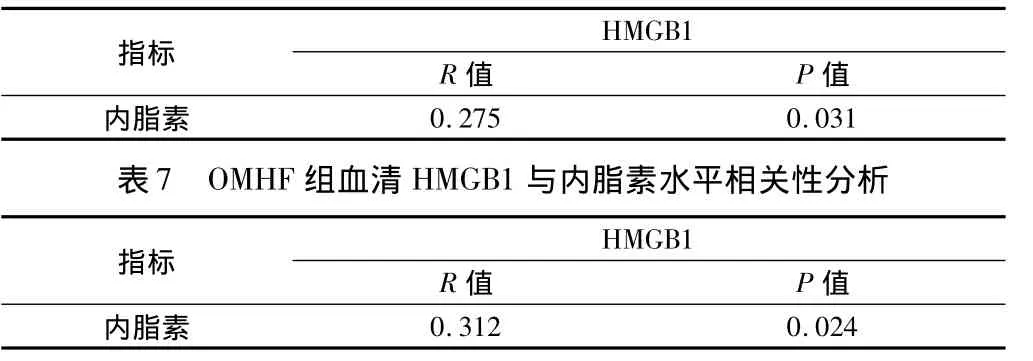
表6 AMHF组血清HMGB1与内脂素水平相关性分析
3 讨论
心力衰竭是AMI的严重并发症之一,严重影响AMI的预后。有文献报道,高达27%~50%的急性心力衰竭患者于3~6个月内再次住院治疗,1年内病死率高达30%[17]。心肌梗死是个复杂的病理过程,不仅涉及到心肌细胞缺血、坏死,还包括间质、血管床和心肌细胞外胶原纤维的损伤,引起心室重构,心力衰竭是其终末阶段。此外,心肌缺血再灌注损伤(ischemiareperfusion injury,IRI)产生的大量氧自由基引起细胞损伤、凋亡也是引起心功能不足的重要原因[18]。虽然AMI、IRI或心室重构的具体机制并未完全阐明,但炎性反应在其中起到关键作用是目前的共识,本结果也证实,AMI组患者的血清IL-6水平高于非AMI组。类似研究也发现,大鼠AMI后24 h内,梗死区域的IL-1β、IL-6及INF-α引起炎症的级联放大反应,增大坏死区域[19]。
HMGB1是一种炎性因子,高度保守的单链多肽,由215个氨基酸残基组成[20],正常生理情况下其血清浓度保持在基础水平[21]。HMGB1是炎症晚期调节因子,参与了 AMI后一系列病理生理过程[22]。Kohno等[23]发现,AMI发生后12 h,HMGB1表达达到高峰,并持续7 d。另有研究表明,离体的心肌细胞暴露在外源重组HMGB1,5 min能导致肌原细胞收缩力下降70%[22]。本研究结果示,在AMI组 cTnI、CK-MBm、NT-proBNP、CRP及IL-6升高的同时,HMGB1明显增高。AMHF组及OMHF组HMGB1高于AMNHF组及NCHD组。相关性分析显示HMGB1与AMHF组NT-proBNP及IL-6正相关,与OMHF组NT-proBNP正相关,提示HMGB1的增高是心力衰竭发生的危险因子。HMGB1通过损伤或坏死的细胞被动释放、炎性细胞的主动分泌至胞外发挥致炎作用[24,25]。致炎作用主要由晚期糖基化终产物受体介导,激活MAPK、ERK1/2、JNK及p38等多个信号转导途径,引起激酶磷酸化,产生cAMP反应元件结合蛋白的核内局限化及NK-kB和Spl的核内转位等效应[26-28]。
内脂素是一种脂肪细胞因子,存在于含有大量脂质的巨噬细胞中,调节糖脂代谢,参与冠心病、急性冠脉综合症等疾病的演变[29]。内脂素可降低caspase 23和caspase 28的活性,抑制中性粒细胞凋亡,使IL-1β、IL-6及TNF-α等炎性因子表达增加,炎性因子亦能刺激内脂素的表达,形成级联放大反应[30]。本研究发现,AMI组及OMHF组的内脂素水平高于NCHD组,而AMHF组及OMHF组高于AMNHF组。相关性分析结果表明,AMHF组中内脂素与cTnI及CRP正相关(P<0.05),与NT-proBNP及IL-6无明显相关性(P>0.05);OMHF组中内脂素与NT-proBNP及CRP正相关(P<0.05)。有研究发现,粥样硬化斑块中的泡沫细胞及巨噬细胞均表达大量的内脂素[31]。因此,我们推测AMI后居高不下的内脂素水平使受损区的心肌产生持久的慢性炎性反应,最终造成心室重构、心功能不全。
此外,AMHF组及OMHF组血清HMGB1与内脂素水平均呈正相关(P<0.05)。因此,HMGB1与内脂素之间也存在某种联系,联合二者结果在预测心力衰竭的发生中有一定的意义。
单纯拮抗一种炎性因子不能有效缓解AMI及IRI时强大的炎性反应,但广泛抑制炎性反应又抵消了其有利的一面。另有研究发现HMGB1的作用呈剂量-效应依赖性,中等浓度及以下可促进修复及再生,而高浓度使炎性恶化,甚至出现器官功能障碍[32],因此如何有效控制HMGB1的浓度可作为今后的研究方向。
综上所述,HMGB1及内脂素在预测AMI后心力衰竭中有一定意义,值得临床工作中作为AMI的联合预测指标。
1 Weir RA,McMurray JJ,Velazquez EJ,et al.Epidemiology of heart failure and left ventricular systolic dysfunction after acute myocardial infarction: prevalence,clinical characteristics,and prognostic importance.Am J Cardiol,2006;97:13F-25F.
2 Lopez AD,Murray CC.The global burden of disease,1990-2020.Nat Med,1998,4:1241-1243.
3 顾小龙.急性心肌梗死合并心力衰竭再灌注后早期应用洋地黄的近期疗效和安全性研究.南方医科大学,2011.
4 Indications for ACE inhibitors in the early treatment of acute myocardial infarction:systematic overview of individual data from 100 000 patients in randomized trials.ACE Inhibitor Myocardial Infarction Collaborative Group.Circulation,1998,97:2202-2212.
5 Spencer FA,Meyer TE,Gore JM,et al.Heterogeneity in the management and outcomes of patients with acute myocardial infarction complicated by heart failure:the national registry of myocardial infarction.Circulation,2002,105:2605-2610.
6 Steg PG,Dabbous OH,Feldman LJ,et al.Determinants and prognostic impact of heart failure complicating acute coronary syndromes;observations from the Global Registry of Acute Coronary Events(GRACE).Circulation,2004,109:494-499.
7 Hasdai D,Topol EJ,Kilaru R,et al.Frequency,patient characteristics,and outcomes of mild-to-moderate heart failure complicating ST-segment elevation acute myocardial infarction:lessons from 4 international fibrinolytic therapy trials.Am Heart J,2003,145:73-79.
8 Vaur L,Danchin N,Genes N,et al.Epidemiology of myocardial infarction in France:therapeutic and prognostic implications of heart failure during the acute phase.Am Heart J,1999,137:49-58.
9 Spencer FA,Meyer TE,Goldberg RJ,et al.Twenty year trends(1975-1995)in the incidence,in-hospital and long-term death rates associated with heart failure complicating acute myocardial infarction:a communitywide perspective.J Am Coll Cardiol,1999,34:1378-1387.
10 Spencer FA,Meyer TE,Gore JM,et al.Heterogeneity in the management and outcomes of patients with acute myocardial infarction complicated by heart failure:the National Registry of Myocardial Infarction.Circulation,2002,105:2605-2610.
11 Steg PG,Dabbous OH,Feldman LJ,et al.Determinants and prognostic impact of heart failure complicating acute coronary syndromes:observations from the Global Registry of Acute Coronary Events(GRACE). Circulation,2004,109:494-499.
12 Yin X,Zheng Y,Zhai XJ,et al.Diabetic inhibition of preconditioning and postconditioning-mediated myocardial protection against ischemia/ reperfusion injury.Exp Diabetes Res,2012,78:1-9.
13 Degryse B,Bonaldi T,Scaffidi P,et al.The high mobility(HMG)boxes of nuclear protein HMG1 induce chemotaxis and cytoskeleton reorganization in rat smooth muscle cells.J Cell Biol,2001,6:1197-1206.
14 De Luis DA,Gonzalez S M,Conde R,et al.Effect of a hypocaloric diet on serum visfatin in obese non-diabetic patients.Nutrition,2008,24: 517-521.
15 中华医学会心血管病学分会,中华心血管病杂志编辑委员会,中国循环杂志编辑委员会.急性心肌梗死诊断和治疗指南.中国循环杂志,2001,16:407-430.
16 胡申江.2012年欧洲心脏学会《急性和慢性心力衰竭诊断和处理指南》相关诊断标准.心脑血管病防治,2012,12:435-437.
17 Gheorghiade M,Braunwald E.Hospitalizations for heart failure in the U-nited States-a sign of hope.JAMA,2011,306:1705-1706.
18 Ruiz-Gines JA,Lopez-Ongil S,Gonzalez-Ruhio M,et al.Reactive oxygen species induce proliferation of bovinea orticen doth elialcells.J Cardiovasc Pharmacol,2000,35:109-113.
19 Deten A,Volz HC,Briest W,et al.Cardiac cytokine expression is upregulated in the acute phase after myocardial infarction.Experimental studies in rats.Cardiovascular Research,2002,55:329-340.
20 张蕊,鲍红光.高迁移率族蛋白B1在炎症性疾病中的研究进展.现代生物医学进展,2012,12:5988-5990.
21 Lum HK,Lee KL.The human HMGB1 promoter is modulated by a silencer and an enhancer-containing intron.Biochim Biophys Acts,2001,1520:79-84.
22 宫玉玲,邢启崇.高迁移率族蛋白B1与动脉粥样硬化.中国动脉硬化杂志,2008,16:742-744.
23 Kohno T,Anzai T,Naito K,et al.Role of high mobility group box 1 protein in post infarction healing process and left ventricular remodeling. Cardiovasc Res,2009,3:565-573.
24 姚咏明,徐珊,盛志勇.高迁移率族蛋白B1的组织损伤效应及干预途径.中国医学科学院学报,2007,29:459-465.
25 Rouhiainen A,Tumova S,Valmu L,et al.Pivotal advance:analysis of proinflammatory activity of highly purified eukaryotic recombinant HMGB1(amphoterin).J Leukoc Biol,2007,81:49-58.
26 Kokkola R,Andersson,Mullins G,et al.RAGE is the Major Receptor for the Proinflammatory Activity of HMGB1 in Rodent Macrophages.Scandinavian Journal of Immunology,2005,61:1-9.
27 Orlova AA,Choi EY,Xie C,et al.A novel pathway of HMGB1-mediated inflammatory cell recruitment that requires Mac-1-integrin.EMBO J,2007,26:1129-1139.
28 Fan J,Li Y,Levy RM,et al.Hemorrhagic shock induces NAD(P)H oxidase activation in neutrophils:role of HMGB1-TLR4 signaling.J Immunol,2007,178:6573-6580.
29 Fukuhara A,Matsuda M,Nishizawa M,et al.Visfatin:a protein secrected by visceral fat that mimics the effects of insulin.Science,2005,307: 426-430.
30 De Luis DA,Gonzalez SM,Conde R,et al.Effect of a hypocaloric diet on serum visfatin in obese non-diabetic patients.Nutrition,2008,24: 517-521.
31 Dahl TB,Yndestad A,Skjelland M,et al.Increased expression of visfatin in macrophages of human unstable carotid and coronary atherosclerosis possible role in inflammation and plaque destabilization.Circulation,2007,115:972-980.
32 Yang H,Ochani M,Li J,et al.Reversing established sepsis with antagonists of endogenous high mobility group box 1.Proc Natl Acad Sci USA,2004,101:296-301.

