伊马替尼在慢性粒细胞性白血病慢性期治疗中的应用效果
程雅馨,朱薇波,刘欣,蔡晓燕,童娟,姚雯,张旭晗,伍权
(安徽医科大学附属省立医院、安徽省立医院,a 血液科,b中心实验室,合肥 230001)
·论著·
伊马替尼在慢性粒细胞性白血病慢性期治疗中的应用效果
程雅馨a,朱薇波a,刘欣a,蔡晓燕a,童娟a,姚雯a,张旭晗a,伍权b
(安徽医科大学附属省立医院、安徽省立医院,a 血液科,b中心实验室,合肥 230001)
[摘要]目的探讨伊马替尼治疗慢性粒细胞性白血病(CML)临床效果及生存情况,比较相关影响因素,为CML临床治疗提供依据。 方法选取明确诊断为CML慢性期患者120名,监测各组行伊马替尼治疗后,获得完全血液学缓解(CHR)、完全细胞遗传学缓解(CCyR)、主要细胞遗传学缓解(MCyR)、完全分子学缓解(CMR)情况及不良反应。结果3个月CHR为81%、6个月CCyR为57%、12个月主要分子学缓解(MMR)为33%,累积获得的CHR为97%,完全遗传学缓解为78%,CMR为40%,5年总生存期(OS)、5年无进展生存期(PFS)分别为89%和79%;Sokal评分系统5年PFS分别为96%、80%、69%(P=0.035,P=0.008),5年OS分别为100%、89%、71%(P=0.035,P=0.022)。 EUTOS评分系统5年PFS分别为92%、71%(P=0.036,P=0.001),5年OS分别为94%、77%(P=0.026,P=0.005)低危组疗效均明显优于高危组,但Sokal评分低危组和中危组、中危组和高危组之间OS和PFS差异无统计学意义。对于患者在服用伊马替尼过程中,6个月细胞遗传学缓解率、12个月分子学缓解率与远期疾病进展密切相关(P<0.05)。根据单因素分析、COX回归分析,严重血细胞减少、停药>4周均为影响慢性期OS和PFS的不良因素,多因素分析中仅停药>4周为不良因素。非血液学不良反应未出现Ⅲ级以上不良反应,Ⅲ级以上血液学不良反应为粒细胞缺乏12%(16/120)、血小板减少7.5%(9/120),仅3例在治疗期间,反复出现Ⅲ级以上血细胞减少,改为尼洛替尼治疗。结论(1)伊马替尼其良好的疗效及安全性适合多数新确诊的慢性粒细胞白血病慢性期患者,为慢性粒细胞白血病慢性期一线治疗药物;(2)对于伊马替尼治疗的疗效评价,EUTOS评分系统可能较Sokal评分系统更为有效;(3)对于处于Sokal高危组或EUTOS高危组的患者,应尽早使用二代酪氨酸激酶抑制剂提高临床缓解率。
[关键词]白血病,髓样,慢性期;甲磺酸盐类;缓解诱导
慢性粒细胞性白血病作为一种骨髓造血干细胞异常增生性疾病,发病率为0.001%~0.002%,占成人白血病15%左右[1]。疾病特点为形成Ph染色体,由9号染色体q34的abl易位至22号染色体q11上的断裂丛集区,形成BCR-ABL融合基因。此基因普遍存在于95%慢性粒细胞白血病(CML)患者细胞中,通过编码酪氨酸激酶改变下游多种蛋白磷酸化作用,从而影响细胞分化。伊马替尼作为第一代小分子酪氨酸激酶抑制剂(TKIs),因其明确疗效及良好耐受性,迅速取代干扰素(IFN)与阿糖胞苷(Ara-C),成为CML治疗的首选治疗方案[2]。本文将对我院确诊的CML P210阳性120位患者进行分析,其在伊马替尼治疗中临床表现、血液学、骨髓细胞学、细胞遗传学等特征变化,比较伊马替尼治疗处于不同疾病分期、不同危险组的患者临床疗效、生存期,及早期细胞遗传学、分子生物学缓解率、各临床因素对远期预后影响。
1对象与方法
1.1研究对象选取2010年1月至2015年1月在我院明确诊断为慢性粒细胞性白血病患者慢性期(CP)120例,男性86例,女性34例;年龄21~70岁,中位年龄为47岁;服药时间6~60个月,中位服药时间24个月。
所有患者均行血液学、骨髓细胞学、染色体和基因检查,慢粒诊断及疗效标准均符合张之南主编的《白血病诊断及疗效标准》。所有患者依据Sokal评分、EUTOS评分进行分组。Sokal评分:低危组60例,中危组38例,高危组22例;EUTOS评分:低危组90例,高危组30例。
1.2治疗方法所有初发患者均先用羟基脲降白细胞至白细胞达20×109/L万时服用伊马替尼治疗,伊马替尼应在进餐时服用,慢性期患者每次400 mg,每星期检查1次血常规,达到血液学缓解(CHR)后,则每2周检查1次。每6个月检测染色体、骨髓细胞学、RT-PCR检测bcr-ablP210拷贝数。治疗过程中出现严重血液学不良反应,根据NCCN2014年指南减量或暂停用药。
1.3观察指标与疗效评价标准根据2014年版美国国立综合癌症网络(NCCN)指南中CML疗效评价标准,观察患者服药期间临床表现、血常规、生化、骨髓细胞学、染色体及BCR/ABL计数,及3个月完全血液学缓解(CHR)、6个月完全遗传学缓解(CcyR)、12个月主要分子学缓解(MMR)、以及累积获得的CHR、CCyR、CMR。同时注意患者服药期间药物不良反应:血液学反应(白细胞下降、血小板减少、贫血等)和非血液学反应(包括水肿、皮疹、肝损害、心脏毒性等)。
1.4总生存率(OS)及无进展生存率(PFS)OS:患者从开始服用伊马替尼至死亡或随访截止。PFS:开始伊马替尼治疗至疾病进展(失去已获得血液学缓解、细胞遗传学缓解、及进展为急变期或加速期)。
1.5安全性估计 根据美国国立癌症研究所(NCI)/美国国立卫生研究院(NIH)毒性标准分析。
1.6统计学处理采用SPSS13.0统计软件,使用Kaplan-Meier法行生存期分析,组间率的比较应用χ2检验,采用双侧检验;影响PFS及OS的单因素分析采用Log-rank检验,多因素分析采用COX回归分析。P<0.05差异有统计学意义。
2结果
2.1慢性期总体疗效分析本组120名慢性期患者,3个月完全CHR为81%、6个月完全CCyR为57%、12个月主要MMR为33%。累积获得的CHR为97%,完全CcyR为78%,完全CMR为40%。5年总生存期(OS)、5年无进展生存期(PFS)分别为89%和79%;
2.2慢性期Sokal评分不同危险组疗效比较根据Sokal评分,慢性期120名患者,可分为低危组占50%(60/120)、中危组占 32%(38/120)、高危组18% (22/120),各组疗效比较见表1。
三组患者5年PFS分别为96%、80%、69%(P=0.035,P=0.008)(图1),5年OS分别为100%、89%、71%(P=0.035,P=0.022)(图2)均差异有统计学意义。低危组疗效明显优于中危组和高危组。
2.3慢性期EUTOS评分不同危险组疗效比较根据EUTOS评分,慢性期120名患者,分为低危组占75%(90/120)、高危组占25%(30/120)。各组疗效见表2。
二组患者,5年PFS分别为92%、71%(P=0.036,P=0.001)(图3),5年OS分别为95%、74%(P=0.04,P=0.005)(图4)差异均有统计学意义,低危组疗效明显优于高危组。
2.46个月获得CCyR对PFS的影响根据慢性期120名患者服用伊马替尼6个月获得的细胞遗传学缓解率,患者分为3组,CCyR为57%(68/120)、PCyR为18%(22/120)、未达到MCyR为25%(30/120),3组5年PFS分别为97%、85%、63%(χ2=7.531,P=0,023)(图5)。
2.512个月获得MMR对PFS影响根据慢性期120名患者服用伊马替尼12个月获得的主要分子遗传学缓解率,患者分为2组,MMR为33%(39/120)、未获得MMR为67%(81/120),2组5年PFS分别为100%、73%(χ2=6.075,P=0.01)(图6)。
2.6安全性评估非血液学主要包括:水肿(包括四肢和眶周)73%(88/120)、肌肉疼痛49%(59/120)、消化道反应(包括呕吐、腹泻)38%(46/120)、疲乏60%(72/120)、皮疹20%(24/120),肝功能损害5%(6/120)。无Ⅲ级以上的非血液学不良反应发生,无药物减量和更换其他药物发生。血液学不良反应:包括粒细胞减少、血小板减少、贫血,其中以粒细胞减少50.7%(61/120)和血小板减少22.4%(27/120)最为常见。其中Ⅲ级以上血液学不良反应粒细胞缺乏12%(16/120)、血小板减少7.5%(9/120)。仅3例在治疗期间,因反复出现Ⅲ级以上血细胞减少,行药物减量、终止用药和加用细胞刺激因子处理后效果不佳,改为尼洛替尼治疗。
2.7OS和PFS影响因素分析对于可能影响OS和PFS的因素,包括脾脏大小、确诊时白细胞计数、血小板计数、骨髓中原始细胞数、Ⅲ级以上白细胞减少、Ⅲ级以上血小板减少、EUTOS评分、Sokal评分、停药时间>4周进行单因素分析和COX回归分析,单因素分析中,Ⅲ级以上白细胞减少、Ⅲ级以上血小板减少、停药时间>4周、均为OS和PFS影响因素。COX回归分析显示,停药时间>4周为PFS(P=0.015)和OS(P=0.012)共同影响因素。
3讨论
慢性粒细胞白血病绝大部分多在慢性期被确诊,若无有效治疗,则迅速进展为加速期或急变期。既往无TKIs治疗前,急变期患者中位生存期仅有4~5个月[3]。伊马替尼,通过2-苯胺嘧啶键连接于BCR-ABL的ATP基团上,抑制基团自身磷酸化和磷酸化水平,减少基因复制从而促进凋亡。在I期试验中,300 mg伊马替尼,98%对于IFN-α耐药的慢性期患者获得血液学缓解,其中31%获得完全遗传学缓解[4]。
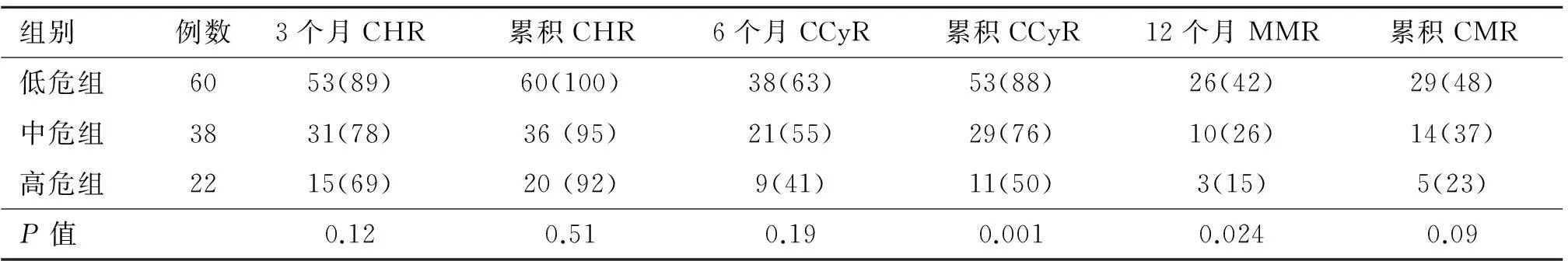
表1 Sokal评分系统各组疗效对比[例(%)]
注:P值为低危组、中危组、高危组组间比较χ2检验结果
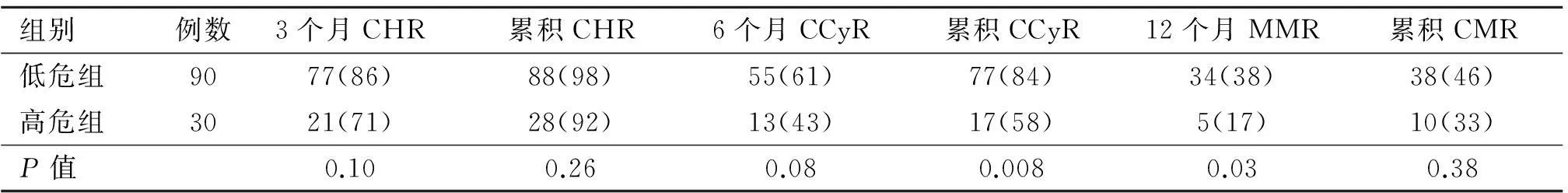
表2 EUTOS评分系统各组疗效对比[例(%)]
注:P值为低危组、高危组组间比较χ2检验结果
IRIS明确提出伊马替尼治疗过程中早期细胞遗传学、分子遗传学反应与慢性期患者远期疾病进展有关。本组实验通过比较120名慢性期患者患者在6个月、12个月所获得临床缓解与远期预后之间的关系,不难发现,6个月获得CCyR患者、12个月获得MMR患者5年PFS明显高于同一时期其他患者(P<0.05)。故在临床治疗中,适时监测患者染色体、BCR-ABL计数至关重要,对于早期治疗效果不佳的患者,及时药物加量或更换其他酪氨酸激酶抑制剂,可明显改善患者预后。
IRIS试验中[5],根据Sokal评分对慢性期患者60个月随访统计,完全遗传学缓解(CCyR)低危组∶中危组∶高危组分别为89%∶82%∶69%,12个月MMR为50%∶30%∶19%。我们将120例患者按照Sokal评分分为低危组、中危组和高危组。研究显示低危组12个月MMR、累积获得CCyR、CMR、PFS、OS明显高于高危组(P<0.05)。但低危组和中危组5年PFS(P=0.052)、5年OS(P=0.073),中危组和高危组5年PFS(P=0.202)、5年OS(P=0.258)差异均无统计学意义。本研究中Sokal评分系统对于中危组的疗效评价并无明确意义,还需要更多的临床病例资料统计分析。
2011年,欧洲白血病组织首次提出EUTOS评分,与既往使用的Sokal评分、HasFord评分不同,该评分仅与嗜碱性粒细胞百分比、脾脏大小有关,将患者分为低危和高危两组[6]。ELN通过统计2060位服用伊马替尼慢性期患者,两组18个月CCyR、5年PFS有统计学意义。另一组ELN试验中[7],208名慢性期患者,EUTOS评分系统5年OS(97%比80%,P=0.03)、5年PFS(95%比80%,P=0.02)均差异有统计学意义。Breccia等[5]认为,该评分系统明显优于Sokal评分和HadFord评分。但Hoffmann[8]在随访中发现,两组无论CCyR、MMR或PFS、OS均差异无统计学意义。Jabbour[9]同样得出两组之间PFS及OS无明显差异的结论。本次数据EUTOS评分,5年PFS分别为92%、71%(P=0.036,P=0.001),5年OS分别为95%、74%(P=0.04,P=0.005)均有统计学意义。但在单因素分析和多因素分析中,EUTOS评分并不是作为慢性粒细胞白血病慢性期患者OS(P=0.164,P=0.109)和PFS(P=0.089,P=0.051)的影响因素。国内目前鲜有对于EUTOS评分与慢性期患者OS、PFS关系的大样本回顾性研究,EUTOS评分是否可以成为更有效的评价伊马替尼疗效的方法,还需要进一步验证。
国外随机三期试验[10],慢性期患者粒细胞减少Ⅲ级和Ⅳ级分别为11%和2%,血小板减少Ⅲ级和Ⅳ级分别为7%和1%,加速期和急变期服用400 mg伊马替尼2~4周即可出现明显骨髓抑制,较8周的慢性期患者早,考虑可能与骨髓中正常造血组织含量和造血功能有关。Marin等[11]在早期报道中提出药物使用时间是影响CMR唯一独立因素的论点。本组中,Ⅲ级以上的粒细胞减少和血小板减少分别为12%(14/120)和7.5%(9/120),这些患者药物依从性下降,至随访结束,仅1例达到CMR。同时单因素分析及COX分析中,均提示停药时间>4周为影响OS及PFS不良因素。因此在治疗期间密切监测患者血象,加强支持治疗,必要时可更换TKIS以求获得良好预后。
作为慢性粒细胞白血病慢性期治疗的一线药物,伊马替尼治疗过程中其高疗效及安全性有目共睹,在本研究中同样予以证实。慢性粒细胞白血病早期临床缓解率与远期预后密切相关。对于早期疗效不佳,或处于Sokal高危组、EUTOS高危组的患者,尽早更换二代TKI药物,或联合其他治疗改善预后。
(本文插图1~6见封三)
参考文献
[1]Juan AAS.Structural investigation of PAP derivatives by CoMFA and CoMSIA reveals novel insight towards inhibition of Bcr-Abl oncoprotein[J].J Mol Graph Modell,2007,26(2): 482-493.
[2]James Signorovitch,Rajeev Ayyagari,William M.Reichmann,et al.Major molecular.Response during the first year of dasatinib,imatinib or nilotinib treatment fo-r newly diagnosed chronic myeloid leukemia[J].Cancer Treat Rev,2014,40(2):285-292.
[3]Sacha T,Hochhaus A.ABL-kinase domain point mutations as a cause of imatinib resistance in CML patients who progress to myeloid blast crisis[J].Leuk Res,2003,27(12):1163-1166.
[4]Hauoala A,Zanolari B,Rochat B,et al.Therapeutic drug monitoring of the new targeted anticancer agents imatinib,nilotinib,dasatinib,sunitini-b,sorafenib and lapatinib by LC tandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2009,877(22):1982-1996.
[5]Breccia M,Finsinger P,Loglisci G,et al.The EUTOS score identifies chronic myeloid leukeamia patients with poor prognosis treated with imatinib first or second line[J].Leuk Res,2012,36(9):e209-e210.
[6]Breccia M,Alimena G.The pros and cons of new prognostic eutos s-core for chronic myeloid leukemia patients.Leukemia Research[J].Leuk Res,2013,37(11):1436-1437.
[7]Hasford J,Baccarani M,Hoffmann V,et al.Predicting complete cytogenetic res-ponse and subsequent progression-free survival in 2060 patients with CML on imatinib treatment:the EUTOS score[J].Blood,2011,118(3):686-692.
[8]Hoffmann VS,Baccarani M,Lindocrfer D,et al.The EUTOS prognostic score:re-view and validation in 1288 patients with CML treated frontline with imatinib[J].Leukemia,2013,27(10):2016-2022.
[9]Jabbour E,Cortes J,Nazha A,et al.EUTOS score is not predictive for surviva-l and outcome in patients with early chronic phase chronic myeloid leukemia patients with poor prognosis treated with imatinib first or second line[J].Blood,2012,119 (19): 4524.
[10] Quintás-cardama A,Cortés JE,Kantarjian H..Practical Managemen-t of Toxicities Associated with Tyrosine Kinase Inhibitors in Chronic Myeloid Leukemia[J].Clin Lymphoma Myeloma,2008,8 Suppl 3: 82-88.
[11] Marin D,Bazeos A,Mahon FX,et al.Adherence is the critical factor for achieveing molecular responses in patients with chronic myeloid leukemia who achieve complete cytogenetic responses on imatinib[J].J Clin Oncol,2010,28(14):2381-2388.
Clinical effect of imatinib on chronic myelogenous leukemia during chronic phaseChengYaxin*,ZhuWeibo,LiuXin,CaiXiaoyan,TongJuan,YaoWen,ZhangXuhan,WuQuan(*DepartmentofHematology,ProvincialHospitalAffiliatedtoAnhuiMedicalUniversity,Hefei230001,China)
[Abstract]ObjectiveTo explore the clinical effect of imatinib on the chronic myeloid leukemia (CML) and compare the related factors,and provide the basis for clinical therapy of CML.MethodsOne hundred and twenty patients with chronic phase CML were selected,and were treated with imatinib,all data of complete hematological remission(CHR),complete cytogenetic remission(CCyR),major cytogenetic response (MCyR) and complete molecular response (CMR) and adverse reactions were collected.ResultsThe CHR of 3 months was 81%,the complete cytogenetic response (CCyR) of 6 months was 57%,the major molecular remission (MMR) of 12 months was 33%;the cumulative gain CHR was 97%,the complete cytogenetic remission was 78%,the complete molecular remission (CMR) was 40% and 5-year overall survival (OS),5,progression free survival (PFS) were 89% and 79% respectively; the Sokal scoring system of 5-year PFS were 96%,80% and 69% (P=0.035,P=0.008),the 5-year OS respectively were 100%,89%,71% (P=0.035,P=0.022).EUTOS scoring system for 5 years respectively were 92%,71% (P=0.036,P=0.001),5 years OS were 94%,77% (P=0.026,P=0.005) ; Sokal score system,5 years PFS respectively were 96%,80%,69% (P=0.035,P=0.008),5 years OS were 100%,89%,71% (P=0.035,P=0.022).Eutos prognostic scoring system of 5-year PFS were 92%,71% (P=0.036,P=0.001) and 5-year OS were 94%,77% (P=0.026,P=0.005).The effect of low risk group were significantly better than those in the high risk group,but there were no statistical significance by Sokal score.In the process of take imatinib,the cytogenetic remission rate of 6 months、the molecular remission rate of 12 months were closely related with the long-term disease progression (P<0.05).According to single factor analysis and COX regression analysis,severe blood cell reduction,stop drug>4 weeks were the adverse factors of chronic phase OS and PFS,multiple factors analysis showed only stop drug >4 weeks was the adverse factors.Non-hematologic adverse reactions did not appear above 3 grade adverse reaction,grade III /Ⅳ blood adverse reactions was neutropenia 12% (16/120) and thrombocytopenia 7.5% (9/120),Only 3 cases during treatment,repeated grade III /Ⅳhematocytopenia,changed to nilotinib.Conclusions(1)The good efficacy and safety of imatinib is suitable for the majority of patients with chronic myeloid leukemia,which is a first-line treatment for chronic myeloid leukemia;(2)For the efficacy evaluation of imatinib,the EUTOS score system may be better than the Sokal scoring system;(3)For patients in the high-risk group of Sokal or EUTOS high risk group,the second generation drugs should be used to improve the clinical remission rate as soon as possible.
[Key words]Leukemia,myeloid,chronic-phase;Mesylates;Remission Induction
(收稿日期:2015-09-05)
Corresponding author:Zhu Weibo,Email:Zhuwb2009@163.com
通信作者:朱薇波,主任医师,硕士生导师,Email:Zhuwb2009@163.com
作者简介:程雅馨,在读硕士,Email:cyxcyx11@qq.com
中图分类号:R733.72
文献标识码:A
DOI:10.3969/J.issn.1672-6790.2015.06.015

