小鼠14-3-3ε蛋白基因的克隆及其真核表达载体的构建*
孟 峻,侯艳军,唐 韬,张永梅,刘 珊,刘 洋,呼格吉乐
(内蒙古医科大学附属医院检验科,呼和浩特 010050)
·论 著·
小鼠14-3-3ε蛋白基因的克隆及其真核表达载体的构建*
孟 峻,侯艳军,唐 韬,张永梅,刘 珊,刘 洋,呼格吉乐
(内蒙古医科大学附属医院检验科,呼和浩特 010050)
目的 构建小鼠14-3-3ε真核表达载体pcDNA3.1-ZEO-HA-14-3-3ε,并观察其在真核细胞中的表达。方法 通过反转录-聚合酶链反应从小鼠肝组织中获得编码14-3-3ε的cDNA,定向克隆至真核表达载体pcDNA3.1-ZEO(+)中,经酶切和测序鉴定正确后,应用脂质体转染HEK293细胞,并通过蛋白免疫印迹检测细胞内14-3-3ε的表达。结果 构建了真核表达载体pcDNA3.1-ZEO-HA-14-3-3ε,将其转染HEK293细胞48 h后,蛋白免疫印迹检测到细胞内14-3-3ε的表达。结论 成功构建了真核表达载体pcDNA3.1-ZEO-HA-14-3-3ε,为研究14-3-3ε在小鼠卵母细胞和小鼠-细胞受精卵G2/M转换中作用的研究奠定了基础。
14-3-3ε蛋白; HEK293细胞; 真核表达载体
14-3-3蛋白家族是一组高度保守的可溶性酸性蛋白质,相对分子质量为(28~33)×103,广泛分布于各种真核细胞中[1]。14-3-3蛋白不仅是一种存在于脑组织中的蛋白,而且也广泛存在于其他各种组织中。14-3-3蛋白高度保守,在哺乳动物发现7个家族成员,分别为β、γ、ε、σ、ζ、τ和η,并且有7个不同的基因编码,果蝇、酵母只有两种基因编码,植物有13种基因编码14-3-3蛋白[2]。14-3-3作为一个二聚体蛋白家族,调控蛋白质之间的相互作用,广泛参与细胞信号转导、周期进程、生长增殖、分化凋亡和扩展迁移。
1 材料与方法
1.1 材料 细胞株、菌种和质粒:克隆载体pGEM-T vector为Promega公司产品;真核表达载体pcDNA3.1-ZEO为Invitrogen公司产品;E.coli DH5α感受态菌株、HEK293细胞购自北京全式金生物技术有限公司。
1.2 试剂与仪器 DMEM培养基(GIBCO公司产品);TRIZOL试剂、LipofectamineTM2000为美国Invitrogen公司产品;限制性核酸内切酶(XhoI、BamHI、XbaI、EcoRI)及Pfu DNA Polymerase为MBI公司产品;质粒DNA小提取试剂盒(上海生工生物有限公司产品);DNA凝胶回收试剂盒(大连宝生物公司产品;T4 DNA连接酶为New England Biolab公司产品;鼠抗兔14-3-3ε单克隆抗体(Abcam)、β-Actin抗体(Santa Cruz)、兔来源HA标签单克隆抗体为Sigma公司产品。聚合酶链反应(PCR)扩增引物的合成由Invitrogen 公司完成,DNA测序均由上海生工公司完成。基因扩增仪(Biometra,德国);低温超速离心机(Sigma,美国);台式高速离心机(TG16-WS,上海卢湘仪离心机仪器有限公司);电泳仪、电泳槽0.75ram垂直板(美国Bio-tad公司);凝胶自动成像仪GDS8000(BIO-RAD,美国);紫外分光光度仪(PYE-UNICAM SPECTRONIC公司,美国);细菌培养箱、空气浴振荡器(上海艾测电子科技有限公司);CO2培养箱CBll5(WTB-binder,德国)。
1.3 方法
1.3.1 引物设计 为了构建HA标签的14-3-3ε表达载体,在编码14-3-3ε cDNA起始密码上游加上HA的编码序列,Forward primer:5′-ATG TAC CCA TAC GAT GTT CCA GAT TAC GCT GAT GAT CGG GAG GAT CT-3′,reverse primer:5′-GCT TTT ATT TCG TCT CAC TGA TTC TCA TCT T-3′。
1.3.2 提取总RNA 将小鼠颈椎脱位处死,剪开腹部,取其肝组织约30 mg。将30 mg肝组织移入2 mL直筒离心管中,加入Trizol 1 mL,剪碎肝组织,电动匀浆,匀浆后4 ℃ 12 000 g 离心1 min去除不溶物。取上清液,移入1.5 mL EP管中,液体量约为1 mL,加入0.2 mL氯仿,剧烈振摇15 s,室温静置2 min。4 ℃ 12 000 g离心15 min,吸取上层水相至另一新EP管中,加入异丙醇0.5 mL,室温静置10 min,4 ℃ 10 000 g离心10 min,离心后管底见明显白色胶样沉淀,弃上清液,加入75%乙醇1 mL,温和振荡离心管,悬浮沉淀。4 ℃ 7 500 g离心5 min,尽量弃上清液。室温晾干15 min(直至没有明显乙醇液体),加50 μL DEPC H2O溶解RNA样品,用吸管反复吹打溶解RNA,测A值定量RNA浓度。
1.3.3 反转录PCR(RT-PCR)合成目的cDNA片段 反应体系为50 μL:2×反应混合物25 μL、模板RNA 10 μL、正向/反向引物(10 μmol/L)各1 μL、反转录Taq Mix 1 μL、去RNA酶水12 μL。反应条件:94 ℃预变性3 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,反应35 个循环,72 ℃延伸5 min。
1.3.4 PCR产物的回收和纯化 琼脂糖电泳检测PCR产物大小,在紫外灯下切出琼脂糖胶块中的目的DNA,切碎胶块后,加入适量Binding Buffer Ⅱ,55 ℃水浴将胶块完全熔化,然后移入UNIQ10柱中,8 000 r/min离心1 min,弃滤液。加入Wash Solution,离心1 min,弃滤液,将柱子放入同一收集管中,重复此过程。12 000 r/min再次离心15 s,在UNIQ10柱子上加入适量的提前65 ℃预热的Elution Buffer,室温静置、离心,离心管中液体即为含有HA-14-3-3ε的cDNA片段。取少量样品进行琼脂糖凝胶电泳,检测回收质量,并测定A260/A280。
1.3.5 目的基因与T载体的连接及其鉴定 纯化的PCR产物与pGEM-T载体连接,反应体系为10 μL,HA-14-3-3ε的cDNA 2 μL、2×快速连接缓冲5 μL、T载体1 μL、T4 DNA连接酶1 μL、去RNA酶水1 μL。16 ℃反应过夜,将连接后的载体转化到感受态大肠杆菌中,在LB培养基中增菌,37 ℃振荡培养l h后,涂布于Amp+琼脂平板培养基中,37 ℃过夜。挑取单菌落于Amp+LB培养基中培养12~16 h,测其A值约2~3时用质粒提取试剂盒提取质粒。
1.3.6 用质粒提取试剂盒提取质粒 细菌培养液1.5~5.0 mL,12 000 r/min离心2 min,倒掉或吸干培养基,在菌体沉淀中加入250 μL SolutionⅠ,吸打或振荡至彻底悬浮菌体。加入250 μL SolutionⅡ,立即温和颠倒离心管5~10次混匀,室温静置2~4 min,加入350 μL SolutionⅢ,立即温和颠倒离心管5~10次混匀,12 000 r/min离心10 min,将上清液全部小心移入吸附柱,8 000 r/min离心30 s,倒掉收集管中的液体,在吸附柱中加入500 μL Wash Solution,10 000 r/min离心1 min,倒掉收集管中的液体,再用500 μL Wash Solution洗一次,10 000 r/min离心1 min,空吸附柱,12 000 r/min离心2 min,将吸附柱放入干净的1.5 mL离心管中,在吸附膜中央加入50~100 μL Elution buffer,室温静置2 min,10 000 r/min离心1 min,将所得质粒DNA溶液置于-20 ℃保存。
1.3.7 质粒的酶切鉴定 质粒用限制性内切酶EcoRI单酶切,酶切反应体系如下:10×缓冲液1 μL、pGEM-T/HA-14-3-3ε 1 μL、EcoRI 0.5 μL、双蒸水7.5 μL、总体积10 μL。37 ℃ 90 min,琼脂糖电泳(胶的浓度为1.5%)检测酶切条带,选择酶切条带片段大小与预期相符合的阳性克隆保存,然后进行DNA测序分析。
1.3.8 表达载体的构建及鉴定 经测序鉴定正确的阳性克隆与pcDNA3.1-ZEO(+)载体用EcoRI单酶切后进行连接反应,酶切反应体系为20 μL:pGEM-T/HA-14-3-3ε(或pcDNA3.1-ZEO(+)2 μL、10×缓冲液2 μL、EcoRI 1 L、双蒸水15 L。37 ℃过夜,消化完的pcDNA3.1-ZEO(+)加 1 μL CIP,37 ℃水浴60 min去磷酸基,然后进行琼脂糖凝胶电泳(胶的浓度为1.5%),分别从分离胶中回收HA-14-3-3ε片段、pcDNA3.1-ZEO(+)载体,分别测定回收片段相应的浓度。连接反应的反应体系为20 μL(HA-14-3-3ε cDNA 与pcDNA3.1-ZEO(+)按摩尔比3∶1混合:10×T4连接酶缓冲液2 μL、目的产物、pcDNA3.1-ZEO(+)、T4 DNA连接酶 1 μL。16 ℃反应过夜,将反应的连接产物转化到感受态大肠杆菌,挑选单菌落进行培养,用质粒提取试剂盒提取质粒。质粒用EcoRI单酶切鉴定,选择酶切条带片段大小与预期相符合的阳性克隆保存,进一步行质粒DNA序列测定分析,构建成pcDNA3.1-ZEO-HA-14-3-3ε表达载体。
1.3.9 细胞培养和转染 HEK293细胞用DMEM培养液(添加10%胎牛血清,100 U/mL青霉素,10 μg/mL链霉素)培养。用LipofectamineTM2000 按说明书进行转染HEK293细胞。将HEK293细胞分散于100 mm的培养皿(2×106细胞/皿,10 mL含10% FBS培养液/皿)。在24 h后,细胞共转染5 μg pcDNA3.1-ZEO-HA-14-3-3ε DNA。
1.3.10 蛋白免疫印迹检测14-3-3ε的表达 转染细胞48 h 后离心去除培养液,加入SDS样品缓冲液,裂解细胞提取总蛋白,用BCA 蛋白定量试剂盒定量,进行12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白,转膜,5%脱脂奶粉封闭,分别用一抗(鼠抗兔HA标签抗体,鼠抗羊β-Actin单克隆抗体)及羊抗鼠二抗进行孵育,洗膜后,ECL化学发光法显影成像。
2 结 果
2.1 小鼠14-3-3εcDNA的克隆及鉴定 提取小鼠肝组织细胞总RNA,琼脂糖电泳检测总RNA的提取情况。用RT-PCR反转录出14-3-3εcDNA,PCR产物进行琼脂糖凝胶电泳(胶的浓度为1.5%),14-3-3εcDNA片段大小为809 bp,结果在大约800 bp的位置可见特异性目的条带(图1),与预期结果完全一致。

注:1为RT-PCR产物;Marker为DNAmarkerDL10 kb。
图1 RT-PCR产物琼脂糖凝胶电泳分析
2.2 真核表达载体pcDNA3.1-ZEO-HA-14-3-3ε的构建及鉴定 HA-14-3-3ε片段与T连接,阳性克隆经测序鉴定基因插入正确。挑选鉴定正确的克隆pGEM-T/HA-14-3-3ε和pcDNA3.1-ZEO(+)载体均以EcoRⅠ单酶切后连接,连接产物经限制性内切酶EcoRⅠ酶切鉴定,结果见图2。电泳结果显示800 bp相应的目的条带和5 000 bp的载体条带,与预期片段大小相符,经测序进一步证明插入基因正确,获得pcDNA3.1-ZEO-HA-14-3-3ε载体,用于体外转录。

注:1为pcDNA3.1-ZEO-HA-14-3-3ε质粒DNA的单酶切产物;Marker为DNAmarkerDL15 kb。
图2 pcDNA3.1-ZEO-HA-14-3-3ε质粒DNA的单酶切结果
2.3 真核表达载体pcDNA3.1-ZEO-HA-14-3-3ε在KEK293细胞中的表达 通过脂质体介导的基因转染方法将构建的载体pcDNA3.1-ZEO-HA-14-3-3ε转染Hek293细胞,用anti-β-Actin抗体和anti-HA标签抗体进行Western blotting检测,结果显示,在转染了真核表达载体pcDNA3.1-ZEO-HA-14-3-3ε的Hek293细胞内,HA-14-3-3ε有表达(图3)。提示真核表达载体pcDNA3.1-ZEO-HA-14-3-3ε已成功构建并能正确表达14-3-3ε。
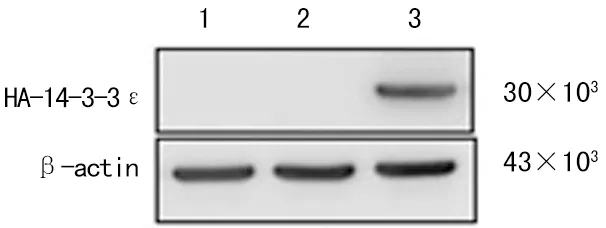
注:1为未转染组;2为转染空载体pcDNA3.1-ZEO;3为转染重组体 pcDNA3.1-ZEO-HA-14-3-3ε。
图3 Western blot检测真核表达载体pcDNA 3.1-ZEO-HA-14-3-3ε在Hek293细胞中的表达
3 讨 论
14-3-3蛋白是一类广泛存在于真核生物体内,相对分子质量为(28~33)×103的酸性蛋白质。14-3-3蛋白家族成员是在1967年由Mooref和Perez首次在哺乳动物的脑组织中发现并鉴定,按照蛋白质系统分类命名法命名为14-3-3蛋白。14-3-3蛋白自我聚集成同或异二聚体,一些家族成员,如σ和γ偏嗜形成同二聚体,其他家族成员如ε偏嗜形成异二聚体。14-3-3二聚体能和细胞内许多蛋白质相互作用,包括许多转录因子、信号分子、凋亡因子和肿瘤抑制因子。功能涉及细胞生长、细胞周期限制点调控、信号转导。14-3-3蛋白能和许多具有特殊磷酸化的丝/苏氨酸结合活性的蛋白质相互作用。14-3-3结合蛋白有2个高亲和14-3-3蛋白结合域:RSXpSXP(mode1)和RXXXpSXP(mode2),pS代表磷酸化的丝氨酸或苏氨酸,X指除半胱氨酸以外的任何一种氨基酸。另外14-3-3蛋白能结合RXXpSX-C00H模序[3-4]。通常与14-3-3蛋白相结合的靶蛋白都具有丝氨酸或苏氨酸位点,14-3-3蛋白以其特有的保守模序与被磷酸化的丝氨酸或苏氨酸相结合,从而调节靶蛋白的生理活性[1]。到目前为止,已经鉴定出超过300种14-3-3人类结合蛋白,而且还有继续增多的趋势[5]。14-3-3蛋白能进行磷酸化修饰,当Ser-58磷酸化后14-3-3蛋白由二聚体转变成单体,单体蛋白不稳定,在结合和调节磷酸化蛋白时活性降低或者完全失去活性[6]。有研究显示,14-3-3ε分子共有12个磷酸化位点,而且每个磷酸化位点与其对应的生物学活性还不清楚[7]。
有许多研究发现,14-3-3蛋白在未受干扰的细胞周期进程中也发挥作用,例如,对发育中果蝇的研究发现,14-3-3ζ和ζ在细胞周期的调控中也发挥着作用,主要是通过抑制CDC2活性,使细胞在适当的时候退出有丝分裂。敲除果蝇的14-3-3ε导致胚胎死亡,尽管14-3-3ε表达正常,然而14-3-3ε对胚胎的发育并不是必须的,14-3-3ε突变的胚胎细胞提前进入有丝分裂。
Uchida等[8]研究结果显示,在HEK293细胞中14-3-3ε能与Cdc25B的309位丝氨酸结合并控制Cdc25B的细胞质定位。在小鼠卵母细胞由GV期向GVBD过渡时Cdc25B从细胞质进入细胞核,使Cdc2/cyclinB复合体发生去磷酸化并激活,从而使小鼠卵母细胞恢复减数分裂,暗示在细胞质中14-3-3蛋白和Cdc25B的结合[9-10]。
目前,国内少见小鼠 14-3-3ε真核表达载体的构建研究和14-3-3ε在小鼠卵母细胞和受精卵发育中作用和机制的相关研究。本研究采用RT-PCR从小鼠肝组织中克隆小鼠14-3-3ε基因,并成功构建14-3-3ε真核表达载体pcDNA3.1-ZEO-HA-14-3-3ε。通过脂质体介导的方法将pcDNA3.1-ZEO-HA-14-3-3ε载体转染HEK293细胞后,Western blotting证实转染细胞内14-3-3ε的表达,为下一步研究14-3-3ε基因的结构、功能及其在小鼠卵母细胞发育的调控作用奠定了良好的基础。
[1]Aitken A.14-3-3 proteins:a historic overview[J].Semin Cancer Biol,2006,16(3):162-172.
[2]Obsilova V,Silhan J,Boura E,et al.14-3-3 proteins:a family of versatile molecular regulators[J].Physiol Res,2008,57(Suppl 3):S11-S21.
[3]Foote M,Zhou Y.14-3-3 protein in neurological disorders[J].Int J Biochem Mol Biol,2012,3(2):152-164.
[4]Coblitz B,Shikano S,Wu M,et al.C-terminal recognition by 14-3-3 proteins for surface expression of membrane receptors[J].J Biol Chem,2005,280(43):36263-36272.
[5]Mackintosh C.Dynamic interactions between 14-3-3 proteins and phosphoprotein regulate diverse cellular processes[J].Biochem J,2004,15(381):329-342.
[6]Sluchanko N,Gusev N.Oligomeric structure of 14-3-3 protein:what do we know about monomers[J].FEBS Lett,2012,586(24):4249-4256.
[7]李子健,何鑫,潘晨宇,等.14-3-3ε蛋白磷酸化修饰的生物质谱分析[J].分析化学,2013,41(11):1653-1658.
[8]Uchida S,Kuma A,Ohtsubo M,et al.Binding of 14-3-3beta but not 14-3-3sigma controls the cytoplasmic localization of CDC25B:binding site preferences of 14-3-3 subtypes and the subcellular localization of CDC25B[J].J Cell Sci,2004,117(Pt 14):3011-3020.
[9]Oh JS,Han SJ,Conti M.Wee1B,Myt1,and Cdc25 function in distinct compartments of the mouse oocyte to control meiotic resumption[J].J Cell Biol,2010,188(2):199-207.
[10]Xiao JY,Liu C,Hou JJ,et al.Ser149 is another potential PKA phosphorylation target of Cdc25B in G2/M transition of fertilized mouse eggs[J].J Biol Chem,2011,286(12):10356-10366.
Gene cloning of mouse 14-3-3ε and construction of its eukaryotic expression vector*
MENGJun,HOUYan-jun,TANGTao,ZHANGYong-mei,LIUShan,LIUYang,Hugejile
(DepartmentofClinicalLaboratory,AffiliatedHospitalofInnerMongoliaMedicalUniversity,Hohhot,InnerMongolia010050,China)
Objective To construct mouse′s eukaryotic expression vector pcDNA3.1-ZEO-HA-14-3-3ε,and to examine its expression in vitro.Methods Total RNA was extracted from mouse liver tissue and reverse transcription-polymerase chain reaction (RT-PCR) was performed to obtain the cDNA fragment encoding 14-3-3ε,which was inserted into the pcDNA3.1-ZEO(+)vector.And the new construct,pcDNA3.1-ZEO-HA-14-3-3ε was confirmed by restriction enzyme digestion and DNA sequencing.HEK293 cells were transfected with the pcDNA3.1-ZEO-HA-14-3-3ε vector and pcDNA3.1-ZEO(+) vector,respectively.The expression of 14-3-3ε was detected by Western blotting.Results The eukaryotic expression vector pcDNA3.1-ZEO-HA-14-3-3ε was constructed,and 14-3-3ε expression was detected in the HEK293 cells 48 h after transfection.Conclusion The eukaryotic expression vector pcDNA3.1-ZEO-HA-14-3-3ε was constructed successfully,which would lay the foundation for the mechanism research of 14-3-3ε in the G2/M transformation of mouse oocyte and oosperm.
14-3-3 ε protein; HEK293 cell; eukaryotic expression vector
国家自然科学基金资助项目(81360109);内蒙古自然科学基金资助项目(2013MS1163)。
孟峻,男,博士,主任技师,主要从事生物化学和分子生物学研究。
10.3969/j.issn.1672-9455.2015.24.001
A
1672-9455(2015)24-3611-03
2015-03-25
2015-06-15)

