生物催化硫醚底物的不对称氧化反应研究进展
卓俊睿,陈永正
(遵义医学院药学院,贵州 遵义 563000)
金属和有机小分子催化的硫醚的不对称氧化反应得到了长足的发展,而生物催化硫醚的不对称氧化由于环境友好、反应条件温和、反应体系较为简单等优点,近年来引起了研究人员的广泛关注[1]。生物催化剂的来源主要有自然来源的微生物的筛选、纯酶和基因工程菌(Scheme 1)。

Scheme 1
本文综述了生物催化硫醚底物的不对称氧化反应的研究进展,重点介绍了微生物菌株整细胞、纯酶和基因工程菌等催化剂在硫醚底物的不对称氧化反应中的应用。
1 微生物催化剂
自然界存在丰富的微生物资源,筛选获得高活性的氧化酶产生菌株一直是研究者发现和获取新酶的重要途径,人们也从未停止去发现和挖掘源于自然的新型生物催化剂(表1)。早在上世纪90 年代,Holland 课题组[2-5]就发现使用真菌Helminthosporiumspecies NRRL4671和Mortierella isabellina的整细胞为催化剂开展了一系列工作,实现了通过催化系列硫醚底物合成具有较高对映选择性的手性亚砜。他们[6]同时也发现真菌Beau-veria bassianaATCC 7159能选择性的氧化L-型或者D-型的蛋氨酸成(SSSC或SSRC)的亚砜。后来他们[7]又发现了Rhodococus erythropolisIGTS8 用于芳香硫醚的不对称氧化反应。French和Gordon等[8]预测了Rhodococus erythropolisIGTS8 催化硫醚底物结构与活性位点关系模型。
Kelly 等[9]也发现Acinetobactersp.NCIMB 9871,Pseudomonassp.9872,Xanthobacter autotrophicusDSM 431和Black yeast NV-2等催化剂也能实现芳香硫醚的不对称氧化反应。后来,Collado课题组[10]发现了三株真菌,其中Botrytis cinerea显现出了S选择性,而Eutypa lata和Trichoderma Viride菌株则具有相反的选择性,获得R构型的手性亚砜。
近年来,许建和课题组[11]从上海、山东和江苏等地煤的气化站采集的土壤中分离获得了对映选择性互补的微生物菌种库,其中单加氧酶产生菌株Rhodococcussp.Strain ECU0066能有效的催化系列硫醚底物的不对称氧化反应,获得14% ~86%的产率和38%~99%ee值的手性亚砜类化合物,他们并研究了该反应的机理,该反应是通过氧化-氧化拆分二步来实现,底物浓度能达到10 mmol·L-1。为了进一步提高反应的催化效率,他们[12]建立了水-异辛烷双相反应体系,在2.4 L的生物反应器中可以实现底物浓度为150 mmol·L-1的苯甲硫醚的生物氧化反应,产率为49%,对映选择性达到99%。采用水-正辛烷两相反应体系,以Rhodococcussp.CCZU10-1 为催化剂,也可以获得S构型的苯甲亚砜,底物浓度可达到55.3 mmol·L-1,产物的ee值达到 99%[13]。由于他们发现单加氧酶产生菌株Rhodococcussp.Strain ECU0066催化苯甲硫醚的反应是通过氧化-氧化拆分来进行的,他们[14]探索了采用消旋化的亚砜为底物,研究其不对称氧化拆分反应,在较短的反应时间内仍然可以催化消旋化亚砜底物的不对称氧化拆分,获得较高的对映选择性。

表1 主要微生物来源催化剂Table 1 The main sources of microorganisms biocatalysts
与此同时,Elkin课题组[15]发现了一些能完全转化硫醚为手性亚砜的生物酶催化剂,Gordonia terraeIEGM136和RhodococcusIEGM66能有效的催化系列芳香硫醚为相应的高光学活性的亚砜,其ee值分别达到89%和95%。本课题组[16]也从河床的淤泥中发现一株假单胞菌Pseudomonas monteiliiCCTCC M2013683,能有效催化苯甲硫醚的不对称氧化反应,底物浓度在30 mmol·L-1的情况下,仍然可以获得99%的产率和99%的ee值,但是当芳香环上具有不同的取代基时,反应的活性和对映选择性均受较大影响。
对于芳香硫醚底物的直接氧化,可以直接将一些手性亚砜类药物的前体硫醚作为底物,通过生物催化氧化,实现一步氧化直接合成目标亚砜药物(Chart 1)。比如 Nagasawa等[17]通过筛选获得菌株Cunninghamella echinulataMK40,其整细胞可以直接催化雷贝拉唑前体硫醚的氧化,可获得ee值达到99%的S构型的雷贝拉唑。Kyslík等[18]筛选获得菌株Lysinibacillussp.B71,几乎可以得到对映纯的埃索美拉唑。
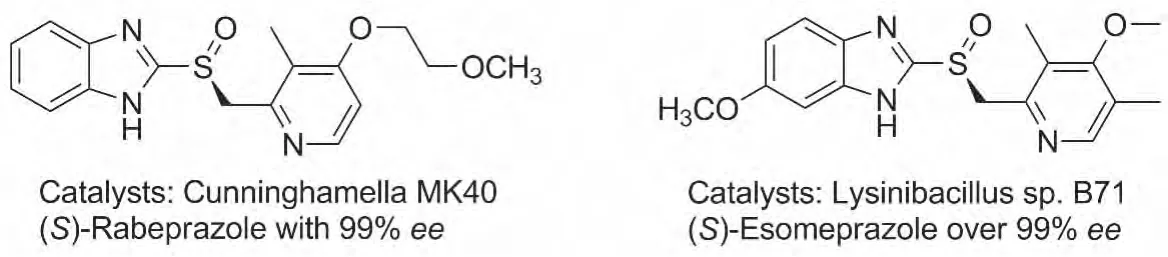
Chart 1
2 纯酶催化剂
生物催化硫醚不对称氧化反应所使用的纯酶催化剂主要有超氧化物酶、单加氧酶及其他酶等。1995年,Holland小组从AcinetobacterNCIB9871菌株中发现了依赖于NADPH的环己酮单加氧酶催化系列芳香硫醚的不对称氧化反应,硫醚的底物结构对催化活性和对映选择性均具有较大影响,比如烷基侧链连接Cl,CN,CH=CH2和OH等基团时,催化效率很低。他们后来构建了葡萄糖脱氢酶和环己酮单加氧酶的循环体系,促进辅酶循环再生,转化率得到提升,同时副产物砜减少[19]。Baeyer-Villiger单加氧酶可以催化硫醚、二噻烷和消旋化亚砜的对映选择性氧化,苯乙酮单加氧酶和4-羟基苯乙酮单加氧酶可以催化芳香硫醚的氧化,后来4-羟基苯乙酮单加氧酶的变种显现出了更广的底物范围[20]。Gotor等[21]采用苯乙酮单加氧酶和4-羟基苯乙酮单加氧酶研究了杂环类硫醚的不对称氧化反应,大多数底物均获得了25% ~99%的ee值。
超氧化物酶是一类重要氧化还原酶,在生物氧化反应中有较多的应用,比如可以催化硫醚、烯烃或者 C -H 键的氧化反应[22]。Hager等[23]首次将氯过氧化物酶从真菌Caldariomycesfumago中分离出来,Allenmark等人使用氯超氧化物酶催化系列芳香环状硫醚的氧化,获得9% ~99%的产率和3% ~99%ee值。Lutz等[24]通过采用电化学原位产生过氧化氢代替传统的直接加入氧化剂的方式,采用氯过氧化物酶催化合成R构型的手性亚砜。

Scheme 2
Jiang等[25]使用氯过氧化物酶催化合成了手性药物莫达非尼(Scheme 2),加入[ENIM][Br]离子液体和季铵盐至反应体系中可提高产率。Wever等[26]在用来源于Ascophyllum nodosum的钒溴超氧化物酶催化芳香硫醚的氧化时发现芳香环上连有吸电子基团的硫醚作为反应底物时,反应活性急剧下降,而当吸电子基团为NO2或CN时,反应甚至不能发生。此外,该酶还可以催化非芳香的环状硫醚的不对称氧化拆分,获得相应的亚砜。
3 基因工程菌催化剂
现代分子生物学技术的发展为高效基因工程菌催化剂的构建提供了可能,同时还可以通过改造酶和进化酶获得高活性和选择性的催化剂。许建和课题组[27]通过P450单加氧酶和葡萄糖脱氢酶的共表达,构建的重组工程菌能有效实现对氯苯甲硫醚的氧化,底物浓度可达2 mmol·L-1~5 mmol·L-1。陈振明等[28]将来源于Acinetobater calcoaceticus的环己酮单加氧酶基因与来源于Candida boidinii的醇脱氢酶基因在大肠杆菌中共表达,在底物浓度达20 mmol·L-1的情况下,产物ee值达99%。Bornscheuer等[29]从PseudomonasputidaJD1中发现4-羟基苯乙酮单加氧酶也能有效催化苯甲硫醚的不对称氧化。源于Stenotrophomonas maltophilia的黄素单加氧酶可以采用NADPH或者NADH为辅酶的单加氧酶,Grogan课题组[30]突变单加氧酶 sMFO时,将52-位的苯丙胺酸替换为缬氨酸时,得到Phe52Val突变体,其催化系列硫醚合成7%~41%ee的S构型的亚砜产物,而采用未突变的单加氧酶sMFO催化反应时,获得19% ~80%ee且构型为R的亚砜。
Fishman等[31]以甲苯单加氧酶为研究目标,通过突变V106的缬氨酸和I100的亮氨酸,其反应速率和对映选择性均得到了较大提高。后来他们又通过饱和突变的方法对硝基苯双加氧酶207位残基进行突变,获得突变体V207I和V207A,在催化苯甲硫醚的反应时显示出了不同的对映选择性,并认为硫醚底物与对硝基苯双加氧酶之间的活性位点可能与疏水相互作用和空间位阻有关,从而相应的影响活性与对映选择性。Li课题组[32]采用P450pyrI83H与葡萄糖脱氢酶进行共表达,在磷酸缓冲溶液和离子液体[P6,6,614][Ntf2]的双相反应体系中,离子液体对底物和酶显示出了较好的溶解性和生物相容性,在催化反应的过程中,底物浓度和对映选择性均得到了不同程度提高。
4 结论与展望
生物催化硫醚的不对称氧化反应近年来取得了较大的突破和进展,但是同生物催化还原和水解等反应相比较,硫醚底物浓度低仍然是研究过程中最关键的瓶颈。与此同时,如何抑制过度氧化产物砜的形成也是未来研究的重点,其核心是要发现和改造高活性和高对映选择性的催化剂。野生菌株的筛选是获得具有高底物浓度和高选择性的生物催化剂的常规方法之一。随着现代分子生物学技术的发展,如何通过基因组数据库挖掘高活性和高选择性的硫醚氧化酶基因将成为研究的重点,并结合定向进化和半理性设计等人工改造的方式,去寻找和发现高活性的硫醚氧化酶。此外,构建辅酶循环再生系统、酶的固定化、反应介质体系以及生物酶反应器的设计和综合考虑,对实现硫醚底物的高效不对称氧化反应的潜在的过程化和工业化的研究均具有重要意义。
[1]Wojaczyńska E,Wojaczyński J.Enantioselective synthesis of sulfoxides:2000 - 2009[J].Chem Rev,2010,110:4303 -4356.
[2]Holland H L,Brown F M,Larsen B G.Preparation of(R)-sulfoxides by biotransformation usingHelminthosporiumspecies NRRL 4671[J].Tetrahedron:Asymmetry,1994,5:1129 -1130.
[3]Holland H L,Brown F M,Larsen B G.Biotransformation of organic sulfides.Part 6.Formation of chiral para-substituted benzylmethylsulfoxidesbyHelminthosporiumspecies NRRL 4671[J].Tetrahedron:Asymmetry,1995,6:1561 -1567.
[4]Holland H L,Bommann M J,Lakshmaiah G.Biotransformation of organic sulfides.Part 9.Formation of(S)-parasubstituted phenyl methyl sulfoxides by biotransformation usingHelminthosporiumspecies NRRL 4671[J].J Mol Catal B:Enzym,1996,1:97 -102.
[5]Holland H L,Allen L J,Chernishenko M J,et al.Side chain oxidation of aromatic compounds by fungi.7.A rationale for sulfoxidation,benzylic hydroxylation,and olefin oxidation byMortierella isabellina[J].J Mol Catal B:Enzym,1997,3:311 -324.
[6]Holland H L,Brown F M.Biocatalytic and chemical preparation of all four diastereomers of methionine sulfoxide[J].Tetrahedron:Asymmetry,1998,9:535 -538.
[7]Herbert L,Holland H L,Brown F M,et al.Biotransformation of sulfides byRhodocoeccus erythropolis[J].J Mol Catal B:Enzym,2003,22:219 -223.
[8]French J B,Holland G,Holland H L,et al.A comparative molecular field analysis of the biotransformation of sulfides byRhodococcus erythropolis[J].J Mol Catal B:Enzym,2004,31:87 -96.
[9]Kelly D R,Knowles C J,Mahdi J G,et al.The enantioselective oxidation of sulfides to sulfoxides withAcinetobactersp.NCIMB 9871,Pseudomonassp.NCIMB 9872,Xanthobacter autotrophicusDSM 431(NCIMB 10811)and the Black Yeast NV - 2[J].Tetrahedron:Asymmetry,1996,7:365 -368.
[10]Pinedo-Rivilla C,Aleu J,Cpllado I G.Enantioslective oxidation of organic sulfides by the filamentous fungiBotrytis cinerea,Eutypa lataandTrichoderma viride[J].J Mol Catal B:Enzym,2007,49:18 -23.
[11]Li A T,Zhang J D,Xu J H,et al.Isolation ofRhodococcussp.strain ECU0066,a new sulfide monooxygenase-producing strain for asymmetric sulfoxidation[J].Appl Environ Microbiol,2009,75:551 -556.
[12]Li A T,Zhang J D,Yu H L,et al.Significantly improved asymmetric oxidation of sulfide with resting cells ofRhodococcussp.in a biphasic system[J].Process Biochem,2011,46:689 -694.
[13]He Y C,Ma C L,Yang Z X,et al.Highly enantioselective oxidation of phenyl methyl sulfide and its derivatives into optically pure(S)-sulfoxides withRhodococcussp.CCZU10-1 in ann-octane-water biphasic system[J].Appl Microbiol Biotechnol,2013,97:10329-10337.
[14]Lin G Q.Resolution of racemic sulfoxides with high productivity and enantioselectivity by aRhodococcussp.strain asan alternative to biooxidation of prochiral sulfides for efficient production of enantiopure sulfoxides[J].Bioresour Technol,2011,102:1537-1542.
[15]Elkin A A,Kylosova T I,Grishko V V,et al.Enantioselective oxidation of sulfides to sulfoxides byGordonia terraeIEGM 136 andRhodococcus rhodochrousIEGM 66[J].J Mol Catal B:Enzym,2013,89:82 -85.
[16]Chen Y Z,Zhuo J R,Zheng D J,et al.Stereoselective oxidation of sulfides to optically active sulfoxides with resting cells ofPseudomonas monteiliiCCTCC M2013683[J].J Mol Catal B:Enzym,2014,106:100-104.
[17]Yoshida T,Kito M,Tsujii M,et al.Microbial synthesis of a proton pump inhibitor by enantioselective oxidation of a sulfide into its corresponding sulfoxide byCunninghamella echinulataMK40[J].Biotech Lett,2001,23:1217 -1222.
[18]Babiak P,Kyslíková E,Štěpánek V,et al.Wholecell oxidation of omeprazole sulfide to enantiopure esomeprazole withLysinibacillussp.B71[J].Bioresour Technol,2011,102:7621 -7626.
[19]Pasta P,Carrea G,Holland H L,et al.Synthesis of chiral benzyl alkyl sulfoxides by cyclohexanone monooxygenase fromAcinetobacterNCIB 9871[J].Tetrahedron:Asymmetry,1995,6:933 -936.
[20]Gonzalo G,Pazmiño D E T,Ottolina G,et al.Oxidations catalyzed by phenylacetone monooxygenase from Thermobifida fusca[J].Tetrahedron:Asymmetry,2005,16:3077 -3083.
[21]Rioz-Martínez A,Gonzalo G,Pazmiño D E T,et al.Enzymatic synthesis of novel chiral sulfoxides employing Baeyer-Villiger monooxygenases[J].Eur J Org Chem,2010,6409 -6416.
[22]Colonna S,Gaggero N,Richelmi C,Pasta P.Recent biotechnological developments in the use of peroxidases[J].Tibtech,1999,17:163 -168.
[23]Allenmark S G,Andersson M A.Chloroperoxidasecatalyzed asymmetric synthesis of a series of aromatic cyclic sulfoxides[J].Tetrahedron:Asymmetry,1996,7:1089-1094.
[24]Kohlmann C,Lütz S.Electroenzymatic synthesis of chiral sulfoxides[J].Eng Life Sci,2006,6:170 -174.
[25]Gao F Q,Wang L M,Liu Y,et al.Enzymatic synthesis of(R)-modafinil by chloroperoxidase-catalyzed enantioselective sulfoxidation of 2-(diphenylmethylthio)acetamide[J].Biochem Eng J,2015,93:243 -249.
[26]Brink H B,Holland H L,Schoemaker H E,et al.Probing the scope of the sulfoxidation activity of vanadium bromoperoxidase fromAscophyllum nodosum[J].Tetrahedron:Asymmetry,1999,10:4563 -4572.
[27]Zhang J D,Li A T,Yu H L,et al.Synthesis of optically pureS-sulfoxide by Escherichia coli transformant cells coexpressing the P450 monooxygenase and glucose dehydrogenase genes[J].J Ind Microbiol Biotechnol,2011,38:633 -641.
[28]Zhai X H,Ma Y H,Lai D Y,et al.Development of a whole-cell biocatalyst with NADPH regeneration system for biosulfoxidation[J].J Ind Microbiol Biotechnol,2013,40:797 -803.
[29]Rehdorf J,Zimmer C L,Bornscheuer U T.Cloning,expression,characterization,and biocatalytic investigation of the 4-hydroxyacetophenone monooxygenase fromPseudomonas putidaJD1[J].Appl Environ Microbiol,2009,75:3106 -3114.
[30]Jensen C N,Ali S T,Allen M J,et al.Mutations of an NAD(P)H-dependent flavoprotein monooxygenase that influence cofactor promiscuity and enantioselectivity[J].FEBS Open Bio,2013,3:473 -478.
[31]Shainsky J,Bernath-Levin K,Isaschar-Ovdat S,et al.Protein engineering of nirobenzene dioxygenase for enantioselective synthesis of chiral sulfoxides[J].Protein Eng Des Sel,2013,26:335 -345.
[32]Gao P F,Li A T,Lee H H,et al.Enhancing enantioselectivity and productivity of P450-catalyzed asymmetric sulfoxidation with an aqueous/ionic liquid biphasic system[J].ACS Catal,2014,4:3763 -3771.

