不同蛋白质水平下丝兰皂甙对山羊氮代谢的影响*
樊艳华,孙海洲,李胜利,桑 丹,任晓萍,凌树礼
(1.内蒙古农业大学动物科学学院,内蒙古 呼和浩特 010018;2.内蒙古自治区农牧业科学院动物营养与饲料研究所,内蒙古 呼和浩特 010031)
不同蛋白质水平下丝兰皂甙对山羊氮代谢的影响*
樊艳华1,2,孙海洲2,*,李胜利2,桑 丹2,任晓萍2,凌树礼2
(1.内蒙古农业大学动物科学学院,内蒙古 呼和浩特 010018;2.内蒙古自治区农牧业科学院动物营养与饲料研究所,内蒙古 呼和浩特 010031)
探讨丝兰皂甙(YES)对不同蛋白质水平下白绒山羊氮代谢及微生物非氨态氮(NAN)供给的影响。试验选用12只体况良好,体重为45.63±3.15kg,装有永久性瘤胃瘘管的内蒙古白绒山羊半同胞羯羊,按体重随机分为4组,每组3只。采用2×2因子随机区组试验设计分组,即低氮不驱虫组(7.5%,FAUN)、低氮驱虫组(7.5%,PDFAUN)、高氮不驱虫组(13.5%,FAUN)、高氮驱虫组(13.5%,PDFAUN)。采用YES作为驱原虫剂。结果表明:(1)添加YES后,高氮日粮组驱除原虫达80%(P<0.01),低氮日粮组驱除原虫的数量显著多于高氮日粮组(P<0.01);(2)不同日粮蛋白水平下,部分驱原虫后瘤胃氨氮浓度(NH3-N)显著降低(P<0.05),尿氮排出分别减少了2.24 g/d和1.52 g/d,沉积氮占总采食氮的比例分别增加了5.38%和2.81%,总嘌呤衍生物(PD)显著增加(P<0.01),微生物(NAN)供给分别增加了2.84 g/d和2.73 g/d。试验结果表明,在低氮日粮水平下,部分驱原虫更有利于提高内蒙古白绒山羊氮利用率。
部分驱原虫;微生物非氨氮供给量;低氮日粮;氮利用率
随着人口增长和人们生活水平的提高,全球面临着粮食和饲料资源短缺,环境污染严重的问题,而畜牧业粪污排放是污染的主要来源。在广泛的日粮条件下,反刍动物与单胃动物相比,日粮氮利用率较低,仅达25%[1],以在反刍动物当中对日粮氮利用率较高的奶牛为例,也只有43%[2],其它的氮都以粪和尿的形式排放到环境中。所以,提高日粮氮利用率,降低日粮成本,减少环境污染,是待需解决的问题。反刍动物瘤胃中原虫的数量占到瘤胃微生物总量的20%~70%,但其对十二指肠微生物蛋白合成量的作用仅为20%~40%[3]。瘤胃原虫可降解日粮和细菌蛋白质,导致瘤胃内NH3-N增加。研究发现,驱除原虫能够降低瘤胃NH3-N[4],通过增加尿素酶活性[5]和尿素氮在瘤胃上皮的转运[6-7],最终增加尿素氮循环,提高微生物蛋白质合成[8]。另外,驱除原虫对瘤胃NH3-N浓度的影响随着日粮蛋白水平的变化而变化[9],当动物在采食低氮日粮时,驱除原虫对氮利用提高的程度更大[10],所以驱除原虫和日粮蛋白水平对氮利用的影响之间存在交互作用。因此,本试验旨在阐明YES对不同日粮蛋白质水平下白绒山羊氮代谢及微生物非氨态氮(NAN)供给的影响。
1 材料与方法
1.1 试验动物
选用12只体况良好,体重为(45.63±3.15) kg的装有永久性瘤胃瘘管的内蒙古白绒山羊半同胞羯羊,按体重随机分为4组,每组3只,试验期29 d,预试期21 d,正试期8 d。单笼饲养,常规光照、驱虫与管理,自由饮水。
1.2 日粮设计
日粮设计参照参考美国Feedstuff饲料成分分析表(2007版)[11],具体日粮设计成分组成如下表1。ME为1.4倍维持代谢能。
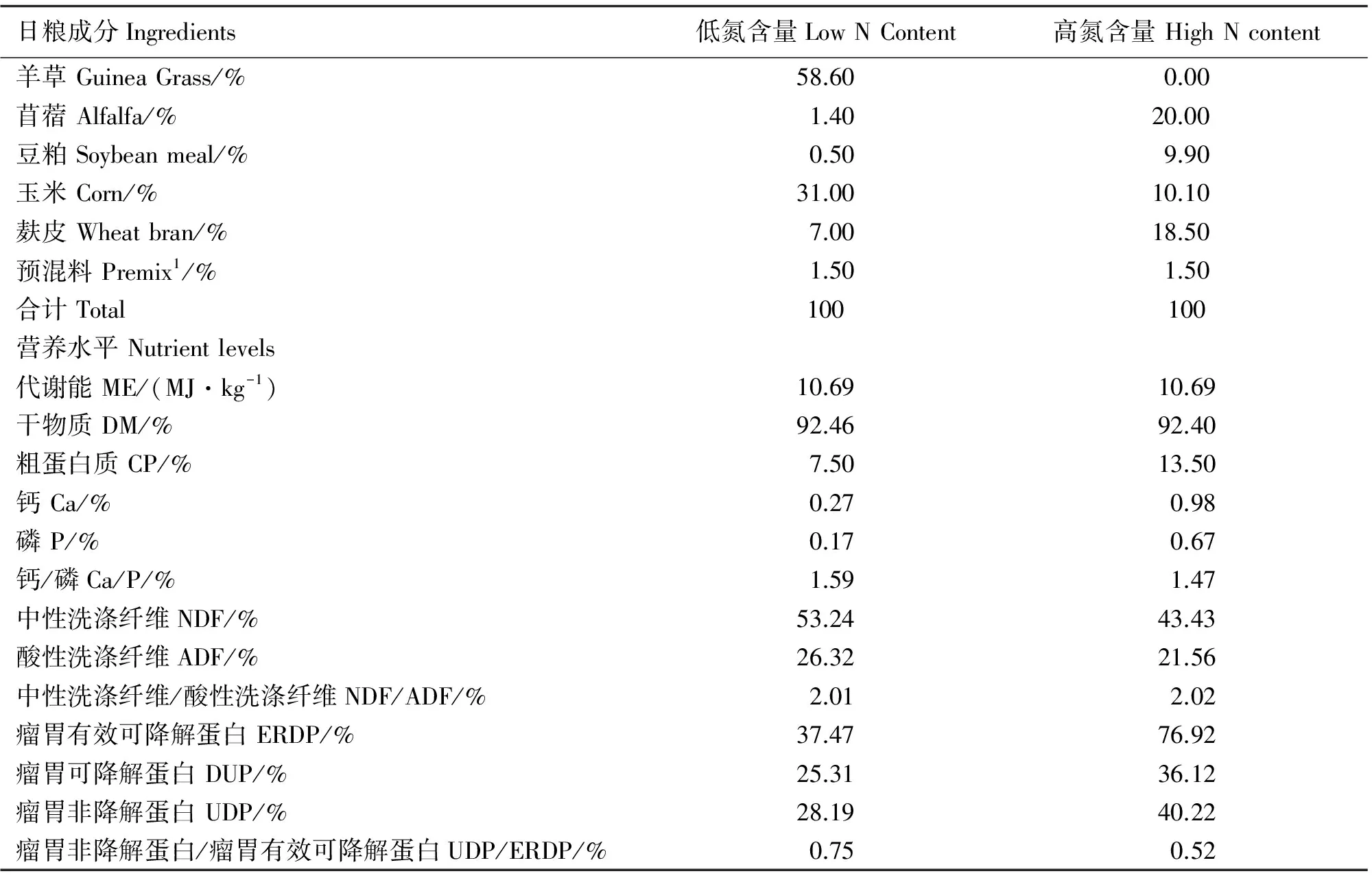
表1 基础日粮组成及营养水平(干物质基础)
注:1)每千克预混料含有 :Fe(FeSO4·7H2O)900~1200mg;Cu(Cu SO4·5H2O)150~180 mg;Zn(ZnSO4·7H2O)900~1200 mg;Co(CoCl2·6H2O)2~4 mg;VA>50000 IU;VD310000~15000IU;VE 200 mg;water≤10%。
2)ERDP、DUP和UDP为计算值,参考美国Feedstuff饲料成分分析表(2007版)。
Notes: 1; Per KG of premix provided: Fe(FeSO4·7H2O)900~1200mg;Cu(Cu SO4·5H2O)150~180 mg;Zn(ZnSO4·7H2O)900~1200 mg;Co(CoCl2·6H2O)2~4 mg;VA>50000IU;VD310000~15000IU;VE 200 mg;water≤10%。2; ERDP、DUP and UDP are calculated values according to the U.S. feedstuff ingredient analysis table (2007 edition).
1.3 饲养管理
试验羊每天在07:00和19:00饲喂,自由饮水。驱原虫剂是丝兰皂甙,以600 mg/kg[12](DM基础)与精料混匀,从预试期开始每天饲喂。试验期前一天给试验羊空腹称重后,带上集粪袋、集尿袋,每日准确记录试验羊的采食量和剩草料量。
驱原虫剂中丝兰皂甙的含量为50%,由西安合健生物科技有限公司提供,添加剂量参考陈旭伟[13]。
1.4 样品采集
1.4.1 瘤胃液的采集 在第1~3、6、9、12、15、19、20、21天的11:00采瘤胃液,将采集的瘤胃液直接测定pH后,用四层纱布过滤,一部分进行原虫计数,当部分驱除组原虫数目基本恒定时,按以上时间点采部分驱虫组和对照组动物的瘤胃液进行原虫的计数和分类。在整个正式期随机抽查,以确保其数量恒定。另一部分用3 500 r/min离心15 min,取0.5 mL上清液用来测定NH3-N,另取0.5 mL上清液加25%的偏磷酸后测定VFA。
1.4.2 血样收集和处理 正式期的第1~3 d的08:30采血颈静脉10 mL,缓慢注入涂有肝素(750 IU)的离心试管中,在30 min 14 ℃ 2 000 g条件下离心15 min分离血浆样本,制备样品-20℃保存。
1.4.3 粪尿样收集 尿样收集:正试期的第1~5 d收集尿样1 M H2SO4(100 mL/d)调整尿液至pH<3。记录每天总排尿量,过滤后按5%取样制混合样,-20 ℃保存。
粪样收集:将正试期的第1~5天收集的鲜粪样称重后按10%采样混合,冷冻保存,试验结束后制成风干样。
1.5 样品的分析方法
1.5.1 原虫计数
参考陈旭伟[13]的方法。
1.5.2 尿中排出的嘌啉衍生物及微生物NAN供给量的测定 参照Chen[14]测定尿中排出的嘌呤衍生物,用尿嘌呤衍生物法估测微生物供给量。
1.6 计算方法
1.6.1 尿嘌呤衍生物总量的计算 PD(m mol/d)=尿囊素(m mol/d)+尿酸(m mol/d)+黄嘌呤(m mol/d)+次黄嘌呤(m mol/d)
1.6.2 微生物NAN的计算方法 山羊嘌呤衍生物的摄取量的计算[15]如下:
Y=0.76X+(0.202W0.75e-0.25);
式中:X代表山羊嘌呤衍生物的摄取量;Y代表尿中排出的嘌呤衍生物的总量;0.76代表嘌呤衍生物排出的嘌呤衍生物占总摄取的比例,为恒定值[14];0.202 mmol/kgW0.75为恒定值,代表内源嘌呤供给量[16]。
每日微生物NAN供给的计算[15]如下:
MN(g N/d)=X×70/(0.116×0.83×1000)=0.727×X;
式中:微生物嘌呤的消化吸收率为0.83;嘌呤中氮的含量是70 mg N/m mol;嘌呤中的氮:瘤胃微生物总氮=11.6∶100。
推荐理由:文化的历史,说到底是人类的历史。现代人是如何从十万年前的东非小部落,成长为如今超过70亿人口并遍布整个世界的?在人类进化早期,基因对文化起到决定性作用;而在 “走出非洲”的扩张阶段,文化演进才是现代人成功的最大秘密。本书讲述了人类伟大的迁移史、人类基因的秘密以及基因与文化的深刻互动和相互影响,以生物进化理论为基础,为读者呈现了一幅宏大的人类文化演进的历史画卷。所有这些内容会帮助我们重新认识种族差异、文化差异和人类本身。
1.7 数据统计与分析
数据处理采用 SAS9.0软件的 ANOVA进行多因素方差分析,用Duncan氏法进行多重比较。试验结果均以平均值 ±标准差表示,以P<0.05作为差异显著判断标准,以P<0.01作为差异极显著判断标准。
2 结果与分析
2.1 瘤胃内环境发酵参数的测定
2.1.1 瘤胃原虫计数
图1 内毛虫
图2 全毛虫
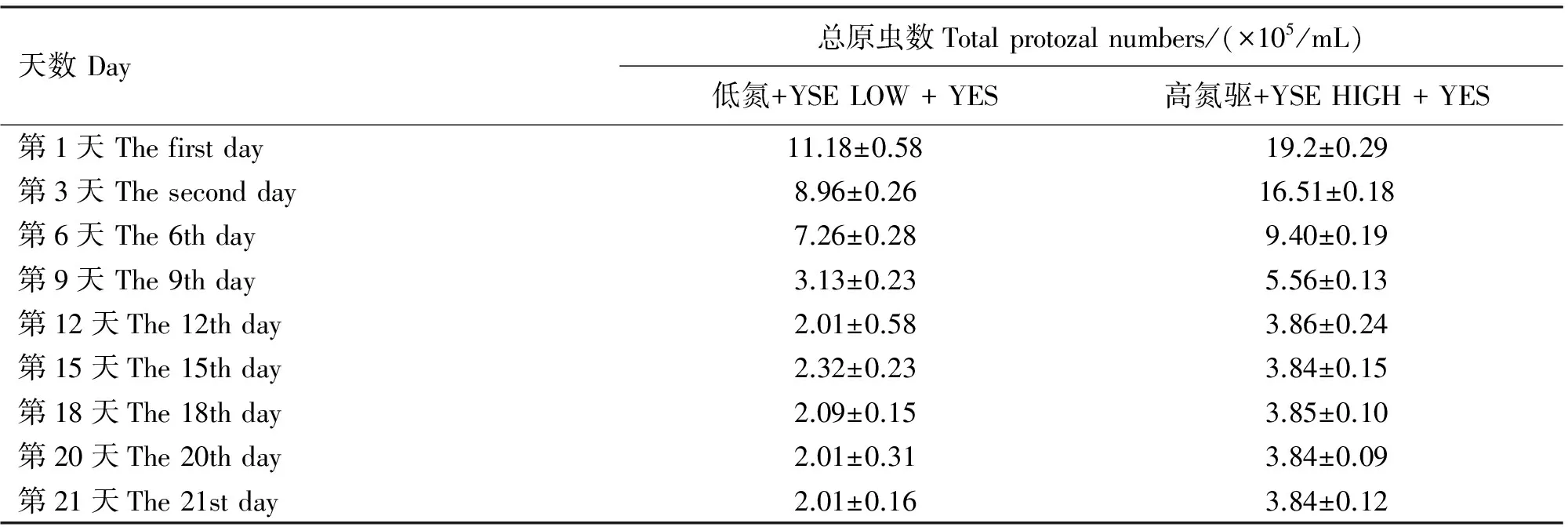
表2 瘤胃原虫计数
添加丝兰皂甙后,瘤胃原虫数量变化情况见表2。瘤胃原虫数量测定持续了21 d,在第12天达到最大,试验期原虫数量基本恒定不变。观察到的原虫总类分为内毛虫、全毛虫和水解纤维素原虫三类[17],具体的形态如图1、2。未驱除原虫的绒山羊瘤胃内有大约92%的内毛虫、4%~5%的全毛虫和2%~4%的水解纤维素类原虫。饲喂低氮日粮时,驱除原虫达82%(P<0.01),饲喂高氮日粮时,驱除原虫达80%(P<0.01)。

表3 最终的驱虫结果
注:差异不显著(P>0.05),差异显著(P<0.05),差异极显著(P<0.01)。下同。
Notes:No significant differences were detected whenP>0.05, significant difference detected whenP<0.05, and highly significant difference detected whenP<0.01. The same as below.
2.1.2 瘤胃发酵参数的测定
2.1.2.1 瘤胃微生物区系一致,不同日粮水平对瘤胃发酵参数的影响具体结果见表4。饲喂低氮日粮与饲喂高氮日粮相比,氨氮浓度显著降低(P<0.01),乙酸、丙酸和总VFA的浓度无显著变化(P>0.05)。
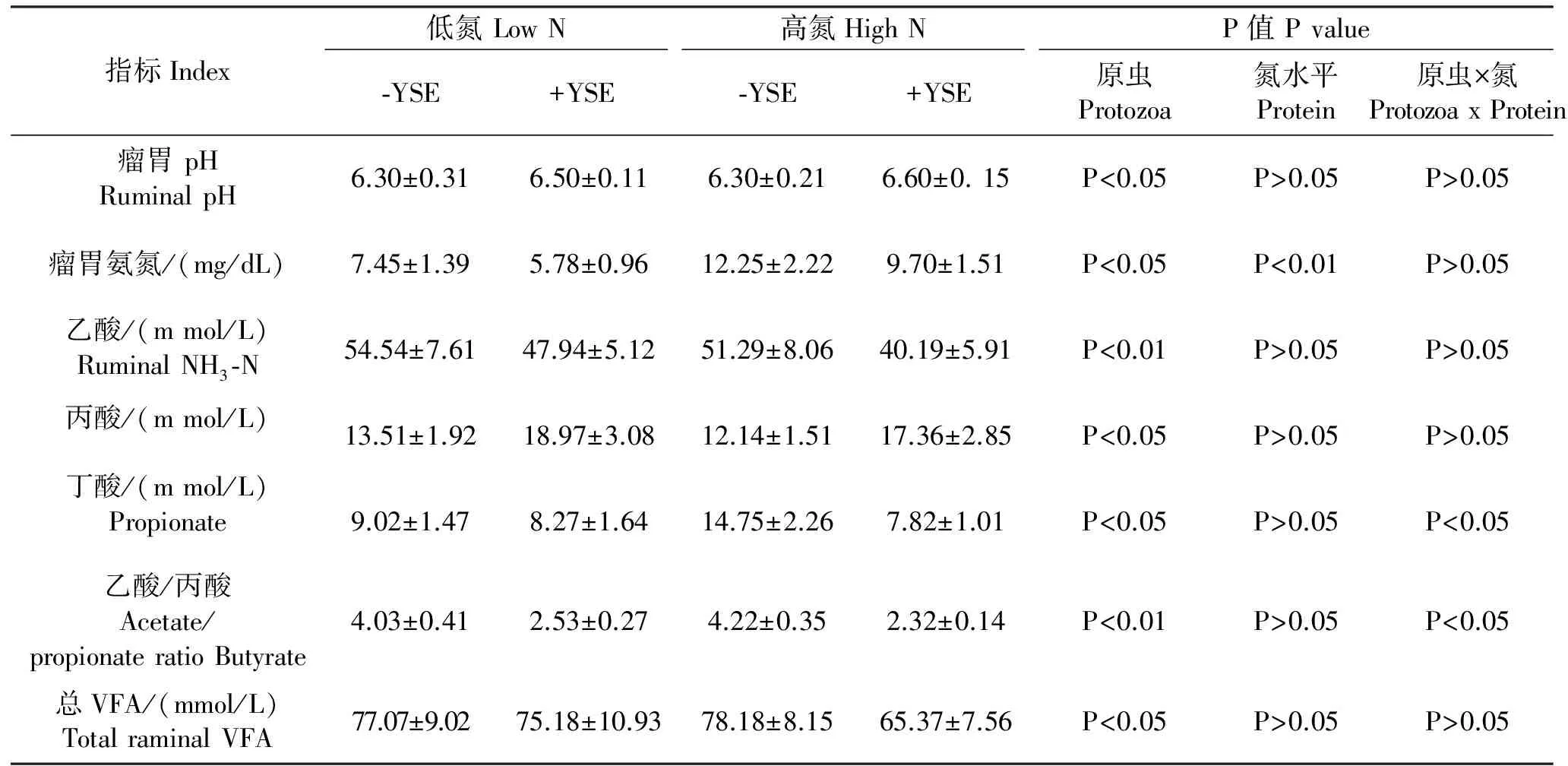
表4 瘤胃发酵参数的测定
2.2 调控瘤胃和日粮因素对内蒙古白绒山羊氮利用率的影响
2.2.1 不同日粮蛋白水平下,部分驱原虫对内蒙古白绒山羊氮利用率的影响 结果见表5和6。部分驱原虫后,粪氮排出无显著性的增加(P>0.05),尿氮排出显著减少(P<0.01),总氮排出显著减少(P<0.05),沉积氮占总采食氮的比例显著增加(P<0.05)。尿中排出的尿囊素和总PD显著增加(P<0.01),尿酸、黄嘌呤和次黄嘌呤没有明显变化,微生物NAN供给量显著增加(P<0.05)。
2.2.2 瘤胃微生物区系一致,不同日粮蛋白水平对内蒙古白绒山羊氮利用率及微生物NAN供给的影响 结果见表5和6。饲喂低氮日粮与饲喂高氮日粮相比,粪氮排出没有显著变化,尿中尿素氮、血浆尿素氮和尿氮排出显著减少(P<0.05),总氮排出显著减少(P<0.05),沉积氮占总采食氮的比例无显著变化(P>0.05)。尿中排出的尿囊素、尿酸和总PD显著减少(P<0.01),黄嘌呤和次黄嘌呤无明显变化,微生物NAN在供给量显著减少(P<0.01)。
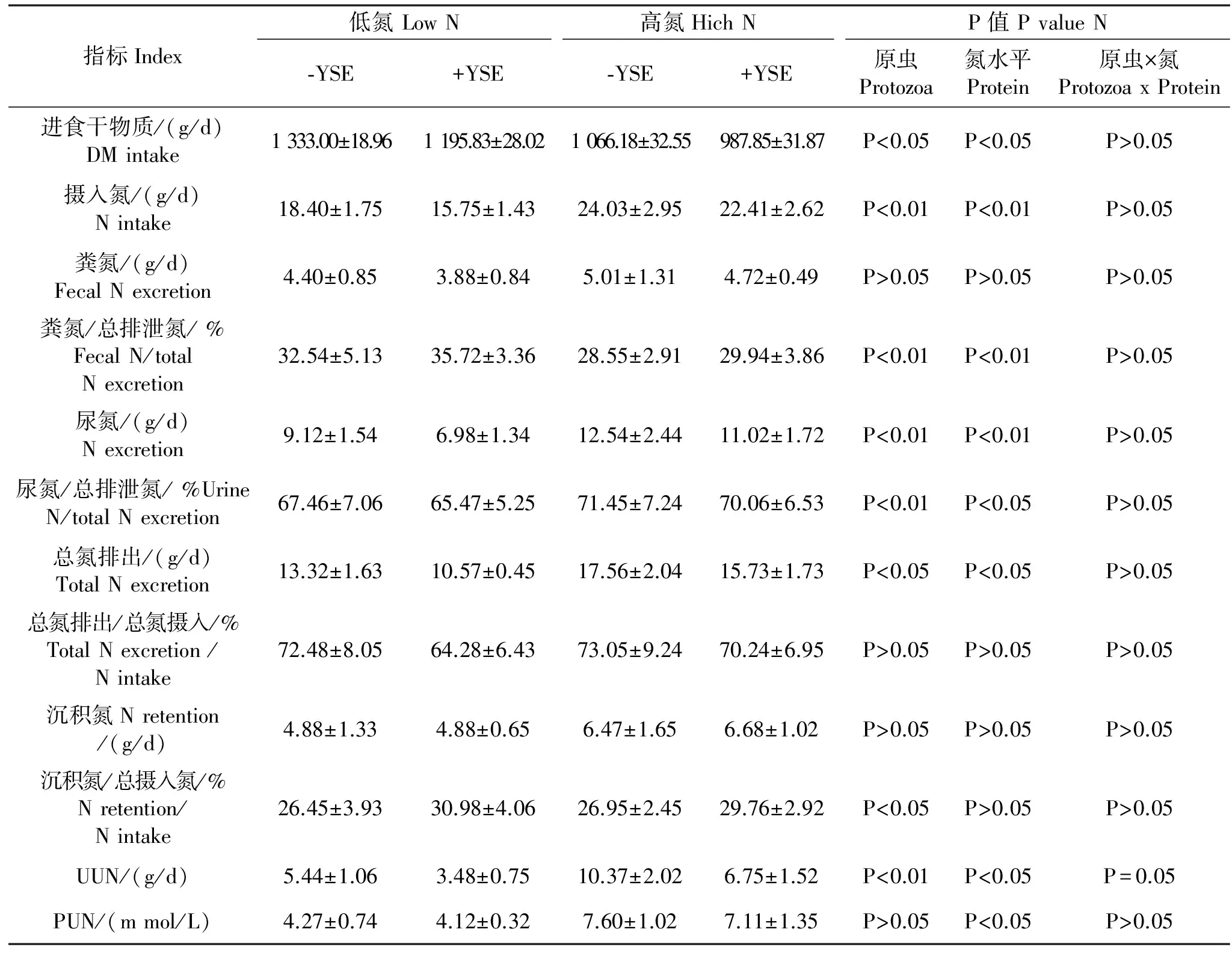
表5 调控瘤胃和日粮因素对内蒙古白绒山羊消化代谢的影响
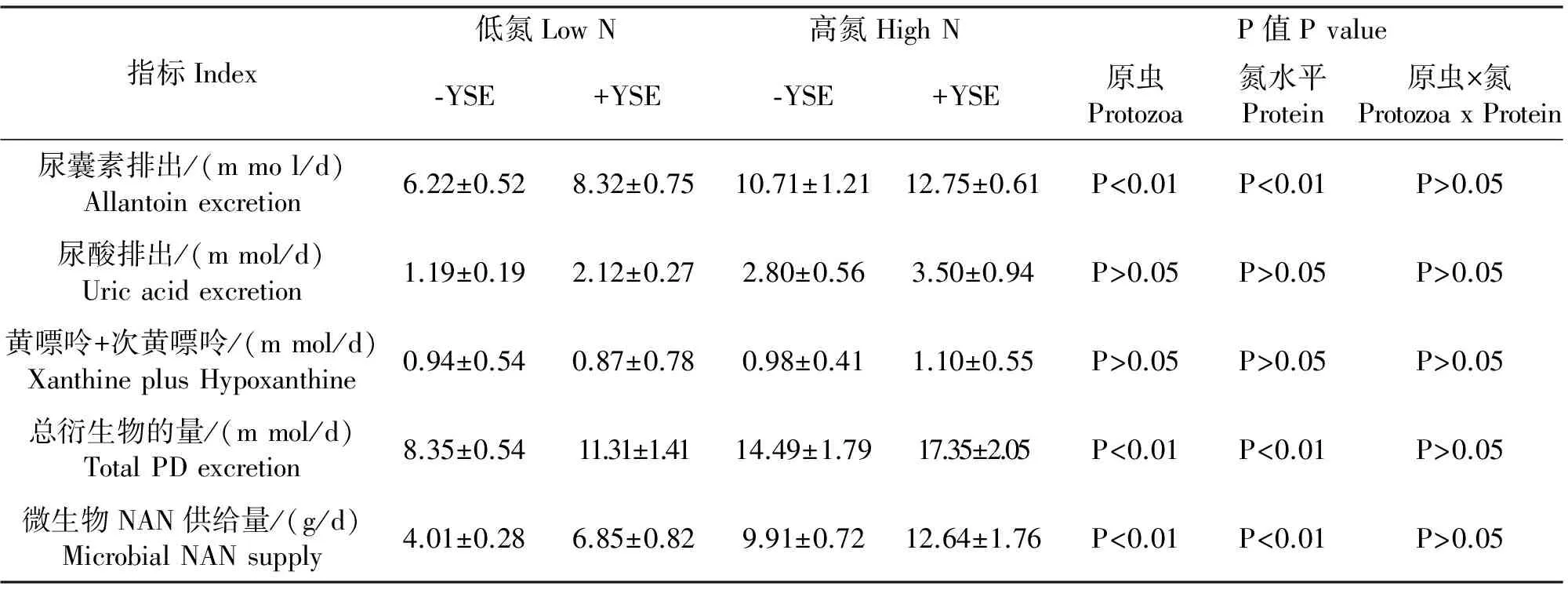
表6 调控瘤胃和日粮因素对内蒙古白绒山羊尿嘌呤衍生物的排出量和微生物NAN供给的影响
3 讨 论
3.1 调控瘤胃和日粮因素对内蒙古白绒山羊瘤胃微生物区系的影响
3.1.1 不同日粮蛋白水平对驱除瘤胃原虫的影响
本试验选用丝兰皂甙作为驱虫剂。驱除瘤胃原虫的方法有很多,大多是使用化学试剂作为驱虫剂[10],使瘤胃原虫中毒。这些方法的主要缺点是毒害试验动物,并且能改变其它瘤胃微生物群的种类,所以本试验选择丝兰皂甙作为驱虫剂。试验发现,饲喂低氮日粮比饲喂高氮日粮驱除原虫比例大2%,而国外在2010年得出结果饲喂低氮日粮时驱原虫的比例较饲喂高氮日粮更大。这是因为饲喂高氮日粮会导致瘤胃原虫数量增加,因为增加了供原虫生长的底物[18]。
3.1.2 不同日粮蛋白水平下,部分驱原虫对绒山羊瘤胃发酵参数的影响 本试验发现部分驱原虫会导致瘤胃NH3-N浓度降低。许多研究报道部分[19]或全部驱原虫[20]能降低瘤胃内NH3-N浓度。主要原因是瘤胃内源氮素再循环减少,降低了NH3-N浓度,同时增加用于合成微生物蛋白的NH3-N,以及瘤胃内日粮含氮化合物的水解作用减少[21]。还有研究者在绵羊上发现[22]部分驱原虫后瘤胃内NH3-N浓度降低。大多数氨氮进入静脉血池在肝脏被解毒转化为尿素,如果瘤胃内NH3-N浓度降低,进入肝脏的NH3-N浓度减少,肝脏内尿素的生成减少,尿中排出的氮就减少,那么大部分的氮进入尿素循环,用于瘤胃内或肠道内微生物蛋白质的合成。但是,试验发现驱原虫对降低瘤胃NH3-N浓度的作用受日粮含氮水平的影响,其提高氮利用率的优势在日粮氮不足的情况下更为明显。Engene等[10]也得出同样的结果。
部分驱原虫也可降低瘤胃内VFA的总浓度,主要是乙酸和丁酸的浓度降低。并且乙酸浓度在日粮水平和驱原虫交互作用下也有显著降低,这可能是干物质采食量之间的差异导致的[23]。相似的,已经报道关于饲喂高氮日粮的奶牛丁酸浓度较高,可能的原因是摄入较高的日粮蛋白物质的真蛋白源的AA的脱氨基作用和脱羧反应。
3.2 不同日粮蛋白水平下,部分驱原虫对绒山羊氮利用率及微生物NAN供给的影响
本试验从粪尿氮的排出量、尿中尿素氮的排出和微生物NAN供给三个指标诠释了部分驱原虫提高了绒山羊的氮利用率。部分驱除原虫对干物质采食量的影响不大。大多可利用的研究也得出相同的结果[9]。粪氮排出无显著变化,粪氮占总氮排出的比例显著增加。这可能是结构性碳水化合物在肠道的消化,导致细菌蛋白质的合成较高,如果没有肠道机制的消化和合成细菌蛋白质的吸收,多余的氮会从粪便排出。而尿氮排出和尿中尿素氮有显著性的减少,一方面沉积氮占总采食氮的比例增加,另一方面,再循环回胃肠道的尿素氮的比例增加,绒山羊氮利用率提高。其它研究者在绵羊上也发现了相同的结果[24]。
对于反刍动物,估测微生物蛋白质的方法有很多,包括最早的冻干法等。目前,普遍沿用尿嘌呤衍生物法来估测瘤胃微生物NAN的供给量,然而在计算过程中尿嘌呤衍生物中的氮占瘤胃微生物总氮的比值仍然无法实测,假设它是一个恒定值11.6/100,并且在不同的日粮处理下仍然不变。事实上,试验发现一些因素例如日粮和饲喂时间可能改变比值。尽管存在一些局限性,但尿嘌呤衍生物的技术仍然是我们现在沿用估测微生物NAN供给量的方法。本试验发现部分驱原虫后,绒山羊尿囊素和总嘌呤衍生物的量会增加,微生物NAN供给量增加。许多研究者[22]也已经表明驱原虫后微生物NAN供给量增加,可能的原因一方面是原虫数量减少,对细胞的吞噬减少,原虫间对自身生长所需营养物质的竞争减少了;另一方面,瘤胃NH3-N水平与瘤胃尿素氮转运呈负相关,较高的氨氮水平能够降低尿素氮在瘤胃上皮的渗透性,驱除瘤胃原虫能够降低瘤胃NH3-N水平,通过增加尿素酶活性和尿素氮在瘤胃上皮的转运,最终增加尿素氮循环,提高微生物蛋白质的合成量。
3.3 日粮蛋白水平与瘤胃微生物对反刍动物氮利用率的交互影响
通过本次试验和之前已有的研究,我们知道原虫和日粮蛋白水平对反刍动物氮利用率有交互作用,然而对氮代谢的交互作用差异不显著。低氮日粮的粗蛋白含量是7.5%,显著低于绒山羊正常需要的粗蛋白量(10%CP,NRC),高氮日粮的粗蛋白含量是13.5%,高于绒山羊正常生长需求。所以,这两组日粮蛋白水平差异很大。因为绒山羊在日粮不足的情况下,部分驱原虫更有利于氮的利用,所以原虫和日粮蛋白水平对微生物NAN在小肠的流通量的交互作用是存在的。
研究者们基于对75个关于驱原虫对氮代谢影响的研究做了荟萃分析[10],发现随着日粮蛋白水平减少,部分驱除瘤胃原虫对瘤胃NH3-N浓度的影响减少,说明原虫和日粮蛋白水平之间有很重要的交互作用。在荟萃分析中,部分驱原虫后瘤胃NH3-N浓度减少多于5.0 mg/dL,而本试验中,低氮驱原虫与低氮不驱原虫组比较,高氮驱原虫与高氮不驱原虫组比较,瘤胃NH3-N浓度分别仅减少了2.73 mg/dL和2.55 mg/dL。如之前在绵羊的研究一样,不能足够说明部分驱原虫和日粮蛋白水平对氮利用之间的交互作用。
4 结 论
(1)饲喂600 mg/kg DM 的丝兰皂甙对部分驱除瘤胃原虫是有效的。不同日粮蛋白水平下,部分驱原虫后,总排出氮显著减少,沉积氮占总采食氮的比例有显著增加;瘤胃NH3-N浓度显著降低,微生物NAN供给量显著增加,绒山羊氮有效利用率提高。
(2)瘤胃微生物区系一致,随着日粮蛋白水平的增加,尿氮排出增加,而沉积氮占总采食氮的比例无显著变化。
(3)饲喂高氮日粮时,部分驱原虫后微生物NAN供给量增加了2.73 g/d,而饲喂低氮日粮时,部分驱原虫后微生物NAN供给量增加了2.84 g/d,说明原虫和日粮蛋白水平对微生物NAN供给量有交互作用。
[1] Calsamiglia S,Ferret A,Reynolds C K,et al. Strategies for optimizing nitrogen use by ruminants[J].Animal, 2010,4(7):1 184-1 196.
[2] Van Duinkerken G,Bannink A ,A M van Vuuren,et al. Improving nitrogen efficiency of dairy cows and its environmental impact[C].Penn State Dairy Cattle Nutrition Workshop, The Netherlands:The Netherlands Animal Nutrition Group,2011.
[3] Jouany J P.Effect of rumen protozoa on nitrogen utilization by ruminants[J].The Journal of Nutrition,1996(126):1 335-1 346.
[4] Koenig K M,Newbold C J,McIntosh F M,et al.Effects of protozoa on bacterial nitrogen recycling in the rumen[J].Journal of Animal Science,2000(78):2 431-2 445.
[5] Firkins J L,Z Yu,Morrison M.Ruminal nitrogen metabolism: Perspectives for integration of microbiology and nutrition for dairy[J].Journal of Dairy Science,2007,90(1):1-16.
[6] Kennedy P M,Milligan L P.The degradation and utilization of endogenous urea in the gastrointestinal tract of ruminants: a review[J].Journal of Animal Science,1980(60):205-221.
[7] Egan A R, K Boda,Varady J. Regulation of nitrogen metabolism and recycling[J].Control of Digestion and Metabolism in Ruminants, New Jersey: Prentice-Hall,1986, 386-402.
[8] Rémond D,L Bernard,I Savary-Auzeloux,et al.Partitioning of nutrient net fluxes across the portal-drained viscera in sheep fed twice daily:effect of dietary protein degradability[J].British Journal of Nutrition,2009(102):370-381.
[9] Cheng K J,Wallace R J.The mechanism of passage of endogenous urea through the rumen wall and the role of ureolytic epithelial bacteria in the urea flow[J].British Journal of Nutrition,1979(42):55 3-557.
[10] Eugène M H, Archimède, Sauvant D.Quantitative meta-analysis on the effects of defaunation of the rumen on growth, intake and digestion in ruminants[J].livestock production science,2004(85):81 -97.
[11] Leng R A,Nolan J V. Nitrogen metabolism in the rumen[J].Journal of Dairy Science,1984(67):1 072-1 089.
[12] 李 玫.美国Feedstuffs饲料成分分析表(2007版)[J].饲料广角,2007(12):37-40.
[13] 刘春龙.丝兰属植物提取物对绵羊瘤胃发酵及饲粮养分消化的影响[D].黑龙江哈尔滨:东北农业大学,2004.
[14] 陈旭东.不同皂甙对山羊瘤胃原虫和细菌种属变化以及纤维降解率的影响[D].扬州:扬州大学,2009.
[15] Chen X B, Gomes M J. Estimation of microbial protein supply to sheep and cattle based on urinary excretion of purine derivatives- and overview of the technical details[J]. Int Feed Resources Unit,1992,1-19.
[16] Chen X B,Ørskov E R.Research on urinary excretion of purine derivatives in ruminants:Past, present and future[M].Estimation of microbial protein supply in ruminants using urinany purine derivatives.Netherlands:spring:2004,180-210.
[17] Carro M D,Cantalapiedra-Hijar G,Ranilla M J,et al.Urinary excretion of purine derivatives, microbial protein synthesis, nitrogen use, and ruminal fermentation in sheep and goats fed diets of different quality[J].Journal of Animal Science,2012(90):3 963-3 972.
[18] Mosoni P,Martin C,Forano E,et al.Long-term defaunation increases the abundance of cellulolytic ruminococci and methanogens but does not affect the bacterial and methanogen diversity in the rumen of sheep[J].Journal of Animal Science,2011(89):783-791.
[19] Kiran D, Mutsvangwa T.Effects of partial ruminal defaunation on urea-nitrogen recycling, nitrogen metabolism, and microbial nitrogen supply in growing lambs fed low or high dietary crude protein concentrations[J].Journal of Animal Science,2010(88):1 034-1 047.
[20] Kiran Doranalli,Timothy Mutsvangwa.Feeding sunflower oil to partially defaunate the rumen increases nitrogen retention, urea-nitrogen recycling to the gastrointestinal tract and the anabolic use of recycled urea-nitrogen in growing lambs[J].British Journal of Nutrition,2011(105):14-1464.
[21] Firkins J L,Z Yu,Morrison M.Ruminal nitrogen metabolism :Perspectives for integration of microbiology and nutrition fot dairy[J].Journal of Dairy Science,2007,90(1):1-16.
[22] Wallace R J,G A Broderick, Brammall M L.Microbial protein and peptide metabolism in rumen fluid from faunated and ciliate-free sheep[J].British Journal of Nutrition,1987(58):87-93.
[23] Kiran Doranalli. Factors regulating urea-nitrogen recycling in ruminants[D].SK Canada, University of Saskatchewan,2010.
[24] Belanche A de la, Fuente G,Pinloche E,et al.Effect of diet and absence of protozoa on the rumen microbial community and on the representativeness of bacterial fractions used in the determination of microbial protein synthesis[J].Journal of Animal Science,2012(90):3 924-3 936.
[25] Colmenero J J, Broderic G A. Effect of dietary crude protein concentration on milk production and nitrogen utilization in lactating dairy cows[J].Journal of Dairy Science,2006,89(5):1 704-1 712.
[26] Belanche A,Abecia L,Holtrop G,et al.Study of the effect of presence or absence of protozoa on rumen fermentation and microbial protein contribution to the chyme[J].Journal of Animal Science, 2011(89):4 163-4 174.
Effect of Saponins from Yucca Schidigera Extract on Nitrogen Metabolism of Goats with Different Dietary Protein Level
FAN Yan-hua1, SUN Hai-zhou2*,LI Sheng-li2, SANG Dan2, REN Xiao-ping2, LING Shu-li2
(1.CollegeofAnimalSciences,InnerMongoliaAgriculturalUniversity,Hohhot,InnerMongolia010018,China; 2.InstituteofAnimalNutritionandFeed,InnerMongoliaAcademyofAgricultural&AnimalHusbandryScience,Hohhot,InnerMongolia010031,China)
To study the effect of saponins from yucca schidigera extract (YSE) on nitrogen metabolism and microbial NAN supply in goats fed with low (7.5%)or high(13.5%) dietary crude protein concentrations (DM basis),12 half-sib castrated male Inner Mongolia White Cashmere goats (45.63±3.15 kg of initial BW) fitted with permanent cannulas in the rumen were divided into 4 groups following a 2 x 2 factorial randomized block design, ie, low nitrogen dietary vs. high nitrogen dietary and partial defaunation (PDFAUN) vs. faunation (FAUN). YSE was fed as anti-protozoal agent. Results showed that: (1) YSE decreased (P<0.01) total ruminal protozoa by 82% and 81% in goats fed LOW and HIGH N diets. (2) under different diet protein levels, partial defaunation decreased ruminal NH3-N(P<0.05), total purine derivatives increased (P<0.01) , urinary N decreased by2.24 and 1.52 g/d, proportion of N retention in N intake increased by 5.38 and 2.81%,and microbial NAN supply increased by 2.17 and 2.73 g/d .The results concluded that partial defaunation improved the utilization of N in cashmere goats fed with LOW N diets.
partial ruminal defaunation; microbial NAN supply; low nitrogen dietary; nitrogen utilization
2014-06-12,
2014-12-19
国家自然科学基金(31260563);国家公益性行业(农业)科研专项(201303059);国家绒毛用羊产业技术体系建设(CARS-40-12);内蒙古自治区自然科学基金(2012MS0416);内蒙古农牧业科技创新基金项(2013CXJJM05)
樊艳华(1987-),女,内蒙古呼和浩特人,硕士研究生,研究方向:动物营养与饲料科学。E-mail:250939689@qq.com
*[通讯作者] 孙海洲(1971-),男,内蒙古呼和浩特人,研究员,硕士生导师,研究方向:反刍动物营养理论和技术的研究 。E-mail:sunhaizhou@china.com
S811.6
A
1005-5228(2015)02-0021-08

