粘着斑激酶FAK基因功能研究进展*
马 勇,鞠志花,王秀革,张 燕,王长法,刘树真
(1.山东师范大学 生命科学学院,山东 济南 250014; 2.山东省农业科学院奶牛研究中心,山东济南 250131)
学科动态
粘着斑激酶FAK基因功能研究进展*
马 勇1,2,鞠志花2,王秀革2,张 燕2,王长法2*,刘树真*
(1.山东师范大学 生命科学学院,山东 济南 250014; 2.山东省农业科学院奶牛研究中心,山东济南 250131)
粘着斑激酶FAK是一类胞质非受体蛋白酪氨酸激酶,有细胞粘附、凋亡、分化、迁移/移动、细胞周期进程及连接重建等功能。论文概述了FAK的结构、蛋白定位和FAK的几种可变剪切体的形式,重点阐述了FAK与肿瘤的关系,FAK在生殖和早期发育方面的作用,对FAK在肿瘤研究以及生殖方面研究提出了有意义的方向。
FAK;肿瘤促进;生殖
粘着斑激酶( focal adhesion kinase,FAK)是一类胞质非受体蛋白酪氨酸激酶(protein tyrosine kinase PTKs),属于蛋白酪氨酸激酶超家族,FAK在细胞信号转导中发挥重要作用,它是胞内外信号出入的中枢,介导多条信号通路。FAK可以接受来自整合素、生长因子以及机械刺激等的信号,激活胞内PI3K/Akt、Ras/MAPK 等信号通路,调节细胞生长。FAK还与胚胎发育、肿瘤发生与迁移有关。Ryu关于转移性乳腺癌细胞的研究表明:miR-708能靶向结合内质网蛋白neuronatin(NNAT),降低细胞内钙离子水平,导致ERK和FAK活性的降低,从而降低细胞迁移,降低肿瘤的转移[1]。FAK作为细胞粘附和细胞移动起作用的信号分子在血睾屏障中也起到重要作用。精卵受精需要完成一系列事件,涉及到信号转导途径,参与这些途径的一系列酪氨酸蛋白激酶的表达明显高于其它细胞。本文对FAK的结构和蛋白定位以及FAK在肿瘤、生殖和早期发育方面的作用进行概述。
1 FAK基因家族的结构及其蛋白的定位研究
1.1FAK的表达和蛋白定位
目前,FAK家族共有两个成员,PTK2(FAK)和Pyk2(proline-rich tyrosine kinasen 2, Pyk2)。Pyk2蛋白与FAK蛋白有48%的相同氨基酸,这两种激酶都不含SH2和SH3结构,属于非受体酪氨酸激酶。FAK几乎表达于所有的细胞和组织类型,在睾丸和脑中高表达。FAK最先在v-Src[2]和BALB/c3T3[3]成纤维细胞转化来的鸡胚胎细胞中被发现,它是一种非受体125 kDa酪氨酸激酶,因其定位在粘着斑上所以命名为粘着斑激酶,它还具有酪氨酸激酶活性,能在受到原癌基因产物和胞外基质-整合素的刺激后发生磷酸化。组织特异性表达的该基因RNA经可变剪切可产生不同自身磷酸化率的FAK的亚型,在脊椎动物中高度保守[4-6]。为了便于区分,将没有增添额外外显子的FAK定为标准亚型,命名为FAK0,在903残基之后插入的三个残基的FAK亚型称为FAK+[7-8],在392残基之后插入六个额外的残基(box6)称为FAK6,在411位置之后插入7个残基(box7)的称为FAK7,FAK6+7是指上述三种残基插入均有,FAK+6,7,28是指在靠近N末端增添额外的28个残基。FAK6+7插入的两个短肽(box6和box7)在Tyr-397的两边,是在神经细胞中表达的主要亚型,在啮齿动物的海马中,该亚型能够被几种神经递质或者神经调质刺激从而自磷酸化,显示该亚型在神经元的发育和突触的可塑性方面可能起重要作用。所有的亚型在细胞和体外都能自磷酸化,当Tyr-397被磷酸化后可募集Src家族激酶磷酸化FAK的其它残基如Tyr-576和Tyr-577,从而增加FAK活性,Tyr-925的激活又为含有SH2结构域的Grb2蛋白提供结合位点,从而通过Ras途径介导ERK1/2的激活。可变剪切还改变了FAK的自磷酸化率,细胞转染和免疫沉淀激酶测试(CITIK assays)结果显示FAK+与FAK0有相同的自磷酸化能力,FAK+6,7与FAK+6,7,28的自磷酸化能力增加,Boxes 6和7都有助于自磷酸化能力的增强[9],单独box7比单独的box6具有更强的自磷酸化能力。研究表明FAK的N末端的删除能够增加酪氨酸的磷酸化活性和FAK的自磷酸化活性[10-11],说明FAK的N末端FERM/JEF区域对于FAK的分子间自磷酸化有抑制作用。文献来源研究结果还表明FAK+的自磷酸化是由于分子间的反应,且FAK+的二聚化足以引起Tyr-397的磷酸化。而FAK+6,7除了有分子间的磷酸化能力还存在分子内的自磷酸化能力,并且对于N末端的抑制没有那么敏感。在转染的COS-7细胞中,C末端区域的删除能够阻止FAK+的Tyr-397的磷酸化,但对于FAK+6,7,28没有影响。表明环绕在Tyr-397位点额外的残基序列的增加改变了FAK的自磷酸化机制。
1.2FAK的结构
FAK是一种非受体125 kDa酪氨酸激酶,由1028个氨基酸组成,结构上可分为4个功能域:在N端附近的FERM区域、中央催化激酶域、三个富含脯氨酸的区域PRI, PRII, PRIII和在C末端附近的粘着斑目标域(focal adhension targeting sequence FAT)(图1)。FAK的羧基端存在多个可与细胞骨架蛋白和信号转导蛋白结合的位点,其功能可能是将多种蛋白聚集在一起。在FAK羧基末端的150个氨基酸中包含一个粘着斑定位序列,对于FAK与粘着斑相连是充分而且又必要的序列。已知FAK有6个可以磷酸化的位点:Tyr-397, -407, -576, -577,-861和 -925,其中Tyr397是主要的自身磷酸化位点,FAK的N末端附近和整合素受体如β1整合蛋白相互作用介导构象变化暴露Tyr-397位点,创造出与不同的调节蛋白如Src家族激酶、PI-3K,PLC-γ,Grb7,PTEN,和Nck-2结合的位点(图1)。因此这些蛋白的SH2结构域可以与FAK结合。然而,尽管整合蛋白没有内在催化活性,它和FAK的相互作用和接下来它的配体和整合蛋白的耦合能介导下游信号影响细胞功能。事实上,在体外支持细胞-精子细胞共培养中[12],p-FAK-Tyr397在结构上可以和β1整合蛋白、粘着斑蛋白、c-Src通过建立起来的锚定连接(桥粒连接、ES)相互作用。其它的五个磷酸化位点是Src家族激酶的靶位结合位点,通过这五个磷酸化位点的任何一个激活FAK介导内在激酶活性,或者募集调节蛋白、信号蛋白到FAK来影响细胞功能。例如,FAK激酶域内的Tyr-576 和 Tyr-577的磷酸化提高它的内在激酶催化活性,被磷酸化的Tyr925可以与接头蛋白Grb2 结合, 作为一个配体募集Sos与FAK相互联系,激活下游ERK1/2、JNK、MAPK信号事件,有助于FAK介导的细胞生长和细胞生存。最后,FAK的FAT能够与桩蛋白、踝蛋白及信号蛋白Stat-1相互联系。FAT也能够通过桩蛋白将FAK连接到整合蛋白(图1)。
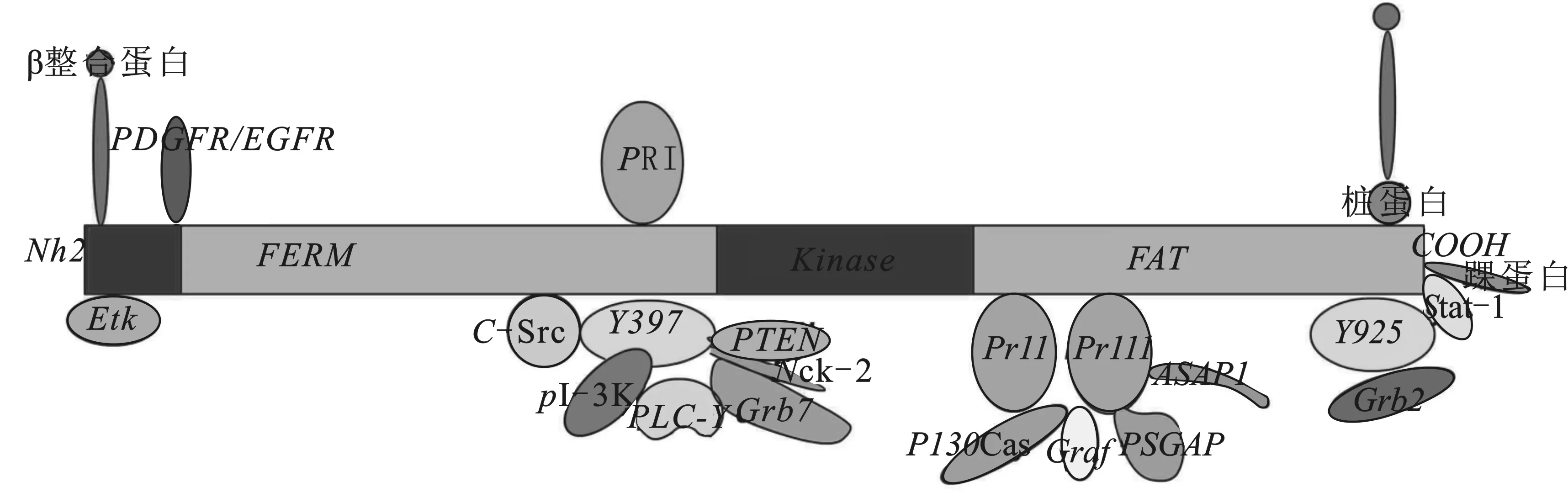
图1 FAK结构及不同功能领域模式示意图[13]
2 FAK的功能
FAK作为一种高酪氨酸磷酸化的蛋白定位在整合素丰富的细胞粘附位点,是整合素介导的信号转导通路的调节者,可调节细胞表达、粘附、凋亡、分化、迁移/移动、细胞周期进程、连接重建及不同上皮细胞的紧密连接渗透性,大量研究显示FAK在肿瘤细胞中的表达量上升,说明FAK在肿瘤细胞中起到一定作用。然而,FAK在睾丸中的表达量比非性腺组织要高20~100倍[14],提示FAK在生理生殖和早期胚胎发育可能有重要作用。
2.1FAK与肿瘤
FAK在细胞增殖和生存过程中起作用大都是通过体外培养的细胞系研究证明的。中国仓鼠卵巢细胞的FAK的过表达导致了细胞周期中G1到S期的加速转变,增加了细胞周期素D的表达,表明了FAK在促进细胞增殖方面的作用[15]。Zhao等[16]报道FAK在纤维母细胞的过表达促进了ERK的激活,加速了细胞周期进程,Western blot显示星形细胞瘤中细胞周期蛋白D和E表达上升,为了探究肿瘤组织中FAK的下游信号或许对FAK的活性增强有影响,发现在肿瘤组织中主要表达Shc的52-kDa亚型,而在正常组织中主要表达Shc的46-kDa亚型,这两种亚型在序列、区域及功能方面的同源性都很高,在正常组织与在肿瘤组织中表达不同的亚型意义不明确。此外,肿瘤组织中的FAK和磷酸化的Shc可发生免疫共沉淀现象,但非肿瘤脑组织中FAK却不能和磷酸化的Shc发生免疫共沉淀现象,这和体外研究的恶性星形细胞瘤的FAK的表达和Shc与FAK的联系增强的结果是一致的。Burgaya等通过SDS-PAGE电泳检测发现在正常成年大鼠脑组织的FAK蛋白因为在自磷酸化位点有3个外显子的插入[17],电泳位置在129 kDa处。这些研究者用含有FAK可变剪切的片段转染在体外培养的COS-7细胞,结果发现酪氨酸397的磷酸化水平提高。用体外FAK转染COS细胞研究发现,自磷酸化位点的可变剪切体的表达能够抑制Src对FAK酪氨酸397位点的磷酸化[18]。而Timothy的研究表明在缺乏可变剪切的肿瘤样品与存在可变剪切的非肿瘤组织相比却表现出高4倍的FAK磷酸化水平,因而FAK是否存在可变剪切体或许可作为恶性星形细胞瘤的诊断标志。Agochiya等[19]发现人的几种肿瘤细胞系的FAK水平的升高和这几种细胞的FAK基因的扩增相关,FAK基因位于人的8号染色体上,扩增时与FAK临近的c-myc基因也扩增,FAK基因的扩增可能促进了FAK蛋白的表达。Western blot分析表明FAK蛋白在一级肿瘤中磷酸化水平很低,ERK-2的活性也很低,从而FAK活性很低,所以肿瘤细胞的增殖迁移能力都很低,这也就是为什么早期肿瘤易于治疗而晚期肿瘤因为FAK表达量高使得肿瘤细胞易于转移而难以治疗的一个原因所在。上述研究表明FAK蛋白在多种肿瘤组织中的表达水平升高,伴随着酪氨酸激酶生长因子受体的激活和升高,导致FAK、Src活性的升高以及Shc磷酸化的增加,ERK的激活,促进肿瘤细胞的增殖。
2.2FAK在生殖和早期胚胎发育方面的作用
2.2.1FAK与血睾屏障(blood-testis barrier,BTB) 在雄性哺乳动物的睾丸中,存在一种重要的屏障结构-血睾屏障。血睾屏障在生理上将生精上皮分为两个腔室:基底小室和近腔小室。基底小室内主要有精原细胞和早期精母细胞,而近腔小室有精子发生过程中各个阶段的生精细胞。前细线期精母细胞必须穿过血睾屏障才能进入近腔小室,该过程涉及多种分子及相关的信号传导通路。免疫组化和免疫荧光研究结果显示FAK存在于生精上皮周期血睾屏障的所有阶段,但在生精上皮周期的阶段八初级精母细胞经过BTB处时,BTB处的FAK大大减少,表明FAK可能是BTB完整性的调节成分。免疫共沉淀显示FAK是在BTB处的occludin/zonula occludens-1蛋白复合物的组成成分,免疫共染睾丸切片显示FAK与occludin/ZO-1共定位[20]。当用镉处理血睾屏障而导致BTB最终破坏时,检测到FAK与闭合蛋白(occludin)和ZO-1的联系的瞬间增加[21],表明FAK对occludin和ZO-1的磷酸化的增加导致BTB的紊乱。为研究FAK的重要性,在体外培养FAK敲除的支持细胞,支持细胞建立紧密连接屏障结构和basal ectoplasmic specialization(basal ES)超微结构,当跨膜电阻经过支持细胞的时候,敲除FAK的支持细胞建立起来的紧密连接屏障丢失,这种屏障功能的丢失伴随着occludin和Junctional adhesion molecule A(JAM-A)在支持细胞分布的变化,可能因为蛋白质内吞作用的提升,使得这些蛋白质从细胞-细胞接触面移到细胞质。FAK的敲除导致occludin的Tyr(P<0.05)和Ser(P<0.01)的磷酸化降低,但Thr的磷酸化没有降低,这和先前的研究报道,FAK调节闭合蛋白的磷酸化,使得磷酸化的闭合蛋白能够募集到BTB组装成紧密连接纤维,从而保持BTB的完整性[22-23]结论一致。FAK及时调节BTB“开”、“关”,从而促进精子发生过程中生精上皮周期处于阶段八的前细线期精母细胞通过血睾屏障进入近腔室中。在生精上皮周期期间BTB必须保持“关闭”状态(图2右顶端),然而,当外部刺激、雄激素/雄激素受体水平的降低、睾丸暴露于环境毒物(如镉)等这些情况都能介导FAK从occludin/ZO-1蛋白复合体分离或者功能丧失。这会导致FAK对闭合蛋白occludin的磷酸化水平降低,引起内吞作用和内吞作用介导的蛋白质降解的加速,导致BTB不稳定允许BTB“打开”,从而使得在生精上皮周期中发育到阶段八的前细线期精母细胞进入近腔室(图2)。
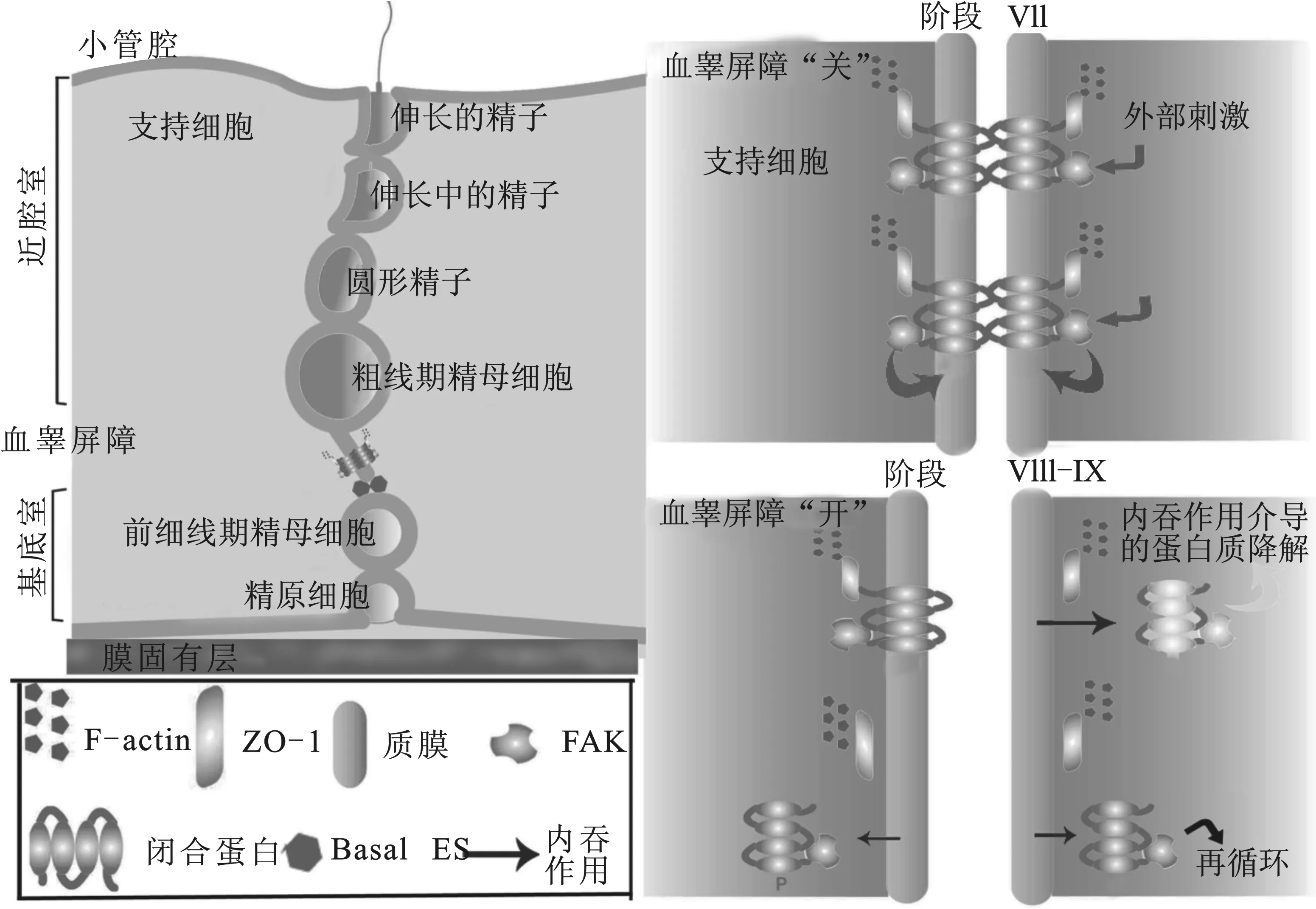
图2 FAK-闭合蛋白-ZO-1蛋白复合物(左)调节睾丸BTB的重建示意图[24]
在上皮细胞周期中,阶段I-VII(右图顶端),FAK使得位于BTB的紧密连接纤维处的闭合蛋白保持最优的磷酸化状态。然而,外界刺激如在阶段VIII-IX由精子或者支持细胞释放的细胞因子或者外界毒物(如镉),介导闭合蛋白的脱磷酸化,引起复合物从ZO-1的分离和重新分布,或许是通过内吞作用介导的,使得BTB不稳定(右图底部)。
晚期精母细胞进入近腔室,经历减数第一次分裂和第二次分裂之后形成圆形精子。圆形精子经历形态变化和1-19(在大鼠中经历19个步骤,在小鼠中经历16个步骤,在人中经历6个步骤)个步骤分化后成为完全成熟的精子[25]。而在步骤8-19的精子和支持细胞之间出现一种新的特有的锚定连接形式称为apical ectoplasmic specialization (apical ES)[26-28]。有研究报道在apical ES存在一种FAK-p130Cas -DOCK180-RhoA-vinculin信号蛋白复合物,也是一种以β1整合蛋白为基础的粘附复合物。免疫组化显示除了p-FAK-Tyr397 和 p-FAK-Tyr576,β1整合蛋白、p130Cas、RhoA 和 vinculin在生精上皮周期中都是阶段特异性表达。β1整合蛋白结合到p-FAK,创建了一个独一无二的蛋白质复合物β1整合蛋白-p-FAK-p130Cas-DOCK180-RhoA-vinculin。这一复合物的产生,或许是通过激活FAK的Tyr397和Tyr576位点而募集p130Cas、Dock180和粘着斑蛋白,同时这一过程也涉及Crk、R-ras和Grb2激活RhoA,共同调节apical ES以肌动蛋白丝束为基础的细胞骨架网络,通过和其它肌动蛋白质,共同调节肌动蛋白丝束的“可塑性”和“流动性”,来调节apical ES的“粘附”和“脱粘附”,协调精子发生过程中发育中的精子能及时通过生精上皮。从而促进精子发生过程中的细胞事件进行。P-糖蛋白( P-glycoprotein)隶属于ABC转运蛋白超家族,是研究最为透彻的一员,主要功能是防止机体对外来有害物质的摄入。P-糖蛋白和FAK都定位在BTB支持细胞中[29],FAK是闭合蛋白/ZO-1复合物的组成成分,该复合物能够通过磷酸化BTB处的闭合蛋白来调节细胞粘附。体外培养支持细胞3天后建立功能性紧密连接屏障,免疫共沉淀发现P-糖蛋白可和FAK结构上相互作用,然后用RNA干扰技术敲除P-糖蛋白,发现闭合蛋白几乎和ZO-1失去联系,但是和FAK的相互作用增加。FAK能够使闭合蛋白的丝氨酸和苏氨酸磷酸化位点的磷酸化分别降低和增加,但酪氨酸磷酸化不变,在P-糖蛋白敲除后FAK和闭合蛋白的相互作用增加,改变了闭合蛋白正常的磷酸化状态,使得BTB处支持细胞之间的粘附连接降低,从而引起支持细胞紧密连接屏障的瞬间干扰。而P-糖蛋白敲除后,闭合蛋白/ZO-1复合物失去平衡,从而导致闭合蛋白和ZO-1蛋白-蛋白相互作用的丢失,也导致支持细胞粘附的丢失,从而干扰支持细胞紧密连接功能。总之,P-糖蛋白能与FAK发生作用从而产生Occludin/ZO-1/FAK/P-糖蛋白调节复合体。将P-糖蛋白基因敲除后会使支持细胞之间的血睾屏障紧密连接出现漏洞,其机制是通过改变由FAK引起的闭合蛋白/ZO-1的蛋白质复合物的磷酸化状态,进而影响内吞蛋白囊泡状态并弱化屏障作用来实现。
2.2.2FAK与精子释放 排精是成熟精子从支持细胞释放的过程。在早期排精之前,精子是靠apical ES粘附到支持细胞。先前研究显示ES这种粘附连接,在精子释放前30 h会被移除,推测还有一种新的未被识别的粘附连接调节精子释放[30]。免疫组化分析表明,α6整合蛋白和FAK的磷酸化形式FAK-Tyr397,在ES移除之后直到精子释放,一直存在于晚期精子和支持细胞之间。这两种蛋白都和激素介导的排精失败导致的精子保留有关。β1整合蛋白可能是调节精子与支持细胞分离复合物的一个组成成分,它存在于精子释放期间,还存在于ES移除之后,直到精子与支持细胞分离,它都存在于精子头部的背面。在成年大鼠体内由于激素抑制的保留精子(未被成功释放的精子)处能够看到。ILK和FAK是两种存在于睾丸中与β1整合蛋白介导的细胞粘附作用的两种激酶[31](图3)。免疫定位研究表明FAK并不存在于排精位点,但用抗FAK特定磷酸化形式的抗体进行研究,发现它的磷酸化形式P-FAK在排精期间存在于精子周围,能与β1整合蛋白免疫共沉淀。免疫组化显示,在排精期间,FAK-Tyr397存在于阶段七、阶段八、第19步骤中,环绕精子头的背侧。α6整合蛋白、β1整合蛋白、FAK-Tyr397这些蛋白存在于精子释放的最后时刻,也存在于性激素抑制的未被释放的精子周围,表明这些蛋白在精子释放期间起着重要作用(图3)。性激素抑制而导致的精子释放失败也说明激素可调节α6β1整合蛋白和磷酸化FAK的复合物释放精子。
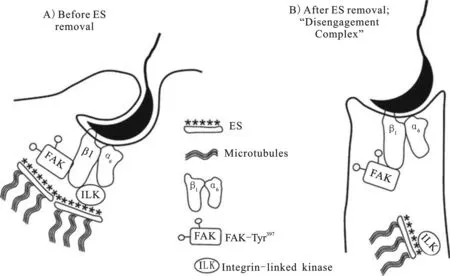
图3 相关分子参与的精子分离的示意图[32]
(A)在阶段VII期间,ES连接和相关的微管相联系。α6β1整合蛋白存在于支持细胞的质膜,支持细胞的质膜还和精子的背侧相联系,磷酸化的FAK和整合蛋白相关的激酶ILK大概通过β1整合蛋白与之相联系。(B)在阶段VIII精子分离之前ES连接连同ILK一同被移走。相反,包含有磷酸化FAK以及α6β1整合蛋白的“分离复合物”存在于精子和支持细胞之间,微管存在于支持细胞胞质茎中,但此时却和精子没有联系。
2.2.3FAK与精子获能 精子获能对于哺乳动物是成功受精的关键,精子获能的标志之一就是酪氨酸磷酸化(PY)的全面增加[33]。为了探究FAK家族蛋白是否参与种马精子的酪氨酸磷酸化过程,González-Fernández等将不同浓度(1 μM, 5 μM 和10 μM)的FAK抑制剂 (PF-431396)[34],分别添加到不含钙和含钙但不含钙调抑制剂的两组培养基中,结果显示两组的酪氨酸磷酸化的增加都被抑制[35]。在不含钙和含钙但不含钙调抑制剂的两组培养基中均能检测到PTK2和PTK2B的磷酸化,但在添加了FAK抑制剂的上述两种培养基中,FAK家族的两种蛋白的磷酸化都被抑制。上述结果显示FAK家族蛋白参与了种马精子的获能,研究结果还表明在种马精子中有两种独立的途径介导酪氨酸磷酸化,PRKA途径和不涉及PRKA的钙刺激途径。此外,在大鼠血管平滑肌细胞中,PTK2B可被CAMK2激活[36],所以人们推测CAMK2是PRKA的靶标,CAMK2作为PRKA和FAK的信息传递者,FAK是PRKA途径和钙刺激途径的作用位点。PRKA途径和钙刺激途径在获能条件下有很多蛋白经历酪氨酸磷酸化,所以激酶特异性对选择性细胞信号是关键的,FAK或许是这两种途径下游的其它酪氨酸激酶的激活剂。
2.2.4FAK与卵母细胞成熟FAK的激酶活性起初是在斑马鱼卵母细胞中被检测到[37],FAK在卵母细胞中高表达,主要定位在卵母细胞皮质[38]。免疫复合物激酶测试表明,斑马鱼卵母细胞中总FAK激酶活性在受精时下降百分之五十。通过磷酸特异性位点的抗体可检测到在减数第二次分裂后期卵母细胞皮质的局部性激活,表明虽然FAK的总体活性在受精后下降,但是却可能激活了局部的FAK激酶池。Steven Pelech等[39]在猪卵母细胞成熟过程中用抗体微阵列分析信号转导蛋白的表达和磷酸化,发现从GV期到MI期FAKSer-732 的磷酸化降低30%。相比之下,从MI到(减数第二次分裂)MII期间FAKSer-722、FAKSer-732磷酸化的分别增加60%、46%,用牛的卵母细胞做了抗体微阵列分析,发现猪和牛的卵母细胞FAKSer-722的磷酸化增加具有一致性变化。FAKSer-722的免疫印迹结果和抗体微阵列分析结果一致,说明从MI期到MII期FAK的磷酸化增加,FAK蛋白激酶磷酸化参与卵母细胞的减数分裂周期的调控。
2.2.5FAK与早期胚胎发育 在小鼠早期胚胎发育过程中如缺乏FAK会死亡,表明了FAK的重要生理意义。FAK在早期发育过程中高度磷酸化,FAK在正常胚胎中的表达无所不在,但在中胚层中的表达尤为强烈。以FAK敲除的小鼠作为实验材料,发现交配后第7.5天时(E 7.5)胚胎仍表现正常,开始形成正常的原肠胚,但到E 8.0的胚胎就表现异常,而且体外培养E 8.0胚胎的细胞迁移性下降,粘着斑位点的数目增多,表明FAK参与了粘着斑位点的更新[40],到E8.5的胚胎异常表现特别明显,前后轴的发育明显弱化,中胚层发育缺陷,头部间质内卷消失,不能形成脊索和体节。在非洲爪蟾的早期胚胎的细胞质、细胞核和细胞膜中检测到FAK,而磷酸化的FAK几乎只存在于细胞膜上。FAT对于FAK靶定到粘着斑位点是必要的,但研究表明单独的FAT或者FERM都不能使得FAK结合到胚胎细胞的细胞膜上[41]。已有证据表明FAK在粘着斑位点的更新过程中通过Rho的激活和抑制发挥了关键作用,FAK的FERM区域和发动蛋白2的相互作用促进了依赖微管的粘着斑位点的分解[42-45]。FAK敲除的小鼠表型和纤连蛋白及整合蛋白α5敲除的小鼠表型相似,也表现出中胚层衍生组织的缺陷,前后轴的缩短,和异常血管组织的发育。FAK敲除和纤连蛋白(FN)及整合蛋白α5敲除的表型相似,表明了FAK介导早期胚胎发育过程中的FN-整合蛋白信号。这些相互作用的干扰会导致径向夹层的失败和动物极深层外胚层细胞的极性的丢失,这两个过程都是外包需要的,形态发生运动使得在原肠胚形成结束时外胚层变薄和扩展将整个胚胎包括进去[46]。Fonar等研究表明FAK在神经胚形成过程中调节Wnt3a的表达和细胞命运的特化[47];Doherty等研究表明FAK在非洲爪蟾的心脏发生过程中扮演重要角色[48];Petridou[49]等构造了一个包含FAK的FERM和C末端(FRNK)的结构,命名为FF。在非洲爪蟾胚胎内,FF主要定位在细胞-细胞接触面。实验结果表明FERM对于募集FAK到新生粘附位点起作用,而且对于调节FAK对粘附斑位点的亲和力和动态也是重要的;FF能将磷酸化的FAK从粘着斑位点替换掉,体现了FF的显性抑制活性;表达FF的细胞与对照组相比,粘着斑位点的数量和强度显著增加,表明FF导致粘着斑位点更新的显著降低,从而降低了细胞迁移;FF的表达导致了囊胚腔顶的加厚,外包和径向夹层被阻断,从而干扰外包过程,外包也可能与FF降低细胞迁移相关;FF表达导致了严重的原肠胚形成的缺陷,胚孔的关闭;胚胎的变小,弯曲和严重缩短,并导致大多数实验胚胎在蝌蚪期死去。关于FAK在多种多样的发育过程的作用还有待于未来进一步的研究。
[1] Ryu S, McDonnell K, Choi H, et al. Suppression of miRNA-708by polycomb group promotes metastases by calcium-induced cell migration[J].Cancer Cell, 2013,23(1):63-76.
[2] Schaller M D, Borgman C A, Cobb B S, et al. pp125FAK: a structurally distinctive proteintyrosine kinase associated with focal adhesions [J]. Proc Natl Acad Sci USA,1992,89(1):5 192-5 196.
[3] Hanks S K, Calalb M B, Harper M C, et al. Focal adhesion protein-tyrosine kinase phosphorylated in response to cell attachment to fibronectin [J]. Proc Natl Acad Sci USA,1992,89(8): 8 487-8 491.
[4] Burgaya F, Girault JA. Cloning of focal adhesion kinase from rat stiatum reveals multiple transcripts [J]. Mol Brain Res,1996,37(1-2):63-73.
[5] Burgaya F, Toutant M, Studler J M, et al. Alternatively spliced focal adhesion kinase in rat brain with increased autophosphorylation activity [J]. J Biol Chem,1997(272):28 720-28 725.
[6] Hens M D, DeSimone D W. Molecular analysis and developmental expression of the focal adhesion kinase pp125FAK in Xenopus laevis [J]. Dev Biol,1995,170(2)274-288.
[7] Derkinderen P, Toutant,M. Burgaya F,et al. Regulation of a neuronal form of focal adhesion kinase by anandamide [J]. Science 1996(5282):1 719-1 722.
[8] Menegon A, Burgaya F, Baudot P, et al. FAK+ and PYK2/CAK,two related tyrosine kinases highly expressed in the central nervous system: Similarities and differences in the expression pattern [J]. Eur J Neurosci,1999,11(11):3 777-3 788.
[9] Toutant M, Studler J M, Burgaya F,et al. Autophosphorylation of Tyr397 and its phosphorylation by Src-family kinases are altered in focal-adhesion-kinase neuronal isoforms.[J]. Biochem J,2000(1):119-128.
[10] Chan P Y. KannerS B, Whitney G. et al. A transmembrane-anchored chimeric focal adhesion kinase is constitutively activatedand phosphorylated at tyrosine residues identical to pp125FAK [J]. J Biol Chem, 1994,269(32):20 567-20 574.
[11] Schlaepfer D D, T Hunter. Evidence for in vivo phosphorylation of the Grb2 SH2-domain binding site on focal adhesion kinase by Src family protein-tyrosine kinases [J]. Mol Cell Biol,1996,16(10):5 623-5 633.
[12] Siu M K Y, Mruk D D, Lee W M, et al. Adhering junction dynamics in the testis are regulated by an interplay of β1-integrin and focal adhesion complex (FAC)-associated proteins. [J]. Endocrinology, 2003,144(5):2 141-63.
[13] Cheng F Y, Mruk D F D. Regulation of blood-testis barrier dynamics by focal adhesion kinase (FAK): an unexpected turn of events. [J]. Cell Cycle. 2009,8(21):3 493-3 499.
[14] Ilic D, Damsky C, Yamamoto T. Focal adhesion kinase:at the cross-roads of signal transduction [J]. Cell Sci,1997,110(4):401-407.
[15] Zhao J, Reiske H,Guan J L. Regulation of the cell cycle by focal adhesion kinase[J]. Cell Biol,1998,143(17):1 997-2 008
[16] Zhao J, Zheng C,Guan J L. Pyk2 and FAK differentially regulate progression of the cell cycle. [J]. Cell Sci,2000,113(117):3 063-3072.
[17] Burgaya F, Toutant M, Studler J M, et al. Alternatively spliced focal adhesion kinase in rat brain with increased autophosphorylation activity [J]. J Biol Chem,1997,272(45):28 720-28 725.
[18] Toutant M, Studler J M, Burgaya F, et al. Autophosphorylation of Tyr397 and its phosphorylation by src-family kinases are altered in focal adhesion kinase neuronal isoforms[J]. Biochem J,2000(1): 119-128.
[19] Agochiya M, Brunton V G, Owens D W, et al. Increased dosage and amplification of the focal adhesion kinase gene in human cancer cells [J]. Oncogene, 1999,18(41): 5 646-5 653.
[20] Siu E R, Wong E W P ,Mruk D D ,et al. An occludin-focal adhesion kinase protein complex at the blood-testis barrier:a study using the cadmium model [J]. Endocrinology 2009,150(17):3 336-3 344.
[21] Siu E R, Wong E W P ,Mruk D D ,et al. Focal adhesion kinase is a blood-testis barrier regulator [J]. Proc Natl Acad Sci USA,2009,106(23):9 298-9 303.
[22] Sakakibara A, Furuse M, Saitou M, et al. Possible involvement of phosphorylation of occludin in tight junction formation [J]. J Cell Biol,1997,137(6):1 393-1 401.
[23] Tsukamoto T, Nigam S K. Role of tyrosine phosphorylation in the reassembly of occludin and other tight junction proteins [J]. Am J Physiol,1999,27(6):737-750.
[24] Siu F R, Wong E W, Mruk D D,et al.DFocal adhesion kinase is a blood-testis barrier regulatorProc Natl Acad[J]. Sci USA. 2009,106(23):9 298-9 303.
[25] Cheng C Y, Mruk D D. A local autocrine axis in the testes that regulates spermatogenesis [J] . Nature Rev Endocrinol 2010,6(7):380-395.
[26] Wong E W,Mruk D D, Cheng C Y. Biology and regulation of ectoplasmic specialization, an atypical adherens junction type,in the testis[J] . Biochem Biophys Acta,2008,78(3):692-708.
[27] Toyama Y, Maekawa M, Yuasa S. Ectoplasmic specializations in the Sertoli cells:new vistas based on genetic defects and testicular toxicology [J] . Anat Sci Int,2003,78(1):1-16.
[28] Vogl A, Pfeiffer D, Mulholland D, et al. Unique and multifunctional adhesion junctions in the testis:ectoplasmic specializations.[J] . Arch Histol Cytol,2000,63(1):1-15.
[29] Beardsley A, O'Donnell L. Characterization of normal spermiation and spermiation failure induced by hormone suppression in adult rats [J]. Biol Reprod, 2003,68(4):1 299-1 307.
[30] Hannigan G E, Dedhar S. Protein kinase mediators of integrin signal transduction [J]. Mol Med,1997,75(1):35-44.
[31] Chapin R E, Wine R N, Harris M W, et al. Structure and control of a cell-cell adhesion complex associated with spermiation in rat seminiferous epithelium.[J]. Andrology,2001,22(6):1 030-1 052.
[32] Beardsley A, Robertson D M, O'Donnell L. A complex containing alpha6beta1-integrin and phosphorylated focal adhesion kinase between Sertoli cells andelongated spermatids during spermatid release from the seminiferous epithelium [J]. Endocrinol,2006 ,190(3):759-770.
[33] Naz R K, Ahmad K, Kumar R. Role of membrane phosphotyrosine proteins in human spermatozoal function.[J] . Cell Sci,1991,99 (1): 157-165.
[34] Tse K W, ng-Lawson M, Lee R L, etal. B cell receptor-induced phosphorylation of Pyk2 and focal adhesion kinase involves integrins and the Rap GTPases and is required for B cell spreading.[J] . Biol Chem,2009,284(34):22 865-22 877.
[35] Lauro González-Fernández, Beatriz Macías-García, Shavahn C. Loux, etal.Focal adhesion kinases and calcium/calmodulin-dependent protein kinases regulate protein tyrosine phosphorylation in stallion sperm1.[J]. Biol Reprod,2013,88(6):138.
[36] Ginnan R, Singer H A. CaM kinase II-dependent activation of tyrosine kinases and ERK1/2 in vascular smooth muscle. [J]. Am J Physiol Cell Physiol,2002,282(4): C754-C761.
[37] Tsai W B, Zhang X, Sharma D, et al.Role of Yes kinase during early zebrafish development. [J].Dev Biol,2005.277(1):129-141.
[38] McGinnis L K, Carroll D J, Kinsey W H.Protein tyrosine kinase signaling during Oocyte maturation and fertilization.[J].Mol Reprod Dev. 2011,78(10-11):831-845.
[39] Pelech S, Jelinkova L, Susor A, et al.Antibody microarray analyses of signal transduction protein expression and phosphorylation during porcine oocyte maturation.[J] J Proteome Res,2008, 7(7):2 860-2 871.
[40] IliĉD, Furuta Y, Kanazawa S,et al.. Reduced cell motility and enhanced focal adhesion contact formation in cells from FAKdeficient mice. [J]Nature,1995,377:539-544.
[41] Petridou N I, Stylianou P, Christodoulou N, etal.Activation of endogenous FAK via expression of its amino terminal domain in Xenopus embryos.[J].PLoS ONE,2012,7(8):42577.
[42] Ezratty E J, Partridge M A,Gundersen G G,Microtubuleinduced focal adhesion disassembly is mediated by dynamin and focal adhesion kinase.[J].Nat Cell Biol,2005,7(6):581-590.
[43] Lim Y, Lim S T, Tomar A, et al.PyK2 and FAK connections to p190Rho guanine nucleotide exchange factor regulate RhoA activity, focal adhesion formation, and cell motility. [J]Cell Biol,2008,180(1):187-203.
[44] Ren X D, Kiosses W B, Sieg D J, et al.Focal adhesion kinase suppresses Rho activity to promote focal adhesion turnover. [J]J Cell Sci. 2000,113 (20):3 673-3 678.
[45] Tomar A,Lim S T,Lim,Y.et al.A FAK-p120RasGAPp190 RhoGAP complex regulates polarity in migrating cells.[J]J Cell Sci,2009,122(11):1 852-1 862.
[46] Keller R E. The cellular basis of epiboly: an SEM study of deep-cell rearrangement during gastrulation in Xenopus laevis.[J].J Embryol Exp Morphol,1980(60):201-34.
[47] Fonar Y, Gutkovich Y E, Root H, et al. Focal adhesion kinase protein regulates Wnt3a gene expression to control cell fate specification in the developing neural plate.[J].Mol Biol Cell,2011,22(13):2 409-2 422.
[48] Doherty J T, Conlon F L, Mack C P,et al.Focal adhesion kinase is essential for cardiac looping and multichamber heart formation.[J].Genesis,2010,48(8):492-504.
[49] Petridou N I,Stylianou P, Skourides PA.A dominant-negative provides new insights into FAK regulation and function in early embryonic morphogenesis.[J].Development,2013,140(20):4266-42 76.
Advances in the FAK Gene Function Research
MA Yong1,2, JU Zhi-hua2,WANG Xiu-ge2, ZHANG Yan2,WANG Chang-fa2*,LIU Shu-zhen1*
(1.CollegeofLifeSciences,ShandongNormalUniversity,Jinan,Shandong250014,China; 2.DairyCattleResearchCenter,ShandongAcademyofAgriculturalScience,Jinan,Shandong250131,China)
FAK is a kind of cytoplasmic non-receptor protein tyrosine kinase which can regulate cell adhesion, apoptosis, differentiation and migration/mobile, cell cycle progression and connection reconstruction, etc. The study briefly reviewed the structure, the protein localization, kinds of variable spliceosome of FAK, illustrated its relationship with tumor, its role in the reproduction and early development, and proposed reasonable predictions for future FAK study in tumour and reproduction research.
FAK; tumor induction;reproduction
2014-07-09,
2014-11-19
国家科技支撑计划项目(2011BAD19BO4);现代农业产业技术体系(编号CARS-37);山东省良种工程项目(2013LZ015-06);山东省自然科学基金项目(ZR2013CQ035)
马勇(1990-),女,山东泰安人,硕士,研究方向:动物学。E-mail:1095407574@qq.com
*[通讯作者] 王长法(1967-)男,江苏淮安人,博士,研究员,研究方向:动物遗传育种与繁殖。E-mail:wangcf1967@163.com刘树真(1972-),女,山东聊城人,副教授,博士,硕士生导师,研究方向:动物发育机理。E-mail:shuzhen26@163.com
S811.6
A
1005-5228(2015)02-0001-08

