鸡BCs原代培养贴壁性影响因素分析*
王 坤,张佰忠,易康乐,蒋 隽,王庆桥,李昊帮,燕海峰,*
(1.湖南光大牧业科技有限公司,湖南 长沙 410131;2.湖南农业大学动物科学技术学院,湖南 长沙 410128;3.湖南天心黄鸡育种有限公司,湖南 长沙 410143)
鸡BCs原代培养贴壁性影响因素分析*
王 坤1,2,张佰忠1,易康乐1,2,蒋 隽2,王庆桥3,李昊帮1,燕海峰1,3*
(1.湖南光大牧业科技有限公司,湖南 长沙 410131;2.湖南农业大学动物科学技术学院,湖南 长沙 410128;3.湖南天心黄鸡育种有限公司,湖南 长沙 410143)
试验从鸡第X期胚胎中分离囊胚,使用含10%FBS、青霉素和链霉素的高糖DMEM培养基,对鸡X期BCs进行无饲养层培养。分别在6 h、12 h、24 h对细胞贴壁性进行评价,探究分离方法、离散程度、培养细胞密度、离心损伤对细胞培养的影响。结果表明:滤纸环法在分离胚胎上效果最好;细胞离散程度上,吹打20下效果最好,与吹打30下差异不显著(P>0.05),二者与吹打40下差异均显著(P<0.05);接种密度上,1×103个/mL和5×103个/mL两组差异不显著(P>0.05),这两组与其它组,以及其它组之间差异均显著(P<0.05),密度为1×105个/mL时效果最好,5×104个/mL次之,但密度为5×104个/mL时更方便观察;离心处理上,都离心5 min的条件下,5 590 ×g和1 398 ×g组差异不显著(P>0.05),但其与224 ×g处理组差异显著(P<0.05),其中5 590 ×g组效果最佳。因此,滤纸环法分离胚胎,吹打20下离散细胞,使用5 590 ×g离心5 min,稀释成5×104个/mL的密度,接种到96孔板培养,可以获得较好的结果。
鸡;X期BCs;原代培养;贴壁性
禽类种蛋产出时,受精卵已发育成为具有内外胚层,总数达4万~6万个细胞的细胞团(即X期囊胚)[1],该时期的细胞称为BCs (Blastodermal cells,BCs)。鸡BCs在禽类生物技术研究领域具有十分重要的作用:第一,它是潜在的鸡胚胎干细胞[2];第二,它是禽类转基因技术研究中的主要靶细胞[3-5];第三,在禽类种质资源保护利用方面,通过解冻BCs制备嵌合体而重新获得活体[6-8],解决无法冷冻保存禽类母系(W)遗传资源的问题。
目前,以上领域的研究与应用的技术瓶颈就是获得BCs,因此建立高效获取BCs方法并优化其冷冻程序就显得尤为重要。目前对囊胚获取与处理过程缺乏细致描述,对BCs活力评价还缺乏简单实用方法,尤其是后者,大部分文献报道的台盼蓝染色法[5-9],经本研究室应用证明缺乏实用性。细胞培养是研究活组织和活细胞的良好方法,也是一切细胞研究的基础。鸡BCs在体外培养时,一部分细胞贴壁生长并最终分化为不同类型的细胞,还有一部分细胞则悬浮聚集分化,形成简单的类胚体。所以通过其贴壁生长的难易程度,可以更加准确的判定其作为潜在胚胎干细胞的活力[10]。
本文通过优化鸡BCs获取及处理过程中几个关键因素,建立一种实用的BCs贴壁培养方法,为解决BCs活力评价方法困境奠定基础,促进BCs在禽类生物技术领域的研究与应用。
1 材料与方法
1.1 试验材料与试剂
白来航鸡种蛋,黑丝羽乌鸡种蛋,由湖南省畜牧兽医研究所提供。麻林香妃黑土鸡种蛋,湖南天心黄鸡育种有限公司提供(58周龄左右,种蛋受精率约为96%)。
96孔平底细胞培养板(LabServ,TC处理,聚苯乙烯,无热源,无菌),倒置显微镜(CK40-F 200,Olympus),离心机(TGL-16C,上海安亭科学仪器厂制造)。
DMEM高糖培养基、胎牛血清(FBS)购于Gibco公司,配制成含10%FBS、双抗(青霉素100 UI/mL和链霉素100 ug/mL)的DMEM生长培养基。
1.2 方法
1.2.1 鸡X期囊胚的分离
1)种蛋储存与消毒
种蛋储存于10~18 ℃,一般采用10 d内的种蛋。用70%酒精擦拭消毒,置于紫外线消毒过的蛋托上,转移到无菌室水平朝上静置30 min左右,备在超净工作台中,取胚按文献[2-7]方法进行操作。
2)药勺获取法按文献[11]操作
3)改进的滤纸环法
使用内孔略大于囊胚的打孔器,制作滤纸环(内外直径差约为1~2 mm),灭菌。根据种蛋大小选取合适培养皿,种蛋保持静止时的方位不变,便于囊胚位于正上面,从底部小心敲破蛋壳,两手从底部破口处,往两侧迅速掰开,内容物快速落入培养皿中,避免蛋壳扎破蛋黄膜。使囊胚位于水平上面,用眼科剪将卵黄膜外囊胚上方的浓蛋清完全剪开,暴露干燥的卵黄膜,用尖嘴小镊子夹取滤纸环,孔正对胚胎,准确贴在卵黄膜上[2]。沿纸环外径边缘小心将卵黄膜剪开,用镊子夹住滤纸环边缘,在盛有0.9%生理盐水的几个培养皿中轻轻摇动,依次漂洗,去除蛋黄及蛋黄膜,直到囊胚从滤纸环上脱离。
4)发环法具体文法按文献[11-12]操作
1.2.2 BCs的培养 囊胚的捡取与转移:用剪去约3 mm的1 mL Tip吸取脱离蛋黄膜的囊胚,转入含生长培养基的液滴中,分离到足够的囊胚(本文每次实验一般取16个胚左右)。
囊胚的离散:用上述方法将每次试验所用胚转移到2 mL 离心管中,添加1 mL生长培养基,每次吸入1 mL再完全排出,反复进行10~40下,制成不同离散程度的细胞悬液。
BCs密度调整:4×104按每个胚平均值5×104个估算[1],通过调整所添加培养基体积,获得密度为1×103~1×105个/mL的不同细胞悬液。
BCs培养:使用96孔板培养,每孔接种悬液200 uL,在37 ℃、5% CO2浓度与95%相对湿度的CO 2培养箱中培养,每24 h半量换液。
1.2.3 不同离散程度对细胞贴壁性影响 每次收集16个胚,按步骤1.2.2描述的细胞离散方法,分10下、20下、30下与40下4个批次,进行不同离散程度细胞悬液的培养,每个批次接种10个孔,按步骤1.2.2描述的方法培养。
1.2.4 不同细胞密度对细胞贴壁性影响 每次收集8~16个胚,采用步骤1.2.2描述的方法离散(吹打次数参考步骤1.2.3的实验结论),按步骤1.2.2描述的方法调整细胞密度为1×103个/mL 、5×103个/mL、1×104个/mL、5×104个/mL、1×105个/mL 5个批次,每批次接种10个孔,按步骤1.2.2描述的方法培养。
1.2.5 不同离心转数对细胞贴壁性影响 实验收集16个胚,按步骤1.2.3描述的方法与优化的结果进行离散处理。将细胞悬液分3个组,分别用224 ×g、1 398 ×g、5 590 ×g离心 5 min,去上清液,用生长培养基稀释,细胞密度参考步骤1.2.4实验的结论,接种在96孔板,每组接种10个孔,按步骤1.2.2描述的方法培养。
1.2.6 细胞培养的观察及数据统计 贴壁细胞呈明显的集落状生长,边缘清晰,细胞间隙不明显,多为梭形或三角性状,未贴壁细胞呈散沙状[13]。
通过两种参数估算培养细胞贴壁率:一是出现贴壁情况的迟早,二是指定时间出现贴壁情况的孔数、每孔出现贴壁细胞的比例(%)。分别在培养6 h、12 h、24 h时,在倒置显微镜下观察细胞贴壁情况并进行记录。使用SAS软件对数据进行分析。
2 结 果
2.1 BCs不同分离方法的比较
试验发现,在分离囊胚的方法中,本文改进的滤纸环法最好,易于掌握,(如图2),操作成功率达到80%以上,分离16个胚平均耗时1.5 h左右。其它分离方法,尽管可达到类似分离效果,但操作效率低。药勺获取法在漂洗时比较难操作,容易漂洗不干净,发环法操作复杂,成功率低。
此外,还发现:1)种蛋越新鲜,胚的质量越好(如图1),分离胚就越容易,而且胚也越完整,越易离散。这可能是随着种蛋储存时间延长,水分蒸发等原因,使囊胚与蛋黄发生黏连所致;2)浓蛋清剪除要彻底,否则,滤纸环就不能紧紧吸住卵黄膜从而吸取囊胚,导致漂洗过程中滤纸环容易脱离,影响囊胚分离质量与效率。

图1 优质胚的种蛋 图2 分离后完整的胚盘
Fig.1 Egg with high quality embryo Fig.2 Complete blastoderm separated
2.2 细胞贴壁性的判断
不同培养时间贴壁细胞所占面积,如图3,A、B、C、D的贴壁率分别为5%、10%、40%、70%。该方法可以较为精确和直观的评定细胞培养情况,但每次观测记录时时间不能太长,不然会影响细胞的生长效果,也容易造成细胞的污染。
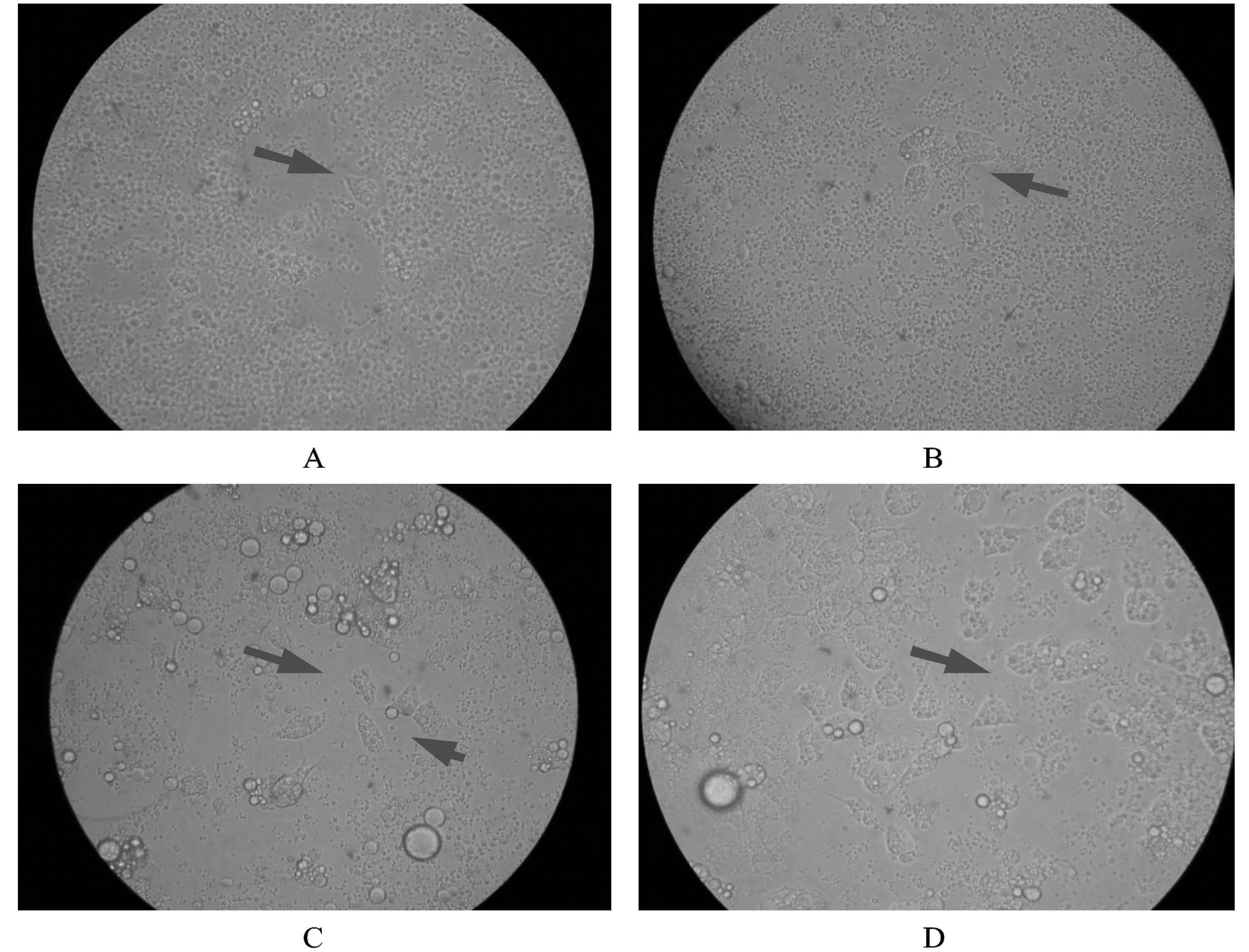
图3 细胞培养不同时间的贴壁效果图(250×)
注:A.培养30min;B.培养6h;C.培养12h;D.培养24h
Notes:A. Cells cultured for 30min; B. Cells cultured for 6h; C. Cells cultured for 12h; D. Cells cultured for 24h
2.3 不同离散程度对细胞贴壁性影响
由表1可知,分别吹打10、20、30、40次会导致培养结果有差异,吹打20次效果最佳,吹打30次差异不显著(P>0.05),但与吹打40次差异显著(P<0.05)。吹打10次时发现仍然有较大胚块的存在,不符合细胞分散培养的要求,未进行贴壁性比较。吹打40次时,细胞基本不贴壁,前期极少数贴壁的细胞也很快死亡,从显微镜中也只能看到呈散沙状态。
2.4 不同细胞密度对细胞贴壁的影响
由表2可知,接种细胞密度为1×103个/mL与5×103个/mL时差异不显著(P>0.05),其与其余组,以及其余组之间比较的差异均显著(P<0.05)。当接种密度为1×105个/mL时贴壁效果最佳,5×104个/mL次之。但由于接种密度为1×105个/mL时细胞较多,虽然贴壁快,但视野里细胞拥挤,不利于观察。因此建议接种密度为5×104个/mL为宜,贴壁效果好且视野清晰。当接种密度为5×103个/mL或者更低时,细胞的贴壁情况较差,培养6 h后大量细胞很快死亡。

表1 不同离散程度对细胞贴壁性影响
注:同一列中,字母相同表示差异不显著(P>0.05),字母不相同表示差异显著(P<0.05),下同。
Notes:In the same column,the same superscripts meant no significant difference (P> 0.05),different superscripts meant significant difference (P< 0.05),the same as below.
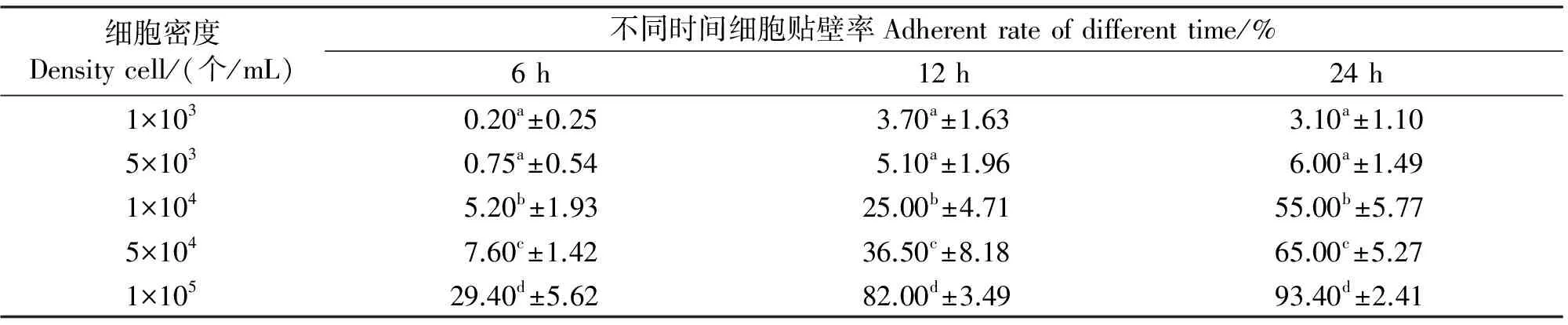
表2 不同细胞密度对细胞贴壁性影响
2.5 不同离心力对细胞贴壁的影响
实验发现,1 398 ×g 和5 590 ×g两组贴壁情况差异不显著(P>0.05),但这两组与224 ×g离心所得的结果都有显著性差异(P<0.05)。5 590 ×g 离心处理的效果最佳,224 ×g离心得到的细胞贴壁效果最差。
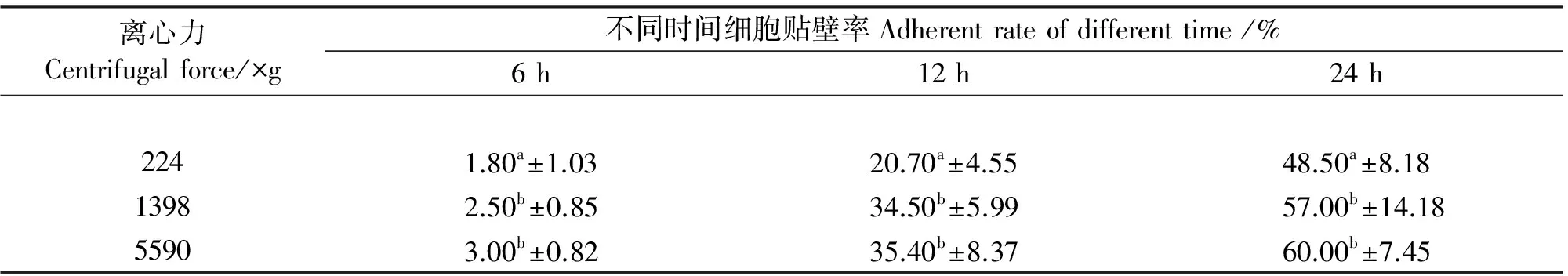
表3 不同离心力处理对细胞贴壁性影响
3 讨 论
3.1 影响细胞培养贴壁性因素
本试验着重对鸡X期BCs的无饲养层体外培养相关操作进行研究,虽然饲养层在BCs的培养过程中起着重要作用,能促进BCs的增殖并抑制其分化[14], 但其本身分泌成分复杂,而且饲养层细胞需经有丝分裂阻断剂处理,即使极微量残留都会对BCs产生毒性[15],给细胞培养增加了许多不确定因素,难以用于BCs分化分子机制的研究[16]。非饲养层培养体系可以减少这些因素的干扰,提高BCs培养的可操作性与可重复性。
BCs是贴壁生长的细胞,细胞能否贴壁是细胞培养成败的关键[17]。采用本文的贴壁性判断方法,通过使用96孔板培养,比以往35 mm培养皿,更容易对细胞贴壁性进行量化判断。实验还发现,培养板的质量也是关键因素。由于贴壁细胞需要伸展在培养材料的表面才能增长,故培养器皿的亲水性直接影响细胞的生长[18]。目前市场上用于培养细胞的一次性耗材都是由聚苯乙烯注塑成型后,再经一些特殊的表面处理(Tissue culture treatment),使其满足一些细胞或组织的贴壁需求。
3.2 囊胚细胞的分散方法
囊胚的分散主要有酶消化与物理分散方法。酶消化通常采用胰蛋白酶和EDAT混合液处理囊胚,物理方法采用吸管反复吹打。从保护细胞活性角度,物理法更合适,这在家鸡胚胎干细胞的培养上能得到较好结果[19]。有实验认为BCs原代培养用物理分散,而传代培养用酶消化能取得较好效果[13]。本试验采用物理消化法分散细胞,发现细胞离散程度密切关系到细胞的贴壁效果,分散的单个细胞较难形成新的集落,而多个细胞簇则易形成,提示相邻细胞间可能存在一定的信号通路,能互相促进生长[20]。也有报道显示,在细胞生长外部条件完全相同的情况下,细胞分散程度不同,会导致不同的增殖倍数,影响细胞产量[21]。
使用物理法对鸡囊胚进行吹打离散的效果,显然与很多因素有关,如胚的数目、培养基的体积、每次吹打吸排的体积、Tip头的种类等,因此本文对这些条件进行了限定,在不同实验条件下,还需要根据本文提供的技术进行适当调整。
3.3 细胞培养密度与离心处理
接种密度影响细胞培养效果,也需随原代或传代培养目的不同而进行调整。有研究发现细胞接种密度是影响细胞传代是否成功的重要因素,首次传代接种密度应该大一些,经传代后的细胞可以适当降低接种密度[22]。实验发现,使用96孔板培养时,接种密度为5×104个/mL效果最佳,贴壁速率快,视野清楚,可以观察到贴壁细胞的形态特征,也容易对比出不同时间段细胞贴壁的变化。接种密度太大,悬浮细胞比较多,影响观察。但有的实验为了促进细胞增殖,就选用较大的接种密度[23]。如果接种密度太小则可能让细胞之间的联系不足[20],导致细胞贴壁较慢,贴壁效果不好。
离心处理,在一定程度上可以去除卵黄及其它非细胞杂质,也可以用来调整细胞密度,但也可能对细胞造成一定机械性损伤[24]。对比离心与未离心培养组也可以发现,虽然视野内杂质较少,但离心处理过的贴壁情况都略差于未离心组,证明离心处理对细胞的确存在影响。本实验发现5 590 ×g离心5 min效果最好,贴壁率最高,而224 ×g离心得到的细胞贴壁效果最差,这可能是由于离心速率小,相同时间(都为5 min)内,细胞没有沉降下来,最终导致细胞密度变小,从而影响细胞贴壁。也有文献指出,离心时转速不宜过高,一般规律是慢速比快速好,变速比匀速好,先慢速后快速更好,不同的转速组合其细胞产量可相差15%[21]。
采用本文优化的条件,培养基成分简单,培养板的价格每块6元左右,但培养细胞起始贴壁时间提前到了30 min。有文献报道BCs早期贴壁时间为4~6 h[2,25],也有培养5~6 h后观察到细胞趋于聚集[16],还有培养24 h才出现细胞集落[11],但他们使用的培养基成份复杂,利用了饲养层,甚至有的还采用繁琐的加盖片培养方法[2]。本试验在优化培养操作技术的同时也很好的简化了培养条件,降低了培养的难度。
4 结 论
本试验表明,使用滤纸环法分离胚盘,机械吹打20下离散细胞,5 590 ×g离心5 min去除杂质,然后将细胞悬液稀释成5×104个/mL的密度,接种到96孔板培养,可以获得较好的结果。本文所建立的BCs高效获取及活力检测方法,为其在禽类转基因技术、冷冻保存母系遗传资源技术中冷冻损伤评价方法等领域的应用奠定了基础。
[1] Zhang Y N,Yang H Y,Zhang Z T,et al.Isolation of chicken embryonic stem cell and eparation of chicken chimeric model[J].Molecular Biology Reports,2013(40):2149-2156.
[2] Yan H F,Lee C Y,Xiao B N,et al .Production of Transgenic Chicken Chimeras via Blastodermal Cells[J].Asian-Australiasian Journal of Animal Science,2005,18(2):158-164.
[3] Bao S Q,Leitch H G,Gillich A,et al.The germ cell determinant blimp1 is not required for derivation of pluripotent stem cells[J].Cell Stem Cell,2012,11(1):110-117.
[4] Koo B C,Kwon M S,Lee H,et al.Tetracycline-dependent expression of the human erythropoietin gene in transgenic chickens[J].Transgenic Research,2010,19(3):437-447.
[5] 杨海燕,孙 敏,田智泉,等.鸡X期BCs电转染外源基因条件的探索[J].中国畜牧杂志,2010,46(23):15-20.
[6] Nakamura Y,Usui F,Miyahar A D,et al.Efficient system for preservation and regeneration of genetic resources in chicken: concurrent storage of primordial germ cells and live animals from early embryos of a rare indigenous fowl (Gifujidori)[J].Reproduction Fertility and Development,2010(22): 1237-1246.
[7] 燕海峰,邓 缘,TREFIL P,等.以黑丝羽乌骨鸡为供体制作家鸡嵌合体的研究[J].激光生物学报,2010,19(4):535-541.
[8] Kino K,Pain B,Leibo S P,et al.Production of chicken chimeras from injection of frozen-thawed blastodermal cells[J].Poultry Science,1997(76):753-760.
[9] Hamidu J A,Rieger A M G,Fasenko M,et al.Dissociation of chicken blastoderm for examination of apoptosis and necrosis by flow cytometry[J].Poultry Science,2010(89):901-909.
[10] Petitte J N,Liu G ,Yang Z.Avian pluripotent stem cells[J].Mechanisms of Development,2004,121(9):1 159-1 168.
[11] 戴建明,何先红,赵文明,等.鸡胚胎干细胞的分离和培养[J].中国畜牧杂志,2007,43(19):15-19.
[12] 吴信生,何先红,戴建明,等.鸡胚胎干细胞分离培养和单细胞克隆的制备[J].中国家禽,2008,30(22):30-34.
[13] 安 静,杜立新.鸡胚胎干细胞的分离、培养和鉴定[J].动物学报,2003,49(5):695-703.
[14] Horiuchi H,Tategaki A,Yamashita Y,et al .Chicken leukemia inhibitory factor maintains c1icken embryonic Stem cells in the undifferentiated state[J].Journal of Biological Chemistry,2004,279(23): 24 514-24 520.
[15] 孙加斌,顾 翔,潘月晴.人胚胎成纤维细胞饲养层的制备[J].中国组织工程研究,2013,17(40):7 096-7 101.
[16] 陈志胜,王丙云,黄文静,等.不同饲养层对鸡胚胎干细胞培养效果的影响[J].生物技术通讯,2010,21(3):416-418.
[17] 艾庆辉,李庆飞,麦康森.鱼类细胞培养技术研究进展[J].鱼类细胞培养技术研究进展,2012,33(3):122-128.
[18] 张样娥. 真空等离子处理与电晕处理的细胞培养皿的培养效果研究[J].科技创新,2012,11(30):9.
[19] 燕海峰,肖兵南,TREFIL P,等.鸡BCs嵌合体制作技术研究及其应用前景[J].遗传,2004,26(4):537-543.
[20] Ohtsuka F S,Dalton S.Molecular and biological properties of pluripotent embryonic stem cells[J]. Gene Therapy.2008,15(2):74-81.
[21] 甘 露,张志辉,吕美娜,等.细胞培养技术[J].中国组织工程研究与临床康复. 2008,12(29):5 739-5 742.
[22] Pan C, Kumar C,Bohl S, et al.Comparative proteomic phenotyping of cell lines and primary cells to assess preservation of cell type-specific functions[J].Molecular & Cellular Proteomics, 2009,8(3):443-450.
[23] 赵志敏,叶永安,王硕仁,等.细胞培养实验中条件培养基相关问题探讨[J].中西医结合肝病杂质,2010,20(1):23-26.
[24] 董 丰,龚开政,张振刚,等.原代心肌细胞培养方法的探讨[J].大连医科大学学报,2001,23(4):307-308.
[25] 陈胜锋,黄文静,陈志胜,等.鸡胚胎干细胞的离体培养与鉴定[J].畜牧与兽医,2009,41(8):62-64.
Factors Affecting the Adherent Rate of Primary Cultured Chicken Blastodermal Cells
WANG Kun1,2,ZHANG Bai-zhong1,YI Kang-le1,2,JIANG Jun2,WANG Qing-qiao3,LI Hao-bang1, YAN Hai-feng1,3*
(1.HunanGuangdaAnimalHusbandryScienceandTechnologyCo.,Ltd.,Changsha,Hunan, 410131; 2.CollegeofAnimalScienceandTechnology,HunanAgricultureUniversity,Changsha,Hunan410128; 3.HunanTianxingYellowChickenBreedingCo.,Ltd.,Changsha,Hunan410143)
The chicken blastodermal cells (BCs) were isolated from stage X embryos, and cultured using the high glucose DMEM medium (10% FBS, Penicillin and streptomycin) without feeder layers cells. The cell adherent rate was evaluated at cells cultured for 6h, 12h and 24h,respectively to study the effects of the blastoderm separating, discrete degree, density of cells, and centrifugal force. The results showed that the filter paper ring method worked best on separating the embryo. The discrete degree was the best when blowing 20 times and was not significantly different from that when blowing 30 times (P>0.05), but significant different (P<0.05) when compared with the data in 40-time-beating group. The cells density during culture revealed no significant difference(P>0.05) between the group of 1×103cells/mL and 5×103cells/mL, and significant difference displayed(P<0.05)when compared with other groups and among other groups. The density of 1×105cells / mL reached the best adherent rate, and next was the density of 5×104cells/ mL which was much more convenient to observe with the microscope. Centrifuging for 5 min revealed no significant difference between the group of 5 590 ×g and 1398 Xg(P>0.05), and significant difference displayed when these two groups compared with the group of 224 ×g(P<0.05)and the group of 5 590 ×g performed the best. In conclusion, the best BCs culture procedures was to seperate chicken embryos with filter paper ring,blowing the embryos in the medium for 20 times, centrifuging the cell suspension by 5 590 ×g and culturing the cells at the density of 5×104cells/mL in the 96-well cell culture plates. The results proved efficient for BCs acquisition and activity detection, and benefitial for its application in the avian transgenic technology, especially for freezing injury evaluation in genetic resources preservation technology.
chicken; blastodermal cells (BCs) at stage X;primary cell culture;cell adherent rate
2014-10-14,
2014-12-01
国家国际科技合作专项(2013DFG31810),湖南省科技计划(2014WK2008),长沙市科技计划(K1307134-24)
王 坤(1990 -),男,云南曲靖人,硕士研究生,研究方向:动物遗传育种与繁殖。E-mail:295443957@qq.com
*[通讯作者] 燕海峰(1969-),男,湖南桃源人,研究员,博士,研究方向:动物遗传育种与繁殖。E-mail:hfyan2005@163.com
S811.6
A
1005-5228(2015)02-0061-06

