一株血清型O101多重耐药牛致病性大肠杆菌菌株的分离鉴定
李书光,张 娜,王玉茂,李 峰,林初文,沈志强,李金林*
(1.山东省滨州畜牧兽医研究院,山东滨州256600;2.山东绿都生物科技有限公司 山东 滨州 256600)
一株血清型O101多重耐药牛致病性大肠杆菌菌株的分离鉴定
李书光1,2Δ,张 娜2Δ,王玉茂1,2,李 峰1,2,林初文2,沈志强1,李金林1,2*
(1.山东省滨州畜牧兽医研究院,山东滨州256600;2.山东绿都生物科技有限公司 山东 滨州 256600)
试验对病料进行病原检测,并对分离到的病原菌进行分子生物学鉴定、血清学鉴定、药物敏感性试验、小鼠致病性试验研究,依据研究结果进行针对性治疗。试验结果:成功分离到一株牛致病性大肠杆菌,该株菌多重耐药,对小鼠具有高度致病性,其血清型为O101,使用该菌株的敏感药物对后续腹泻犊牛进行了及时治疗,成功控制了该养殖场犊牛腹泻的问题。
犊牛腹泻;大肠杆菌;多重耐药;临床治疗
牛腹泻性大肠杆菌病是危害养牛业生产的主要疾病之一,主要侵害犊牛,青年牛在应激环境下也可发病,临床上以肠毒血症、败血症和肠炎为主要特征。在有传染源的农场,犊牛一年四季均可发生,在冬末春初和气温多变季节发病更为严重,且由于耐药性的产生,养殖场使用药物治疗效果不明显,常导致犊牛因腹泻脱水死亡[1]。
2013年12月,山东某规模肉牛养殖场发生多例犊牛腹泻病,死亡率达50%,为表明病周本实验以患病犊牛为试验对象,采集其血样和腹泻物,开展相应的病原分离鉴定,为有效防治牛大肠杆菌病提供依据。
1 材料与方法
1.1 实验材料
选择患病10~30日龄犊牛 头,送山东省滨州畜牧兽医研究院进行诊治,无菌采集病牛腹泻物和血样。
1.2 试剂及实验动物
革兰氏染液、TSA血平板由山东省滨州预防兽医学与动物生物技术重点实验室制备、保存;药敏纸片购自北京天坛药物生物技术开发公司,大肠杆菌标准血清购自中国兽医药品监察所,血清包括:O1、O2、O6、O15、O20、O21、O22、O25、O29、O32、O33、O34、O35、O36、O37、O39、O45、O53、O78、O80、O83、O86、O88、O91、O101、O107、O123、O141、O138、O154。体重18~22 g昆明系小白鼠购自山东大学实验动物中心。
1.3 细菌的分离培养
将无菌采集的病牛腹泻物在TSA血平板接种进行病原菌的分离,置37 ℃培养24 h。挑取平板上各形态的单菌落,涂片进行革兰氏染色镜检,观察菌落形态。
1.4 分离菌株的PCR鉴定
鉴定引物参照赵战勤[2]等常见革兰氏阴性杆菌多重PCR引物,由上海生工生物有限公司合成,扩增大肠杆菌保守基因uidA基因,扩增长度为264 bp。
PCR扩增反应体系为25 μL,25 μM上下游引物各1 μL,2.5 mM dNTP Mixture 2 μL,10×Buffer 2.5 μL,rT aqDNA 酶( 5 U/μL) 0.25 μL,挑取单菌落作为模板,ddH2O补足体系。PCR反应条件为:94 ℃预变性5 min;94 ℃变性40 s,56 ℃退火30 s,72 ℃延伸30 s,进行30个循环;最后72 ℃延伸10 min,同时以ddH2O做空白对照。取5 μL PCR产物在1%琼脂糖凝胶电泳检测。
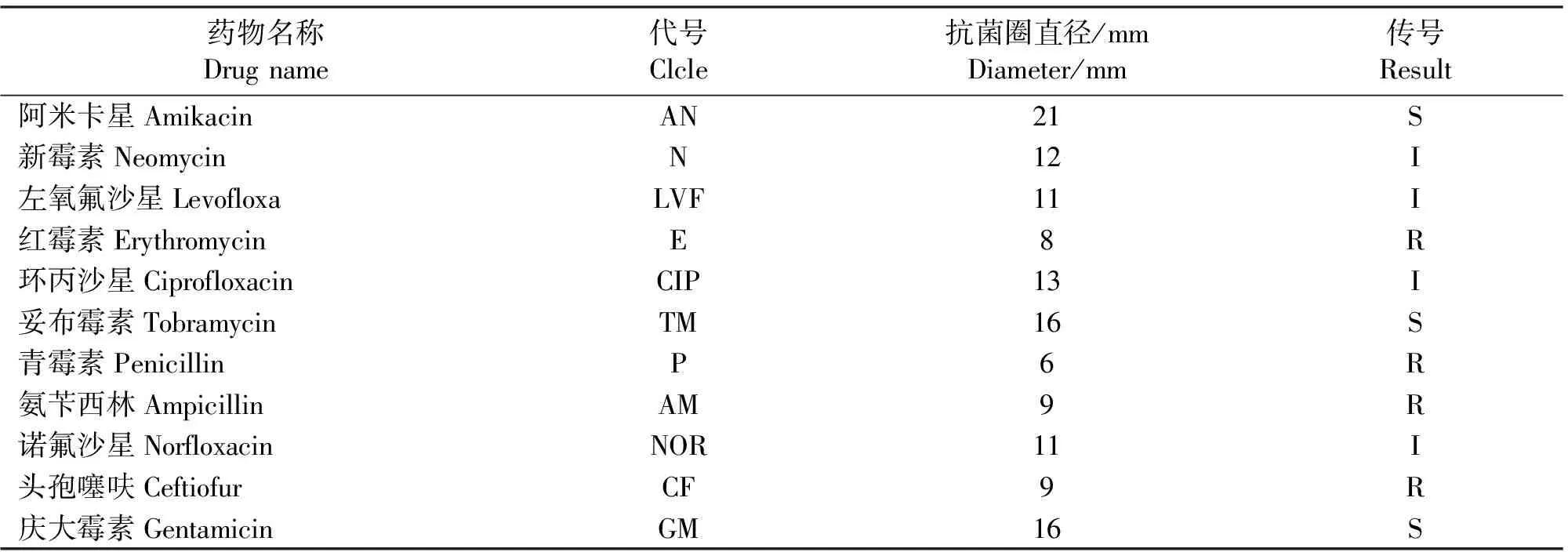
表1 分离菌株药敏试验结果
注:S 表示高度敏感(Φ>15mm),I 表示中度敏感(10mm≤Φ≤15mm),R 表示低度敏感或不敏感(Φ<10mm)。
Notes:S stood for high sensitivity(Φ>15mm);I for moderate sensitivity(10 mm≤Φ≤15 mm),R for low or no sensitivity(Φ<10 mm).
1.5 分离菌株的血清型鉴定
大肠杆菌普通肉汤培养液37 ℃振荡培养18 h,培养基呈均匀浑浊生长,生理盐水洗涤3遍后,121 ℃高压2 h,制成高压抗原,使用比浊管调整至100亿/ml。参照李书光等[3]微量凝集试验方案,对分离株进行血清学鉴定。
1.6 致病性试验
挑取鉴定纯培养的犊牛大肠杆菌分离株,接种于成品营养肉汤中37 ℃培养18 h后,活菌计数,调整浓度至1×108CFU/mL。20只18~22 g体重的昆明系小白鼠,随机分成2组,每组10只,1号组每只小白鼠皮下注射0.2 mL菌液,2号组腹腔注射等量生理盐水做对照组,隔离饲养观察7 d。
1.7 药敏试验
将鉴定完毕的病原菌密集划线接种于新的TSA培养皿,无菌放置干燥抗菌药物纸片紧贴于密集划线接种了菌种的培养基表面,每个直径90 mm的平皿贴7个药敏纸片、盖上平皿,倒置平皿置37 ℃温箱培养24 h,取出测量观察结果,判断标准按2010版CLSI M100—S20执行。
1.8 临床治疗
使用敏感药物静脉注射进行临床治疗。
2 结果与分析
2.1 细菌的分离培养
分离菌在TSA血平板上呈单一形态菌落,无其他杂生或弱势菌株。分离菌在TSA血平板上可见中等大小、圆形隆起、表面光滑、呈浅灰色半透明菌落。革兰氏染色镜检显示其为革兰氏染色阴性,两端钝圆,多数呈单个散在、个别成双排列、无芽孢的杆菌,如图1所示。
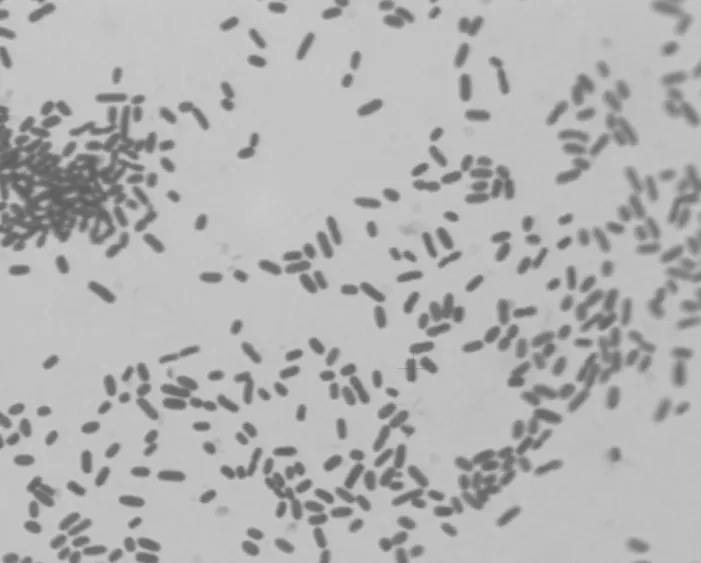
图1 分离菌的革兰氏染色镜检(1 000)
2.2 PCR鉴定
PCR产物经琼脂糖凝胶分析,结果显示在260bp左右有一条特异性条带,空白对照无条带,说明分离菌为大肠杆菌。
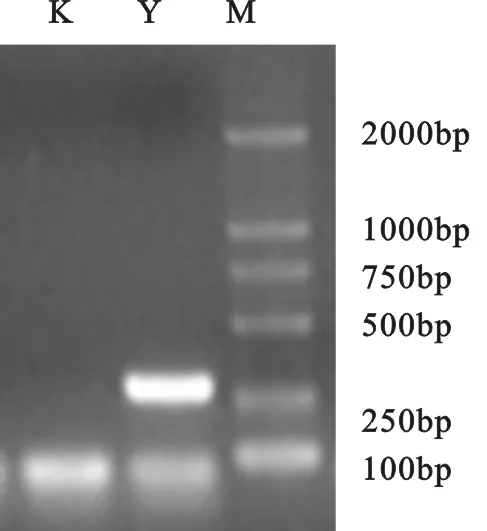
图2 大肠杆菌PCR鉴定结果
2.3 分离菌株的血清型鉴定(本部分有无图或表支持现结论)
血清型试管凝集试验结果表明,该菌株与O35、O78、O101发生凝集反应,但仅与O101大肠杆菌阳性血清发生强凝集反应,因此该菌株的血清型为O101。
2.4 分离菌株的致病性
实验组小鼠腹腔注射分离菌培养物,24 h内全部死亡,对照组小鼠未见任何症状。剖检死亡小鼠,未见明显病变。从死亡小鼠肝脏中分离细菌进行培养,并进行PCR和血清学鉴定,结果显示,该菌与接种菌为同种细菌。
2.5 药敏试验
药敏试验结果显示:该分离菌对阿米卡星、妥布霉素、庆大霉素高度敏感;对新霉素、左氧氟沙星、环丙沙星、诺氟沙星中毒敏感;而该菌株对红霉素、青霉素、氨苄西林、头孢噻呋等产生耐药性。
2.6 临床治疗
使用静脉滴注阿米卡星,连用2天,发病犊牛在5天内均康复。
3 讨 论
经过试验,证实该牛场的犊牛腹泻主要病原是血清型为O101的致病性大肠杆菌。药敏试验实验中选用的11种药物,分离菌对阿米卡星、妥布霉素、庆大霉素高度敏感,在生产中可优先考虑。血清型O101的大肠杆菌是引起犊牛腹泻的主要血清型,其他的还有O3、O8、O9、O14、O15、O20、O26、O43、O60、O78、O93、O101、O105、O109等血清型[4]。此次临床诊断、病原菌的分离鉴定及药物治疗,弄明白了困扰该场犊牛成活率的原因是多重耐药致病性大肠杆菌,由于抗生素的广泛使用,导致多重耐药菌株的出现[5-6],使用药物治疗控制效果不明显,犊牛体质较差,腹泻导致严重脱水,严重影响了初生犊牛的存活率[7]。试验过程中,筛选到的敏感药物取得了较好的防治效果,但是伴随着耐药性的产生,要从根本上来净化养殖场,还要采取多重的净化措施[8],包括种牛引进、产房的隔离、药物配合疫苗的使用等综合方案。
在试验过程中,为了鉴别诊断是否有BVDV混合感染,本研究室采用上海继锦化学科技有限公司的牛(Bovine)病毒性腹泻抗体(BVDV-Ab)ELISA检测试剂盒和BVDV、BCV和BRV三重RT-PCR检测方法进行了相应的抗原和抗体检测,检测结果显示为阴性,排除该场犊牛腹泻的病毒性因素,进一步证实了病原菌分离鉴定的科学性和严谨性。
本研究分离株的血清型为O101,使用K88、K99、987p和F41的PCR鉴定引物均没有扩增到目的条带[9],与早期研究中牛羊群中主要的菌毛蛋白为K99和F41有区别[10-11]。昆明系小白鼠作为大肠杆菌的毒力模型使用较为广泛[12],本研究中仅采用了小白鼠毒力试验[13],没有使用本动物回归试验检测分离菌株的毒力,有待于后期研究中进一步开展。
[1] 尚婷婷,张耀相,林 青,等. 犊牛大肠杆菌病病原的分离鉴定[J]. 动物医学进展,2012(6): 143-146.
[2] 赵战勤,裴 洁,薛 云,等. 猪源支气管败血波氏杆菌的分离鉴定及生物学特性研究[J]. 中国农业科学,2008(12): 4 209-4 217.
[3] 李书光,李 峰,李天芝,等. 混合O血清型蛋鸡大肠杆菌的分离与鉴定[J]. 中国家禽,2013(19): 53-54.
[4] 喻华英,杨晓华. 新疆部分地区犊牛腹泻病大肠杆菌的分离、鉴定与血清型分析[J]. 新疆农业科学,2011(9): 1 752-1 756.
[5] 夏利宁,向 发,郭庆勇,等. 新疆不同地区牛源大肠杆菌耐药性分析[J]. 中国畜牧兽医,2014(2): 203-207.
[6] 余 婷,谢 敏,冀智佩,等. 宁夏地区牛源大肠埃希菌ESBLs检测及耐药性分析[J]. 动物医学进展,2013(3): 25-28.
[7] 张 陆,蒋 月,盛鹏飞,等. 腹泻犊牛大肠杆菌血清型抗菌药物耐药性耐药基因鉴定及脉冲场凝胶电泳分型[J]. 中国兽医杂志,2013(9): 15-17.
[8] 米兴亮,李云龙,王晓兰,等. 规模化牛场犊牛腹泻大肠杆菌对常用消毒剂的敏感性研究[J]. 安徽农业科学,2012(22): 11 317-11 319.
[9] 段新华,李建军,杨学云,等. 致犊牛腹泻肠毒素大肠杆菌多重PCR检测方法的建立[J]. 中国动物检疫,2010(1): 33-34.
[10] 李书光,李 峰,苗立中,等. ETEC K88菌毛蛋白抗体PPA-ELISA检测方法的建立[J]. 动物医学进展,2012(6): 95-98.
[11] 李书光,管 宇,肖跃强,等. 大肠杆菌K_(99)-ST_1双价基因工程菌株的构建及其免疫原性[J]. 中国兽医学报,2009(5): 598-602.
[12] 高 娃,敖日格乐,王纯洁,等. 牛源致病性大肠杆菌感染小鼠模型的建立[J]. 黑龙江畜牧兽医,2013(1): 88-89.
[13] 李书光,沈志强,肖跃强,等. 产肠毒素性大肠埃希菌主要毒力因子及疫苗的研究进展[J]. 动物医学进展,2007(10): 59-63.
Isolation and Identification of O101 Multidrug-resistant Serotype Bovine PathogenicEscherichiacoli
Li Shu-guang1,2, Zhang Na1,2, Wang Yu-mao1,2, Li Feng1,2, Lin Chu-wen2, Shen Zhi-qiang1, Li Jin-lin1,2
((1.ShandongBinzhouAcademyofAnimalScience&VeterinaryMedicine,Binzhou,Shandong256600; 2.ShandongLvduBio-technologyCo.Ltd,Binzhou,Shandong256600))
The cases of calf diarrhea death in a large-scale beef cattle farm were collected, the corresponding isolated pathogen, molecular identification, serological identification, drug sensitivity test, mice pathogenicity test were conducted and a targeted therapy was undertaken thereafter to the herds. The results showed that one srain of bovine pathogenic Escherichia coli, serotype O101 with strong multidrug resistance and high pathogenicity to mice, was successfully isolated and used in the sensitive medicine for timely treating of follow-up diarrhea calves.
calf diarrhea; escherichia coli; multidrug resistance; clinical treatment
2014-07-31,
2014-11-16
山东省现代农业产业技术体系牛产业创新团队(SDAIT-12-011-12);
李书光(1982-),男,山东惠民人,在读博士研究生,助理研究员,主要从事预防兽医学研究,E-mail:lshug@163.comΔ同等贡献作者:张 娜(1984-),女,硕士,助理研究员,山东泰安人,主要从事预防兽医学研究,E-mail:
*[通讯作者] 李金林(1960-),男,山东治化人,推广研究员,主要从事洼地绵羊选育研究与开发。E-mail:lijinlin116@163.com
S811.6
A
1005-5228(2015)02-0072-03

