(4R,5R)-1,3-二氧戊环-2,2-二苯基-4,5-二-[亚甲基-N,N'-(1-甲基-4-羟基苯甲醛)]的合成及其催化性能*
姜 艳,石宇杰,杜晓莹,孙小强
(常州大学江苏省精细石油化工重点实验室,江苏常州 213164)
1984年 Oguni和 Omi[1]首次报道了二烷基锌对羰基的不对称催化加成,以简单的(S)-亮氨醇为手性催化剂,获得了49%ee值的(R)-1-苯基-1-丙醇。该反应后来被 Pu[2-3]和 Walsh[4]深入研究。自此二烷基锌试剂对羰基化合物的不对称加成研究得到迅速发展。Noyori等[5]用(-)-3-外型-二甲氨基冰片醇催化二乙基锌和醛的不对称加成,成功获得(S)-1-苯基丙醇,ee值高达98%,使得二烷基锌对醛的不对称加成反应被化学家们广泛关注,由此奠定了二烷基锌对醛的不对称加成反应在不对称催化领域中的重要地位。之后又出现了很多手性配体催化该类反应,因此二烷基锌对醛的不对称加成也成了检验各种新手性配体对映识别效能的模型反应。在手性配体的作用下,二烷基锌和醛进行不对称加成后形成手性中心,获得具有光学活性的手性二级醇。酒石酸是含有两个手性碳原子,有光活性特性,具有立体选择性和手性识别功能。它本身是一种廉价易得的天然手性原料,在对映体的拆分、高效液相色谱流动相添加剂及不对称合成等方面应用广泛,并且,以酒石酸为手性源合成的衍生物也被广泛应用于不对称反应[6-8]。
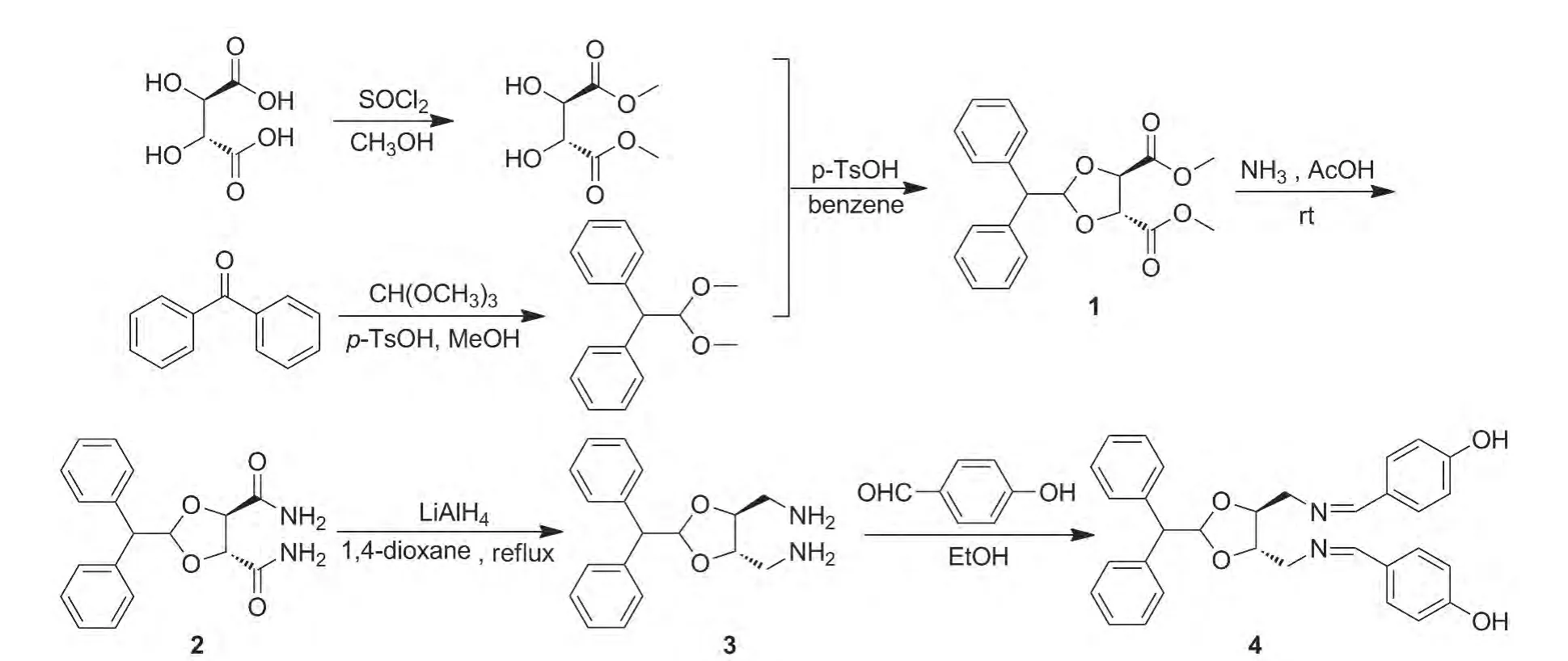
Scheme 1
本文以L-酒石酸和二苯甲酮为原料,经酯化、缩酮、加成、消除、还原和缩合等反应合成了一种新型席夫碱类化合物——(4R,5R)-1,3-二氧戊环-2,2-二苯基-4,5-二-[亚甲基-N,N'-(1-甲基-4-羟基苯甲醛)](4,Scheme 1),其结构经1H NMR,13C NMR和LC-MS表征。以二烷基锌对苯甲醛的不对称加成为模板反应,考察了4的不对称催化性能。
1 实验部分
1.1 仪器与试剂
XT4-100X型显微熔点仪(温度未校正);Perkin-Elmer 141型旋光仪;ARX-500 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);GCMSQP2010型质谱仪;LC-20AD型高效液相色谱仪[手性柱:OD-H 柱(Particle size:5 μm,Dimensions:4.6 mm φ × 250 mmL),流动相:正己烷/异丙醇 =98/2,流速:1.000 mL·min-1;进样体积:10 μL;LC 停止时间:20.00 min;柱温:25 ℃]。
(4R,5R)-1,3-二氧戊环-2,2-二苯基-4,5-二甲酸甲酯(1)按文献[9-10]方法合成;其余所用试剂均为分析纯,其中苯甲醛经氮气保护下减压蒸馏,1,4-二氧六环用前经除水。
1.2 合成
(1)(4R,5R)-1,3-二氧戊环-2,2-二苯基-4,5-二甲酰胺(2)的合成[11]
在反应瓶中依次加入1 1.00 g(2.92 mmol)和无水乙醇20 mL,将干燥氨气导入反应瓶,搅拌下于室温反应至终点(TLC跟踪)。抽滤,滤饼用无水乙醇洗涤,用无水乙醇重结晶得白色固体2 0.76 g,收率 82%,m.p.182.0 ℃ ~ 182.1 ℃;1H NMR δ:7.51 ~ 7.34(m,10H,PhH),4.87(s,2H,CH),6.08(s,2H,NH2),6.68(s,2H,NH2);MS m/z:189{[M+H]+}。
(2)(4R,5R)-1,3-二氧戊环-2,2-二苯基-4,5-二甲胺(3)的合成[12-13]
N2保护下,在三口瓶中加入氢化铝锂50.0 mg(1.28 mmol)和1,4-二氧六环10 mL,搅拌下回流反应1 h。缓慢滴加2 100.0 mg(0.32 mmol)的1,4-二氧六环(10 mL)溶液,滴毕,回流反应至终点(TLC跟踪)。倒入烧杯,冰浴冷却,搅拌下缓慢滴加饱和硫酸钠溶液至液体中无气泡生成,静置过夜;抽滤,滤饼用乙酸乙酯洗涤后干燥得3粗品,直接进行下步反应。
(3)4 的合成[14]
在反应瓶中加入对羟基苯甲醛 86.4 mg(0.71 mmol)和无水乙醇10 mL,搅拌使其溶解;缓慢滴加3 102.4 mg(0.36 mmol)的无水乙醇(10 mL)溶液,滴毕,于室温反应3.5 h(TLC跟踪,析出白色固体)。抽滤,滤饼用无水乙醇洗涤后用无水乙醇重结晶得黄色固体 4 78.0 mg,收率40%,m.p.198.4 ℃ ~199.0 ℃;1H NMR δ:9.93(s,2H,OH),8.19(s,2H,N=CH),7.56 ~7.53(d,J=8.6 Hz,4H,ArH),7.38 ~7.37(m,10H,PhH),7.29 ~7.27(dd,J=1.6 Hz,4H,ArH),6.82 ~6.79(d,J=8.6 Hz,4H,ArH),4.29(s,2H,CH),3.83 ~ 3.80(d,J=10.3 Hz,2H,CH2),3.73 ~3.70(d,J=7.9 Hz,2H,CH2);MS m/z:493{[M+H]+}。
2 结果与讨论
2.1 合成
2的合成是1经氨解反应而得。文献[11]方法直接用氨水和酯反应,或将酯溶于甲醇后通入氨水制得酰胺。本文按文献方法将氨水通入1的甲醇溶液中,反应中有许多杂质产生,推测可能是由于1中的缩酮部分不稳定,反应体系中含有的少量水使其又断开。后来,尽量让反应体系中无水。考虑到溶剂及氨气中可能含有少量的水,将氨气干燥后直接通入1的无水乙醇溶液,反应即可在室温下顺利进行。1在室温不全溶于无水乙醇,但随着反应进行,反应液中固体减少,直至液体变澄清透明,继续反应可产生大量白色固体2。实验室没有现成的氨气,我们用氨水加热分解的方法制得氨气,经干燥后通入反应瓶中,为了防止倒吸需加一个防倒吸装置。
3是合成席夫碱类手性配体的重要中间产物,因为N原子与金属有很好的配位能力。本文选择先将酯氨解成酰胺后再用氢化铝锂还原成氨的方法,反应条件比较温和。目前文献方法多用THF、乙醚作溶剂,但是实验结果表明收率均较低,后来尝试以1,4-二氧六环(经严格除水)为溶剂,且先让氢化铝锂在1,4-二氧六环中回流1 h,再将2的1,4-二氧六环溶液缓慢滴加入反应液,收率较高,反应时间较短。后处理时,向反应液中慢慢滴加饱和硫酸钠溶液至液体中不再有气泡产生,使过量的氢化铝锂形成固体络合物。需要注意的是,抽滤过的滤饼应进行多次洗涤,以保证将固体络合物上的产品尽可能多地洗出。可能是因为1,4-二氧六环的沸点比较高,提高了酰胺的活性,使反应顺利的进行。反应所得的胺粗产物不需提纯,可以直接进行下一步反应,简化了后处理纯化过程。
2.2 不对称催化性能
以二烷基锌对苯甲醛的不对称加成为模板反应(Scheme 2),考察4的不对称催化性能。

Scheme 2
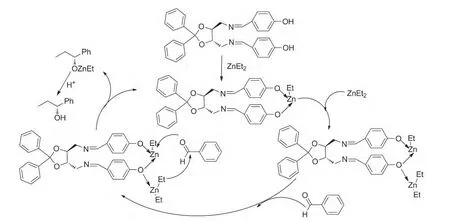
Scheme 3
在史莱克管中加入4 5.5 mg(0.008 mmol)和正己烷1 mL,氮气保护,冰浴冷却,搅拌下加入二乙基锌0.32mL(0.32mmol),反应1h。加入新蒸苯甲醛17.0 mg(0.16 mmol),于室温反应 48 h。用5%盐酸酸化,用无水乙醚萃取,有机层用无水硫酸钠干燥,旋蒸除溶后经硅胶柱层析[洗脱剂:V(丙酮)∶V(石油醚)=1∶7]纯化得淡黄色黏稠液体苯基丙醇10.3 mg。
实验结果表明,配体4对二乙基锌催化苯甲醛的不对称加成效果ee值达52%。参考文献[15]方法对该反应机理(Scheme 3)进行了推理。
[1]Oguni N,Omi T.Enantioselective addition of diethylzinc to benzaldehyde catalyzed by a small amount of chiral 2-amino-1-alcohols[J].Tetrahedron Lett,1984,25:2823-2824.
[2]Pu L,Yu H B.Enantioselective addition of organozinc reagents to aldehydes[J].Chem Rev,2001,101:757-824.
[3]Pu L.Asymmetric alkynylzinc additions to aldehydes and ketones[J].Tetrahedron,2003,59(50):9873 -9886.
[4]Walsh P J.Titanium-catalyzed enantioselective additions of alkyl groups to aldehydes:Mechanistic studies and new concepts in asymmetric catalysis[J].Acc Chem Res,2003,36(10):739 -749.
[5]Masato K,Seiji S,Koji K,et al.Catalytic asymmetric induction.Highly enantioselective addition of dialkylzincs to aldehydes[J].J Am Chem Soc,1986,108(19):6071-6072.
[6]Gondi V B,Gravel M,Rawal V H.Hydrogen bond catalyzed enantioselective vinylogous Mukaiyama Aldol reaction[J].Org Lett,2005,7(25):5657 -5660.
[7]惠爱玲,张金堂,汪志勇.酒石酸衍生物促进的醛酮不对称烷基加成反应研究进展[J].有机化学,2009,29(3):334 -340.
[8]Tanaka K,Honke S,Urbanczyk-Lipkowska Z,et al.New chiral hosts derived from dimeric tartaric acid:Efficient optical resolution of aliphatic alcohols by inclusion complexation[J].Eur J Org Chem,2000,3171 -3176.
[9]MaGee D I,Silk P J,Wu J,et al.Synthesis of chiral alkenyl epoxides:The sex pheromone of the elm spanworm Ennomos subsignarius(Hubner)(Lepidoptera:Geometridae)[J].Tetrahedron,2011,67(29):5329 -5338.
[10] 王丽丽,姜艳.新型含杂环醚类手性配体的合成及其不对称催化性能[J].合成化学,2014,22(3):308-312.
[11]Shishido K,Takahashi K,Oshio Y,et al.Synthetic studies towards(-)-quassimarin:An intramolecular Diels- Alder approach to the BCE ring system[J].Heterocycles,1988,27(2):495 -508.
[12]Shainyan B A,Ustinov M V,Bel'skii V K,et al.Diamines having a C2symmetry.Synthesis and application as ligands in the hydrogenation of prochiral substrates over rhodium complexes[J].J Org Chem,2002,38(1):104 -110.
[13]Ludivine L,Emilia P,Geraldine S,et al.A HTS assay for the detection of organophosphorus nerve agent scavengers[J].Chemistry,2010,16(11):3510 -3523.
[14]Nindakova L O,Lebed F M,Zamazei A Y,et al.New C2-symmetric optically ative salen ligands and their cobalt(Ⅱ)complexes.Hydridoborate reduction of prochiral C=O and C=C bonds[J].J Org Chem,2007,43(9):1322 -1329.
[15]Melissa A D,Shawn R.Divergent enantioselective pathways in the catalytic asymmetric addition of diethylzinc to aldehydes in the presence and absence of titanium tetraisopropoxide[J].Tetrahedron,2008,19:2563-2567.
——非均布滤饼的局部比阻与平均比阻的测定与计算方法

