箭竹多糖理化分析及对肿瘤抑制作用研究
黄 伟,张志发,杜俊峰*,孙超超,魏 衡,唐 超
(1.武汉大学 药学院,湖北 武汉 430071;2.华中科技大学 同济医学院,湖北 武汉 430030; 3.杭州市中医院,浙江 杭州 310007;4.湖北新华医院,湖北 武汉 430015; 5.湖北省茶叶精深加工工程技术研究中心,湖北 宜昌 443100)
箭竹多糖理化分析及对肿瘤抑制作用研究
黄 伟1,张志发2,杜俊峰2*,孙超超3,魏 衡4,唐 超5
(1.武汉大学 药学院,湖北 武汉 430071;2.华中科技大学 同济医学院,湖北 武汉 430030; 3.杭州市中医院,浙江 杭州 310007;4.湖北新华医院,湖北 武汉 430015; 5.湖北省茶叶精深加工工程技术研究中心,湖北 宜昌 443100)
从箭竹中纯化制备多糖,获得纯化的箭竹多糖组分FP(fargesia polysaccharides )。FP的总多糖含量为90.77%,蛋白质含量为5.81%,分子量180904。IR分析表明FP为典型的碳水化合物;化学成分分析表明,FP为一种结合蛋白肽的多糖复合物。FP对人白血病细胞K562和人肝癌细胞HepG2均具有显著抑制作用,呈现剂量效应,且FP对HepG2的抑制效果总体上强于K562。FP的高、中、低剂量组对小鼠S180 肉瘤均具有显著抑制作用(P<0.01或P<0.05) , 且呈现剂量效应。
箭竹;多糖;肿瘤;抑制作用
竹叶在我国具有悠久的药、食两用历史,我国的竹林资源约占全国森林总面积的3%,占世界竹林总面积的25%[1]。箭竹(fargesia)是我国竹叶的主要品种之一,为多年生地下茎匍匐竹类,主要分布于四川、云南及湖北等地[2]。箭竹林地面积大、资源丰富,但因其秆小,作为传统竹材加工使用受到限制。箭竹有效成分的提取及利用可为箭竹资源的深入开发提供新途径。
竹叶中除含有黄酮类功效成分外,多糖亦是其重要的天然活性物质,目前关于箭竹多糖的研究较少。本工作开展了箭竹多糖的理化特性及抗肿瘤活性研究,为其大规模生产制备及深加工终端产品的开发提供理论基础。
1 材料与方法
1.1 材料、试剂及主要仪器
箭竹,产自四川凉山。SPF级昆明种小鼠,雄性,体重18~22g,购自南京生物医药研究院。SHIMADZU UV-2550紫外-可见分光光度计,Nicolet-170X 红外光谱仪,Agilent 1200系列高效液相色谱仪(HPLC),蒸发光散射检测器(ALLTECH ELSD 3300),美国ALLTECH公司;TSK-GEL G3000PWXL,TOSOH公司;Thermo Trace2000气相色谱仪、毛细管柱Rtx-5MS (30m×0.32mm i.d.),美国Thermo Finnigan公司;Thermo Scientific Series 8000细胞培养箱。 Dextran Standard T系列标准品,Pharmacia公司;bradford法蛋白测定试剂盒,碧云天公司。其它试剂为国产分析纯。
1.2 箭竹多糖纯化制备及化学成分分析
取箭竹叶500g加水4 000mL,机械搅碎,沸水煎煮,过滤,Saveg法去蛋白质,活性炭脱色,乙醇沉淀,冷冻干燥, 得6.88g黄色粉末,为箭竹粗多糖CFP(Crude fargesia polysaccharides )。将箭竹粗多糖CFP 溶于水,经DEAE-纤维素DE32离子交换柱层析纯化,获得箭竹多糖纯化组分,经水透析、冻干后得浅黄色絮状粉末为箭竹多糖FP (fargesia polysaccharides)。
采用蒽酮-硫酸法测定箭竹多糖FP糖含量[3];Bradford法测定FP的蛋白质含量[4];糖腈乙酸酯衍生法测定FP单糖组成[5]。
1.3 分子量测定
箭竹多糖的分子量测定采用高效液相凝胶渗透色谱法(HPGPC)-蒸发光散射检测器(ELSD)分析,以Dextran Standard T系列葡聚糖T-10,T-40,T-70,T-500和T-2000(分子量分别为:10 000,40 000,70 000,500 000和2 000 000)作为标准品,以标准品重均相对分子质量对数lgMr与其HPGPC-ELSD色谱的保留时间tR做标准曲线,获得线性回归方程。
1.4 红外光谱测定
取3.0mgFP经适量溴化钾压片,采用 Nicolet-170X 红外光谱仪于4 000cm-1~400cm-1区间扫描。
1.5 FP对肿瘤细胞体外抑制作用
K562细胞和HepG2细胞分别培养于RPMI-1640培养基,培养基含青霉素100IU/mL,链霉素100U/mL,10%新生胎牛血清(56℃、30min灭活),置饱和湿度、37℃和5%CO2培养箱培养。
取对数生长期的上述肿瘤细胞分别用胰蛋白酶消化,再接种于96孔板, 实验组各孔加入终浓度为400、200、100、50μg/mL的FP。阴性对照每孔加入同体积的RPMI1640培养基,各组均设3个复孔, 于37℃,5%CO2培养箱培养48h后,加入MTT,继续培养4h后测定A570nm,细胞生长抑制率IR(%)=(1-实验组A570nm/对照组A570nm)×100%。
1.6 对S180荷瘤小鼠的抑瘤作用
选取体重18~22g昆明种小鼠,雄性,于右腋皮下接种S180细胞悬液(5.0×107个/mL)0.18mL/20g, 接种24h后随机分组, 每组10只。荷瘤对照组:给予等量生理盐水;FP剂量组:分为高、中、低剂量组,各组分别灌胃60、120和240mg/kg·d剂量FP多糖试样;阳性对照组:腹腔注射给予5-氟尿嘧啶(5-FU )120mg/kg·d。各组连续给药10天,给药结束后,次日以颈椎脱臼法处死小鼠,解剖剥取瘤块称重;解剖剥取胸腺、脾脏称重。分别按下列公式计算肿瘤抑制率和胸腺、脾脏的脏器指数。抑瘤率(%)=[(荷瘤对照组平均瘤重-实验组平均瘤重)]/荷瘤对照组平均瘤重×100%;脏器指数(mg/g)=脏器重量(mg)/体重(g),计算胸腺、脾脏指数。
2 结果与分析
2.1 箭竹多糖纯化组分FP化学成分及分子量
蒽酮硫酸法测得纯化组分的FP总多糖含量为90.77%,蛋白质含量为5.81%。箭竹多糖为一种结合蛋白肽的多糖复合物。GC分析表明箭竹多糖FP的多糖部分由6种单糖组成(见表1),分别为葡萄糖、半乳糖、鼠李糖、阿拉伯糖、甘露糖、木糖组成。各单糖组成的摩尔比表明FP以葡萄糖、半乳糖和阿拉伯糖为主,占总糖组成的80%以上。HPGPC-ELSD测得FP的相对分子量为180904。

表1 箭竹多糖FP单糖组成及摩尔比
2.2 红外光谱分析
红外光谱分析结果见图1。FP在3 417、2 924、2 854、1 649、1 419、1 384、1 077、547和471cm-1等具有特征吸收峰。其中3 417cm-1为O-H的伸缩振动;2 924cm-1和1 419cm-1分别为C-H伸缩振动和弯曲振动特征吸收;1 649cm-1左右的大峰是H2O的峰,表明FP易吸水;1 077cm-1处特征吸收由C-O-C伸缩振动引起。547cm-1和471cm-1两个吸收峰是含有多羟基化合物的缔合羟基弯曲振动吸收峰。官能团的红外光谱特征吸收分析结果表明,FP为典型的碳水化合物。
2.3 FP对K562和HepG2细胞抑制作用
细胞实验结果表明,箭竹多糖纯化组分FP对人白血病细胞K562和人肝癌细胞HepG2均具有显著抑制作用,且呈现剂量效应。当浓度达到200μg/mL以上时,FP对K562和HepG2的抑制率可达30%以上;随着浓度增加1倍,FP对K562和HepG2的抑制率接近或达到50%。FP在培养基中的浓度提高到500μg/mL,其对此两种细胞的抑制作用达到60%左右。FP对HepG2的抑制效果总体上强于K562。
2.4 FP对小鼠肉瘤S180抑制作用
与荷瘤组比较,FP高、中、低剂量组对小鼠S180 肉瘤均具有显著抑制作用(P<0.01或P<0.05) ,且呈现剂量效应,随着剂量的加大,FP对对荷瘤小鼠S180肿瘤的抑制率由23.55%提高到66%以上。高剂量组的抑瘤率与5-Fu药物组相当,见表3。
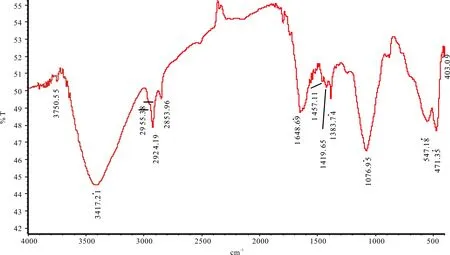
图1 箭竹多糖FP的红外光谱
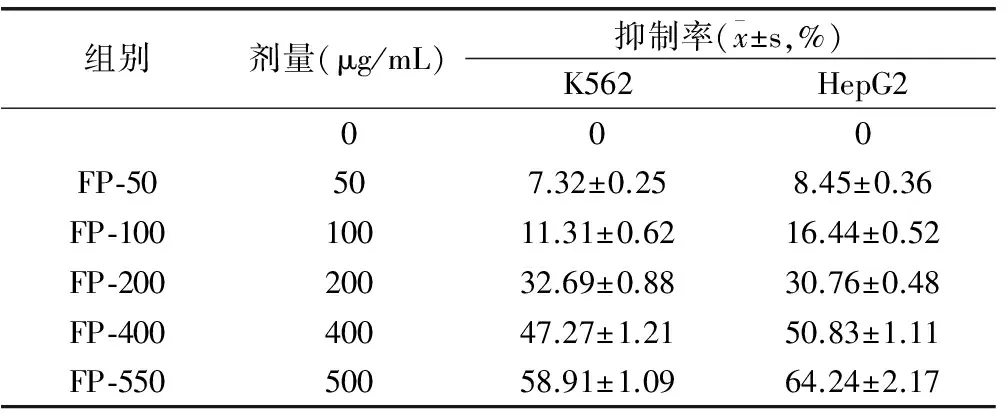
组别剂量(μg/mL)抑制率(x±s,%)K562HepG2000FP⁃50507.32±0.258.45±0.36FP⁃10010011.31±0.6216.44±0.52FP⁃20020032.69±0.8830.76±0.48FP⁃40040047.27±1.2150.83±1.11FP⁃55050058.91±1.0964.24±2.17

表3 FP对S180小鼠肉瘤抑制作用
注:与荷瘤对照组比较,*P<0.05,**P<0.01。
2.5 FP对S180小鼠免疫器官的影响
由表4可知,FP高剂量组的脾指数是荷瘤对照组的2.8倍,胸腺指数是荷瘤对照组的1.8倍,中、高剂量组与荷瘤对照组比较均差异显著(P<0.01)。表明FP对S180荷瘤小鼠的脾脏和胸腺均具有促生长作用,且呈剂量效应推测FP对小鼠免疫增强作用与其抑瘤作用具有相关性。
3 结论
本研究表明,箭竹多糖为一种结合蛋白的杂聚多糖复合物,所获得的箭竹多糖组分的分子量为180 904。细胞和动物水平研究均表明,箭竹多糖具有显著的抑制肿瘤作用,且呈现剂量效应,这与其免疫增强功能相关。箭竹多糖的功能活性是其开发利用的基础,对其理化特性的系统研究可为批量生产制备提供指导。
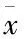
表4 FP对S180荷瘤小鼠脾指数和胸腺指数的影响 (±s)
注:与荷瘤对照组比较,*P<0.05,**P<0.01。
[1] 王文渊.竹叶黄酮的功能研究进展[J].中国食物与营养,2012,18(6):71-74.
[2] 胡毅,向卫国,朱克云,等.汪万江箭竹生长及开花的气象条件研究[J].成都气象学院学报,1997,12(3):225-233。
[3] 张惟杰. 糖复合物生化研究技术[M]. 第2版.杭州: 浙江大学出版社, 1999.
[4] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein binding[J].Anal Biochem,1976(72):248-254.
[5] 周鹏,沈金灿,谢明勇,等.GC-MS法分析茶叶中提取物TGP的单糖组成及机理探讨[J]. 厦门大学学报:自然科学版,2003,42(2):213-217.
(责任编辑:魏 晓)
2014-11-13
黄伟(1981-),男,武汉大学硕士研究生,主管药师,研究方向药物成分分析及药理学。
杜俊峰(1975-),男,华中科技大学同济医学院医师,研究方向为营养与健康。
R285
A
1673-2197(2015)07-0039-03
10.11954/ytctyy.201507018

