芡实多糖的提取、抗氧化活性及对质粒DNA氧化损伤防护作用的研究
张 溢,孙培冬,陈桂冰,曹光群
(江南大学 食品胶体与生物技术教育部重点实验室 化学与材料工程学院,江苏无锡 214122)
芡实多糖的提取、抗氧化活性及对质粒DNA氧化损伤防护作用的研究
张 溢,孙培冬*,陈桂冰,曹光群
(江南大学 食品胶体与生物技术教育部重点实验室 化学与材料工程学院,江苏无锡 214122)
采用纤维素酶超声辅助法提取芡实多糖,由正交实验获得芡实多糖的最佳提取条件,并探究其体外抗氧化活性及对H2O2光解反应诱导质粒pBR322 DNA损伤的保护作用。结果表明芡实多糖的最佳提取条件为:料液比1∶20(g/mL)、pH3、纤维素酶用量为原料质量的2.0%、超声时间5min、提取时间3h、提取温度40℃,多糖得率为17.04%。芡实多糖清除DPPH·、羟基自由基的能力较好,IC50分别为1.78、6.96mg/mL,清除过氧化氢、超氧阴离子自由基的能力较弱,浓度为10mg/mL时,清除率分别为48.00%、20.32%。芡实多糖对抑制DNA损伤具有显著作用,在多糖水溶液质量浓度为0.08mg/mL时,具有最佳保护作用;在质量浓度大于1.0mg/mL时,对质粒DNA没有保护作用,甚至促进了DNA的损伤。综上所述,芡实多糖具有抗氧化及抑制DNA氧化损伤的能力。
芡实,提取,抗氧化活性,DNA氧化损伤
芡实(Semeneuryales))又名鸡头米、鸡头苞、鸡头莲等,是睡莲科植物芡(EuryaleferoxSalisb)种子的成熟种仁[1],它性平、味甘涩,具有有益肾固精、补脾止泻、祛湿止带、抗衰老等功效,是一种食疗养生的佳品。芡实含有丰富的碳水化合物,如:淀粉、多糖、粗纤维,一般含量达到70%~80%[2]。糖类不仅可以作为能源物质,其中的活性多糖更是在提高人体免疫力、抗肿瘤活性、防治动脉硬化、抗病毒、抗氧化、抗辐射等方面起着重要作用。
正常情况下,人体内的自由基总是处于不断产生和消除的动态平衡中,但由于空气污染、紫外线照射、疾病等原因,会造成体内自由基产生过多不能及时清除,进而氧化体内的大分子化合物,甚至损伤器官[3],如:自由基引起脂质过氧化,可导致动脉粥样硬化;自由基引起的DNA损伤,易诱发癌症;自由基破坏蛋白质,导致炎症和衰老[4]。近年来的研究发现,多种活性多糖具有清除自由基和抗氧化作用,如:王红丽等[5]研究了枸杞多糖的抗脂质过氧化作用,陈克克等[6]指出了党参多糖对质粒DNA的氧化损伤保护作用。在已报道的文献中,对芡实多糖的提取多采用传统的热水提取法或是超声提取法,如刘玉凤等[2]研究了芡实多糖的水提醇沉工艺,谢燕娟等[7]研究了超声波法提取芡实多糖,提取率均不超过10%。此外,也有研究证明芡实多糖具有清除羟基自由基和超氧阴离子自由基的能力[8-9],但研究结果差异较大。本实验采用纤维素酶超声辅助法从芡实中提取多糖并提纯,然后测定其体外抗氧化活性及对质粒DNA氧化损伤的防护作用。

表1 提取多糖的因素水平表Table 1 The factors level of polysaccharide extraction
1 材料与方法
1.1 材料与仪器
芡实 产于江苏苏州,干燥,粉碎,过40目筛;DPPH Sigma Wolsen;七水合硫酸亚铁 AR,宜兴市展望化工试剂厂;纤维素酶、抗坏血酸、焦性没食子酸、苯酚、无水乙醇、NaOH、H2O2(30%)、十二水合磷酸氢二钠、二水合磷酸二氢钠、1,10-菲啰啉、三氯乙酸(TCA)、三羟甲基氨基甲烷、盐酸、硫酸 AR,国药集团化学试剂有限公司;琼脂糖、质粒pBR322 DNA、Goldview、DL5000 DNA Marker 宝生物工程有限公司。
KH-100B超声波清洗器 昆山禾创超声仪器有限公司;RE-5203旋转蒸发仪 上海申顺生物科技有限公司;TU-1900双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;HH-S2数显恒温水浴锅 金坛市医疗仪器厂;TG1650-WS离心机 上海卢湘仪离心机仪器有限公司;LyoQuest-85型冷冻机 西班牙泰事达公司;DYY-8C型电泳仪 北京市六一器厂;凝胶成像分析系统 美国伯乐公司Bio Rad。
1.2 实验方法
1.2.1 芡实粗多糖的提取条件优化 参照文献[10-11],并结合芡实特性,选择料液比(A)、pH(B)、酶用量(C)、超声时间(D)、提取时间(E)、温度(F)6个因素,每个因素选取3个水平设计正交实验,因素水平表见表1。精确称取2.00g芡实粉末,以水为提取溶剂,按表1的因素水平进行正交实验。将不同提取条件下所得的提取液,经8000r/min离心15min,上清液定量转移至100mL容量瓶中,加水定容。
1.2.2 芡实多糖的定量测定
1.2.2.1 葡萄糖标准曲线的制作 参照文献[12],以葡萄糖为标准品,采用苯酚-硫酸法绘制葡萄糖标准曲线Y=12.721X-0.1561(R2=0.9995)。
1.2.2.2 芡实多糖的定量测定 精密移取100mL容量瓶中提取液2mL,定量转移至50mL容量瓶中、定容,采用苯酚-硫酸法进行显色,并测量其吸光度值,代入1.2.2.1中葡萄糖标准曲线计算多糖的浓度,进而得到多糖提取率。
1.2.3 TCA-正丁醇法脱蛋白 准确称取芡实粉末100g,在最佳提取条件下进行提取,旋转蒸发浓缩体积至100mL左右,加入4倍体积无水乙醇沉淀,静置过夜,冷冻干燥得芡实粗多糖。芡实粗多糖以50mL蒸馏水溶解,加入50mL 5% TCA和50mL正丁醇,振荡,静置30min,弃上层正丁醇及中间蛋白层,反复多次,直至中间无蛋白层,用0.5mol/L NaOH溶液中和水层至中性,旋蒸除去正丁醇,并浓缩体积至100mL左右,加入4倍体积无水乙醇,静置过夜,离心收集沉淀,冷冻干燥,得芡实多糖。
1.2.4 芡实多糖的体外抗氧化活性
1.2.4.1 羟基自由基清除活性的测定 参照文献[13],在试管中分别加入1mL邻二氮菲乙醇溶液(0.75mmol/L),2mL磷酸缓冲溶液(0.2mol/L,pH7.4),1mL多糖水溶液,1mL硫酸亚铁溶液(0.75mmol/L),摇匀,最后加入1mL 0.01%过氧化氢,37℃水浴1h,在510nm处测定其吸光度值A。清除率计算公式如下:
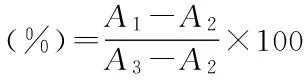
式中:A1:1mL邻二氮菲+2mLPBS+1mLFeSO4+1mL多糖水溶液+1mLH2O2;A2:1mL邻二氮菲+2mLPBS+1mLFeSO4+1mLH2O+1mLH2O2;A3:1mL邻二氮菲+2mLPBS+1mLFeSO4+2mLH2O。
1.2.4.2 过氧化氢清除活性的测定 参照文献[14],取40mmol/L过氧化氢磷酸缓冲溶液(0.2mol/L,pH7.4)0.5mL,多糖水溶液0.5mL于试管中,用磷酸缓冲溶液(0.2mol/L,pH7.4)稀释至8mL,摇匀,静置反应10min,在210nm处测其吸光度A。清除率计算公式如下:
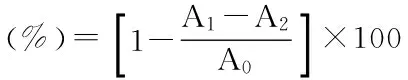
式中:A1:0.5mL H2O2+0.5mL多糖水溶液+7mL磷酸缓冲溶液;A2:0.5mL多糖水溶液+7.5mL磷酸缓冲溶液;A0:0.5mL H2O2+7.5mL磷酸缓冲溶液。
1.2.4.3 超氧阴离子自由基清除活性的测定 参照文献[15],在具塞试管中分别加入0.3mL多糖水溶液,5mL Tris-HCl缓冲溶液(0.05mol/L,pH8.2),混匀,37℃水浴20min。再加入7.5mmol/L的邻苯三酚溶液0.3mL,迅速摇匀,在37℃条件下,320nm处80s内每5s测量一次,绘制邻苯三酚自氧化曲线,求出斜率F。清除率计算公式如下:

式中:F1:5mL Tris-HCl+0.3mL多糖水溶液+0.3mL邻苯三酚;F0:5mL Tris-HCl+0.3mL H2O+0.3mL邻苯三酚。
1.2.4.4 DPPH·清除活性的测定 参照文献[16],取0.1mmol/L的DPPH·乙醇溶液4mL与不同浓度多糖水溶液1mL混匀,室温下避光静置50min,在516nm处测其吸光度值A。清除率计算公式如下:

式中:A1:4mL DPPH·+1mL多糖水溶液;A2:4mL 乙醇+1mL多糖水溶液;A0:4mL DPPH·+1mL H2O。
1.2.5 芡实多糖对质粒DNA氧化损伤的防护作用 采用琼脂糖凝胶电泳法研究芡实多糖对质粒DNA氧化损伤的防护作用。精密量取1μL pBR322 DNA(100ng/μL),2μL多糖水溶液加入微量离心管中,混匀。再加入30%过氧化氢1μL,用蒸馏水补足反应体积至5μL,37℃水浴25min后,紫外光照射15min。结束后,加入6×Loading buffer 2.5μL,混匀后点样于1%琼脂糖凝胶,80V电压下电泳50min,使溴酚蓝移动到距胶板正极端约l cm处时停止电泳。以DL5000 DNA Marker作为定量分析标准,在凝胶成像系统下观察电泳结果,并定量分析超螺旋结构剩余含量。
2 结果与讨论
2.1 芡实多糖提取条件优化
由正交实验结果得知:芡实多糖提取因素的显著性为pH>提取温度>料液比>酶用量>超声时间>提取时间。由表2可得,最佳提取条件为:料液比为1∶20,pH3,纤维素酶用量为原料质量的2.0%,超声时间为5min,提取时间为3h,提取温度为40℃,最佳得率为17.04%。纯化后芡实多糖纯度为84.32%,蛋白脱除率为67.45%。
2.2 芡实多糖的体外抗氧化活性
2.2.1 羟基自由基清除活性 羟基自由基(OH·)是一种重要的活性氧,在人体内主要由代谢产生,由于具有极强的氧化能力,其在人体内可能引起一系列病变。如图1所示,当多糖质量浓度从1mg/mL增大至10mg/mL时,OH·的清除率逐渐升高,其IC50值为6.96mg/mL。
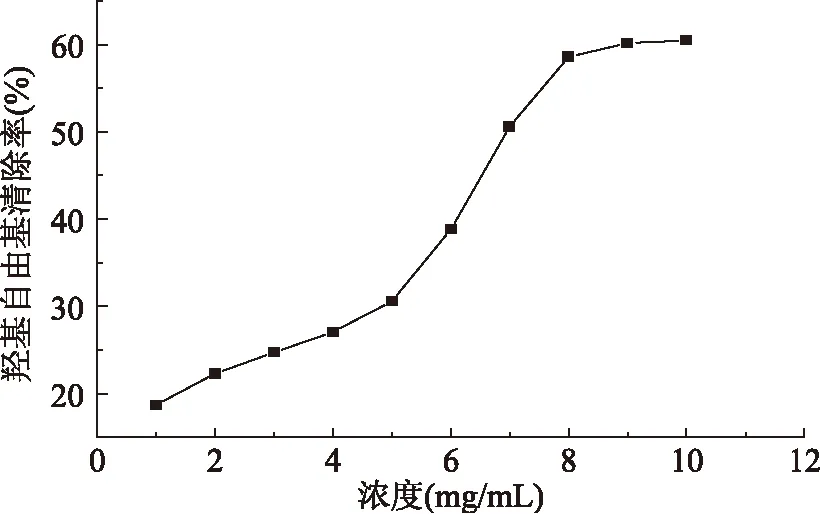
图1 芡实多糖的羟基自由基清除活性Fig.1 The hydroxyl radical scavenging activity of Semen Euryl polysaccharide
2.2.2 过氧化氢清除活性 过氧化氢是一种很强的抗氧化剂,可致人体遗传物质DNA损伤及基因突变,加快衰老进程,与老年帕金森氏病、脑中风、动脉硬化及糖尿病性肾病和糖尿病性神经性病变的发展密切相关[17]。如图2所示,在质量浓度为1~7mg/mL范围内,过氧化氢清除率随着浓度的升高而增大,当质量浓度为7mg/mL时,过氧化氢清除率为48.00%,但当质量浓度大于7mg/mL时,其清除率趋于平缓。

表2 多糖提取的正交实验Table 2 Orthogonal experiment of polysaccharide extraction

图2 芡实多糖的过氧化氢清除活性Fig.2 The hydrogen peroxide scavenging activity of Semen Euryl polysaccharide
2.2.3 超氧阴离子自由基清除活性 人体内有一定数量的超氧阴离子自由基存在,不发生化学变化对人体无害,但与羟基结合后的产物会导致细胞DNA损坏,破坏人类机体功能。图3显示出芡实多糖对超氧阴离子自由基的清除效果较弱,随着多糖质量浓度的升高,其清除率呈平缓上升趋势,当多糖质量浓度为10mg/mL时,对超氧阴离子自由基的清除率仅为20.32%。
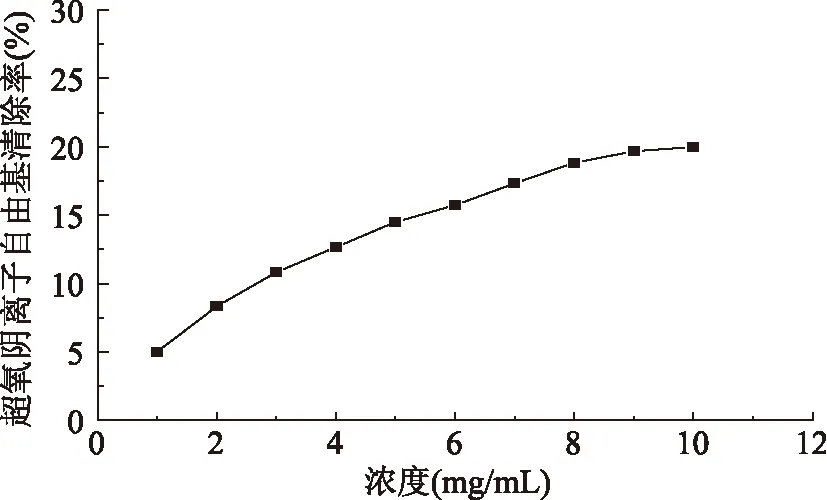
图3 芡实多糖的超氧阴离子清除活性Fig.3 The superoxide radical scavenging activity of Semen Euryl polysaccharide
2.2.4 DPPH自由基清除活性 芡实多糖对DPPH·的清除效果如图4所示,DPPH·的清除率与芡实多糖的质量浓度呈正相关,当多糖质量浓度为5mg/mL时,DPPH·的清除率达到94.63%,其IC50值为1.78mg/mL,说明芡实多糖对DPPH·有较好的清除效果。

图4 芡实多糖的DPPH·自由基清除活性Fig.4 The DPPH· scavenging acticity of Semen Euryl polysaccharide
2.3 芡实多糖对质粒DNA氧化损伤的防护作用
通常情况下,人体内H2O2的活性并不足以直接损伤DNA,然而在紫外光(UV)的照射下,过氧化氢可被光解产生羟基自由基[18],羟基自由基被认为是最活泼的活性氧,也是引起DNA氧化损伤的主要因素之一。图5显示了芡实多糖对H2O2在光解作用下诱导质粒DNA损伤的保护作用。质粒DNA在自然状态下为超螺旋结构(sc)(泳道1),在电泳状态下条带移动较快,当被损伤后,DNA可能变为开环(oc)或线性结构(lin),条带移动较慢。泳道2显示,在H2O2和UV的作用下,部分DNA由sc变为oc,因此呈现出两条谱带,超螺旋结构剩余含量为57.51%。泳道3到泳道11分别为不同浓度多糖水溶液对H2O2和UV共同作用下诱导质粒DNA损伤的影响情况。
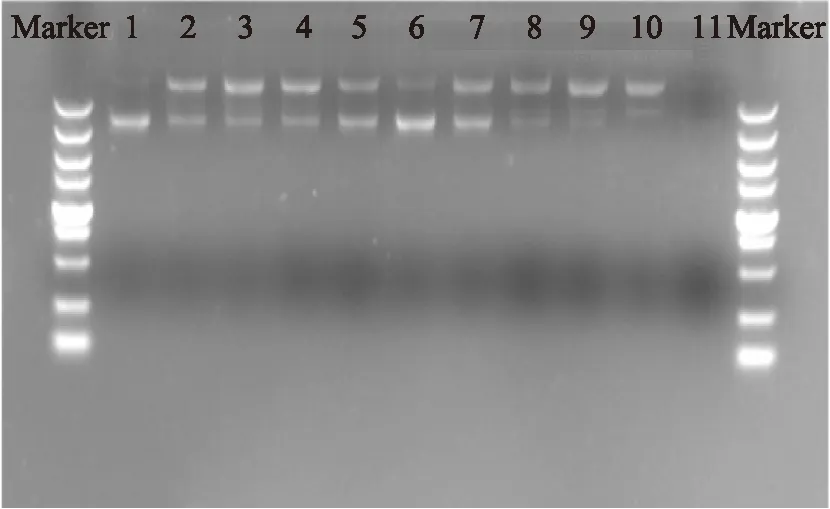
图5 不同浓度多糖水溶液对H2O2光解反应 诱导质粒DNA损伤保护作用的电泳图Fig.5 Electrophoretic pattern of pBR322 DNA after UV-photolysis and H2O2 treatment in the presence or absence of polysaccharides注:泳道1:DNA;泳道2~11:DNA+UV+H2O2+多糖溶液 (0、0.02、0.04、0.06、0.08、0.1、0.5、1.0、1.5、2.0mg/mL)。
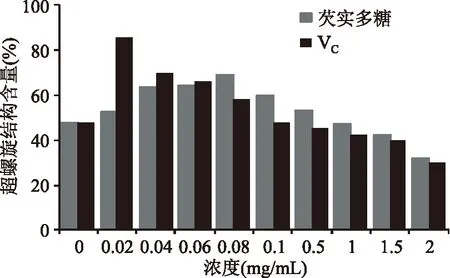
图6 不同浓度多糖水溶液及VC对H2O2光解反应 诱导质粒DNA损伤保护作用超螺旋结构含量的影响Fig.6 Remaining SC form of pBR322 DNA after UV-photolysis and H2O2 treatment in the presence or absence of polysaccharides and VC
图6中对比了芡实多糖和VC对DNA氧化损伤的影响,结果表明,芡实多糖在质量浓度为0.02~0.5mg/mL范围内,对质粒DNA的保护作用先增大后减小,在质量浓度为0.08mg/mL时,对质粒DNA的保护作用最好,超螺旋结构剩余含量为68.39%,质量浓度大于1.0mg/mL时,促进了DNA的损伤;VC在质量浓度为0.02mg/mL时保护作用最佳,超螺旋结构剩余含量为85.66%,当VC质量浓度大于0.08mg/mL时,对DNA存在一定的损伤作用,这与周殿风等[19]测定VC对质粒DNA氧化损伤的防护作用的结果相同。芡实多糖及VC在低浓度时均呈现出对DNA损伤的保护作用,而在高浓度时增大了损伤作用,其原因有待进一步探究,但由此可以说明,药物浓度过高可能对机体有副作用。对比芡实多糖水溶液体外抗氧化性能及对DNA氧化损伤的保护作用可得,后者的作用浓度远小于前者,推测其原因是DNA本身对一定浓度H2O2的损伤具有抑制作用[20],多糖水溶液只需清除部分自由基即可达到保护效果,且多糖对DNA的保护作用不仅仅是简单清除自由基,更有可能通过与DNA的络合、嵌入等方式形成加合物从而起到保护作用[21]。
3 结论
本文采用纤维素酶超声辅助法提取芡实多糖,最佳提取条件为:料液比为1∶20(g/mL),pH3,纤维素酶用量为原料质量的2.0%,超声时间为5min,提取时间为3h,提取温度40℃,最佳得率为17.04%。脱除蛋白后,多糖纯度为84.32%。比较芡实多糖水溶液对不同自由基的清除效果可得,芡实多糖对DPPH·有较好的清除效果,在质量浓度为5mg/mL时,清除率为94.63%;对羟基自由基、过氧化氢的清除效果较为明显,质量浓度为10mg/mL时,对羟基自由基清除率为60.67%,质量浓度为7mg/mL时,对过氧化氢清除率为48.00%;对超氧阴离子自由基的清除效果较弱,质量浓度为10mg/mL,清除率仅为20.32%。
探讨不同浓度芡实多糖水溶液对H2O2光解反应诱导质粒DNA氧化损伤的保护作用,发现在0.02~0.5mg/mL质量浓度范围内,芡实多糖水溶液对质粒DNA有较好的保护作用,当质量浓度为0.08mg/mL时最佳,DNA超螺旋结构剩余含量为68.39%,但当质量浓度大于0.08mg/mL时,VC对DNA呈现损伤作用,而芡实多糖水溶液在1.0mg/mL以下对DNA均呈现出保护作用,其对DNA保护作用的浓度范围比VC更宽。综上所述,芡实多糖具有较好的抗氧化活性,对DNA氧化损伤具有较为显著的保护作用,是一种天然有效的抗氧化剂,可以广泛用于食品添加剂及保健食品中。
[1]沈蓓,吴启南,陈蓉,等.芡实的现代进展研究[J].西北药学杂志,2012,27(2):185-187.
[2]刘玉凤,王保国,张晓娟,等.芡实多糖的水提醇沉工艺研究[J].中华中医药学刊,2012,30(5):1100-1102.
[3]李素云,王立芹,郑稼琳,等.自由基与衰老的研究进展[J].中国老年学杂志,2007,27(20):2046-2048.
[4]崔剑,李兆陇,洪啸吟,等.自由基生物抗氧化与疾病[J].清华大学学报:自然科学版,2000,40(6):9-11.
[5]王红丽,杨孝来,王彩琴,等.枸杞多糖的抗脂质过氧化作用研究[J].卫生职业教育,2005,23(17):112-113.
[6]陈克克.党参多糖含量和组成分析及其对质粒DNA的保护作用研究[D].西安:陕西师范大学,2007.
[7]谢燕娟,陈晓丹,王晓波,等.超声波辅助提取芡实多糖条件优化[J].食品研究与开发,2010,31(8):15-18.
[8]刘玉风,王保国,李会娟,等.芡实多糖的分离纯化及抗氧化作用研究[J].济宁医学院学报,2011,34(6):392-394.
[9]赵翾,李红良,叶倩雯.芡实多糖的粗提取及其对羟自由基的清除效果[J].食品与发酵工业,2010,36(11):177-181.
[10]涂宗财,张秋婷,王辉,等.酸角果肉多糖的提取工艺优化研究[J].食品工业科技,2010,31(10):303-305.
[11]祝士惠.画眉草中多糖成分提取及其应用研究[D].无锡:江南大学,2011.
[12]邹林武,赵谋明,游丽.香菇多糖提取工艺的优化及其抗氧化活性研究[J].食品工业科技,2013,19(34):178-179.
[13]金鸣,蔡亚欣,李金荣,等.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553-555.
[15]Xie Z J,Huang J R,Xu X M,et al. Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J]. Food Chemistry,2008,111:370-376.
[16]王和才,胡秋辉.DPPH法测定紫红薯提取物清除自由基的能力[J].食品研究与开发,2010,31(1):133-134.
[17]Wiseman H,Halliwell B. Damage to DNA by reactive oxygen and nitrogen species:role in infammatory disease and progression to cancer[J].Biochemical Journal,1996,313:17-29.
[18]Akhilesh K,Sharmila C. DNA damage protecting activity and antioxidant potential of pudina extract[J].Food Chemistry,2007,100:1377-1384.
[19]周殿风,柯惟中,陈年风,等.不同浓度维生素C对DNA紫外损伤的影响[J].光谱学与光谱分析,2005,25(12):2012-2015.
[20]张德莉,朱圣姬,罗光富,等.自由基与DNA氧化损伤的研究进展[J].三峡大学学报:自然科学版,2004,26(6):564-565.
[21]张海容.修饰多糖的抗氧自由基活性及其与DNA结合机理的荧光法研究[D].广州:华南理工大学,2003.
Antioxidant activity and protective effect on oxidative plasmid DNA damage of polysaccharides fromSemenEuryales
ZHANG Yi,SUN Pei-dong*,CHEN Gui-bing,CAO Guang-qun
(The Key Laboratory of Food Colloids and Biotechnology,Ministry of Education,School of Chemical and Material Engineering,Jiangnan University,Wuxi 214122,China)

SemenEuryales;extracts;antioxidant potential;oxidative DNA damage
2014-08-08
张溢(1988-),女,硕士研究生,研究方向:化学工程。
*通讯作者:孙培冬(1967-),女,硕士,副教授,研究方向:天然活性成分提取及有机合成。
TS201.1
A
1002-0306(2015)11-0122-05
10.13386/j.issn1002-0306.2015.11.016

