山羊INHA和INHBA基因的cDNA克隆、序列分析及组织表达研究
郑 杰,刘 霜,罗 斌,字向东
(西南民族大学生命科学与技术学院,四川 成都 610041)
山羊INHA和INHBA基因的cDNA克隆、序列分析及组织表达研究
郑 杰,刘 霜,罗 斌,字向东
(西南民族大学生命科学与技术学院,四川 成都 610041)
分别提取处于同一发情周期的5只低繁藏山羊和5只高繁金堂黑山羊的卵巢、垂体的总RNA,并通过RT-PCR技术对INHA、INHBA基因cDNA进行克隆、序列分析,以Real-time PCR技术对其进行组织表达研究.结果表明:藏山羊和金堂黑山羊INHA基因编码区均长1083bp,编码360个氨基酸,两品种基因编码区有7处碱基不同,并导致3处氨基酸的差异;INHBA基因编码区均长1278bp,编码425个氨基酸,两品种基因编码区有4处碱基不同,并导致1处氨基酸的差异.藏山羊INHA基因编码区核苷酸序列与金堂黑山羊、绵羊、牛、野猪、小鼠、褐家鼠、人的同源性分别为:99.4%、98.9%、95.8%、88.6%、81.0%、79.5%和84.8%;藏山羊INHBA基因编码区核苷酸序列与金堂黑山羊、绵羊、牛、野猪、小鼠、褐家鼠、人的同源性分别为:99.7%、99.4%、98.1%、91.7%、88.0%、88.5%和91.2%.INHA和INHBA基因mRNA在两个山羊品种的卵巢、垂体中均有表达,但两品种间无显著性差异(P>0.05).说明INHA和INHBA基因在动物进化中比较保守,与山羊多羔性状的相关性有待进一步研究.
藏山羊;金堂黑山羊;INHA;INHBA;多羔性状
抑制素(inhibin,INH)是由睾丸支持细胞和卵巢颗粒细胞分泌的一种大分子糖蛋白激素,属于TGF-β家族成员[1].抑制素有 α(INHA)、βA(INHBA)和 βB(INHBB)三种类型的亚基基因[2],是由 α、β 两个亚基通过二硫键连接形成的异二聚体,可协同激活素通过内、旁和自分泌途径特异性抑制垂体前叶合成和分泌促卵泡素(FSH),进而影响雌性动物卵泡的发育和排卵的数量[3-4].抑制素可促进促黄体生成素(LH)的分泌,但剂量高于界定值时会抑制LH的分泌[5].在雄性动物中,抑制素可抑制精子的发生过程并降低睾丸的生精能力,使精液的生成量减少,也有刺激睾丸间质细胞产生睾酮的作用,从而影响哺乳动物的繁殖性能[6-7].许多研究结果表明,抑制素与FSH呈负相关关系,对动物体内卵泡发育具有反馈调节作用,所以可推断出抑制素是动物体排卵数的原始信号并且调控FSH的分泌[8],已被作为与动物繁殖性能相关的候选基因[9-13].目前国内外关于抑制素对绵羊繁殖力影响的研究较多,但对山羊繁殖力影响的研究不多.
藏山羊广泛分布在青藏高原,其产乳和繁殖性能较低,性成熟较晚.母羊多一年一胎,每胎多产1羔,产羔率约为110%[14].金堂黑山羊是经长期群选群育形成的优良地方山羊品种,主要分布在成都市金堂县及周边,具有多胎、繁殖力高等特点[15].山羊的产羔数是山羊生产中具有巨大经济效益的繁殖性状,其遗传力较低(0.05~0.15)[16],所以常规的选育方法效果不明显,进展缓慢.因此寻找影响山羊多胎性的主效基因,提高山羊的产羔数,对于提高山羊产业的经济效益具有重大的意义.故本研究通过对单胎山羊品种藏山羊与多胎山羊品种金堂黑山羊INHA和INHBA基因的cDNA克隆、序列分析、组织表达分析,以探索INHA和INHBA基因在山羊卵母细胞形成中可能发挥的作用,以期为研究山羊多胎机制提供理论依据.
1 材料与方法
1.1 试验动物及样品采集
本试验分别在四川省理县和金堂县选取藏山羊和金堂黑山羊各5只.对选取的10只母山羊同时进行同期发情处理[17]:首先把孕酮阴道栓(CIDR)牢固塞入山羊阴道内,避免掉落,再经10天后选择肌肉注射氯前列醇钠(Merck Animal Health,Canada)2mL,第二天取出CIDR.最后将取出CIDR的母山羊经40h后进行屠宰,并立即进行样品采集,用已做好标记的冷冻管装好采集的卵巢、垂体等组织,投入到液氮罐中保存.
1.2 主要试剂和载体
DNA Marker DL2000、2×Taq PCR MasterMix购自上海天根生物科技有限公司;E.coli DH5α感受态细胞购自康迪生物技术有限公司;克隆载体pMD-19 Vector、IPTG、X-Gal、氨苄青霉素均购自大连宝 Taka-Ra生物工程有限公司;反转录试剂盒购自Fermentas(MBI)公司;SsoAdvancedTMSYBRGreen Supermix购自伯乐公司;DNA凝胶回收试剂盒购自康宁生命科学(吴江)有限公司;引物合成与测序由成都擎科梓熙生物技术有限公司完成.
1.3 总RNA的提取和cDNA第一链的合成
采用Trizol法提取金堂黑山羊和藏山羊2种组织(卵巢、垂体)的总RNA.用Fermentas(MBI)公司的试剂盒进行cDNA第一链的合成.
1.4 引物设计和PCR扩增
根据选用的NCBI上已发表的INHA、INHBA的基因序列,利用Primer Premier 5设计克隆引物,引物序列见表1.PCR扩增程序:95℃预变性5 min;95℃变性45s,57℃(INHA)、58℃ (INHBA)退火 40s,72 ℃ 延伸120s,32个循环;最后72℃延伸5 min;4℃保存.

表1 克隆引物序列Table 1 Primer pairs for cloning
1.5 INHA、INHBA基因的克隆和测序
首先用含有GoldView的1%琼脂糖凝胶电泳对PCR产物进行检测,再经DNA胶回收试剂盒对其进行回收.将 0.5μL pMD-19Vector、4.5μL 纯化回收产物和5μL Solution于16℃金属浴中反应过夜,保证连接彻底.连接后的产物再转化100μL宿主菌E.coli DH5α感受态细胞,然后经冰浴、热激活等步骤后均匀涂布于含有0.1%的氨苄青霉素(Amp)的LB固体培养基上,涂布至干后封口倒置于37℃恒温培养箱中培养12h.在超净工作台中,用灭菌枪头挑取白色单克隆菌落于含有Amp(浓度为0.1%)的LB液体培养基中,37℃、180rpm震荡培养6~8h至菌液浑浊.取0.5μL菌液作为模板进行PCR扩增反应及电泳检测鉴定后,最后挑选含目的基因片段的阳性单克隆菌液送至成都擎科梓熙生物技术有限公司进行测序.
1.6 INHA、INHBA基因的生物信息学分析
利用 DNAstar、DNAman等软件对相应物种的INHA、INHBA基因序列进行序列对比和同源性比对,利用Clustal X、MEGA 6.0生物软件构建核苷酸系统发生树.
1.7 实时荧光定量PCR扩增
根据已测序得到的山羊INHA、INHBA的基因序列设计定量引物,引物序列见表2.

表2 定量引物序列Table 2 Primer pairs for qPCR
对藏山羊、金堂黑山羊的卵巢、垂体中的INHA、INHBA基因及内参β-actin基因mRNA表达量进行实时荧光定量 PCR检测.反应条件为:95℃预变性3min;95℃变性10s,INHA、INHBA退火温度分别为60℃ /20s、58℃ /20s,65℃ 延伸 5s,40 个循环;65℃ 延伸5min;4℃保存.每个样品设置3个重复,并设置阴性对照.实验结果采用 Pfaffl法[18]分析INHA、INHBA基因分别在两种山羊不同组织中的相对表达量,计算公式为:

其中:Eref表示内参基因的扩增效率;Etarget表示目的基因的扩增效率;△Ct1表示对照样本中目的基因的CT值与实验样本中目的基因CT值之差,△Ct2表示对照样本中内参基因的CT值与实验样本中内参基因的CT值之差.
2 结果与分析
2.1 INHA、INHBA基因PCR扩增结果
用1%琼脂糖凝胶电泳对藏山羊和金堂黑山羊INHA、INHBA基因PCR产物进行检测.结果如图1、图2所示,其中INHA和INHBA基因的目的条带清晰明亮,与预期大小基本相符,且无杂带和拖尾现象,可进行下一步实验.

图1 INHA基因PCR产物电泳检测泳道1为藏山羊INHA基因;泳道2为金堂黑山羊INHA基因;泳道M为DNA Marker DL2000Fig.1 Electrophoresis results of INHA PCR product
图2 INHBA基因PCR产物电泳检测泳道1为藏山羊INHBA基因;泳道2为金堂黑山羊INHBA基因;泳道M为DNA Marker DL2000Fig.2 Electrophoresis results of INHBA PCR product
2.2 INHA、INHBA基因核苷酸序列比对
藏山羊和金堂黑山羊INHA基因编码区均长1083bp,编码360个氨基酸,两品种基因编码区有7处碱基不同,并导致了3处氨基酸的差异.INHBA基因编码区均长1278bp,编码425个氨基酸,两品种基因编码区有4处碱基不同,并导致了1处氨基酸的差异(表3).

表3 藏山羊和金堂黑山羊INHA、INHBA基因序列差异Table 3 Sequence variations of INHA and INHBA genes in Tibetan goat and Jintang black goat
2.3 INHA、INHBA基因编码区核苷酸序列同源性比对
通过DNAstar生物软件对藏山羊与金堂黑山羊、绵羊、牛、野猪等其他物种INHA、INHBA基因CDs区核苷酸序列进行比对,分析其同源性.藏山羊INHA基因CDs区核苷酸序列与金堂黑山羊、绵羊(NM_001308579)、牛(NM_174094)、野猪(NM_214189)、小鼠 (NM010564)、褐 家 鼠 (NM_012590)、人(NM002191)的同源性分别为:99.4%、98.9%、95.8%、88.6%、81.0%、79.5%和84.8%;藏山羊INHBA基因CDs区核苷酸序列与金堂黑山羊、绵羊(NM_001009458)、牛(NM_174363)、野猪(NM_214028)、小鼠(NM_008380)、褐家鼠(NM_017128)、人(NM_002192)的同源性分别为:99.7%、99.4%、98.1%、91.7%、88.0%、88.5%和91.2%.
2.4 INHA、INHBA基因系统发生树的构建
利用Clustal X、MAGA6.0软件构建INHA和INHBA基因的Neighbor-Joining(NJ)系统发生树(图3、图4).由图3、图4可知,藏山羊与金堂黑山羊二者都是先聚为一类,再依次与绵羊、牛、野猪、人聚为一类,最后与小鼠、褐家鼠聚为一类.系统发生树的构建结果与核苷酸同源性比对结果一致,与哺乳动物进化程度相符合.

图3 INHA基因的核苷酸系统发生树Fig.3 Phylogenetic tree based on a nucleotide alignment of INHA
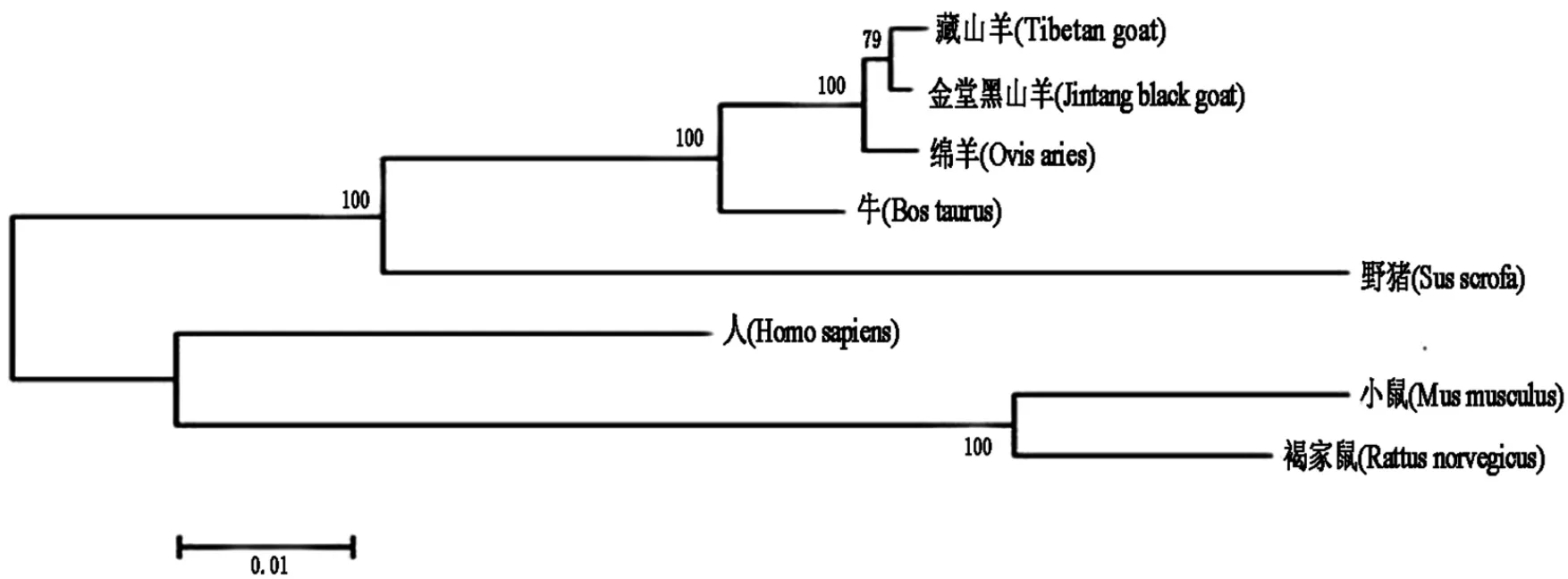
图4 INHBA基因的核苷酸系统发生树Fig.4 Phylogenetic tree based on a nucleotide alignment of INHBA
2.5 目的基因组织表达差异分析
本实验通过实时荧光定量PCR技术,以β-actin基因为参照,检测INHA和INHBA基因在藏山羊和金堂黑山羊不同组织间的mRNA表达量,结果表明:INHA和INHBA的mRNA在山羊卵巢、垂体中均有表达,但两个品种间mRNA表达量无显著性差异(P>0.05,图5 和图6).
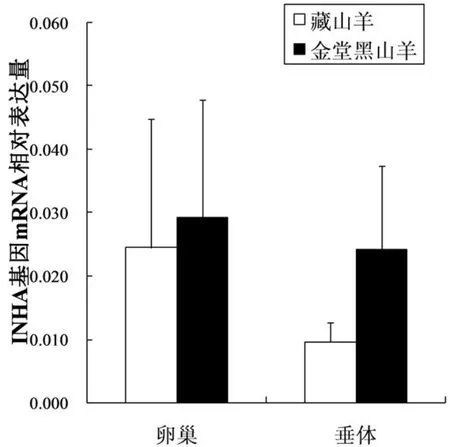
图5 INHA基因在藏山羊和金堂黑山羊不同组织中的相对表达量(Mean±SE)Fig.5 Expression of Tibetan goat and Jintang black goat INHA gene in different tissues(Mean±SE)

图6 INHBA基因在藏山羊和金堂黑山羊不同组织中的相对表达量(Mean±SE)Fig.6 Expression of Tibetan goat and Jintang black goat INHBA gene in different tissues(Mean±SE)
3 讨论
目前,大量的研究已证明抑制素对FSH具有调节作用,但对抑制素的作用机理及其受体的研究还存在较大争议[8,19].由于抑制素能够有效的抑制垂体合成和分泌FSH,而FSH作为影响动物繁殖性能的主要激素之一,其分泌量的高低会直接影响到动物排卵量的多少,所以抑制素被作为动物繁殖性能的候选基因[20].滑国华等[21]对山羊抑制素 INHA 进行 HaeⅡ酶切,对其编码区进行多态性分析,发现G等位基因可能与山羊高产性状呈正相关,并且INHA可能是影响山羊产羔数的一个主效基因.有研究报道,INHA基因的一个突变导致了关中山羊等三个山羊品种内不同基因型间产羔数的差异[22].Jaeger等[23]研究表明,INHBA对绵羊产羔数具有显著影响.索峰等[24]也发现INHBA基因是影响巴美肉山羊产羔数的重要基因.刘月琴等[25]在对太行山羊进行了抑制素的主动免疫后,发现其排卵率得到了有效地提高,进一步说明了抑制素是影响山羊排卵率的一个重要基因.
本实验选取处于发情周期相同阶段的藏山羊和金堂黑山羊为研究对象,克隆得到INHA、INHBA基因序列.藏山羊INHA基因编码区和金堂黑山羊有7处碱基不同,导致了3处氨基酸的差异;INHBA基因编码区有4处碱基不同,导致了1处氨基酸的差异.已有研究结果表明[26-28],抑制素INHA基因和INHBA基因核苷酸的突变会影响母羊的产羔数.藏山羊与金堂黑山羊INHA、INHBA氨基酸序列的差异是否会引起FSH分泌量的变化,进而使得山羊排卵数发生改变而影响山羊的繁殖性状还有待进一步研究.藏山羊、金堂黑山羊的INHA基因和INHBA基因编码区序列与绵羊、牛等其他物种的基因编码区序列的同源性都较高,说明INHA和INHBA基因在各物种间的保守性均较高.利用MAGA6.0软件构建INHA和INHBA基因的核苷酸系统发生树,结果显示,藏山羊和金堂黑山羊二者亲缘关系最近,其次是绵羊、牛、野猪,各分支的置信度高,并且符合动物分类学结果,表明系统发生树可信度较高.INHA、INHBA的mRNA分别在藏山羊和金堂黑山羊的卵巢和垂体中均有表达,但两个品种各组织间mRNA表达量均无显著性差异(P>0.05),说明山羊排卵数差异的主要原因并不是由INHA和INHBA两个基因mRNA表达量的差异引起的.
4 结论
本试验首次克隆出藏山羊、金堂黑山羊INHA和INHBA基因,两个山羊品种的INHA基因编码区序列有7处碱基不同,导致3处氨基酸的差异;INHBA基因编码区序列有4处碱基不同,导致1处氨基酸的差异.INHA和INHBA基因在两个山羊品种的卵巢和垂体中均有表达,但品种间mRNA表达量无显著性差异.
[1]李婷,张英杰,刘月琴,等.反刍动物INHA基因编码区生物信息学分析[J].中国草食动物科学,2014(S1):96-98.
[2]MASON A J,HAYFLICK J S,LING N,et al.Complementary DNA sequences of ovarian follicular fluid inhibin show precursor structure and homology with transforming growth factor-β[J].Nature,1985,318:659-663.
[3]BURGER H.Inhibin:definition and nomenclature in including related substances[J].Endocrinology,1988,117:159-160.
[4]马晓丽,刘开东,贺建宁,等.山羊多胎性状候选基因的研究进展[J].家畜生态学报,2014,35(5):7-12.
[5]李婷.RNA干扰对绵羊抑制素α亚基基因(INHA)表达的抑制效果[D].河北:河北农业大学,2014.
[6]HSUCH R S,HOCHEREAU M I.Courotz M.The process on Secretion of“Inhibin”By Rat Granulosa Cell In Vitro[J].Academy of Sciences of the United States of America,1987,84:5084-5089.
[7]CARTON R S,QUIGG H.Simple and Rapid in Vitro Bioassay for Inhibin[J].Acta Endocrinology,1981,109:1443-1444.
[8]吴迪,齐晓龙,孟洪,等.抑制素的研究与临床应用进展[J].中国奶牛,2015(1):23-36.
[9]马勇江,马毅.抑制素及其对动物繁殖的影响[J].甘肃畜牧兽医,2000(5):38-40.
[10]ENGELHARDT H,SMITH K B,MCNEILLY A S,et al.Expression of messenger ribonucleic acid for inhibin subunits and ovarian secretion of inhibin and estradiol at various stages of the sheep estrous cycle[J].Biology of Reproduction,1993,49:281-294.
[11]PALTA P,BANSAL N,PRAKASH B S,et al.Follicular fluid immunoreactive-inhibin concentrations in relation to follicular diameter and estradiol-17 beta,progesterone and testosterone concentrations in individual ovarian follicles in buffalo.Bubalus-bubalis[J].Indian Journal of Experimental Biology,1998,36:768-774.
[12]GUILBAULT L A,ROUILLIER P,MATTON P,et al.Relationships between the level of atresia and inhibin contents(alpha subunit and alpha-beta dimer)in morphologically dominant follicles during their growing and regressing phases of development in cattle[J].Biology of Reproduction,1993,48:268-276.
[13]田秀娥,孙红霞,王永军.3个绵羊群体INHA基因的遗传多态性及对产羔数的影响[J].西北农林科技大学学报:自然科学版,2010,38(1):23-29.
[14]王杰,王永,欧阳熙,等.藏山羊研究[J].中国畜牧杂志,1993,29(1):10-13.
[15]王春秀,汤守富,刘期华,等.金堂黑山羊繁殖性能的研究[J].四川畜牧兽医,2002,29(4):20-21.
[16]NOTTER DR.Genetic improvement of reproductive efficiency of sheep and goats[J].Animal Reproduction Science,2012,130(3-4):147-151.
[17]胡亮,字向东,卢建远,等.多胎和单胎山羊品种Bcl-2和Bax基因的克隆及组织表达研究[J].畜牧与兽医,2015,47(1):28-32.
[18]PFAFFL MW.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001,29(9):e45.
[19]孟丽娜.5个候选基因在4个山羊品种的多态性分析[D].河北:河北农业大学,2014.
[20]李晓丽,郭志云,曾宪垠.抑制素的研究进展及其在动物繁殖中的应用[J].四川畜牧兽医,2003(11):30-32.
[21]滑国华,陈世林,姚红卫,等.山羊抑制素α亚基基因HaeⅡ酶切多态性及其与产羔数性状的关联分析[J].遗传,2007,29(8):972-976.
[22]HOU J,AN X,LI G,et al.Exploring polymorphisms and their effects on reproductive traits of the INHA and INHβA genes in three goat breeds[J].Journal of Animal Science,2012,83(4):273-278.
[23]JAEGER C,HIENDLEDER S,Cosmid cloning and characterization of the coding regions and regulatory elements of the ovine α-(INHA),βA-(INHBA)and βB-inhibin(INHBB)genes[J].Animal Genetics,1994,25(2):33.
[24]索峰,刘永赋,特日格勒,等.巴美肉羊INHA和INHBA基因多态性与产羔数关系研究[J].华北农学报,2012,27(3):115-119.
[25]刘月琴,刘彦彬,张英杰,等.抑制素免疫对初产母羊排卵率的影响[J].今日畜牧兽医,2013(2):60-61.
[26]董李学,刘月琴,张英杰,等.辽宁绒山羊抑制素A基因遗传变异与双羔性状的关联分析[J].河北农业大学学报,2010,33(1):70-73.
[27]祝铁钢,高彦华,王锋,等.山羊抑制素βA基因多态性的分析[J].畜牧与兽医,2009,41(6):39-41.
[28]周文然,储明星,孙少华,等.小尾寒羊高繁殖力候选基因INHA的研究[J].农业生物技术学报,2007,15(1):32-36.
cDNAcloning,sequence analysis and tissue expression of INHA and INHBA genes in goats
ZHENG Jie,LIU Shuang,LUOBin,ZI Xiang-dong
(School of Life Science and Technology,Southwest University for Nationalities,Chengdu 610041,P.R.C.)
Ovary and pituitary samples were collected from five non-prolific Tibetan goats and five prolific Jintang black goats in estrus,to clone and analyze sequences ofINHAandINHBAcDNA by RT-PCR,and their mRNA expression levels were determined by real-time PCR.The result showed that the coding region of Tibetan goat and Jintang black goatINHAgene were 1083bp long,encoding 360 amino acids.There were seven base changes between the two breeds,leading to three differences in amino acid.The coding region of Tibetan goat and Jintang black goatINHBAgene were 1278bp long,encoding 425 amino acids.There were four base changes between the two breeds,leading to one amino acid difference.The homologies of coding region ofINHAgene between Tibetan goat,Jintang black goat,Ovis aries,Bos taurus,Sus scrofa,Mus musculus,Rattus norvegicus,Homo sapiens were 99.4% ,98.9% ,95.8% ,88.6% ,81.0% ,79.5%and 84.8% ,respectively.The homologies of coding region ofINHBAgene between Tibetan goat,Jintang black goat,Ovis aries,Bos taurus,Sus scrofa,Mus musculus,Rattus norvegicus,Homo sapiens were 99.7%,99.4%,98.1%,91.7%,88.0%,88.5%and 91.2%,respectively.TheINHAandINHBAmRNA were expressed in ovary and pituitary in both goat breeds,but there was no significant difference between the two breeds(P >0.05).The result showed that bothINHAandINHBAgenes were conservative in animal evolution,and their effect on prolificacy in goats needs to be further studied.
Tibetan goat;Jintang black goat;INHA;INHBA;prolificacy
S814;S827
A
2095-4271(2015)06-0672-06
10.11920/xnmdzk.2015.06.003
2015-08-15
字向东(1963-),男,白族,云南云龙人,教授,研究方向:动物遗传育种与繁殖,E-mail:zixd@sina.com
四川省应用基础项目(2013JY0043)
(责任编辑:李建忠,付强,张阳,罗敏;英文编辑:周序林,郑玉才)

