海洋拟诺卡菌SCSIO 11492中次生代谢产物的分离及其抗肿瘤活性研究
苏瑞强,李 晏,彭 坤,李 洁,杨 全,杨献文(.广东药学院中药学院,广东广州50006;.解放军4医院器械科,浙江舟山500;.中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室,广东广州500)
・论著・
海洋拟诺卡菌SCSIO 11492中次生代谢产物的分离及其抗肿瘤活性研究
苏瑞强1,李 晏2,彭 坤1,李 洁3,杨 全1,杨献文3(1.广东药学院中药学院,广东广州510006;2.解放军413医院器械科,浙江舟山510301;3.中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室,广东广州510301)
目的 探索海洋来源的拟诺卡菌(Nocardiopsis sp.)SCSIO 11492的抗肿瘤活性次生代谢产物。方法 采用硅胶、凝胶、ODS等色谱分离方法对海洋来源的拟诺卡菌SCSIO 11492的发酵粗提物进行分离、纯化,根据次生代谢产物的核磁数据及相关的理化性质确定化合物的结构,最后利用活性测试发现活性成分。结果 从海洋拟诺卡菌SCSIO 11492中分离纯化得到5个化合物,经鉴定分别为2′-脱氧腺苷(2′-deoxyadenosine,1)、2′-脱氧胸腺嘧啶核苷(2′-deoxythymidine,2)、2′-脱氧尿苷(2′-deoxyuidine,3)、尿嘧啶核苷(uridine,4)、1-O-棕榈酰基-3-O-β-D-半乳糖基甘油酯(1-O-hexadecanoyl-3-O-β-D-galactopyranosylglycerol,5)。活性测试结果表明化合物5对RAW 264.7显示出较好的生长抑制活性(IC50=10.9μmol/L)。结论 从海洋拟诺卡菌SCSIO 11492中分离得到5个化合物,均为首次从该属中分离得到。其中化合物5可能是该菌抗肿瘤的活性成分。
海洋放线菌;拟诺卡菌;次生代谢产物;抗肿瘤
放线菌是一种非常重要的药源微生物,在已报道的约23 000个具有生物活性的微生物次生代谢产物中,超过10 000个由放线菌所产生。而目前已发现的天然抗生素中有超过2/3是由放线菌所产生[1]。此外,放线菌也产生其他生物活性次生代谢产物,包括临床上使用的抗肿瘤药物丝裂霉素和道诺霉素[2]及免疫抑制剂雷伯霉素和FK506等[3]。然而,经过多年的开发研究,目前从陆生放线菌中获得新活性物质的概率正在逐渐下降[4]。人们将目光转向资源更加丰富的海洋,由于海洋环境极大地不同于陆地环境,因此其次生代谢产物在结构类型及生物活性方面都呈现出与陆生放线菌不同的特点与多样性[5]。为从海洋放线菌中发现结构新颖、活性较好的次生代谢产物,笔者前期对一批海洋来源的放线菌进行了体外抗肿瘤活性筛选,发现其中一株拟诺卡菌(Nocardiopsis sp.)SCSIO 11492具有较好的活性,因此对该株菌进行了大规模发酵培养,通过系统的化学成分研究,从中分离得到5个次生代谢产物(图1),利用NMR等波谱数据,结合理化性质鉴定其结构分别为2′-脱氧腺苷(2′-deoxyadenine,1)、2′-脱氧胸腺嘧啶核苷(2′-deoxythym idine, 2)、脱氧尿苷(deoxyuidine,3)、尿嘧啶核苷(uridine,4)、1-O-棕榈酰基-3-O-β-D-半乳糖基甘油酯(1-O-hexadecanoyl-3-O-β-D-galactopyranosylglycerol,5)。对上述化合物进行了体外抗肿瘤活性检测,发现化合物5对RAW 264.7显示出较好的生长抑制活性(IC50=10.9μmol/L)。
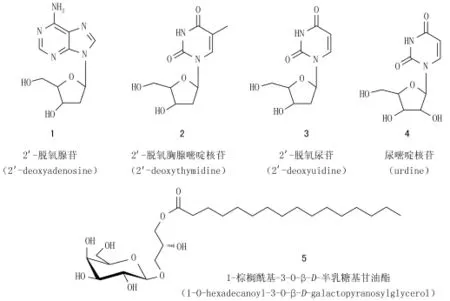
图1 海洋拟诺卡菌SCSIO 11492中分离得到的次生代谢产物
1 仪器与材料
1.1仪器 Bruker AV-500核磁共振波谱仪(德国bruker公司);API 2000质谱仪(美国AB公司);薄层色谱硅胶及硅胶板(烟台江友硅胶有限公司);凝胶Sephadex LH-20(40~70μm,Amersham Pharmacia公司);旋转蒸发仪(日本东京理化公司)。
1.2材料
1.2.1 菌株 海洋拟诺卡菌SCSIO 11492分离自鹿回头岸礁(-6 310 m;142°19.9′E,10°54.6′N)多孔鹿角珊瑚(Acropora m illepora)。经16S rRNA序列(688 bp)比对,与Nocardiopsis f lavescens SA6(T)GU99763的相似度为100%,故确定为拟诺卡菌SCSIO 11492。该菌株保存于中国科学院南海海洋研究所海洋微生物研究中心。
1.2.2 细胞 RAW 264.7(小鼠单核巨噬细胞白血病细胞)、HepG2(人肝癌细胞)、A549(人肺腺癌细胞),均购自中国科学院上海生化细胞所。
1.2.3 培养基 将可溶性淀粉(15 g/L)、大豆粉(5 g/L)、蛋白胨(15 g/L)、甘油(15 g/L)、CaCO3(2 g/L)及海盐(3%)加热溶解,调pH至7.4,分装后于121℃高压灭菌30 m in,待其冷却使用。
2 菌株发酵与分离
2.1发酵 将海洋拟诺卡菌SCSIO 11492接种到80瓶250m l的锥形瓶中(每瓶中30m l培养液),置28℃的培养箱内,200 r/m in震荡培养,48 h后分别将锥形瓶中的种子培养液倒入1 L的锥形培养瓶内(内含270 m l的发酵培养液),继续振荡培养7~8 d,得到24 L发酵液。
2.2次生代谢产物分离 发酵液过滤后的滤液用相同体积的乙酸乙酯萃取3次,萃取液减压蒸干;菌丝体部分用丙酮超声(30 m in)提取后过滤,滤液减压蒸干。经TLC检测对比,发现两部分成分相似,合并后得到5 g浸膏。浸膏通过硅胶柱(100~200目)梯度洗脱(氯仿-丙酮,0%→100%),得到2个组分(Fr.1和Fr.2)。将组分Fr.1通过反相中压,经MeOH-H2O梯度洗脱,最后经凝胶Sephadex LH-20柱(氯仿-甲醇,1∶1)反复纯化得到化合物1(20.1 mg)、2(10.9 mg)和3(13.5 mg)。通过相似的方法,从组分Fr.2得到化合物4(22.1 mg)和5(6.4 mg)。
化合物1:白色粉末,1H NMR(CD3 OD,500 MHz)δH8.32(1H,s,H-8),8.17(1H,s,H-2),6.42(1H,dd,J=7.9,6.1 Hz,H-1′),4.58(1H,dt,J=5.8,2.5 Hz,H-3′),4.07(1H,m,H-4′),3.84(1H,dd,J=12.3,3.0 Hz,H-5′a),3.75(1H,dd,J=12.3,3.4 Hz,H-5′b),2.80(1H,ddd,J=13.4,8.0,5.8 Hz,H-2′a),2.43(1H,ddd,J=13.4,6.0,2.6 Hz,H-2′b);13C NMR(CD3OD,125 MHz)δC157.5(C-6),153.5(C-2),149.9(C-4),141.6(C-8),120.8(C-5),89.9(C-1′),87.1(C-4′),73.1(C-3′),63.7(C-5′),41.5(C-2′)。
化合物2:白色粉末,1H NMR(CD3OD,500 MHz)δH7.81(1H,s,H-6),6.27(1H,t,J=7.0 Hz,H-1′),4.41(1H,m,H-4′),3.91(1H,m,H-3′),3.80(1H,dd,J=12.5,3.5 Hz,H-5′a),3.78(1H,dd,J=12.5,3.5 Hz,H-5′b),2.24(2H,m,H-2′)1.87(3H,d,J=0.8 Hz,5-CH3);δC 166.4(C-4),152.4(C-2),138.2(C-6),111.6(C-5),88.8(C-1′),86.3(C-4′),72.2(C-3′),62.9(C-5′),41.2(C-2′),12.4(5-CH3)。
化合物3:白色固体,1H NMR(CD3OD,500 MHz)δH 7.98(1H,d,J=7.5 Hz,H-6),6.26(1H,t,J=6.5 Hz,H-1′),5.71(1H,d,J=7.5 Hz,H-5),4.38(1H,m,H-4′),3.94(1H,q,J=3.5 Hz,H-3′),3.77(1H,dd,J=12.0,3.2 Hz,H-5′a),3.72(1H,dd,J=12.0,3.8 Hz,H-5′b),2.29(1H,dq,J=13.6,3.5 Hz,H-2′a),2.20(1H,m,H-2′b);13C NMR(CD3OD,125 MHz)δC166.2(C-4),152.2(C-2),142.5(C-6),102.7(C-5),89(C-1′),86.6(C-4′),72.2(C-3′),62.9(C-5′),41.3(C-2′)。
化合物4:白色固体,1H NMR(CD3 OD,500 MHz)δH8.00(1H,d,J=8.1 Hz,H-6),5.90(1H,d,J=4.8 Hz,H-1′),5.70(1H,d,J=8.1 Hz,H-5),4.18(1H,t,J=5.1 Hz,H-2′),4.15(1H,t,J=4.9 Hz,H-3′),4.00(1H,dt,J=4.3,3.0 Hz,H-4′),3.82(1H,dd,J=12.2,2.7 Hz,H-5′a),3.73(1H,dd,J=12.2,3.1 Hz,H-5′b);13C NMR(CD3OD,125 MHz)δC166.2(C-4),152.6(C-2),142.7(C-6),102.7(C-5),90.7(C-1′),86.5(C-4′),75.7(C-3′),71.4(C-2′),62.3(C-5′)。
化合物5:白色固体,1H NMR(CD3OD,500 MHz)δH4.24(1H,d,J=7.2 Hz,H-1″),3.0-4.2(11H,m,H-2″-6″,H-1-3),2.35(2H,t,J=7.4 Hz,H3-2′),1.60(2H,m,H-3′),1.28(24H,m,H-4′-15′),0.87(3H,t,J=7.6 Hz,H3-16′);13C NMR(CD3 OD,125 MHz)δC 175.5(C-1′),105.2(C-1″),76.7(C-2″),74.8(C-3″),72.6(C-5″),71.9(C-3),70.3(C-4″),69.6(C-2),66.5(C-1),62.5(C-6″),35.0(C-2′),30.2-31.0(C-5′-13′),28.1(C-4′),26.0(C-3′),23.8(C-15′),14.4(C-16′)];ESI-MS m/z:515[M+Na]+。
3 体外细胞毒活性测试
分别将3株肿瘤细胞RAW 264.7、HepG2、A549[(1~2)×105个/m l]以200μl每孔加入到96孔板上,置5%CO2、37℃培养箱中孵育过夜,24 h后加药孵育24 h。每孔加入100μl的M TT(0.5 mg/m l),继续培养4 h,小心吸去孔内培养液。每孔加入100μl DMSO,置摇床上低速振荡10~15 m in,然后在酶联免疫检测仪波长570 nm处测量各孔的吸光值。
4 结构鉴定
化合物1:白色粉末,在其1H NMR(CD3OD,500 MHz)谱图中可发现特征的2-脱氧-D-核糖信号,即高场部分有6个H信号:δH4.58(1H,dt,J=5.8,2.5 Hz,H-3′),4.07(1H,m,H-4′),3.84(1H,dd,J=12.3,3.0 Hz,H-5′a),3.75(1H,dd,J=12.3,3.4 Hz,H-5′b),2.80(1H,ddd,J=13.4,8.0,5.8 Hz,H-2′a),2.43(1H,ddd,J=13.4,6.0,2.6 Hz,H-2′b),低场有1个端基质子信号:6.42(1H,dd,J=7.9,6.1 Hz,H-1′)。结合其13C NMR(CD3OD,125 MHz)谱图里的5个对应的C信号:δC 89.9(C-1′),87.1(C-4′),73.1(C-3′),63.7(C-5′),41.5(C-2′),确认化合物1含有2-脱氧-D-核糖。此外还发现一个嘌呤的特征片段[δH8.32(1H,s,H-8),8.17(1H,s,H-2);δC157.5(C-6),153.5(C-2),149.9(C-4),141.6(C-8),120.8(C-5)],因此可确定化合物1为2′-脱氧腺苷(2′-deoxyadenosine),其波谱数据与文献报道一致[6,7]。
化合物2:白色粉末,与化合物1类似,其1H(CD3OD,500 MHz)和13C(CD3OD,125 MHz)NMR谱图里有明显相同的2-脱氧-D-核糖片段:δH 6.27(1H,t,J=7.0 Hz,H-1′),4.41(1H,m,H-4′),3.91(1H,m,H-3′),3.80(1H,dd,J=12.5,3.5 Hz,H-5′a),3.78(1H,dd,J=12.5,3.5 Hz,H-5′b),2.24(2H,m,H-2′);δC88.8(C-1′),86.3(C-4′),72.2(C-3′),62.9(C-5′),41.2(C-2′)。此外还发现一个明显的胸腺嘧啶片段:δH 7.81(1H,s,H-6),1.87(3H,d,J=0.8 Hz,5-CH3);δC 166.4(C-4),152.4(C-2),138.2(C-6),111.6(C-5),12.4(5-CH3)。因此,确定化合物2为2′-脱氧胸腺嘧啶核苷(2′-deoxythymidine),其波谱数据与文献报道一致[8,9]。
化合物3:白色固体,其1H、13C NMR数据与化合物2基本相似,不同之处在于化合物3的NMR谱图上,其高场少了一个甲基的信号,同时化合物2中的sp2季碳δC111.6(C-5)变成了sp2的次甲基[δH5.71(1H,d,J=7.5 Hz,H-5);δC102.7(C-5)];而原来化合物2中氢谱上低场的一个单峰[δH7.81(1H,s,H-6)]也随之变成了双峰[δH7.99(1H,d,J=7.5 Hz,H-6)],由此推测化合物3的苷元为尿嘧啶,综上所述,化合物3鉴定为2′-脱氧尿苷(2′-deoxyuidine),其波谱数据与文献报道基本一致[10,11]。
化合物4:白色固体,其1H NMR谱图与化合物3非常相似,但也有一些明显的差别:低场部分化合物3的糖端基质子为三重峰[δH 6.26(1H,t,J=6.5 Hz,H-1′)],而在化合物4中却明显变成了一个二重峰[5.90(1H,d,J=4.8 Hz,H-1′)]。此外,高场部分化合物3中H2-2′信号(δH2.99,2.20)在化合物4中未出现,却相应地在δH3.5~4.5区间多了一个质子信号,由此推测化合物4中的糖为核糖,而非化合物3中的2-脱氧核糖。该推测在其13C NMR(CD3OD,125 MHz)谱图上也得到了进一步的验证,即化合物3中的2-脱氧核糖片段在化合物4中变成了核糖片段:δC 90.7(C-1′),86.5(C-4′),75.7(C-3′),71.4(C-2′),62.3(C-5′)。因此化合物4鉴定为尿嘧啶核苷(urdine),其波谱数据与文献报道基本一致[12,13]。
化合物5:白色固体,其1H和13C NMR图谱可见明显的1,3-二取代甘油酯片段[δH 3.0-4.0(5H,m,H-1-3);δC 71.9(C-3),69.6(C-2),66.5(C-1)],一个半乳糖片段[δH4.24(1H,d,J=7.2 Hz,H-1″),3.4-4.2(6H,m,H-2″-6″);δC 105.2(C-1″),76.7(C-2″),74.8(C-3″),72.6(C-5″),70.3(C-4″),62.5(C-6″)],以及一个长链脂肪酸片段[δH0.87(3H,t,J=7.6 Hz,H3-16′),1.28(24H,m,H-4′-15′),1.60(2H,m,H-3′),2.35(2H,t,J=7.4 Hz,H3-2′);δC175.5(C-1′),35.0(C-2′),30.2-31.0(C-5′-13′),28.1(C-4′),26.0(C-3′),23.8(C-15′),14.4(C-16′)],结合质谱(其相对分子质量为492),确定该脂肪酸为棕榈酸,因此化合物5的结构鉴定为:1-O-棕榈酰基-3-O-β-D-半乳糖基甘油酯(1-O-hexadecanoyl-3-O-β-D-galactopyranosylglycerol),其波谱数据与文献报道基本一致[14,15]。
5 体外细胞毒活性测试结果
拟诺卡菌SCSIO 11492的发酵提取物对小鼠单核巨噬细胞白血病细胞RAW 264.7、人肝癌细胞HepG2、人肺腺癌细胞A549的IC50分别为8.9、19.8、23.6 mg/L。进一步将化合物1~5在体外对上述3种肿瘤细胞的生长抑制进行活性测试,结果表明仅化合物5对RAW 264.7显示出较弱的活性(IC50=10.9μmol/L),其他化合物均无细胞毒活性(IC50>20μmol/L)。
6 讨论
肿瘤是威胁人类健康的重要杀手之一,因此有关抗肿瘤药物的研究开发一直是医药科研工作者的重点所在。海洋微生物是新颖药物先导化合物发现的一个丰富源泉。笔者在体外抗肿瘤活性筛选的引导下,对一批海洋来源的放线菌进行了活性筛选,发现其中一株具有较好抗肿瘤活性的放线菌SCSIO 11492,该菌属于拟诺卡氏菌,据报道,从该属中分离得到的化合物包括生物碱、环肽、聚酮等[16,17]。笔者对该菌株进行了次级代谢产物的研究,一共分离鉴定了5个化合物,均为首次从该属中分离得到。据报道,化合物1具有刺激种子萌发及DPPH自由基清除作用[18]。笔者对所分离得到的5个化合物进行了体外抗肿瘤活性测试,只有化合物5(1-O-棕榈酰基-3-O-β-D-半乳糖基甘油酯)对RAW 264.7显示出较好的生长抑制活性(IC50=10.9μmol/L)。根据文献,半乳糖甘油酯具有抗肿瘤、抗菌、抗H IV、抗炎、增强免疫力等活性,其活性强弱与脂肪酸链的长度及糖基上取代基团类型有关[19,20],这与本研究的结果一致,提示化合物5可能是该菌抗肿瘤的主要活性成分,进一步的代谢产物研究尚在进行中。
[1] Berdy J.Bioactivem icrobialmetabolites:a personal view[J].JAntibiot,2005,58(1):1-26.
[2] Galm U,Hager M H,Van Lanen SG,etal.Antitumor antibiotics:bleomycin,enediynes,and m itomycin[J].Chem Rev,2005,105(2):739-758.
[3] Simmons TL,Andrianasolo E,M cPhail K,et al.Marine natural products as anticancer d rugs[J].Mol Cancer Ther,2005,4(2):333-342.
[4] Fenical W,Jensen PR.Developing a new resource for drug discovery:marine actinomycete bacteria[J].Nat Chem Biol,2006,2(12):666-673.
[5] W illiams PG.Panning for chem ical gold:marine bacteria as a source of new therapeutics[J].T rends Biotechnol,2009,27(1):45-52.
[6] 陈 超,潘卫东,肖建辉,等.江西青霉甲醇提取物中的化学成分[J].中国实验方剂学杂志,2011,17(22):97-101.
[7] Evidente A,Iacobellis NS,Vellone R,et al.2′-Deoxyzeatin riboside and other cytokinins in culture filtrates of Pseudomonas amygdali[J].Phytochem istry,1989,28(10):2603-2607.
[8] 蔡杨鹏,刘璐璐,闫玉霞,等.沙蜇Stomopholusmeleag ris核苷类成分研究[J].中国海洋药物,2011,30(4):34-37.
[9] 李云秋,王 宾,杨 斌,等.南海海绵Haliclona sp.的化学成分研究[J].热带海洋学报,2011,30(1):124-126.
[10] Li D,Zhu T,Fang Y,et al.The antitumor components from marine-derived bacterium Strep toverticillium luteoverticillatum 11014 II[J].J Ocean Univ China,2007,6(2):193-195.
[11] 王 唐,姜 怡,靳荣线,等.一株大象粪便链霉菌的次生代谢产物研究[J].天然产物研究与开发,2014,26(4):509-512.
[12] Hu XY,Dou DQ,Pei YP,et al.Chem ical constituents of roots of Ranuncu lus ternatus Thunb.[J].JChin Pharm Sci,2006,26(2):127-129.
[13] Ma YT,Qiao LR,ShiWQ,et al.Metabolites produced by an endophyte A lternaria alternata isolated from M aytenus hookeri[J].Chem Nat Com pd,2010,46(3):504-506.
[14] 吴 博,马跃平,袁久志,等.土茯苓化学成分的分离与鉴定[J].沈阳药科大学学报,2010,27(2):116-119.
[15] Pettit GR,Bond TJ,Herald DL,et al.Antineoplastic agents.Part 378.Isolation and structure of spongilipid from the Republic of Singaporemarine porifera Spongia cf.hispida[J].Can JChem,1997,75(6):920-925.
[16] Sun HH,W hite CB,Dedinas J,et al.Methylpendolmycin,an indolactam from a Nocardiopsis sp.[J].J Nat Prod,1991,54(5):1440-1443.
[17] Kim Y,Ogura H,Igarashi Y,etal.Nocapyrones:α-andγpyrones from a marine-derived Nocardiopsis sp.[J].M ar Drugs,2014,12(7):4110-4125.
[18] Yuan Y,Tian JM,Xiao J,et al.Bioactivemetabolites isolated from Penicillium sp.YY-20,the endophytic fungus from Ginkgo biloba[J].Nat Prod Res,2014,28(4):278-281.
[19] Cateni F,Bonivento P,Procida G,et al.Chemoenzymatic synthesis and antim icrobial activity evaluation of monogalactosyl diglycerides[J].Eur JM ed Chem,2008,43(1):210-221.
[20] 李春霞,李英霞,管华诗.甘油糖脂生物活性研究进展[J].中国海洋药物,2003,22(2):47-52.
Sepration and antitumor activities of secondary metabolites from marine actinomycete Nocardiopsis sp.SCSIO 11492
SU Ruiqiang1,LIYan2,PENG Kun1,LIJie3,YANG Quan1,YANG Xianwen3(1.Department of Traditional Chinese Medicine,Guangdong Pharmaceutical University,Guangzhou 510006,China;2.Instrument Department,No.413 Hospital of PLA,Zhoushan 510301,China;3.CASKey Laboratory of TropicalMarine Bio-resources and Ecology,South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China)
ObjectiveTo explore cytotoxic secondary metabolites from amarine actinomycete Nocardiopsis sp.SCSIO 11492.Methods Isolation and purification were carried out by column chromatography over silica gel,Sephadex LH-20,and ODS structures of the isolateswere identifiedmainly by NMR spectroscopic data.And cytotoxic bioassay was performed using MTT method.ResultsFive compounds were identified as 2′-deoxyadenosine(1),2′-deoxythymidine(2),2′-deoxyuidine(3),uridine(4),1-O-palmitoyl-3-d-galactosyl-sn-glycerol spongilipid(5).Compound 5 exhibited weak cytotoxic activity with IC50 value of 10.9μmol/L.ConclusionFive compounds were obtained from amarine actinomycete Nocardiopsis sp.SCSIO 11492.A ll five compounds were reported for the first time from this genus.Compound 5 could be the bioactive compound responsible for the cytotoxic activity of Nocardiopsis sp.SCSIO 11492.
marine actinomycete;Nocardiopsis sp.;secondary metabolites;anti-tumor
R282.77
A
1006-0111(2015)05-0406-05
10.3969/j.issn.1006-0111.2015.05.006
2014-12-31
2015-04-09
[本文编辑]顾文华
国家自然科学基金(21002110,21372233)
苏瑞强,硕士研究生.研究方向:海洋天然产物研究.E-mail:surui2011@126.com
杨 全,博士,教授,硕士生导师.研究方向:中药资源研究与开发.Tel:(020)39352353;E-mail:yangquan7208@vip.163.com

