汉黄芩素与氟尿嘧啶联用抗人肝癌细胞Hep-G2作用的拮抗效应研究
陈维中,蔡靖斌,陈晓兰,陈瑞奇,李夏静,廖联明(.南京军区福州总医院第一附属医院,福建莆田3500;.福建中医药大学中西医结合研究院肿瘤研究所,福建福州35008)
汉黄芩素与氟尿嘧啶联用抗人肝癌细胞Hep-G2作用的拮抗效应研究
陈维中1,蔡靖斌1,陈晓兰1,陈瑞奇2,李夏静2,廖联明2(1.南京军区福州总医院第一附属医院,福建莆田351100;2.福建中医药大学中西医结合研究院肿瘤研究所,福建福州350108)
目的探讨汉黄芩素(wogonin)联合氟尿嘧啶(5-FU)对人肝癌细胞Hep-G2生长活性的影响。方法实验分汉黄芩素组、5-FU组、汉黄芩素+5-FU组和空白对照组,采用MTT法观察药物对肿瘤细胞体外生长活性的影响,采用流式细胞仪分析肿瘤细胞凋亡率的变化。结果MTT实验结果显示汉黄芩素(5、10、20、40μmol/L)作用24、48 h后对肿瘤细胞具有一定的增殖抑制作用(P<0.05);5-FU(5、10、20、40 mg/L)作用24、48 h后对肿瘤细胞增殖有明显的抑制作用(P<0.05);与单用组对肿瘤细胞的抑制作用相比,汉黄芩素联合5-FU组的抗肿瘤作用呈相互拮抗作用(P<0.05);汉黄芩素联合5-FU给药48 h后,联合指数CI值呈现剂量依赖性,CI值随汉黄芩素浓度的加大而增大,说明随汉黄芩素浓度的加大,其拮抗5-FU抗肿瘤效应的作用也越来越明显(P<0.05)。结论汉黄芩素具有一定的抗肿瘤作用,但可拮抗5-FU的抗肿瘤作用,具体机制有待进一步研究。
汉黄芩素;氟尿嘧啶;拮抗作用;肝癌细胞Hep-G2
汉黄芩素(图1)是一种从黄芩(唇形科)中提取的天然黄酮类化合物,其抗肿瘤作用越来越引起学者的重视[1];临床常运用5-FU治疗实体瘤,但易产生耐药性并导致严重的毒副作用,故联合用药增强化疗药物的抗肿瘤效应并减轻其毒副作用成为当今的研究热点。但值得关注的是研究发现联合用药也可能产生一定的相互拮抗作用[2]。本研究在观察汉黄芩素联合5-FU的抗肿瘤作用时发现二者联用存在一定的拮抗作用。现将结果报告如下:
1 材料与方法
1.1药物及试剂 汉黄芩素由福建中医药大学中西医结合研究院肿瘤研究所制备,用二甲基亚砜(DMSO)溶液配制成浓度为200μmol/L的母液,分装,储存于-20℃冰箱,备用;四甲基偶氮唑蓝(MTT)和细胞凋亡试剂盒购自凯基生物试剂公司。
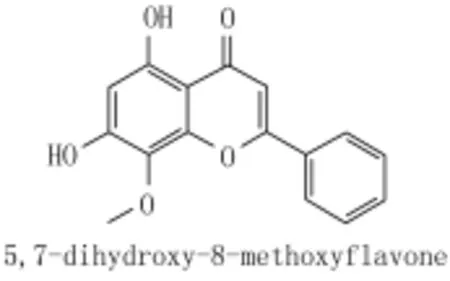
图1 汉黄芩素化学结构式
1.2细胞培养 人肝癌细胞Hep-G2培养于10%胎牛血清,1640培养液中常规培养(37℃培养箱,5%CO2)。
1.3细胞增殖活力检测(M TT法) 取2×103个细胞接种于96孔板中,每孔100μl,培养24 h后给药,分为汉黄芩素组(5、10、20、40μmol/L)、5-FU组(5、10、20、40 mg/L)、联合给药组和空白对照组。每组设8个复孔。药物分别作用24及48 h后,弃培养液。每孔加入100μl 0.5%MTT溶液并在培养箱中作用4 h,倾去培养液,加入DMSO溶液100μl,待完全溶解显色后,用酶标仪于490 nm处测定吸光度(A),计算细胞生长抑制率。
1.4细胞形态学观察 用显微镜分别观察汉黄芩素(40μmol/L)和5-FU(5 mg/L)处理Hep-G2细胞48 h后细胞形态学的变化。
1.5细胞凋亡率检测(流式细胞术) 实验分为对照组、汉黄芩素(20μmol/L)组、5-FU(5 mg/L)组、联合给药组(汉黄芩素20μmol/L+5-FU 5 mg/L)4个组,给药处理Hep-G2细胞24 h,磷酸缓冲液(PBS)洗涤2次,用不含乙二胺四乙酸二钠(EDTA)的胰酶消化,收集1×105个细胞,加入500μl的结合缓冲液悬浮细胞,再加入5μl磷酯酰丝氨酸-异硫氰酸荧光素(Annexin V-FITC)混匀,室温避光反应5~15 m in,1 h内用流式细胞仪进行检测。
1.6联合组给药48 h的联合指数CI计算方法参照相关文献[3-5]:联合指数CI=D1/(DX)1+D2/(DX)2。首先计算汉黄芩素和5-FU的IC50所对应的浓度,(DX)1代表汉黄芩素作用48 h,IC50所对应的汉黄芩素浓度,(DX)2代表5-FU作用48 h,IC50所对应的5-FU浓度。其次计算联用组C1[汉黄芩素(5μmol/L)+5-FU(5、10、20、40 mg/L)]、C2[汉黄芩素(10μmol/L)+5-FU(5、10、20、40mg/L)]、C3[汉黄芩素(20μmol/L)+5-FU(5、10、20、40 mg/L)]、C4[汉黄芩素(40μmol/L)+5-FU(5、10、20、40 mg/L)]48 h给药处理,IC50所对应的汉黄芩素和5-FU的浓度。D1代表联合给药组IC50所对应的汉黄芩素给药浓度,D2代表联合给药组IC50所对应的5-FU的给药浓度。将所得的值代入上述公式得到CI值。当CI<1,表明具有协同作用;当CI=1,表明具有相加作用;当CI>1,表明具有拮抗作用。
1.7数据处理 应用SPSS 18.0统计软件对本研究数据进行统计学分析,实验数据以均数±标准差(±s)表示,各均数间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1汉黄芩素对Hep-G2细胞增殖的抑制作用结果表明,汉黄芩素给药处理24、48 h后,汉黄芩素对人肝癌细胞Hep-G2增殖具有一定的抑制作用,其抑制作用呈剂量和时间依赖关系,见图2、3。
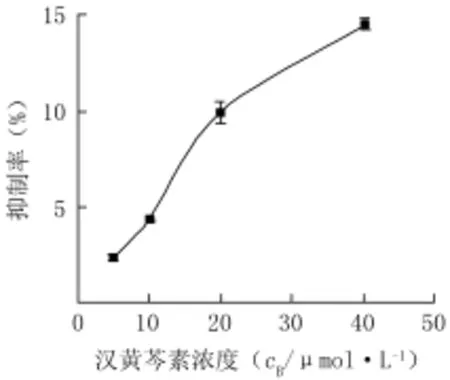
图2 汉黄芩素给药24 h对Hep-G2细胞增殖抑制率
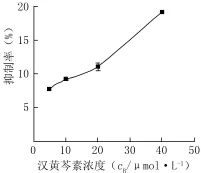
图3 汉黄芩素给药48 h对Hep-G2细胞增殖抑制率
2.2汉黄芩素对Hep-G2细胞形态学的影响 汉黄芩素给药48 h,形态学上观察发现细胞变圆,体积缩小,细胞变形,并伴有坏死细胞及碎片,呈现出典型的细胞凋亡现象。
2.35-FU对Hep-G2细胞增殖的抑制作用 5-
FU给药处理24、48 h后,5-FU对人肝癌细胞Hep-G2具有明显抑制作用,呈现剂量和时间依赖关系,见图4、5。
2.45-FU对Hep-G2细胞形态学的影响 形态学上观察发现细胞变圆,体积缩小,细胞变形,并伴有坏死细胞及碎片,呈现出典型的细胞凋亡现象。
2.5联合给药处理24、48h对Hep-G2细胞增殖抑制作用 联用组对Hep-G2抑制率小于单用组抑制率之和,说明汉黄芩素联合5-FU抗人肝癌细胞Hep-G2具有一定的拮抗作用(P<0.05,见表1、2)。汉黄芩素联合5-FU给药48h,其联合用药指数CI值呈现剂量依赖性,CI值随着汉黄芩素浓度的加大而增大,说明随着汉黄芩素浓度的加大,其拮抗5-FU抗肿瘤效应越明显(P<0.05),见图6。
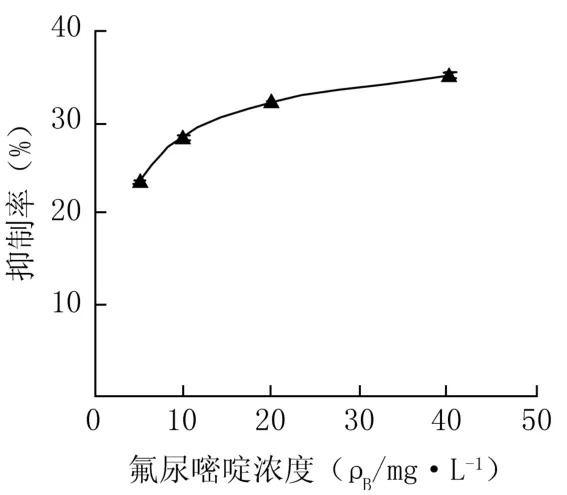
图4 5-FU给药24h对Hep-G2细胞增殖抑制率
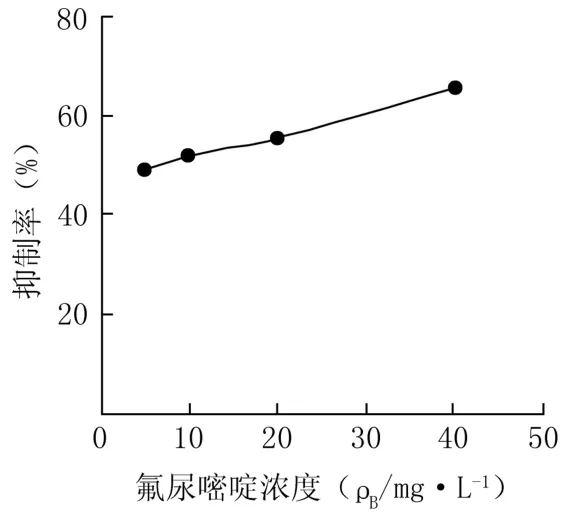
图5 5-FU给药48h对Hep-G2 细胞增殖抑制率
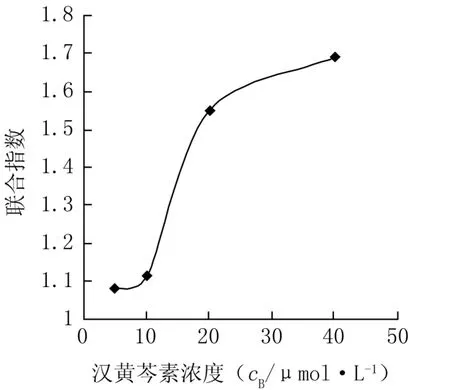
图6 不同剂量汉黄芩素联合5-FU 给药48h对联合指数影响
表1 联用组给药处理24h对Hep-G2细胞增殖抑制率(±s,n=8)
表1 联用组给药处理24h对Hep-G2细胞增殖抑制率(±s,n=8)
汉黄芩素浓度(cB/μmol・L-1)5-FU浓度(ρB/mg・L-1)0 5 102040 0 0 25.35±0.1830.71±0.4034.99±0.4237.62±0.43 5 2.53±0.7524.52±0.1830.72±0.0633.63±0.7136.43±0.90 103.88±0.0725.70±0.1131.96±0.0833.26±0.0938.10±0.75 2010.67±0.5626.50±0.2630.21±0.1432.69±0.0935.98±0.09 4014.52±0.3128.43±0.0832.64±0.0732.67±0.2230.85±0.05
表2 联用组给药处理48h对Hep-G2细胞增殖抑制率(±s,n=8)
表2 联用组给药处理48h对Hep-G2细胞增殖抑制率(±s,n=8)
汉黄芩素浓度(cB/μmol・L-1)5-FU浓度(ρB/mg・L-1)0 5 102040 0 0 48.93±0.0852.38±0.1457.86±0.0967.50±0.02 5 8.10±0.5748.02±0.0448.42±0.0856.73±0.2560.55±0.09 109.74±0.1347.29±0.3549.47±0.1755.90±0.0863.20±0.20 2016.21±0.0645.46±0.1146.17±0.2554.89±0.0563.95±0.08 4024.88±0.1543.77±0.3545.96±0.1055.93±0.0764.06±0.04
2.6联合给药处理24h对Hep-G2细胞凋亡的影响 从实验结果中发现,联用组细胞凋亡率之和小于单用组细胞凋亡率之和,1+1<2,说明汉黄芩素对5-FU抗肿瘤效应具有一定的拮抗作用,见图7。
3 讨论
5-FU在临床上应用较为广泛,对消化道肿瘤及其他实体瘤有良好疗效,在肿瘤内科治疗中占有重要地位,但其在治疗剂量范围内存在着严重的毒副作用,如:胃肠道反应、骨髓抑制导致的白细胞及血小板减少、脱发等。
本实验采用MTT法观察5-FU对人肝癌细胞Hep-G2的增殖抑制作用,证实其对人肝癌细胞Hep-G2具有明显的抑制作用,从细胞形态学上观察,其诱导了Hep-G2细胞产生凋亡,对细胞形态产生一定的影响,说明5-FU对Hep-G2有显著的增殖抑制效应。汉黄芩素具有一定的抗氧化作用及神经保护作用,可以降低氧活性自由基的表达[6],汉黄芩素作用于肿瘤细胞诱导氧自由基产生[7],并激活细胞凋亡信号通路,诱导肿瘤细胞凋亡,并抑制肿瘤细胞生长;汉黄芩素还可作用于肿瘤细胞PI3KAKT信号通路[8-10],诱导细胞凋亡,说明具有一定的抗癌作用。本实验采用MTT法观察汉黄芩素对人肝癌细胞Hep-G2的抑制作用,发现其在体外对人肝癌细胞Hep-G2具有一定的抑制作用,同时从细胞形态学上观察,可诱导Hep-G2细胞凋亡,说明汉黄芩素对Hep-G2有一定的增殖抑制作用。
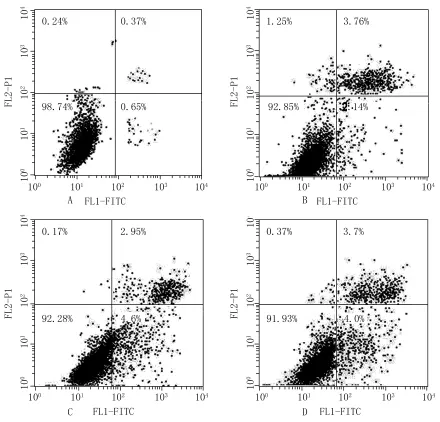
图7 不同给药组处理24 h对细胞凋亡的影响
虽然汉黄芩素在体外具有一定的抗肿瘤作用,但本实验结果显示汉黄芩素有拮抗5-FU的抗肿瘤效应,细胞增殖活力检测(MTT法)和细胞凋亡检测(流式细胞术)发现联合给药组对Hep-G2抑制率小于两药单用抑制率之和,表明汉黄芩素联合5-FU抗人肝癌细胞Hep-G2具有一定的拮抗作用,汉黄芩素联合5-FU给药48 h,联合指数CI>1,随着其浓度加大,CI变大,拮抗作用越明显,说明汉黄芩素与5-FU联合用药不但不能提升疗效,反而可能增加5-FU的毒副作用,汉黄芩素拮抗5-FU的抗肿瘤作用机制有待深入研究。
[1] Zhao L,Chen Z,Zhao Q,et al.Developmental toxicity and genotoxicity studies of wogonin[J].Regul Toxicol Pharmacol,2011,60(2):212-217.
[2] Liu Y,Wang X,Wang Y,et al.Combination of SNX-2112 w ith 5-FU exhibits antagonistic effect in esophageal cancer cells[J].Int JOncol,2015,46(1):299-307.
[3] Chou TC,Talalay P.Quantitative analysis of dose-effect relationships:the combined effects ofmultiple drugs or enzyme inhibitors[J].Adv Enzyme Regul,1984,22:27-55.
[4] Zhao Q,Wang J,Zou M J,et al.Wogonin potentiates the antitumor effects of low dose 5-fluorouracil against gastric cancer through induction of apoptosis by down-regulation of NF-kappaB and regulation of its metabolism[J].Toxicol Lett,2010,197(3):201-210.
[5] Li CJ,Chu CY,Huang LH,etal.Synergistic anticancer activity of triptolide combined w ith cisplatin enhances apoptosis in gastric cancer in vitro and in vivo[J].Cancer Lett,2012,319(2):203-213.
[6] Lee YM,Cheng PY,Chen SY,et al.Wogonin suppresses arrhy thm ias,inflammatory responses,and apop tosis induced by myocardial ischem ia/reperfusion in rats[J].JCardiovasc Pharmacol,2011,58(2):133-142.
[7] Tsai CF,Yeh W L,Huang SM,etal.Wogonin induces reactive oxygen species p roduction and cell apoptosis in human glioma cancer cells[J].Int J M ol Sci,2012,13(8):9877-9892.
[8] Huang KF,Zhang GD,Huang YQ,et al.Wogonin induces apop tosis and dow n-regulates survivin in human breast cancer MCF-7 cells by modulating PI3K-AKT pathway[J].Int Immunopharmacol,2012,12(2):334-341.
[9] Zhou M,Song X,Huang Y,et al.Wogonin inhibits H 2O2-induced angiogenesis via suppressing PI3K/Akt/NF-kappaB signaling pathw ay[J].Vasc Pharmacol,2014,60(3):110-119.
[10] Zhao K,Song X,Huang Y,etal.Wogonin inhibits LPS-induced tumor angiogenesis via suppressing PI3K/Ak t/NF-kappaB signaling[J].Eur JPharmacol,2014,737:57-69.
Combination ofwogonin w ith 5-fluorouracilexhibits antagonistic effecton human Hep-G2 hepatocellular carcinoma cells
CHENWeizhong1,CAIJingbin1,CHEN Xiaolan1,CHEN Ruiqi2,LIXiajing2,LIAO Lianming2(1.First Affiliated Hospital,Fuzhou General Hospitalof Nanjing M ilitary Region,Putian 351100,China;2.Departmentof Oncology,Academy of Integrative Medicine,Fujian University of Traditional Chinese Medicine,Fuzhou 350108,China)
ObjectiveTo investigate the antagonistic effect of wogonin in combination w ith 5-fluorouracil(5-FU)on the proliferation of human Hep-G2 hepatocellular carcinoma cells.MethodsHuman hepatocellular Hep-G2 cellswere divided into experimental group(wogonin group,5-FU group,wogonin+5-FU group)and controlgroup.MTTmethod was used to evaluate tumor cell proliferation in vitro,flow cytometry analysiswas used to evaluate tumor cell apoptosis.ResultsThe results showed that the wogonin inhibited the proliferation of tumor cells at the concentrations of 5,10,20 and 40μmol/L after 24 h and 48 h treatment respectively(P<0.05);5-FU also inhibited the proliferation of tumor cells at the concentrations of 5,10,20 and 40 mg/L after 24 h and 48 h treatment respectively(P<0.05).However when wogonin was combined w ith 5-FU(wogonin+5-FU group),an antagonistic effect was observed on tumor cell proliferation(P<0.05).When cells were treated by wogonin+5-FU for 48 h,the combined index(CI)value slowed a dose-dependentantagonistic effect(P<0.05).ConclusionWogonin has anti-tumor effect.However when wogonin was combined w ith 5-FU,an obvious antagonistic effect on 5-FU′s anti-tumor action was observed.The underlyingmechanism deserves further study.
wogonin;fluorouracil;antagonism;hepatocellular carcinoma cell Hep-G2
R979.1
A
1006-0111(2015)05-0411-04
10.3969/j.issn.1006-0111.2015.05.007
2014-11-20
2015-07-09
[本文编辑] 陈 静
陈维中,本科,副主任药师.研究方向:医院药学.E-mail:cwzhongfz@sina.com
廖联明,博士,副教授,硕士生导师.研究方向:中药抗肿瘤的药理学机制.E-mail:llm@fjtcm.edu.cn

