两种盐酸特拉唑嗪片的人体生物等效性研究
朱蕾蕾,郭丽霞,詹 燕,裘福荣,赵彤芳,叶宇婕,元唯安,李安平,李明花,苏淑芳,蒋 健(.上海中医药大学附属曙光医院临床药理科,上海00;.上海药物代谢研究中心,上海00;.山西振东制药股份有限公司,山西长治460000)
两种盐酸特拉唑嗪片的人体生物等效性研究
朱蕾蕾1,郭丽霞2,詹 燕2,裘福荣1,赵彤芳1,叶宇婕1,元唯安1,李安平3,李明花3,苏淑芳3,蒋 健1(1.上海中医药大学附属曙光医院临床药理科,上海201203;2.上海药物代谢研究中心,上海201203;3.山西振东制药股份有限公司,山西长治460000)
目的评价单剂量口服国产和进口盐酸特拉唑嗪片的人体生物等效性。方法采用单中心、随机、开放、双周期交叉试验设计,21名受试者在不同周期分别空腹口服国产和进口盐酸特拉唑嗪片2 mg,于给药前0 h及给药后60 h内不同时间点采集静脉血4 m l,采用液-质联用(LC-MS/MS)法测定受试者血浆中特拉唑嗪的浓度。结果国产和进口盐酸特拉唑嗪片的t1/2分别为(13.2±2.39)和(12.5±1.93)h;tmax分别为(1.01±0.83)和(1.08±0.69)h;Cmax分别为(40.1±10.6)和(37.3±9.57)ng/m l;AUC0-∞分别为(428±82.1)和(426±85.2)ng・h/m l。国产盐酸特拉唑嗪片的相对生物利用度为(101.2±14.7)%。国产与进口盐酸特拉唑嗪片AUC0-t和C max几何均值比的90%置信区间(CI)均落在80%~125%之间。结论国产和进口盐酸特拉唑嗪片具有生物等效性。
盐酸特拉唑嗪;液-质联用;生物等效性
盐酸特拉唑嗪(terazosin hydrochloride)是一种长效的抗高血压药,具有阻滞外周突触后α1-肾上腺素受体的作用,从而引起血管扩张,外周血管阻力减小而降低血压。本品具有对心输出量影响极小、不引起反射性心跳加快、不减少肾血流量或肾小球过滤等优点。由于α1-肾上腺素受体阻滞而使膀胱颈、前列腺、前列腺包膜平滑肌松驰,尿道阻力和压力、膀胱阻力减小,从而减轻尿道症状,因此盐酸特拉唑嗪也是目前治疗男性良性前列腺增生下尿路症状的一线药物[1]。该研究的目的是评价山西振东制药股份有限公司的盐酸特拉唑嗪片与进口盐酸特拉唑嗪片(高特灵)的人体生物等效性,为药品注册和临床用药提供依据。
1 材料
1.1仪器 岛津液相色谱系统,包括DGU-20A3型脱气机,LC-20ADXR型二元液相泵,SIL-20ACXR型自动进样器和CTO-20AC型柱温箱(日本岛津公司);MS/MS系统,TSQ Quantum Vantage型三重四极杆串联质谱仪,配备加热电喷雾电离源(HESI源)(美国Thermo Fisher公司);CPA225D型分析天平(北京赛多利斯仪器系统有限公司);Hitachi CT15RE型台式高速离心机(日本日立公司);H-101型多功能漩涡混合器(上海康禾光电仪器有限公司)。
1.2药品与试剂 受试制剂:盐酸特拉唑嗪片(山西振东制药股份有限公司,规格:2 mg/片,批号:20130501);参比制剂:盐酸特拉唑嗪片(高特灵,美国雅培制药有限公司生产,上海雅培制药有限公司分包装,规格:2 mg/片,批号:6027752)。内标:哌唑嗪(美国Sigma公司,批号:129K1137V,含量:99%);盐酸特拉唑嗪二水合物(山西振东制药股份有限公司,批号:100375-201103;含量:92.3%,按盐酸特拉唑嗪计算)。甲醇、甲酸、醋酸铵均为色谱纯;水为自制超纯水。
2 方法
2.1受试者选择与试验方案 共有22例男性健康受试者入选试验,实际完成试验21例,年龄(24.48±2.69)岁,身高(175.29±5.43)cm,体重(67.29±7.91)kg,体重指数为19.72~23.92 kg/m2,平均(21.83±1.54)kg/m2。所有受试者均无烟酒嗜好,无药物过敏史和药物滥用史,试验前3个月内没有参加过其他临床试验,试验前2周内没有服用过其他任何中西药物。试验前体格检查和血尿常规、血生化、HBsAg、HCV抗体、H IV抗体等实验室检查和心电图检查均无异常发现,血压均不低于100/70 mm Hg。试验前所有受试者均签署知情同意书。试验方案经上海中医药大学附属曙光医院伦理委员会批准。
采用DAS3.1.1软件包将受试者随机分为2组,分别双周期交叉单剂量单次空腹口服盐酸特拉唑嗪片受试制剂或参比制剂2 mg(1片)。受试者从给药前10 h开始禁食(禁水至少1 h),给药2 h后方可自由饮水,4和10 h后统一进清淡午餐和晚餐。受试者给药后避免由卧位或坐位突然转向立位,给药前(30 m in内)和给药后0.5、1、2、4、8、12 h各监测血压1次,其后每日监测1次。分别于给药前(0 h)和给药后15、30、45、60、80、100 min及2、2.5、3、4、6、9、12、24、36、48、60 h采集肘静脉血,每次4 m l,置肝素抗凝试管中,3 500 r/min离心10 m in,分离血浆,于-20℃冰箱中冷冻保存。
2.2色谱与质谱条件 色谱柱:C18柱(150 mm× 4.6 mm,5μm,美国Agilent公司);流动相:甲醇-10 mmol/L醋酸铵水溶液-甲酸(65∶35∶0.1,V/V/V);流速:0.60 m l/min。离子源:加热电喷雾化学电离源(HESI源),正离子方式检测;源喷雾电压:3 000 V;加热毛细管温度:350℃;气化室的温度:300℃;鞘气(N2)压力35 Pa;辅助气(N2)压力15 Pa;碰撞气(A r)压力0.16 Pa;扫描方式:选择反应监测(SRM);扫描时间:200 ms;特拉唑嗪和内标哌唑嗪用于定量分析的离子反应分别为:m/z 388→m/z(247+290)和m/z 384→m/z 247,全扫描质谱图见图1;特拉唑嗪和内标哌唑嗪的碰撞能量分别为32 V和30 V。
2.3血浆样品处理 受试者血浆样品室温解冻后,涡流混匀。取100μl受试者血浆样品,分别加入25.0μl内标工作溶液、25.0μl甲醇-水(1∶1,V/V)和200μl甲醇,涡流混合1 m in,离心5 min(14 000 r/min),取5μl上清液进行LC-MS/MS分析。
2.4方法学验证
2.4.1 专属性考察 以6个不同来源的人空白血浆及相应空白血浆配制的定量下限(LLOQ)样品评价方法的专属性,结果表明,内源性物质不干扰待测物和内标的测定。典型色谱图见图2。

图1 特拉唑嗪(A)和内标哌唑嗪(B)产物离子全扫描质谱图
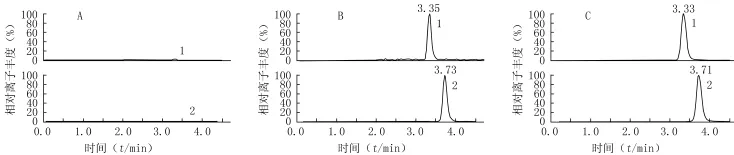
图2 人血浆中特拉唑嗪及哌唑嗪(内标)的典型色谱图
2.4.2 标准曲线的制备 取人空白血浆,配制成相当于特拉唑嗪血浆浓度分别为0.250、0.750、2.50、5.00、12.5、25.0、50.0 ng/m l的血浆样品,以待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,用加权(W=1/x2)最小二乘法进行回归运算,求得的直线回归方程即为标准曲线。测得人血浆中特拉唑嗪的线性范围为0.250~50.0 ng/m l。
2.4.3 精密度及回收率试验 取低、中、高3个浓度特拉唑嗪血浆样品(0.600、4.00、40.0 ng/m l),每个浓度进行6个样本分析,分别在3 d内测试。测得日内相对标准差小于5.5%,日间相对标准差小于10.2%。配制低、中、高3个浓度血浆样品和空白血浆样品预处理后加入相应溶液的样品,以提取后峰面积与未经提取获得的峰面积之比计算回收率,每一待测物及相应内标的回收率均在87.3%以上,且相对标准差(RSD)小于6.4%。结果见表1。
表1 回收率及精密度试验结果(±s)
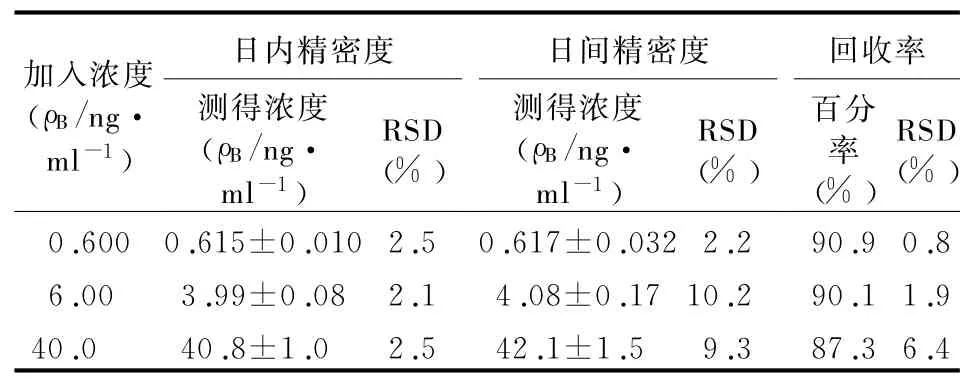
表1 回收率及精密度试验结果(±s)
加入浓度(ρB/ng・m l-1)RSD RSD RSD(%)0.600 0.615±0.010 2.5 0.617±0.032 2.2 90.9 0.(%)(%)回收率百分率(%)日内精密度测得浓度(ρB/ng・m l-1)日间精密度测得浓度(ρB/ng・m l-1)8 6.00 3.99±0.08 2.1 4.08±0.17 10.2 90.1 1.9 40.0 40.8±1.0 2.5 42.1±1.5 9.3 87.3 6.4
2.4.4 稳定性考察 分别考察特拉唑嗪低、高2种浓度的血浆样品室温放置6 h、血浆样品经沉淀蛋白处理后室温放置24 h、血浆样品经历3次冷冻-解冻循环、血浆样品-20℃放置39 d的稳定性。特拉唑嗪血浆样品稳定性的相对标准差(RSD)范围为0.5%~4.2%,相对偏差(RE)为-2.5%~8.8%。
2.4.5 数据处理与统计分析 应用Pharsight公司的Phoenix W inNonlin 6.3软件,采用非房室模型法(NCA)计算药动学参数AUC0-t、AUC0-∞、t max、Cmax和t1/2。对主要药动学参数(AUC、Cmax)对数转换后进行方差分析,采用90%CI法进行两制剂的生物等效性评价,受试制剂的AUC0-t的90%CI在参比制剂相应参数的80%~125%范围内,且受试制剂的C max的90%CI在参比制剂相应参数的75%~133%范围内,即可判断两制剂生物等效[2];tmax采用非参数检验法。对受试者人口学指标和安全性数据进行描述性统计分析。
3 结果
3.1药-时曲线 21名受试者单次口服盐酸特拉唑嗪受试制剂和参比制剂2 mg后的平均药-时曲线见图3。
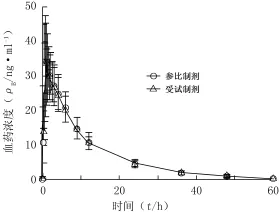
图3 21名受试者单次口服盐酸特拉唑嗪受试制剂与参比制剂2mg后的平均药-时曲线
3.2药动学参数 21名受试者单次口服盐酸特拉唑嗪受试制剂与参比制剂2 mg后的主要药动学参数见表2。
3.3生物等效性评价 方差分析结果显示盐酸特拉唑嗪AUC0-∞、AUC0-t和C max在给药顺序间、两制剂间和两周期间的差异均无统计学意义,盐酸特拉唑嗪受试制剂与参比制剂的AUC和C max几何均值比及其90%CI见表3。t max经非参数检验,受试制剂与参比制剂差异无统计学意义(P=0.213)。
3.4安全性评价 试验期间共有3名受试者发生3次不良事件,均发生在第一周期给药当天。1名受试者给予参比制剂半小时后出现血压下降,伴恶心、呕吐1次,卧位半小时后缓解,因符合剔除标准,最后退出试验;另2名受试者均是在给予参比制剂4 h后,由卧位转为站立时出现头晕,测血压下降,卧位或坐位半小时后缓解。3例不良事件均判断与试验药物有关。其余受试者无不良事件发生。所有受试者试验后各项实验室、心电图检查未见异常。
表2 21名受试者单次口服盐酸特拉唑嗪受试制剂与参比制剂2mg后的主要药动学参数(±s)

表2 21名受试者单次口服盐酸特拉唑嗪受试制剂与参比制剂2mg后的主要药动学参数(±s)
93 tmax(h)1.01±0.83 1.08±0.69 Cmax(ng/m l)40.1±10.6 37.3±9.57 AUC0-t(ng・h/m l)414±78.3 414±81.4 AUC0-∞(ng・h/m l)428±82.1 426±85.2 F(%)101.2±14.参比制剂t1/2(h)13.2±2.39 12.5±1.药动学参数受试制剂7
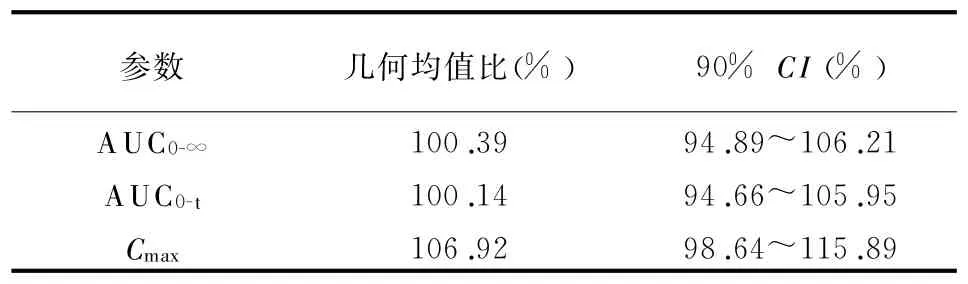
表3 盐酸特拉唑嗪受试制剂与参比制剂的生物等效性评价结果
4 讨论
笔者采用LC-MS/MS测定方法,具有准确性好、精密度和灵敏度高、样品处理简便等优点,测得的主要药动学参数与文献报道基本一致[3,4]。药动学参数等效性统计分析结果表明,盐酸特拉唑嗪片受试制剂与参比制剂特拉唑嗪AUC0-t和Cmax几何均值比的90%CI均落在80%~125%之间,说明2种制剂在体内的吸收、分布、消除过程相似,盐酸特拉唑嗪片受试制剂与参比制剂具有生物等效性。
该研究因试验对象为健康受试者,给药后可能会出现明显的血压下降,1名受试者因此出现恶心、呕吐,由于符合“服药后4 h以内出现呕吐、腹泻等影响药物代谢结果者”的剔除标准而未完成试验;另有2位受试者均是由于卧位转为站立位过快导致的体位性低血压,在加强了受试者的宣教后,第二周期没有再出现任何不良事件。总体可以认为盐酸特拉唑嗪片安全性良好,但在健康受试者给药试验中需排除血压正常偏低者,试验过程中要加强监护,尤其要避免体位的过快转变。
[1] 祝凌飞.特拉唑嗪治疗良性前列腺增生疗效M eta分析[J].中国药房,2013,24(24):2279-2282.
[2] 国家药典委员会.中华人民共和国药典2010年版二部[S].北京:中国医药科技出版社,2010:附录195-199.
[3] 顾逸敏,姚 蓝,刘艳梅,等.进口和国产盐酸特拉唑嗪片的人体生物等效性研究[J].药学服务与研究,2009,9(5):370-373.
[4] 陈 钧,陆 伟,史振祺,等.两种盐酸特拉唑嗪片剂人体生物等效性评价[J].中国药学杂志,2003,38(6):446-448.
Bioequivalence study on two terazosin hydrochloride tablets
ZHU Leilei1,GUO Lixia2,ZHAN Yan2,QIU Furong1,ZHAO Tongfang1,YE Yujie1,YUAN Wei’an1,LI Anping3,LI M inghua3,SU Shufang3,JIANG Jian1(1.Department of Clinical Pharmacology,Shuguang Hospital Affiliated to ShanghaiU-niversity of Traditional Chinese Medicine,Shanghai201203,China;2.ShanghaiCenter for Drug Metabolism and Pharmacokinetics Research,Shanghai201203,China;3.Shanxi Zhendong Pharmaceutical Co.,Ltd.,Changzhi460000,China)
ObjectiveTo evaluate the bioequivalence of domestic and imported terazosin hydrochloride tablets after single oral dose.MethodsItwas a single center,randomized,open,cross-over trail design,21 subjects were fasting oral administered of 2 mg domestic and imported terazosin hydrochloride tablets in different periods,venous blood 4 m l were collected in different time points before and 60 h after adm inistration,plasma concentration of terazosin was determ ined by LC-MS/MS.ResultsThemain pharmacokinetic parameters of domestic and imported terazosin hydrochloride tablets were as follows:t1/2:(13.2±2.39)h vs(12.5±1.93)h,tmax:(1.01±0.83)h vs(1.08±0.69)h,Cmax:(40.1±10.6)ng/m l vs(37.3± 9.57)ng/m l;AUC0-∞:(428±82.1)ng・h/m l vs(426±85.2)ng・h/m l.The relative bioavailability of domestic terazosin hydrochloride tabletswas(101.2±14.7)%.90%CI of domestic and imported terazosin hydrochloride tablets AUC0-tand Cmaxgeometricmean ratio fell between 80%-125%.ConclusionThe domestic tablets are bioequivalent to the imported tablets.
terazosin hydrochloride;LC-MS/MS;bioequivalence
R969;R972.4
A
1006-0111(2015)05-0419-04
10.3969/j.issn.1006-0111.2015.05.009
2014-09-26
2015-03-31
[本文编辑]顾文华
“十二五”重大新药创制《创新药物研究开发技术平台建设》(2012ZX09303009-001);上海市进一步加快中医药事业发展三年行动计划(2014-2016年)中医药专门人才计划(ZY3-RCPY-3-1059)
朱蕾蕾,博士,主治医师.研究方向:新药临床研究.E-mail:zhuleilei1981@163.com
蒋 健,博士,主任医师,博士生导师.研究方向:新药临床研究.E-mail:jiangjiansg@126.com

