紫杉醇脂质体联合顺铂对比紫杉醇联合顺铂治疗晚期非小细胞肺癌的临床观察*
孙银萍 王福立 田玮 刘晓
(淄博市中心医院肿瘤科,山东淄博255036)
紫杉醇脂质体联合顺铂对比紫杉醇联合顺铂治疗晚期非小细胞肺癌的临床观察*
孙银萍 王福立 田玮 刘晓
(淄博市中心医院肿瘤科,山东淄博255036)
目的观察紫杉醇脂质体和紫杉醇分别联合顺铂治疗晚期非小细胞肺癌的临床疗效和不良反应。方法
将50例晚期非小细胞肺癌患者随机分为试验组和对照组,每组各25例。试验组:紫杉醇脂质体150 mg/m2第1天+顺铂25 mg/m2第1~3天;对照组:紫杉醇150 mg/m2+顺铂25 mg/m2第1~3天,化疗每21天为1个周期。结果试验组和对照组客观有效率(RR)分别为44.0%和40.0%,临床获益率(CBR)分别为80.0%和72.0%,两组RR和CBR比较差异无统计学意义(P=0.774,0.508)。试验组的无进展生存时间(PFS)为5.6个月,对照组为4.9个月,两组比较差异无统计学意义(P=0.126)。试验组恶心、呕吐,肌肉关节痛,过敏反应及末梢神经炎的发生率显著低于对照组,两组比较差异有统计学意义(P均<0.05);试验组和对照组的腹泻、白细胞下降、贫血、血小板下降、脱发及肝功损伤的发生率比较差异无统计学意义(P均>0.05)。结论紫杉醇脂质体联合顺铂治疗晚期非小细胞肺癌与紫杉醇联合顺铂疗效相当,但不良反应发生率降低。
紫杉醇脂质体;紫杉醇;非小细胞肺癌;顺铂
肺癌是目前全世界发病率和死亡率最高的恶性肿瘤,在我国城市地区,肺癌已成为癌症死亡的首要原因[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌总数的75%~80%,目前手术、放疗和化疗是治疗非小细胞肺癌的主要手段,但由于70%~80%的NSCLC患者就诊时已属晚期,所以化疗是这些患者的主要治疗手段[2]。紫杉醇联合顺铂为美国国立综合癌症网络(NCCN)指南推荐的用于治疗NSCLC一线方案[3]。因普通紫杉醇应用聚氯乙基蓖麻油作为溶媒,存在较多不良反应,这限制了其临床应用,而紫杉醇脂质体应用脂质体作为载体,故不良反应显著降低[4]。本研究比较了紫杉醇脂质体联合顺铂与普通紫杉醇联合顺铂治疗晚期非小细胞肺癌的疗效和不良反应,现报告如下。
1 资料与方法
1.1 一般资料
选取自2011年1月~2013年12月在淄博市中心医院肿瘤科就诊的晚期非小细胞肺癌初治患者50例,其中男性32例,女性18例,年龄34~76岁,中位年龄(60.7±4.7)岁,应用随机数字表法将患者随机分为试验组和对照组,其中试验组25例,对照组25例。入选标准为①经纤维支气管镜、肺穿刺或细胞学检查确诊且不能手术或根治性放疗的晚期肺癌患者,病理类型为非小细胞肺癌(腺癌、鳞癌、其它非小细胞肺癌);②体力状况(performance statue,PS)评分≤2分,估计生存期超过3个月;③影像学(CT、B超或MRI)至少有一个可测量的病灶,且直径≥1 cm;④血常规、肝功能、肾功能及心电图正常;⑤签署治疗知情同意书,所有治疗方案经淄博市中心医院伦理委员会批准。
1.2 治疗方法
试验组:应用紫杉醇脂质体+顺铂方案,具体用药为:紫杉醇脂质体(南京绿叶思科药业有限公司,国药准字:H20030357)150 mg/m2加入5%葡萄糖液500 ml中,静脉滴注至少3 h,第1天;顺铂25 mg/m2,加入0.9%生理盐水500 ml中,静脉滴注,第1~3天。
对照组:应用紫杉醇注射液+顺铂方案,具体用药为:紫杉醇注射液(辰欣药业股份有限公司,国药准字:H20057404)150 mg/m2加入5%葡萄糖液500 ml中,静脉滴注至少3 h,第1天;顺铂25 mg/m2加入0.9%生理盐水500ml中,静脉滴注,第1~3天。
试验组紫杉醇脂质体和对照组紫杉醇治疗前30分均应用苯海拉明50 mg肌肉注射、西咪替丁300 mg静脉滴注及常规预防性应用止吐药,试验组紫杉醇脂质体治疗前30分给予地塞米松5 mg静脉注射,对照组紫杉醇注射液治疗前6、12h分别口服地塞米松10 mg。试验组和对照组患者均给予化疗4~6个周期。
1.3 观察指标及疗效判定
观察两组患者的近期疗效、无进展生存期及不良反应。首次化疗前和每化疗两个周期行强化CT、B超或MRI评价瘤体大小变化。
近期疗效按照RECIST标准[5]判定:完全缓解(complete remission,CR);部分缓解(partial remission,PR);稳定(stable disease,SD)/无变化(no change,NC);进展(progression,PD)。有效率(response rate,RR)=(CR+PR)/总例数×100%,临床获益率(clinical benefit rate,CBR)=(CR+PR+ SD)/总例数×100%。无进展生存时间(progression free survival,PFS),即肿瘤患者从接受化疗开始,到观察到疾病进展的这段时间。不良反应按照美国国立癌症研究所通用毒性标准[6](national cancer institute common toxicity criteria,NCI-CTC)2.0版标准评价不良反应,不良反应分为0~Ⅳ度。
1.4 统计学方法
采用SPSS 16.0软件进行数据分析。计数资料以率(%)表示,组间比较采用χ2检验,计量资料组间比较采用两独立样本t检验,两组间无进展生存期比较采用Log-Rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较
试验组25例患者共完成134个化疗周期,对照组25例患者共完成120个化疗周期,两组患者完成化疗周期数经统计学分析差异无统计学意义(P>0.05)。试验组和对照组患者的性别、年龄、PS评分、肿瘤病理类型、肿瘤分化程度及临床分期等一般资料经统计学分析差异均无统计学意义,具有可比性(P均>0.05)。见表1。
2.2 临床疗效比较
试验组和对照组均无失访患者。治疗结束后,试验组CR,PR 11例,SD 9例,对照组CR 0例,PR 10例,SD 8例,试验组和对照组RR和CBR经统计学分析差异无统计学意义(P=0.774,0.508)。试验组的PFS为5.6个月,对照组为4.9个月,两组比较差异无统计学意义(P=0.126),见表2。

表2 试验组与对照组患者临床疗效比较[n(%)]
2.3 毒副反应比较
试验组和对照组的毒副反应主要为胃肠道反应(恶心、呕吐及腹泻),骨髓抑制(白细胞下降、贫血及血小板下降),脱发,肝功损伤,肌肉关节痛,过敏反应,末梢神经炎。其中试验组恶心、呕吐,肌肉关节痛,过敏反应及末梢神经炎的发生率显著低于对照组,经统计学分析差异有统计学意义(P均<0.05);其余化疗毒副反应经统计学分析差异均无统计学意义(P均>0.05)。见表3。
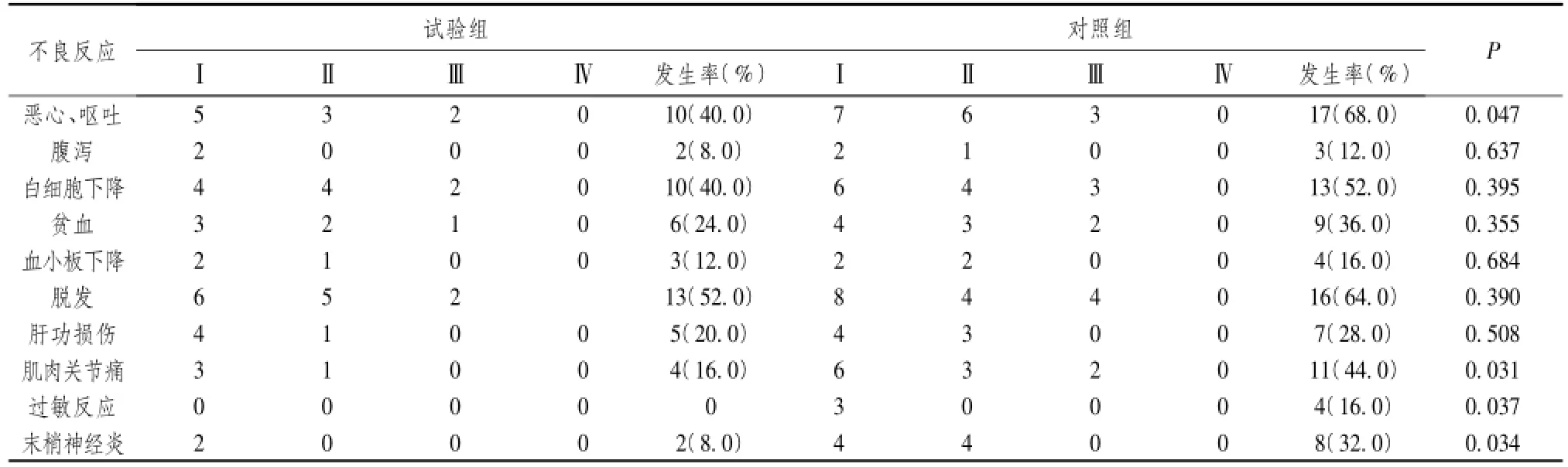
表3 试验组和对照组的毒副反应比较[n(%)]
3 讨论
目前紫杉醇联合顺铂方案被认为是晚期非小细胞肺癌的标准化疗方案之一。化疗方案中的紫杉醇是从红豆杉树皮中提取和纯化的化合物,它是一种广谱植物类抗癌药物,是目前唯一一种微管特异性稳定剂,紫杉醇接触细胞后会使细胞内积累大量的微管,这就干扰了细胞的各种功能,特别是能抑制细胞有丝分裂,从而阻断肿瘤细胞生长[7]。此外,紫杉醇还能通过激活半胱氨酸-天冬氨酸蛋白酶家族途径,诱导肿瘤细胞凋亡[8]。然而,普通紫杉醇水溶性较差,目前临床应用的紫杉醇注射液常加入聚氧乙基代蓖麻油等辅料以增加其溶解性,而聚氧乙基代蓖麻油在体内降解过程中可产生组胺,同时引起神经细胞内颗粒释放,并导致神经脱髓鞘改变,这均增加了紫杉醇的过敏反应和末梢神经毒性[9]。陈卓等[10]研究发现应用紫杉醇注射液的患者过敏反应和神经毒性的总发生率可达到12.2%和22.0%。此外,聚氧乙基代蓖麻油在血液中可形成颗粒包绕紫杉醇分子,影响紫杉醇分子的吸收和分布,使其药代动力学呈非线性分布,这就减弱了其抗肿瘤活性。那么,如何在增加紫杉醇的抗肿瘤活性的同时降低其药物毒副反应呢?
脂质体是一种新型的药物载体,它具有类似生物膜的双分子层结构囊泡,可长时间吸附于靶细胞周围,延长药物的作用时间,使药物充分被靶细胞、靶组织吸收,从而能够有效降低药物的毒性[11]。黄鑫等[12]运用LC-MS/MS法测定紫杉醇脂质体和紫杉醇注射液在大鼠和荷瘤裸鼠体内的组织分布特征,结果显示紫杉醇脂质体和紫杉醇注射液在大鼠和裸鼠体内的组织分布一致,均能特异地分布到肝脏、肺和肠等,但是紫杉醇脂质体具有更好的靶向性和更高的安全性。王杰等[13]比较了紫杉醇脂质体与紫杉醇注射液在大鼠体内的药动学差异,结果显示脂质体不仅能使药物在体内的浓度维持较长时间,而且使药物更好的聚集于肿瘤靶组织,从而增加治疗疗效,减少毒副作用。顾术东等[14]比较了紫杉醇脂质体与紫杉醇联合卡培他滨一线治疗晚期胃癌的疗效和安全性,醇脂质体联合卡培他滨组与紫杉醇联合卡培他滨组的有效率、疾病控制率和中位疾病进展分别为46.2%vs.43.5%、73.1% vs.69.6%、5.7个月vs.5.4个月(P均>0.05),但恶心、呕吐的发生率分别为30.8%vs.60.9%(P= 0.035),关节肌肉酸痛15.4%vs.47.8%(P= 0.014)。
在本研究中,试验组应用紫杉醇脂质体和对照组应用紫杉醇后,两组的客观有效率、临床获益率及无进展生存时间均无显著统计学差异(P均>0.05),这与王杰等[13]的基础研究结果和紫杉醇脂质体在胃癌[14]、肺癌[15]和乳腺癌[16]中的临床研究结果类似。但是本研究中试验组恶心、呕吐,肌肉关节痛,过敏反应及末梢神经炎的发生率显著低于对照组(P均<0.05),这与黄鑫等[12]的基础研究结果和顾术东等[15]在胃癌中的研究结果类似。
综上所述,紫杉醇脂质体与普通紫杉醇联合顺铂治疗晚期非小细胞肺癌疗效相当,但紫杉醇脂质体联合顺铂的患者恶心、呕吐,肌肉关节痛,过敏反应及末梢神经炎等不良反应的发生率显著降低,这就使得患者化疗耐受性提高,值得临床推广应用。
[1]Li L,Liu LY,Chen M,et al.A pilot study of conformal radiotherapy combined with erlotinib-based multimodality therapy in newly diagnosed metastatic non-small-cell lung cancer[J].Eur Rev Med Pharmacol Sci,2015,19(10):1812-1820.
[2]Brown T,Pilkington G,Bagust A,et al.Corrigendum:Clinical effectiveness and cost-effectiveness of first-line chemotherapy for adult patients with locally advanced or metastatic non-small cell lung cancer:a systematic review and economic evaluation[J]. Health Technol Assess,2015,17(31):281-282.
[3]Cheng YJ,Lee YC,Chiu WC,et al.High Id1 expression,a generally negative prognostic factor,paradoxically predicts a favorable prognosis for adjuvant paclitaxel plus cisplatin therapy in surgically treated lung cancer patients[J].Oncotarget,2014,5(22):11564-11575.
[4]Li Y,Wang X,Li J,et al.Combination therapy of liposomal paclitaxel and cisplatin as neoadjuvant chemotherapy in locally advanced cervical cancer[J].Eur J Gynaecol Oncol,2015;36(1): 54-58.
[5]陈智伟,廖美琳.RESIST标准在肿瘤治疗疗效评价中的应用[J].中国肿瘤,2004,13(10):616-618.
[6]Trotti A,Byhardt R,Stetz J,et al.Common Toxicity Criteria (version 2.0):An improved reference for grading the acute effects of cancer treatment—Impact on radiotherapy[J].Int J Radiat Oncol Biol Phys,2000,47(1):13–47.
[7]Xu H,Fan M,Elhissi AM,et al.PEGylated graphene oxide for tumor-targeted delivery of paclitaxel[J].Nanomedicine(Lond),2015,10(8):1247-1262.
[8]Chen C,Hu H,Qiao M,et al.Tumor-targeting and pH-sensitive lipoprotein-mimic nanocarrier for targeted intracellular delivery of paclitaxel[J].Int J Pharm,2015,480(1-2):116-1127.
[9]Jiang J,Liang X,Zhou X,et al.Paclitaxel plus platinum or gemcitabine plus platinum in first-line treatment of advanced nonsmall-cell lung cancer:results from 6 randomized controlled trials[J].Int J Clin Oncol,2013,18(6):1005-1013.
[10]陈卓,蒋常春,唐小川.紫杉醇不良反应及合理用药探析[J].肿瘤药学,2012,2(1):73-74.
[11]Chen M,Zeng Z,Qu X,et al.Biocompatible anionic polyelectrolyte for improved liposome based gene transfection[J].Int J Pharm,2015,490(1-2):173-179.
[12]黄鑫,汤维维,江振洲,等.紫杉醇脂质体在大鼠和荷瘤裸鼠体内的组织分布[J].药学与临床研究,2013,21(2):129-132.
[13]王杰,余瑜.紫杉醇脂质体与注射液在大鼠体内的血药浓度及相关药动学参数对比[J].中国老年学杂志,2014,34:4234-4236.
[14]顾术东,茅国新,刘艳,等.紫杉醇脂质体与紫杉醇联合卡培他滨一线治疗晚期胃癌疗效比较[J].肿瘤基础与临床,2013,26(6):478-481.
[15]邓超,何燕,胡春宏.紫杉醇脂质体治疗非小细胞肺癌40例近期疗效及安全性分析[J].肿瘤防治研究,2011,38(3): 315-318.
[16]张丹华,周恩相.紫杉醇注射液、紫杉醇脂质体以及多西他赛治疗乳腺癌的疗效及安全性[J].中国癌症杂志,2013,23 (12):1014-1016.
Clinical observation of paclitaxel liposome plus cisplatin comparative paclitaxel and cisplatin in advanced non -small cell Lung cancer
SUN Yin-ping WANG Fu-li TIAN Wei LIU Xiao
(Dept.of Oncology,Zibo Central Hospital,Zibo 255000,China)
Objective:To observe the clinical efficacy and adverse reactions between paclitaxel liposome plus cisplatin and paclitaxel plus cisplatin in the treatment of advanced non-small cell lung cancer(NSCLC).Methods:Totally 50 patients with NSCLC were randomly assigned into experimental group and control group.In the experimental group,paclitaxel liposome was injected on day 1 at a dosage of 150 mg/m2and cisplatin was injected on day 1~3 at a dosage of 25mg/m2,the same dose and administration with paclitaxel and cisplatin in the control group,every 21 days for a chemotherapy cycle. Results:In the experimental group and the control group,the objective response rate(RR)and clinical benefit rate (CBR)were 44.0%vs.40.0%,80.0%vs.72.0%,respectively,there were no statistically significant difference between two groups(P=0.774,0.508).Progression-free survival time(PFS)in the experimental group was 5.6 months and 4.9 months in the control group,there was aslo no statistically significant difference between two groups(P=0.126). The incidence of nausea,vomiting,muscle and joint pain,allergic reactions and peripheral neuritis in the experimental group were significantly lower than the control group(P<0.05).There were no statistically significant difference in diarrhea,leukopenia,anemia,thrombocytopenia,alopecia and liver injury between two groups(P>0.05)Conclusion The paclitaxel liposome plus cisplatin is as effective as paclitaxel plus cisplatin in the treatment of NSCLC,but paclitaxel liposome plus cisplatin has less adverse reactions than paclitaxel plus cisplatin.
paclitaxel liposome;paclitaxel;non-small cell lung cancer;cisplatin
R73-36
A
1004-7115(2015)08-0871-04
10.3969/j.issn.1004-7115.2015.8.009
2015-6-8)
孙银萍(1971—),女,山东淄博人,主治医师,硕士,主要从事肺癌的化疗及分子靶向治疗工作。

