抑制自噬促进培美曲塞对A549细胞的增殖抑制作用
赵大海,陆友金
(安徽医科大学第二附属医院呼吸内科,安徽 合肥 230601)
抑制自噬促进培美曲塞对A549细胞的增殖抑制作用
赵大海,陆友金
(安徽医科大学第二附属医院呼吸内科,安徽 合肥 230601)
目的 研究培美曲塞对肺癌细胞A549自噬的作用及自噬的功能。方法 采用MTS法观察培美曲塞对A549细胞的增殖抑制作用;采用透射电镜和免疫印迹观察培美曲塞对A549细胞自噬体和自噬相关蛋白的影响;采用自噬抑制剂CQ抑制自噬后观察培美曲塞对A549细胞的抑制作用。结果 培美曲塞抑制A549细胞的增殖;培美曲塞诱导A549细胞自噬体表达增加,并诱导自噬相关蛋白Beclin-1表达和LC3-Ⅰ向LC3-Ⅱ的转换增加,p62表达降低;自噬抑制剂CQ提高培美曲塞对A549细胞抑制作用,使培美曲塞单药组的抑制率由(28.42±2.45)%增加到CQ联合培美曲塞组的(45.36±3.52)%。结论 培美曲塞可以诱导肺癌细胞A549自噬增加,抑制自噬提高培美曲塞对A549细胞的增殖抑制作用,为肺癌的临床治疗提供新的联合治疗方案。
自噬;培美曲塞;肺癌;LC3; p62;氯喹
自噬是细胞在饥饿、能量缺乏等代谢压力下的一种生理过程。细胞内的蛋白质、细胞器和胞质通过自噬作用被包裹、消化,最终降解成核苷、氨基酸和脂肪酸循环利用,合成新的大分子和ATP,以维持细胞的正常代谢和生存[1]。自噬异常与肿瘤等疾病密切相关[2]。研究表明,抗肿瘤药物可以不同程度引起肿瘤细胞自噬,抑制自噬可以提高抗肿瘤药物对肿瘤细胞的增殖抑制作用,使肿瘤细胞对抗肿瘤药物的敏感性增加[3]。目前正在开展多项临床研究以评价自噬抑制剂联合分子靶向治疗药物或化疗药物对实体瘤的疗效(www.clinicaltrials.gov)。培美曲塞二钠(pemetrexed disodium, PEM) 是一种新型多靶点抗代谢类药物,主要通过抑制胸苷酸合成酶、二氢叶酸还原酶和甘氨酰胺核苷甲酰基转移酶,干扰复制过程中叶酸的代谢而发挥抗肿瘤作用[4]。培美曲塞联合铂类是肺腺癌患者的标准治疗[4]。但是同所有抗肿瘤药物类似,天然或获得性耐药是其疗效不佳的重要原因。培美曲塞在肺癌治疗过程中疗效不佳的原因是否与诱导自噬相关尚不清楚。本实验通过体外研究观察培美曲塞对肺腺癌细胞株A549自噬的作用,并在此基础上探讨自噬的功能,为临床更加合理化的治疗方案提供理论基础。
1 材料与方法
1.1 细胞株与主要试剂人A549肺癌细胞购自中科院上海细胞库;DMEM高糖培养基、胎牛血清购于Gibco公司;预染蛋白分子量Marker购自Fermentas公司;PVDF 膜购于Millipore公司;培美曲塞购于美国礼来公司;氯喹(chloroquine, CQ)购于Sigma Aldrich公司;LC3、Beclin-1、p62、GAPDH和HRP标记的羊抗兔IgG抗体购于Cell Signaling Technology。
1.2 方法
1.2.1 细胞增殖抑制实验 采用MTS法检测细胞增殖。取对数期细胞,接种于96孔培养板内,每孔1×104个细胞,24 h后将培养液换成含药物的新鲜培养液。分别培养24、48、72 h后,加入10 μL MTS试剂,37℃ 孵育0~4 h,每隔30 min用酶标仪在490 nm波长下测量吸光值 (A490 nm)。空白组只含有培养基而无细胞,按下式计算药物对肿瘤细胞生长的抑制率:肿瘤细胞生长抑制率(inhibitory rate, IR)/%=(1-实验组A值/细胞组A值)×100%。通过Graph Pad Prism 3.0 软件绘制细胞增殖活性曲线,并算出半数抑制浓度(IC50)值。
1.2.2 透射电镜观察自噬体 取对数生长期细胞每孔1×105个接种于6孔板上培养过夜,加入指定浓度培美曲塞孵育24 h后,细胞收集在离心管内,PBS冲洗后,用2.5%的戊二醛、1%的锇酸双固定,梯度乙醇脱水、渗透、包埋、聚合、超薄切片,染色,拍照。
1.2.3 免疫印迹分析 将A549细胞接种于6孔板中,24 h后加入相应的药物和新鲜培养液,处理所需时间后,用冷PBS清洗,再用RIPA裂解液裂解细胞,离心后收集上清,取等量蛋白上样液进行SDS PAGE电泳。电泳结束后,将分离的蛋白转移到PVDF膜上,5%脱脂牛奶封闭1 h,之后加入一抗于4℃ 摇床孵育过夜,TBST洗膜加入相应的HRP标记的羊抗兔IgG,37℃孵育2 h, 最后用Biological Industries ECL发光试剂盒显影。富士化学发光成像仪Las-4000成像,观察各条带深浅变化并加以分析,GAPDH作为对照。
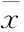
2 结果
2.1 培美曲塞对A549肺癌细胞的增殖抑制作用培美曲塞在0~9.6 μmol·L-1浓度范围内对A549细胞株有增殖抑制作用,抑制率随着药物浓度的升高和时间的延长而增加,呈剂量和时间依赖性(Fig 1)。培美曲塞0、0.6、1.2、2.4、4.8、9.6 μmol·L-1浓度时作用于A549 72 h后的抑制率依次为:(0.56±0.12)%、(8.24±0.98)%、(28.42±2.45)%、(39.56±3.21)%、(65.79±4.63)%。IC50为(6.43±2.57) μmol·L-1。
2.2 培美曲塞诱导肺癌细胞自噬
2.2.1 培美曲塞诱导自噬体增加 自噬在形态学上典型的表现是含有双层膜的自噬体。有无双层膜的自噬体是判断自噬存在与否的金标准。为了观察培美曲塞处理后A549细胞自噬体的变化,我们采用 1.2 μmol·L-1培美曲塞处理A549细胞24 h后,收集细胞采用透射电镜观察自噬体的变化。透射电镜发现药物处理组含有双层膜的自噬体明显增多,而对照组只能观察到少数自噬囊泡形成(Fig 2)。这表明培美曲塞诱导自噬体增多。
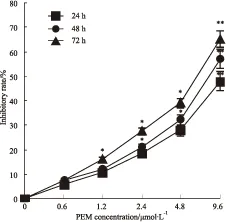
Fig 1 Inhibitory effect of pemetrexed (PEM) on proliferation of A549 cells
*P<0.05,**P<0.01vscontrol
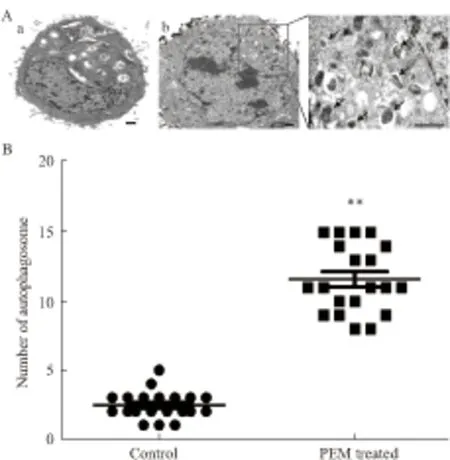
Fig 2 Autophagosome increases in PEM treated A549 cells
A: Numerous typical double-layer membrane autophagosomes (arrows) appeared in A549 cells treated with 1.2 μmol·L-1PEM for 24 h. (a:control, b: PEM treatment); B: The number of autophagosomes was calculated by continuous counts in 30 fields under high resolution. Bar = 1 μm.**P<0.01vscontrol
2.2.2 培美曲塞诱导自噬相关蛋白表达 自噬相关蛋白ATG8在哺乳动物的类似物为微管相关蛋白轻链3 (light chain 3,LC3)。LC3在其C末端被ATG4剪切,形成LC3-Ⅰ。LC3-Ⅰ通过ATG7和ATG3同磷脂酰乙醇胺(phosphatidylethanolamine, PE)相偶联,形成LC3-Ⅱ,定位于自噬体的内外层膜。LC3参与了前体膜的延长和闭合,也参与了自噬体的形成。因此,ATG8/LC3是自噬的重要分子标记物。p62是一种同LC3相互作用的蛋白,p62的表达同自噬活化呈负相关。Western blot分析表明,随着培美曲塞浓度的增加,LC3-Ⅰ向LC3-Ⅱ的转换增加。Beclin-1蛋白随着药物浓度的增加表达增加。相反,p62表达随着培美曲塞浓度的增加而降低(Fig 3)。这表明培美曲塞诱导自噬活化增加。
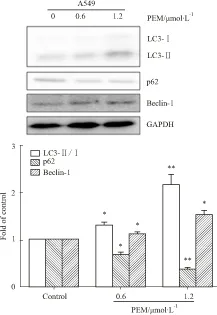
Fig 3 Autophagy related proteins are induced by exposure to PEM
Cells were incubated with the indicated concentration of PEM for 24 h. The transition of LC3-Ⅰ to LC3-Ⅱ and Beclin-1 were increased and the expression of p62 was decreased.*P<0.05,**P<0.01vscontrol
2.3 抑制自噬提高培美曲塞对肺癌细胞的增殖抑制作用自噬在肿瘤的发生发展中起着重要的作用。在本研究中我们观察到培美曲塞诱导肺癌细胞自噬活化增加,但并不清楚自噬活化促进培美曲塞的抗肿瘤作用或导致肿瘤细胞耐药的发生。氯喹(chloroquine, CQ)是特异性自噬抑制剂,主要抑制了自噬体和溶酶体的结合,抑制自噬的降解,使得自噬体在细胞内增加。Western blot分析表明,自噬抑制剂CQ联合PEM组,LC3-Ⅰ向LC3-Ⅱ的转换增加更为明显。MTS分析表明,自噬抑制剂CQ促进了培美曲塞对肺癌细胞A549的抑制作用。1.2μmol·L-1培美曲塞对A549细胞的抑制率为(28.42±2.45)%,CQ联合培美曲塞对A549细胞的抑制率为 (45.36±3.52)% ,见Fig 4。
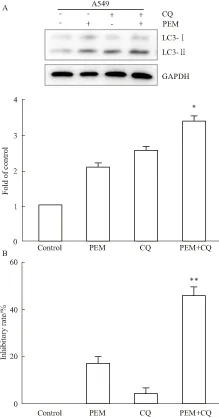
Fig 4 Inhibition of autophagy facilitates the inhibitory effect of PEM on A549 cells
A:Western blot for the transition of LC3-I to LC3-Ⅱ in A549 cells treated with 1.2 μmol·L-1PEM in the presence or absence of 5 μmol·L-1CQ; B:A549 cells were treated with 1.2 μmol·L-1PEM or DMSO in the presence or absence of CQ (5 μmol·L-1) for 72 h. Inhibitory rate was measured by MTS assay.*P<0.05,**P<0.01vsPEM treated alone.
3 讨论
非小细胞肺癌是我国发病率和死亡率位于第1位的恶性肿瘤[5]。铂类为基础的两药联合化疗方案是目前晚期EGFR状态未知肺非鳞癌患者的标准治疗方案。Ⅲ期临床研究表明培美曲塞联合铂类化疗方案能改善患者的总生存时间(over survival, OS)[6]。本研究表明,培美曲塞对A549表现出不同的抗肿瘤作用。培美曲塞对肿瘤细胞的抑制作用具有剂量和时间依赖性。
自噬是广泛存在于从酵母、线虫、果蝇到高等脊椎动物的细胞中一种自我保护的过程[1]。饥饿、能量缺乏等代谢应激可诱导自噬活化[7]。大量的研究表明,抗肿瘤药物如奥沙利铂、氟尿嘧啶等可以不同程度地诱导自噬发生[8-9]。陈美娟等[10]通过对自噬效应在非小细胞肺癌靶向治疗中的应用进行综述分析认为,在非小细胞肺癌治疗的过程中,要充分考虑到自噬的作用,对其进行合理的调节。本研究中,我们发现培美曲塞处理肺癌细胞后透射电镜可以观察到自噬体的增加。此外,蛋白印迹实验表明培美曲塞可以诱导自噬相关蛋白Beclin-1表达增加,p62表达减少,同时促进了LC3-Ⅰ向LC3-Ⅱ的转换。这些结果表明培美曲塞诱导A549细胞自噬活化。
自噬是一种高度动态的过程,在肿瘤的发生发展过程中有两面性。一方面,过度活化的自噬导致细胞死亡的发生,即“自噬性细胞死亡”[11];另一方面,自噬通过降解细胞内大分子成份为自身提供能量从而促进细胞生长,导致肿瘤耐药的发生及加速肿瘤细胞的增殖。在本研究中,我们观察到培美曲塞诱导自噬活化增加,但是我们并不清楚自噬活化在这一过程中是导致细胞对培美曲塞耐药增加,还是导致自噬性死亡。我们发现自噬抑制剂CQ处理后LC3-Ⅱ表达增加。培美曲塞组联合CQ组LC3-Ⅰ向LC3-Ⅱ的转换增加更为明显。MTS实验表明自噬抑制剂CQ提高了培美曲塞对肺癌细胞的增殖抑制作用,使得培美曲塞对肺癌细胞的抑制率由单药时的28%左右增加到联合组的45%左右。这表明自噬活化导致A549肺癌细胞对培美曲塞的敏感性降低,抑制自噬使得培美曲塞对肺癌细胞的抑制作用增加。这与现有的研究相一致,大多数研究认为自噬使得肿瘤细胞对抗肿瘤药物的耐药性增加,抑制自噬可以提高肿瘤细胞对抗肿瘤治疗的敏感性,增加对肿瘤细胞的增殖抑制作用。
总之,培美曲塞可以诱导肺癌细胞自噬发生。自噬活化使得肺癌细胞对培美曲塞的敏感性降低,抑制自噬可以提高培美曲塞对肺癌细胞的抑制作用。培美曲塞诱导自噬的分子机制及抑制自噬提高培美曲塞抗肿瘤作用是否与促进凋亡相关尚需进一步研究。
(致谢:感谢安徽医科大学第一附属医院老年呼吸内科刘荣玉教授的关心和指导,感谢中国科技大学生命科学院周江宁老师及实验室的各位同仁的帮助与支持。)
[1] Rosenfeldt M T, Ryan K M. The multiple roles of autophagy in cancer[J].Carcinogenesis, 2011, 32(7): 955-63.
[2] Won K Y, Kim G Y, Kim Y W, et al.Clinicopathologic correlation of beclin-1 and bcl-2 expression in human breast cancer[J].HumPathol, 2010, 41(1): 107-12.
[3] Sui X, Chen R, Wang Z, et al. Autophagy and chemotherapy resistance: a promising therapeutic target for cancer treatment[J].CellDeathDis, 2013, 4: e838.
[4] Gentzler R D, Patel J D. Optimal first-line and maintenance treatments for advanced-stage nonsquamous non-small cell lung cancer[J].JNatlComprCancNetw, 2014,12(6):889-97.
[5] Jemal A, Bray F, Center M M, et al. Global cancer statistics[J].CACancerJClin, 2011, 61(2): 69-90.
[6] Scagliotti G V. Pemetrexed: a new cytotoxic agent in the development for first-line non-small-cell lung cancer[J].LungCancer, 2005, 50(Suppl 1): S18-9.
[7] Clarke R, Cook K L, Hu R, et al. Endoplasmic reticulum stress, the unfolded protein response, autophagy, and the integrated regulation of breast cancer cell fate[J].CancerRes,2012, 72(6): 1321-31.
[8] Selvakumaran M, Amaravadi R K, Vasilevskaya I A, et al. Autophagy inhibition sensitizes colon cancer cells to antiangiogenic and cytotoxic therapy[J].ClinCancerRes, 2013, 19(11): 2995-3007.
[9] Guo X L, Hu F, Zhang S S, et al. Inhibition of p53 increases chemosensitivity to 5-FU in nutrient-deprived hepatocarcinoma cells by suppressing autophagy[J].CancerLett, 2014, 346(2): 278-84.
[10] 陈美娟,詹 諂,张 旭. 肿瘤自噬效应及其在非小细胞肺癌分子靶向治疗中的潜在应用[J]. 中国药理学通报, 2012, 28(3):300-3.
[10] Chen M J, Zhan Z, Zhang X. Autophagic effect on tumor and its potential applications in non-small cell lung cancer molecular trargetd therapy[J].ChinPharmacolBull, 2012, 28(3):300-3.
[11]Degenhardt K, Mathew R, Beaudoin B, et al. Autophagy promotes tumor cell survival and restricts necrosis, inflammation, and tumorigenesis[J].CancerCell, 2006, 10(1): 51-64.
Autophagy inhibition facilitates the anti-proliferative effect of pemetrexed on A549 cells
ZHAO Da-hai, LU You-jin
(DeptofRespiratoryMedicine,theSecondHospitalofAnhuiMedicalUniversity,Hefei230601,China)
Aim To explore the effect of pemetrexed on autophagy and the function of autohpagy activation in A549 cells. Methods The anti-proliferative effect of pemetrexed on A549 cells was detected by MTS. The formation of autophagosome was observed by transmission electron microscopy (TEM) and the expression of autophagy-related proteins was determined by Western blot. The inhibitory effects of the combination of pemetrexed and a selective autophagy inhibitor on A549 cells were measured by MTS. Results Pemetrexed inhibited the proliferation of A549 cells. Autophagy was activated in A549 cells by exposure to pemtrexed. Autophagosome was increased in pemetrexed treatment cells compared with control group. Pemtrexed treatment led to the formation of autophagosome and the conversion of LC3-Ⅰ to LC3-Ⅱ. The increase of Beclin-1 and the decline of autophagy substrate of p62 were observed in pemtrexed treated A549 cells. The pharmacological autophagy inhibitor chloroquine (CQ) sensitized A549 cells to pemetrexed treatment. The inhibitory rate was (28.42±2.45)% for pemetrexed only, and (45.36±3.52)% for pemetrexed combined with CQ. Conclusions Pemetrexed could activate autophagy in A549 cell lines. The disruption of autophagy facilitates the anti-proliferative effect of pemetrexed on A549 cells, which provides a novel strategy in lung cancer treatment.
autophagy; pemetrexed; lung cancer; LC3; p62;chloroquine
时间:2015-4-15 15:44 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150415.1545.012.html
2014-12-21,
2015-01-28
安徽省高校省级自然科学研究项目(No KJ2013A145)
赵大海(1973-),男,博士生,副主任医师,研究方向:肺癌的治疗,E-mail:879766645@qq.com; 陆友金(1962-),男,硕士,主任医师,副教授,硕士生导师,研究方向:肺癌的治疗,通讯作者,E-mail: luyougolden@hotmail.com
10.3969/j.issn.1001-1978.2015.05.015
A
1001-1978(2015)05-0664-05
R329.24;R329.25;R734.2;R979.1