芒果MSOC1基因的克隆与表达分析
魏军亚,唐 杰,刘国银,刘德兵*,陈业渊
(1中国热带农业科学院热带作物品种资源研究所/农业部热带作物种质资源利用重点开放实验室,海南儋州571737;2海南大学农学院,海口570228;3海南大学应用科技学院,海南儋州571737)
芒果MSOC1基因的克隆与表达分析
魏军亚1,唐 杰2,刘国银3,刘德兵3*,陈业渊1
(1中国热带农业科学院热带作物品种资源研究所/农业部热带作物种质资源利用重点开放实验室,海南儋州571737;2海南大学农学院,海口570228;3海南大学应用科技学院,海南儋州571737)
MADS-box转录因子在多种植物的发育过程、特别是花器官的发育过程中发挥着重要的作用。为研究MADS-box转录因子在芒果花器官发育中的作用,利用RT-PCR和RACE技术分离到1个芒果的SOC1基因,命名为MSOC1(GenBank登录号为KP404094)。MSOC1编码区为733bp,编码223个氨基酸,蛋白质相对分子质量为25.6kD,理论等电点为8.96。序列比对和系统进化树分析表明,MSOC1具有保守的MADS-box及半保守的K区,属于MADS-box家族SOC1/TM3亚家族。组织特异性表达分析表明,MSOC1基因在芒果各个组织部位均有表达,但在茎、叶和花芽中表达量高,而在根和花中表达量低。
芒果;MSOC1;克隆;表达
高等植物开花受一系列内外因素的共同调控,许多特定基因在特定时空环境下表达及相互作用,以确保植物在适当的时间和地点发生从营养生长向生殖生长的转变,从而保证植物在适宜时间开花[1]。开花相关基因的表达和调控是实现这一转变过程的分子基础,花分生组织特征基因和花器官特征基因绝大多数都是MASD-box类基因[2]。MASD-box基因是高等植物中一类重要的转录调控因子,参与植物的生长发育调控和信号传导等多个方面,尤其在花发育调控中发挥关键作用。SOC1(SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1)基因是植物开花途径中控制开花时间的基因,它整合了光周期途径、春化途径、自主途径和赤霉素途径等诱导开花途径的各种信号,作用于下游花分生组织特异基因,促进植物的营养分生组织向花序分生组织转变,从而促进植物的开花[3]。目前已从拟南芥(Arabidopsis thaliana)、水稻(Oryza sativa)、小麦(Triticum aestivum)、非洲菊(Gerbera hybrida)、甜橙(Citrus sinensis)、大豆(Glycine max)等[4-9]多个物种中克隆到SOC1基因,研究发现SOC1基因除了能整合多种开花信号,还具有其他功能,如控制一年生拟南芥的生长习性[10],参与天气冷凉延迟开花、温暖气候促进开花的微调[11]等。
芒果是重要的热带、亚热带果树,享有“热带果王”的盛誉,具有很高的经济价值[12]。目前有关于芒果开花机理的分子生物学研究较少,众多与开花有关的基因,如CO、FT、LFY、FLC、AP1等中,仅对LFY[13]和AP1[14]基因进行了一些研究。为克隆新的芒果开花有关的MADS-box基因,研究其在芒果花发育中的作用,本研究利用RT-PCR和RACE技术克隆得到1个芒果开花调控的重要转录因子SOC1基因的同源基因MSOC1的序列全长,进行了相关生物信息学分析,并研究分析了MSOC1基因在芒果植株不同组织部位的表达,以期为从分子水平上认识芒果成花机理等研究积累资料奠定基础。
1 材料和方法
1.1 试验材料
供试材料吕宋芒(Carabao)采自中国热带农业科学院热带作物品种资源研究所芒果种质资源圃。于2013年年12月15日采收吕宋芒花序,用液氮速冻后,保存在-80℃冰箱中备用,作为提取总RNA的植物材料,用于基因克隆研究。于2014年1月20日分别采收吕宋芒花芽、花以及根、茎、叶等器官,用液氮速冻后,保存在-80℃冰箱保存,用于基因的组织表达特异性分析。
1.2 MSOC1基因全长cDNA克隆
1.2.1 总RNA提取及cDNA第一链合成 参照改良CTAB法[15]提取吕宋芒花序总RNA。将提取的总RNA取3μL在0.8%琼脂糖凝胶上电泳检测,并用紫外分光光度计检测OD值,计算RNA浓度和纯度。以1.0g总RNA为模板,Oligo(dT)primer为引物,采用TaKaRa PrimeScriptTMRTPCR Kit试剂盒[宝生物工程(大连)有限公司]合成cDNA第一链。
1.2.2 芒果MSOC1基因5′-RACE和3′-RACE及全长的克隆 以本实验室前期通过简并引物进行RT-PCR扩增得到一个MADS-box基因的保守片段为依据,分别设计3′-RACE和5′-RACE引物(表1),以上述花序组织反转录的cDNA为模板进行3′-RACE和5′-RACE扩增。RACE操作参照3′-Full RACE Core Set试剂盒和5′-Full RACE Core Set试剂盒(TaKaRa)推荐的方法进行。PCR反应条件为94℃变性5min后进入循环,循环参数为94℃变性45s、55℃退火45s、72℃延伸2min,36个循环,72℃延伸10min。
根据5′-RACE和3′-RACE测序结果,将3′-RACE、5′-RACE和已知片段进行拼接获得全长cDNA序列,根据拼接序列设计全长特异性引物SOC1-1和SOC1-2(表1),以花序组织反转录cDNA第一链为模板进行PCR扩增,PCR反应条件为:94℃预变性5min、94℃变性30s、55℃退火45 s、72℃延伸1.5min,30个循环;72℃延伸10min。1%琼脂糖凝胶电泳检测后,切胶回收与PMD18-T载体(Takara)连接,转化大肠杆菌DH5α,筛选阳性克隆测序。

表1 PCR扩增所用引物及其序列Table 1 Primers required in PCR amplification
1.3 生物信息学分析
利用NCBI的BLAST工具进行同源分析;利用ORF(Open Reading Frame,ORF)Finder软件寻找开放阅读框;利用ProtParam软件(http://web.expasy.org/protparam/)分析编码蛋白的氨基酸序列组成、分子量、等电点等理化性质。采用Ex-PASy ProtParam软件分析序列等电点。采用ClustalW和Mega软件进行推导氨基酸序列的多序列比对和系统进化树构建。
1.4 基因表达特性分析
采用半定量RT-PCR和实时荧光定量PCR检测MSOC1基因在不同组织(花芽、花、根、茎和叶)的表达模式。其中,半定量RT-PCR程序为:94℃预变性5min;94℃变性30s,45℃退火45s,72℃延伸90s,35个循环;72℃延伸10min。每个反应3次重复,扩增产物用0.8%琼脂糖凝胶电泳进行检测。采用SYBR®GreenⅠ嵌合荧光法进行实时定量PCR,反应体系为:10μL SYBR®Premix Ex Taq混合液,正、反向引物各1μL 2μL cDNA,加入ddH2O补足到20μL体系。反应程序为95℃预变性3min;然后95℃5s,60℃30s,共40个循环,试验以Actin为内参基因,3次重复,2-△△Ct法[16]计算不同时间MSOC1基因相对表达量,应用Excel进行数据统计分析。
2 结果与分析

图1 芒果MSOC1基因3′-RACE(A),5′-RACE(B)和全长ORF扩增结果(C)Fig.1 PCR products of 3′-RACE(A),5′-RACE(B)and full length ORF(C)of MSOC1gene M.DL2000
2.1 芒果MSOC1基因克隆与鉴定
以芒果花序cDNA为模板,利用RACE方法分别获得789bp的3′端片段(图1,A)和268bp的5′端片段(图1,B)。将得到的3段序列(中间序列、3′端、5′端序列)在DNAMAN中进行序列拼接,根据拼接序列在ORF两端设计引物进行PCR扩增,得到MSOC1基因的mRNA全长ORF序列(图1, C),测序结果显示,该PCR产物长度为733bp,测序结果与拼接序列相应片段完全一致。
通过NCBI的Blastx比对,发现该序列与四季芒(Siji Mangifera indica L.)的SOC1(GenBank登录号为ADX97324.1)序列一致性达99%,其推导的蛋白序列具有MADS_MEF2类保守结构域和K-box结构域,说明所克隆的基因属于典型的MASD-box基因。因此,初步认为克隆得到了芒果SOC1基因,将其命名为MSOC1,GenBank登录号为KP404094。
2.2 芒果MSOC1全长cDNA序列及生物信息学分析
利用NCBI在线工具分析芒果MSOC1的开放阅读框,发现MSOC1基因编码区由669个核苷酸组成,编码1个含有223个氨基酸的蛋白质,起始密码子为ATG,终止密码子为TGA,且含有加尾信号AATAAA序列和polyA序列(图2)。通过NCBI的Blastp比对发现,MSOC1基因的3~77位氨基酸为典型的MADS结构域,进一步分析发现,MSOC1基因的第75~170位氨基酸为一个K-box结构域。利用ExPASy ProtParam软件分析其理化性质,推测该蛋白的分子式为C1108H1828N332O346S11,相对分子质量为25 689.3,预测其等电点(pI)为8.96。蛋白由20个氨基酸组成,其中负电荷系数[(Asp+Glu)∶35],正电荷系数[(Arg+Lys)∶39],该蛋白中相对含量较多的氨基酸是Glu(E)29占13.0%,Leu(L)22占9.9%,Arg(R)21占9.4%,Lys(K)18占8.1%,其中Pyl、Sec含量为0。不稳定系数为65.51,说明该蛋白是一个不稳定蛋白(40以下为稳定蛋白)。
将MSOC1基因推导的氨基酸序列和其他物种SOC1蛋白的氨基酸序列进行同源比对(图3),结果发现该氨基酸序列与很多植物SOC1蛋白氨基酸序列具有较高的同源性。其中与四季芒(Siji Mangifera indica)SOC1蛋白氨基酸序列相似性最高,达99%;与荔枝(Litchi chinensis)SOC1蛋白氨基酸序列的相似性为72%;和甜橙(Citrus sinensis)SOC1蛋白氨基酸序列的相似性为74%。MADS-box结构域相似性在83%~100%之间,K-box结构域相似性在51%~65%之间。芒果MSOC1在C端具有一个SOC1/TM3亚家族特有的基序,说明所获得的MSOC1属于MADS-box基因家族中的SOC1/TM3亚家族。从系统进化树也可以看出(图4),MSOC1也与四季芒((ADX97324.1)亲缘关系较近,归属于MADS-box基因家族SOC1/TM3亚家族。

图2 MSOC1基因核苷酸序列和推测氨基酸序列带下划线的碱基序列ATG表示起始密码子;*表示终止密码子TGAFig.2 cDNA sequence and deduced amino acid sequence of MSOC1 The nucleotide sequence ATG with underlined means initiator codon;TGA with*means terminator codon

图3 不同植物SOC1氨基酸序列比对划线部分为MADS-box、K-box结构域Fig.3 Alignment of amino acid sequences of SOC1from different plants The MADS-box and F-box are underlined
2.3 芒果MSOC1基因的器官特异表达分析
用半定量RT-PCR方法分析MSOC1在芒果不同组织的表达情况,结果如图5所示,MSOC1基因在根部、茎部、叶片、花芽和花中均有表达,但是表达程度不同。在叶片中表达强度最高,其次是茎部、花芽和根,花中表达量最低。
为了进一步研究MSOC1在不同组织器官中的相对表达量,进行了荧光实时定量分析。结果显示(图6)与半定量结果一致。可见芒果MSOC1基因具有显著的组织表达特异性。尤其在营养器官的根、茎和叶中特异表达,在花芽中也表达,而花的表达量最低。

图4 芒果与其他物种中SOC1蛋白的系统进化树Fig.4 Phylogenetic tree of the deduced amino acid sequences of SOC1in mango and other different species
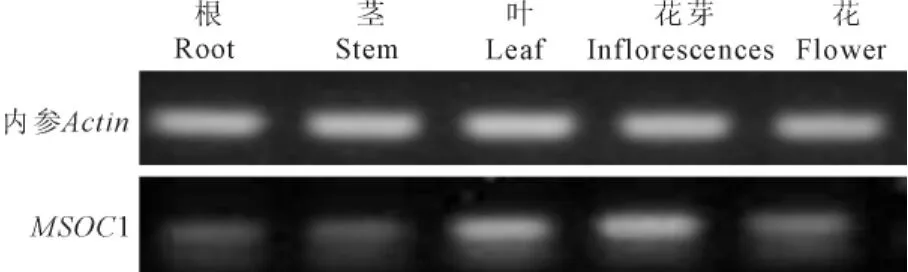
图5 MSOC1在芒果不同组织部位的表达Fig.5 Different expression levels of MSOC1 gene in different organs of M.indica

图6 MSOC1在芒果不同组织部位的相对表达量Fig.6 The relative expression levels of MSOC1 gene in different organs of M.indica
3 讨 论
近年来,随着分子生物学的发展,参与调控植物花器官特征的MADS-box基因研究获得了突破性的进展。其中SOC1作为开花时间调控路径的结点基因,广泛存在于单子叶植物和双子叶植物中[17]。SOC1整合了多条开花途径的开花信号,不仅可调控开花时间,而且也能参与花器官形态建成[18]。Becker等[19]认为SOC1主要在营养器官中表达,在营养器官发育和营养生长向生殖生长转变也起重要的作用。在拟南芥中SOC1在各个部位均表达,在茎尖中表达量最高,其表达量随着营养生长的进程而增加,在成花转变时表达量大量增加,与下游花分生组织特异基因共同作用完成成花转变[20]。
本研究通过RT-PCR和RACE技术克隆得到芒果MSOC1基因,并对其亚家族的分属和表达模式进行了分析。其推导的蛋白序列具有MADS_MEF2类保守结构域和K-box结构域,属于典型的MASD-box基因,在其C端具有一个SOC1/TM3亚家族特有的基序,系统发育树分析将其属于MADS-box基因家族中的SOC1/TM3亚家族。对MSOC1进行不同组织部位的表达分析表明,该基因在根、茎、叶、花和早期花芽中均有表达,且在根中表达水平较低,在叶片和茎中表达较高,花芽的表达量比叶片和茎稍低。在拟南芥中,SOC1基因是调控植物从营养生长向生殖生长转变的重要基因[20],由此推测芒果MSOC1基因可能调控芒果花芽分化前期的表达,在芒果营养生长向生殖生长转变过程中起着重要作用。
SOC1整合了多条开花途径的开花信号,调控花分生组织的建成。目前人们对模式植物拟南芥SOC1已经有了比较广泛和深入的研究,但是仍然有许多问题没有研究清楚,本研究得到MSOC1基因,为进一步深入研究基因表达模式和功能奠定了基础。下一步将构建MSOC1植物表达载体,进行转基因技术研究,以期在分子水平上揭示MSOC1基因在芒果调控营养生长向生殖生长转变过程中的分子机制和作用机理。
[1] AUSIN I,ALONSO-BLANCO C,MARTINEZ-ZAPATER J M.Environmental regulation of flowering[J].Int.J.Dev.Biol.,2005,49:689-705.
[2] WANG ZH H(王珍华),HU L X(胡立霞),ZHONG D(钟 丹),et al.Research progress of AGAMOUS like 6subfamily[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2012,32(7):1 480-1 487(in Chinese).
[3] MA T F(马腾飞),LIN X CH(林新春).Advanced research on SOC1/AGL20genes in plants:a review[J].Journal of Zhejiang A&F U-niversity(浙江农林大学学报),2013,30(6):930-937(in Chinese).
[4] LEE H,SUH S S,PARK E,et al.The AGAMOUS-LIKE 20MADS domain protein integrates floral inductive pathways in Arabidopsis[J].Genes Dev.,2000,4(18):2 366-2 376.
[5] TADEGE M,SHELDON C C,HELIWELL C A,et al.Reciprocal control of flowering time by OsSOC1in transgenic Arabidopsis and by FLC in transgenic rice[J].Plant Biotechonol.J.,2003,1(5):361-369.
[6] ZHAO T,NI Z F,DAI Y,et al.Characterization and expression of 42MADS-box genes in wheat(Triticum aestivumL.)[J].Mol.Genet.Genomics,2006,276(4):334-350.
[7] RUOKOLAINEN S,NG Y P,ALBERT V A,et al.Over-expression of the Gerbera hybrida At-SOC1-like 1gene Gh-SOC1leads to floral organ identity deterioration[J].Ann.Bot.,2011,107(9):1 491-1 499.
[8] ZHONG X F,DAI X,XV J H,et al.Cloning and expression analysis of GmGAL1,SOC1homologgene in soybean[J].Mol.Biol.Rep.,2012,39(6):6 967-6 974.
[9] TAN F C,SWAIN S M.Functional characterization of AP3,SOC1and WUS homologues from citrus(Citrus sinensis)[J].Physiologia Plantarum,2007,131(3):481-495.
[10] MELZER S,LENS F,GENNEN J,et al.Flowering-time genes modulate meristem determinacy and growth form in Arabidopsis thaliana[J].Nature Genetics,2008,40:1 489-1 492.
[11] SEO E,LEE H,JEON J,et al.Crosstalk between cold response and flowering in Arabidopsisis mediated through the flowering-time gene SOC1and its upstream negative regulator FLC[J].The Plant Cell,2009,21:3 185-3 197.
[12] WANG J L(王建立),GUAN ZH X(管正学),ZHANG H ZH(张宏志).Studies on current status of Mango resources and the processing technology[J].Natural Resources(自然资源),1997,6:52-59(in Chinese).
[13] HU G B(胡桂兵),LIN SH Q(林顺权),YE Z X(叶自行),et al.Isolation and sequence analysis of LEAFY homologous gene from mango[J].Subtropical Plant Science(亚热带植物科学),2004,33(2):1-4(in Chinese).
[14] LUO C(罗 聪),HE X H(何新华),CHEN H(陈 虎),et al.Cloning and bioinformatic analysis of the AP1homolog gene from mango[J].Genomics and Applied Biology(基因组学与应用生物学),2009,28(5):851-858(in Chinese).
[15] TONG Z,QU S,ZHANG J,et al.A modified protocol for RNA extraction from different peach tissues suitable for gene isolation and Real-Time PCR analysis[J].Molecular Biotechnology,2012,50(3):229-236.
[16] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(T)(Delta Delta C)method[J].Methods,2001,25(4):402-408.
[17] SMACZNIAK C,IMMINK R G H,ANGENENT G C,et al.Developmental and evolutionary diversity of plant MADS-domain factors:insights from recent studies[J].Development,2012,139:3 081-3 098.
[18] LIU C,XI WY,SHEN LS,et al.Regulation of floral patterning by flowering time genes[J].Development Cell,2009,16:711-722.
[19] BECKER A,THEISSEN G.The major clades of MADS-box genes and their role in the development and evolution of flowering plants[J].Molecular Phylogenetics and Evolution,2003,29:464-489.
[20] LIU C,ZHOU J,BRACHA-DRORI K,et al.Specification of Arabidopsis floral meristem identity by repression of flowering time genes[J].Development,2007,134:1 901-1 910.
(编辑:宋亚珍)
Cloning and Expression Analysis of MSOC1 Gene in Mango(Mangifera indica L.)
WEI Junya1,TANG Jie2,LIU Guoyin3,LIU Debing3*,CHEN Yeyuan1
(1Tropical Crops Genetic Resources Institute/Chinese Academy of Tropical Agriculture Sciences,Danzhou,Hainan 571737,China;2Agriculture College,Hainan University,Haikou 570228,China;3Applied Science and Technology College,Hainan University,Danzhou,Hainan 571737,China)
MADS-box transcription factor plays a crucial role in plant development,especially controlling the formation and development of floral organs.In order to investigate the role of MADS-box transcription factor in mango flower development,we cloned the flower-specific gene from mango inflorescence,named MSOC1(GeneBank accession no.KP404094)with homology-based cloning and RACE method.The open reading frame of MSOC1was 733bps,encoding 223amino acids with molecular weight 25.6kD and isoelectric point 8.96.Sequence alignment and phylogenetic tree analysis indicated that the MSOC1deduced protein contained a conservative MADS-box and semi-conservative K domain and belonged to the SOC1/TM3subfamily of the MADS-box family.Tissue-specific analysis showed that MSOC1was expressed in various tissues of mango,high expression in stems,leaves and inflorescences,low expression in roots and flowers.
mango;MSOC1gene;clone;gene expression
Q785;Q786
A
10.7606/j.issn.1000-4025.2015.06.1092
1000-4025(2015)06-1092-06
2015-02-02;修改稿收到日期:2015-04-17
农业部公益性行业(农业)科研专项(201203092);中央级公益性科研院所基本科研业务费专项(1630032012026);海南大学应用科技学院基金(HYK1402);海南省应用技术研发与示范推广专项(ZDXM2015016)
魏军亚(1974-),女,博士,主要从事植物分子生物学研究。E-mail:junyawei@126.com
*通信作者:刘德兵,博士,副教授,主要从事果树生物技术研究。E-mail:ldebing@126.com

