不同提取方法对红芪多糖体外抗氧化活性的影响研究
寇 宁,李磊强,李 钦,程卫东,2,*
(1.兰州大学基础医学院,甘肃兰州 730000;2.南方医科大学中医药学院,广东广州 510515)
不同提取方法对红芪多糖体外抗氧化活性的影响研究
寇 宁1,李磊强1,李 钦1,程卫东1,2,*
(1.兰州大学基础医学院,甘肃兰州 730000;2.南方医科大学中医药学院,广东广州 510515)
红芪多糖(HPS)是中药红芪中的主要成分。本文分别采用微波辅助、超声辅助及常规热水浸提从红芪中提取HPS,经脱蛋白、冷冻干燥后得到三种方法提取的红芪多糖HPS-M、HPS-C和HPS-H。红外光谱分析表明,HPS-M、HPS-C、HPS-H具有多糖的特征吸收峰;GPC测定结果显示,HPS-M、HPS-C、HPS-H的重均分子量分别为6.29×105、4.56×105、5.13×105,多分散性分别为3.42、3.22、2.31。HPS-H、HPS-M、HPS-C清除羟自由基、超氧自由基、DPPH自由基及还原力测定的体外抗氧化活性实验表明,HPS-M的体外抗氧化活性要显著高于HPS-C、HPS-H,因此,未来可考虑微波辅助法作为红芪多糖提取的首选方法。
红芪,多糖,体外抗氧化活性
红芪为豆科植物多序岩黄芪(HedysarumpolybotrysHand.-Mazz.)的干燥根,具有补气升阳、固表止汗、利水消肿等功效[1]。红芪多糖(HPS)是红芪的主要活性成分之一,是一种由鼠李糖、木糖、阿拉伯糖、葡萄糖和半乳糖组成的杂多糖[2],作为中医常用传统药物在恶性肿瘤及各种退行性疾病的临床治疗与康复中用量较大[1]。李晓东等人的研究发现,HPS-3能降低血糖,对T2DM大鼠的糖脂代谢紊乱有一定的调节作用,能促进T2DM大鼠肝糖原的合成,修复受损的胰岛β细胞,减轻T2DM大鼠胰岛素抵抗[3]。卫东峰等人利用蛋白质组学技术,研究了HPS对S180瘤细胞化疗协同增效作用的差异蛋白质,发现了对S180小鼠瘤细胞化疗增效作用的靶标蛋白,而这些蛋白质涉及能量代谢、氧化应激反应和凋亡信号[4]。杨涛等人采用细胞溶血法对HPS的抗补体活性进行研究结果表明,HPS具有一定程度的抗补体活性[5]。魏舒畅等人利用酶解提取红芪总多糖的研究发现,酶用量、酶解时间、酶解温度、溶剂pH、溶剂用量、提取时间等参数的选择会影响活性成分的提取[6]。
综上所述,对于HPS活性的研究,主要集中在降血糖、抗肿瘤等生物学活性方面,而多糖生物学活性与其清除自由基的能力密切相关。研究表明,不同的提取方法会影响多糖的清除自由基的活性,但对于不同方法提取的HPS的体外抗氧化活性的研究尚无文献报道。
本文以红芪为原料,分别采用微波辅助、超声辅助与常规热水浸提提取HPS,并研究不同提取方法HPS的体外抗氧化活性,从而筛选出获得体外抗氧化活性高的多糖的提取方法,以便为后续的研究提供基础。
1 材料与方法
1.1 材料与仪器
红芪药材购自甘肃武都。
电子天平BL320H 北京赛多利斯天平有限公司;紫外可见分光光度计UV1000 北京莱伯泰科仪器有限公司;集热式恒温磁力搅拌器DF-101B 科瑞仪器有限公司;冷冻干燥机LGJ-18S 郑州长城科工贸有限公司;傅立叶红外光谱仪 Nicolet380 美国热电;Agilent GPC 安捷伦科技有限公司。
1.2 实验方法
1.2.1 HPS的提取 红芪干燥根经预处理后,根据前期实验结果[7],采用超声辅助、微波辅助和常规热水浸提法对其多糖进行提取,得到HPS-C、HPS-M、HPS-H,具体工艺如图1所示。

图1 红芪多糖的提取工艺流程Fig.1 The extracting processes of HPS fromHedysarum polybotrys Hand.-Mazz
1.2.2 红外光谱表征(FT-IR) 充分干燥的样品与KBr压片,用Thermo Nicolet iS10红外光谱仪在400~4000 cm-1范围内扫描,扫描次数16次,分辨率4 cm-1。
1.2.3 分子量测定 采用体积排阻色谱(GPC)测定分子量。红芪多糖样品用去离子水配成所需浓度的溶液,用微孔滤膜过滤,在690 nm波长下用GPC测定。进样量200 μL,流速为0.5 mL/min,温度为25 ℃。

式(1)
1.2.5 对羟自由基(·OH)的清除作用 精确称取一定量的抗坏血酸(VC)与多糖样品,用蒸馏水配制成浓度为0.04、0.06、0.1、0.2、0.4、0.6、1、2、3 mg/mL的溶液,充分摇匀,备用。分别量取不同浓度的多糖溶液、VC溶液各0.1 mL,依次加入反应液(20 mmol/L pH7.4的磷酸盐缓冲液,2.67 mmol/L脱氧核糖,100 mmol/L EDTA)0.6 mL、0.4 mmol/L的硫酸亚铁胺溶液0.2 mL、10 mmol/L过氧化氢溶液0.2 mL,在37 ℃水浴加热15 min,再分别加入1%丙二酰硫脲溶液和2%的三氯乙酸溶液各1 mL,终止反应,然后沸水浴加热15 mim后冷却至室温,以蒸馏水为空白调零,在532 nm下测定吸光值,得Ai,用蒸馏水代替样品,测定A0,根据以下公式计算羟自由基(·OH)清除率[7-10],每个样品重复三次,求平均值。
式(2)
式(3)
1.2.7 还原力 精确称取一定量的抗坏血酸(VC),用蒸馏水配制成浓度为0.04、0.06、0.1、0.2、0.4、0.6、1、2、3 mg/mL的溶液,充分摇匀,作为对照品备用。分别量取不同浓度的多糖溶液、VC溶液各1 mL,依次加入磷酸缓冲液(pH6.6)和铁氰化钾(K3Fe(CN)6)溶液(1 wt%)各2.5 mL,混匀后50 ℃水浴20 min,然后加入三氯乙酸溶液(10 wt%)2.5 mL,混匀,1000 r/min离心10 min,取上清液2.5 mL,再加入蒸馏水和氯化铁(FeCl3,0.1 wt%)各2.5 mL,混匀,静置10 min,蒸馏水调零,在700 nm处测定吸光值,每个样品重复三次,以700 nm吸光值的平均数表示还原力的高低[7,9]。
1.3 数据处理
实验数据用SPSS 13.0软件进行统计学分析处理,组比较采用单因素方差分析(one-way ANOVA),各组间比较采用双尾t-检验,结果以Mean±SD表示,p<0.05表示差异显著,p<0.01为差异极显著。
2 结果与讨论
2.1 HPS的红外光谱
图2为不同方法提取的红芪多糖的红外光谱图。从图2可以看出,三种方法得到的红芪多糖在3418 cm-1有较强吸收峰,为O-H伸缩振动;2935 cm-1是由C-H伸缩振动引起的;1618 cm-1附近的吸收峰是由COO-基团的C=O非对称伸缩振动引起的;在1083 cm-1出现的强吸收峰是由糖环中C-O-C的伸缩振动引起的。

图2 红芪多糖的红外图谱Fig.2 FT-IR spectroscopy of HPS
2.2 HPS的分子量
HPS分子量的GPC色谱图如图3所示。由图3可以看出,HPS的色谱图的峰比较单一,表明HPS的组分没有聚集。GPC测定的HPS-M、HPS-C、HPS-H重均分子量为6.29×105、4.56×105、5.13×105,多分散性分别为3.42、3.22、2.31。这主要是由于微波辐射导致红芪多糖分子的交联,造成微波辅助提取后多糖分子量增大;超声振动会导致分子量断裂,导致超声辅助提取的红芪多糖的分子减小。
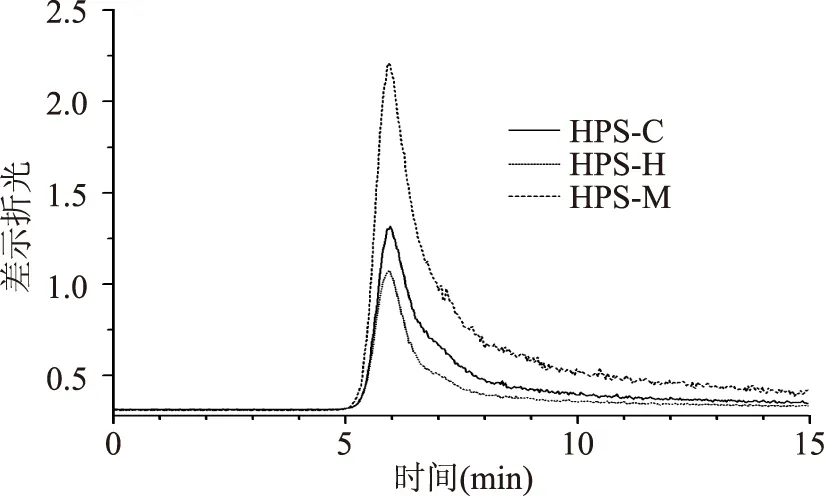
图3 红芪多糖的GPC图谱Fig.3 GPC chromatograms ofsamples Laser light scattering photometry for HPS
2.3 HPS的体外抗氧化活性
2.3.1 对DPPH自由基的清除作用 DPPH自由基是一种有机氮自由基,在517 nm处有吸光值,会随着还原而逐渐的褪色。不同提取方法对HPS清除DPPH自由基的影响如图4。由图4可知,0.04~2 mg/mL的浓度范围内,HPS-M、HPS-C、HPS-H对DPPH自由基的清除率随浓度的升高而增大,并呈剂量依赖;当HPS的浓度高于2 mg/mL时,这种趋势不再明显。HPS-M、HPS-C、HPS-H对DPPH自由基的EC50分别为0.52、0.63、0.72 mg/mL。HPS-M与HPS-C、HPS-H之间差异显著(p<0.05),HPS-C与HPS-H之间差异不显著。从图4可以看出,HPS浓度较高时对DPPH自由基的清除率没有显著增强,这可能主要是由于多糖的溶解度的限制以及氢键的增加所造成的。

图4 不同提取方法对HPS清除DPPH·能力影响Fig.4 The DPPH radical scavenging activityof HPS at different extraction methods
2.3.2 对羟自由基(·OH)的清除作用 超声、微波、热水三种提取方法对红芪多糖HPS清除羟自由基(·OH)的影响如图5所示。羟自由基是体内产生的一种时间短、活性高的自由基,对有机体来说危害非常大,除超氧自由基外,羟自由基被认为是与活细胞中所有功能性生物大分子反应最有效的氧化剂[11-12]。由图5可知,当HPS的浓度在0.04~1.0 mg/mL时,HPS对羟自由基的清除能力呈剂量依赖关系,随浓度的增大而增强;当浓度超过1 mg/mL时,红芪多糖对羟自由基的清除能力随浓度的增大趋势逐渐减缓,达到平衡。HPS-M、HPS-C、HPS-H的半数清除浓度(EC50)分别为0.55、0.67、1.42 mg/mL。HPS-C和HPS-M对羟自由基的清除能力要明显高于HPS-H,且差异显著(p<0.05),其中微波提取的HPS-M对羟自由基的清除活性最高,但三种方法得到HPS清除羟自由基的能力均低于维生素C的清除能力。

图5 不同提取方法对HPS清除·OH能力影响Fig.5 The ·OH radical scavenging activityof HPS at different extraction methods
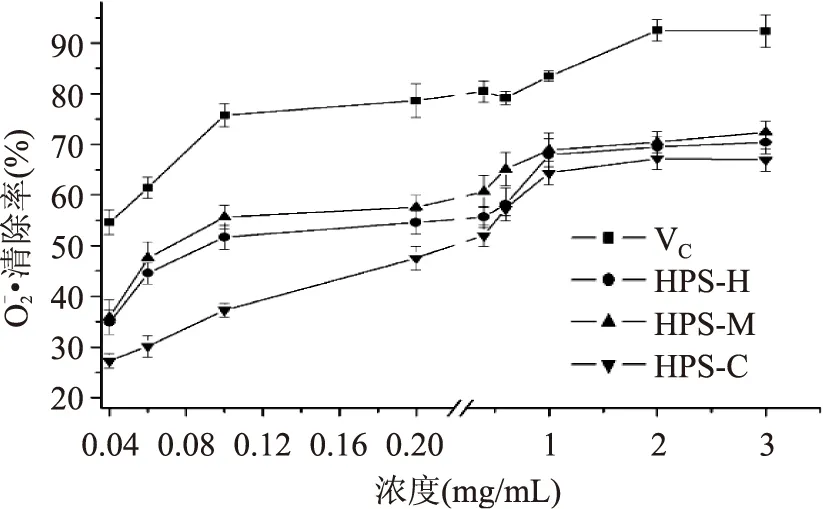
图6 不同提取方法对HPS 清除·能力影响Fig.6 The · radical scavenging activityof HPS at different extraction methods
2.3.4 还原力 多糖的还原能力主要是通过多糖存在时Fe3+-Fe2+的转化所测定的。多糖的还原能力,是多糖所具有的抗氧化活性的重要指标之一。不同处理方法对红芪多糖HPS还原力的影响如图7。由图7可知,在实验浓度范围内,HPS-M、HPS-C、HPS-H的还原力随浓度的增加而增强。在浓度为0.4 mg/mL之前,HPS-M、HPS-C、HPS-H的还原力增强趋势不明显,在0.4 mg/mL之后,随着HPS浓度的增大,还原力明显增强,由此可知,HPS的还原力很大程度上依赖于浓度,浓度增大其活性基团的浓度也随之增加,相应地还原力随之增强。在浓度为0.04~0.2 mg/mL时,HPS-M、HPS-C、HPS-H的差异不显著,0.4 mg/mL时,HPS-M与HPS-C、HPS-H的差异都显著(p<0.05)。

图7 不同提取方法对HPS还原能力影响Fig.7 The reducing power of HPSat different extraction methods
3 结论
3.1 红外光谱分析表明,三种方法得到的HPS-M、HPS-C、HPS-H在3418、2935、1618、1083 cm-1都有吸收峰,此为多糖特征吸收峰,表明HPS-M、HPS-C、HPS-H均为多糖;GPC测定结果显示,HPS-M、HPS-C、HPS-H重均分子量分别为6.29×105、4.56×105、5.13×105,表明微波、超声均会对多糖的分子量产生影响。
3.2 体外抗氧化活性测定实验表明,HPS-M、HPS-C、HPS-H清除羟自由基、超氧自由基、DPPH自由基的能力依次减小,且HPS-M的体外抗氧化活性要远高于HPS-C、HPS-H。多糖清除羟自由基、DPPH自由基、超氧自由基以及其还原力会影响到红芪多糖的调节血糖、抗肿瘤等方面的生物学活性,因此,出于对红芪多糖生物学活性的考虑与提取效率的考虑,未来可选择微波辅助法作为红芪多糖的提取方法。
[1]国家药典委员会.中国药典[S].北京:化学工业出版社,2005:120.
[2]陈同强,ADILBEKOV J,赵良功,等.红芪多糖3中4个组分的单糖组成分析及多糖含量测定[J].中国药学杂志,2012,47(7):551-554.
[3]李晓东,封德梅,赵良功,等.红芪多糖HPS-3对2型糖尿病大鼠糖脂代谢和胰腺组织病理改变的影响[J].中药药理与临床,2012,28(1):83-86.
[4]卫东锋,赵春燕,程卫东,等.红芪多糖对S180 瘤细胞化疗协同增效作用的蛋白质组学分析[J].中药材,2012,35(2):749-752.
[5]杨涛,郭龙,李灿,等.红芪多糖HPS1-D的化学结构和抗补体活性研究[J].中国中医杂志,2014,39(1):90-92.
[6]魏舒畅,陈方圆,闫治攀,等.二次通用旋转组合设计优化红芪总多糖与皂苷的酶解提取工艺[J].中成药,2014,36(2):286-290.
[7]胡燕,程卫东,刘欣,等.红芪多糖超声法提取工艺的正交实验优选研究[J].时珍国医国药,2011,22(8):1953-1954.
[8]张泽庆,田应娟,张静.防风多糖的抗氧化活性研究[J].中药材,2008,2(31):268-272.
[9]BTZhao,JZhang,XGuo,et al. Microwave-assisted extraction,chemical characterization of polysaccharides from Lilium davidii var.unicolor Salisb and its antioxidant activities Ebaluation[J]. Food Hydrocolloids,2013,31:346-356.
[10]JHXie,MYShen,MYXie,et al.Ultrasonic-assisted extraction,antimicrobial and antioxidant activities of Cyclocarya paliurus(Batal.)Iljinskaja polysaccharides[J]. Carbohydrate Polymers,2012,89:177-184.
[11]张翠兰.人体自由基的产生与危害[J].健康,1994,8:183.
[12]周凤鑫.组织血液灌注与微循环的病理(2)-氧化应激与疾病[J]. 外科理论与实践,,2007,6(l2):5-12.
[13]曹泽虹,董玉玮,王卫东,等.牛蒡菊糖的提取及其抗氧化性能的研究[J].农业机械,2011,35:423-428.
Study on anti-oxidant activity of polysaccharides fromHedysarumpolybotrysHand.-Mazz. by different extraction methodinvitro
KOU Ning1,LI Lei-qiang1,LI Qin1,CHENG Wei-dong1,2,*
(1.College of Basic Medical Sciences,Lanzhou University,Lanzhou 730000,China;2.College of Chinese Medicine,Southern Medical University,Guanzhou 510515,China)
Polysaccharides were one of the main components ofHedysarumpolybotrysHand.-Mazz(HPS). In this paper,the antioxidant activity of polysaccharides fromHedysarumpolybotrysHand.-Mazz with microwave-assisted extraction,ultrasonic assisted extraction and hot water extraction methods was investigated. HSP-M,HSP-C and HSP-H after deproteinization and vacuum freeze-drying were characterized by FT-IR and measured by GPC. The result indicated that HSP-M,HSP-C and HSP-H had typical absorption peak of polysaccharides,weight average molar mass(MW)were 6.29×105,4.56×105,5.13×105and polydispersion and gyroradius determined were 3.42,3.22,2.31. Anti-oxidant effect on scavenging DPPH radicals,OH radicals and superoxide radicals and reducing power on HSP-M,HSP-C and HSP-H were measured. The resualts showed that anti-oxidant effect of HSP-M was higher than HSP-C and HSP-H. To get practical methods for the research and manufacture of HPS,microwave-assisted extraction method should be chosen.
HedysarumpolybotrysHand.-Mazz.;polysaccharides;anti-oxidant activityinvitro
2014-11-13
寇宁(1977-),女,硕士研究生,讲师,研究方向:中西医结合治疗常见病,E-mail:kouning1123@163.com。
*通讯作者:程卫东(1961-),男,博士,教授,研究方向:中西医结合治疗常见病,E-mail:chengweidong888@sina.com。
基于不同君药——红芪替换经典复方中黄芪免疫衰老机制比较研究(81373806);用红芪与用黄芪玉屏风散的抗免疫老化机制比较研究(GZK-2012-43);基于蛋白质组学探讨红芪多糖延缓免疫衰老机制(GZK-2013-18)。
TS201.1
A
1002-0306(2015)15-0100-05
10.13386/j.issn1002-0306.2015.15.013

