医学参考实验室的计量学特性研究*
全 灿,徐 蓓,李红梅,史光华,吴佳佳
(1.中国计量科学研究院,北京100029;2.中国合格评定国家认可委员会,北京100062)
医学诊断及其治疗都依赖于临床检测指标的准确可靠。医学实验室的结果应可溯源至较高级别的参考物质和/或参考测量程序[1-2]。参考实验室是指运行参考测量程序,提供测量结果不确定度符合特定要求的测量结果的实验室[1]。按国际检验医学溯源性联合委员会(JCTLM)要求,参考实验室需符合以下3个条 件[3-4]:(1)采 用JCTLM 公 布 的 参 考 测 量 程 序;(2)通过ISO17025与ISO15195认可;(3)定期参加参考实验室室间比对计划。参考测量系统的作用是保证医学检测结果的溯源性[3-4]。
1 医学参考实验室
1.1 溯源性 测量结果溯源是实现医学实验室标准化最重要的策略,旨在实现不同实验室、不同测量方法、不同厂家试剂盒的测量结果的准确可比。根据《国际通用计量学基本术语》(VIM)[5]及《测量不确定度评定与表示指南》(GUM)[6],溯源性的定义为:“通过具备证明文件的不间断的校准链,将测量结果与参照对象联系起来的测量结果的特性,校准链中的每项校准都会引入测量不确定度”[5-6]。
ISO17511《体外诊断医学器具-生物样本中量的测量-校准物质和质控物质定值的计量学溯源》规定:实现溯源性的基础是参考系统,即参考测量程序、参考物质和参考测量实验室和(或)参考测量实验室网络;样品检测结果的溯源性是通过参考物质和参考测量程序的比较来实现。如图1所示。
溯源性要求主要体现在对产品校准品、临床检验结果上。ISO17511设计的溯源图[7]分为3个层次:最上层是由国际计量局(BIPM)或国家计量研究机构(NMI)掌握的原级参考测量程序、原级校准品和二级参考品;中间层次为制造厂(ML),最下一层是终端用户,即临床实验室。从理论上说,临床实验室使用了由制造厂家的与检验系统配套的产品校准品,就完成了对检测结果的溯源保证。在ISO 17511溯源图中,制造厂家起着承上启下的重要作用,其提供的产品校准品为检验结果的准确和一致提供了坚实的物质基础。
在计量溯源图的比较链中,每一次比较都会引入不确定度分量,因此,尽可能缩短溯源链,直接使用原级参考测量程序测量日常样品,可以减少不确定度来源。图1中展现了可以用SI单位表示的被测量量值完整的溯源链。但对于临床医学大部分的被测量,并没有原级校准品和二级参考品,溯源链终止于制造厂的测量程序。对于制造厂生产一种新的诊断标记物,建立起定量参考测量程序时,该标记物的溯源终点为制造厂家的参考测量程序。然而在此情况下,溯源性的概念仍然适用。
测量结果可溯源性的前提是所采用的参考测量程序的特异性。欧盟体外诊断指令规定校准品或参考品德值必须能溯源至较高计量等级的参考物质或者参考测量程序。为此,国际临床化学联合会(IFCC)、BIPM 和国际实验室认可合作组织(ILAC)于2002年联合成立了JCTLM,并成立了参考物质工作组(WG1)和参考测量程序工作组(WG2)。在BIPM 网站上每年更新收录的参考物质和参考测量程序[8]。
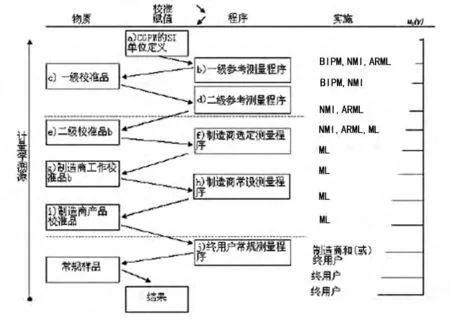
图1 ISO 17511 完整校准等级和计量溯源至SI单位[7]
1.2 临床医学中被测量的定义 什么是被测量貌似一个简单的问题,但在临床医学中,如何准确发现并研究被测量的结构和属性,确颇费精力。例如,葡萄糖、胆固醇等小分子具有明确的结构和分子式,因此生物基质(血清、尿液等)中葡萄糖、胆固醇的检测可以溯源至SI单位,对该类被测量的定义相对完整明确[9]。但对于大多数如蛋白分子等被测量,其情况却要复杂许多[10]。对于这些蛋白分子,因缺乏对其分子结构的准确定义,很难建立可溯源至SI单位的测量系统。对于这一类蛋白,可溯源至一“虚拟参考物质(artifact standard)”实现标准化。在临床化学中有许多类似的标准化实例,溯源至世界卫生组织特定浓度的国际单位,如人心肌肌钙蛋白I(human cardiac troponin I)[11]。
2 参考测量系统
2.1 层级结构图 建立参考实验室网络,除了参考测量程序、参考物质外,更大的挑战是如何实施测量溯源性概念,为此需要建立层级分明的测量框架,主要包括国家计量院、参考(校准)实验室以及常规实验室[4]。
国家计量院位于层级结构图的顶端,通过参加国际比对,签署国际计量委员会互认协议(CIPM MRA),证明其测量能力,为参考物质赋值,为中间层级参考实验室测量结果提供可比溯源,从而为常规实验室室间质量评价的质控品赋值提供可溯源性[2-4]。
2.2 参考测量实验室的要求 有关参考测量程序的详细要求可参见BIPM 网站JCTLM WG2手册,可直接下载[12]。其总体要求包括[3-4]:(1)采用JCTLM 公布的参考测量程序;(2)通过ISO 17025与ISO 15195认可;(3)定期参加参考实验室室间比对计划。
2.2.1 参考测量程序的要求 参考测量程序是经过充分研究的测量程序,其测量值的测量不确定度适合其预期用途,尤其在评价测量相同量的其他测量程序的正确性和鉴定参考物质方面的用途。
参考测量程序的计量学水平,对测量技术和设备都有更高的要求,而终端用户的检测实验室通常不具备。
对参考物质对理想的定值方式就是利用基准方法(基准参考测量程序)进行定值。国际计量委员会/物质的量咨询委员会(CIPM/CCQM)发布的定义如下[13]:“基准方法是一种具有最高计量学品质的测量方法,其操作可以被完全地描述和理解,最终不确定度可以用SI单位表述,测量结果不依赖被测量的测量标准。”
一旦建立了参考测量程序,有许多方法可用于临床有证标准物质(CRM)中的浓度定值,常用的有证标准物质定值方法主要包括:单一的基准方法定值;两种独立的参考测量方法;采用参考测量程序,并用不同的方法联合定值;合作定值等。
参考测量程序最重要的技术就是同位素稀释质谱技术(IDMS),对于临床中常用的同位素稀释质谱法,用高纯同位素标记试剂作为内标,适用于可直接或其衍生物能进行质谱分析的被测量。IDMS作为具有最高计量学等级的基准方法已广泛应用于化学计量领域,该技术建立于1970年的临床实验室中体液中类固醇激素的准确测量,远早于溯源性概念的提出,并已成为最重要的技术,应用于校准品、室间质量评价的参考物质的赋值。如今,IDMS方法作为基准方法已应用于参考实验室中代谢产物、激素、治疗性药物的定值,如肌酐、尿素、胆固醇、总三酰甘油、尿酸、类固醇激素、甲状腺素等。
中国计量科学研究院的大部分临床参考物质均是采用IDMS基准方法进行定值。该方法适用于胆固醇、肌酐、葡萄糖、可的松、激素等被测量定义明确的小分子化合物,可溯源至SI。但对于蛋白分子等,建立IDMS方法仍然任重道远。比较成功的尝试如IDMS法定量血清中胰岛素、前列腺特异抗原、尿白蛋白等。
CCQM-K12.1定量比对研究[14]的目的是检验各国家计量院在独立的实验仪器和独立的检测系统下对血清中肌酐定量检测的条件和能力。目标是通过收集参加比对实验的不同实验室使用不同仪器和不同检测系统得到的实验数据构建可比的数据库,建立准确可靠的绝对定量方法,同时考核参与国家计量机构的检测能力。中国计量科学研究院建立了液相色谱-IDMSC(LC-IDMS)测定血清中肌酐的准确定值方法,以同位素标记物为内标,确定LC-IDMS测定血清中肌酐的色谱、质谱实验条件。利用建立的方法准确测量国际比对样品中肌酐的含量,递交比对结果[14]。
2.2.2 医学参考测量实验室认可要求 按照ISO 15195《临床检验医学-对参考测量实验室的要求》的要求,认可成为校准实验室是参考测量服务的第二个要求。包括对医学参考测量(校准)实验室的管理要素和技术要素。根据JCTLM 程序要求,通 过ILAC 互 认 框 架 下 认 可 机 构 的ISO/IEC17025 和ISO15195认可是医学参考测量实验室进入JCTLM 医学参考测量实验室列表的必要条件之一[15]。中国合格评定国家认可委员会(CNAS)建立了医学参考测量实验室认可制度[16]。根据JCTLM 和ILAC 要求,对医学参考测量实验室应用ISO/IEC 17025[17]与ISO 15195认可制度。
参考测量实验室的ISO/IEC 17025 与ISO 15195认可是一项国际上的新认可制度。CNAS从2005年起跟踪JCTLM和ISO/TC212的相关要求和国际标准,与卫生部、中国计量科学研究院等部门合作开展了相关课题研究。CNAS从2011年开始认可该类实验室。2013年底,由BIPM 举行的JCTLM 执委会议上,我国医学参考测量实验室(711医院参考实验室)顺利通过JCTLM 专家评审,进入JCTLM 医学参考测量实验室列表。随着医学其他领域的认可需求的增长,CNAS将完善血液学、生化领域、免疫学、PCR 等领域的应用说明,制定认可评审工作指导书,另外,ISO 15195、ISO 17511、ISO 18153等与参考测量实验室认可相关的国际标准当前均在进行修订。
2.2.3 能力验证的要求 参加能力验证是JCTLM 对医学参考实验室的第三个要求。根据JCTLM WG2 程序手册规定,参考实验室必须参加能力验证等室间质量评价活动,分析能力验证的一致性程度,并且参加实验室的能力验证结果对外公开。
CCQM 目前只在国家计量院之间就少数几个目标物(如胆固醇、葡萄糖、肌酐等)开展能力验证。2003年,国际临床化学联合会(IFCC)与德国临床化学和实验室协会(DGKL)合作开展了针对参考实验室的室间质量评价[4]。参考(校准)实验室室间质量评价的程序文件、参加实验室能力验证结果以及所有的技术细节都可在DGKL网站下载。实验室要求优先提供使用参考测量测序尤其是JCTLM 列表程序的结果报告。在参考实验室的量值比对过程中,比对结果及参加实验室都对外公开。在比对结果发给所有参加实验室的一个月之内,实验室可就某一特定被测量的比对结果申请撤销,但超过一个月之后,则所有参加实验室的比对结果都会对外公开[18]。
目前参考实验室间的量值比对已经覆盖了30余种物质,包括代谢产物和底物、电解质、酶、激素、蛋白以及治疗药物等[19]。
3 参考物质
3.1 医学参考物质的研制[20-21]研制参考物质样品的定值及其范围需要与临床方面的专家合作,包括血清用量,包装、技术参数等指标的确定。阳性样品的直接添加只适用于待添加的纯物质和基体中的含量确定的体系,如血清肌酐标准物质的研制,对于定义不明确的物质如,添加的心肌蛋白纯物质可能与真实样品中的心肌蛋白表现不一致,导致可能的互换性问题。因此如需要制备大批量的血清心肌蛋白的阳性样品,则需要从临床医院中收集心脏患者的血样作为参考物质的原料。但在采样的过程中需要征得患者的同意,因此,血清原料的收集具有很大的挑战性。
3.2 参考物质均匀性稳定性检验 临床标准化的目标是确保检验结果在时间、空间上的稳定性和一致性。为此,有证标准物质必须是均匀稳定的。均匀性包括瓶间均匀性和瓶内均匀性。由于绝大部分临床有证标准物质是冰冻液体(如血清、血浆或尿液)或者分装后冻干,很少发现瓶内不均匀的。但在大批量的标准物质分装成数千小瓶过程中,换瓶可能导致瓶间不均匀性的产生,因此对有证标准物质开展瓶间均匀性的检验就尤为关键。通常从同一批次中抽取一定数量的样品开展瓶间均匀性检验,抽取的瓶数取决于该批次的样本数量以及所使用的方法的精度[22]。
有证标准物质的稳定性主要包括短期稳定性和长期稳定性。短期稳定性主要指标准物质在运输条件下,其有证值随时间的变化。通过较高温度,比较模拟运输条件下被测量值与储存条件下值的变化。临床有证标准物质的长期稳定性则主要检验有证值在储存条件下有效期内是否有效[23]。稳定性检验的方法很多,如何选择取决于被测量所期望的稳定性。
3.3 参考物质的质量保证 为了建立起完整的参考测量系统,国家计量院必须持续不断的研制标准物质,建立参考测量程序。如何保证参考物质的质量,是其能否成功应用的关键。国家计量院依据ISO17025[17]及ISO 导则34[24],建立 质量体系,研制标准物质。参加临床领域的国际比对,持续为临床检验领域提供参考物质;此外,还通过参与JCTLM 临床有证标准物质的评审。
国家计量院通过参与BIPM/CCQM 组织的国际比对,证明其测量能力。CCQM 组织的国际比对为各国计量院在化学领域实现测量能力互认提供了技术支撑。许多比对集中在如葡萄糖、肌酐、钙等临床分子。各国通过参加国际比对可以证明其测量能力,有国际比对支持的有证标准物质可在全球范围内证明可比性,并成功申报CMC。
中国计量科学研究院在JCTLM 中也发挥着积极作用,JCTLM 旨在“指导和促进世界公认的医学检验等效测量,为检验医学测量标准溯源提供全球平台”[15]。临床领域的参考物质被JCTLM 高级参考物质数据库收录。中国计量院的相关研究人员作为评审专家也在JCTLM 的参考物质和参考测量程序两个工作组中发挥着积极作用。
3.4 互通性评价 ISO15194互通性[25]定义为“参考物质的属性,是指用不同测量程序测量该物质时,各测量程序所测的结果之间的数字关系,与用这些测量程序测量实际临床样品时测量结果数字关系的一致程度”。意即使用常规方法时,测量标准物质应与测量临床实际样本一致。大多数临床有证标准物质在制备过程中经常前处理,改变了基质或者目标化合物等,导致与真实的临床样本不同。
互通性问题通常在标准物质定值之后即在其使用过程中遇到的[26]。由于定值所采用的参考测量程序包括目标物从基质的分离萃取,对基质相对独立,因次互通性问题在标准物质定值过程中并不十分凸现。当某一参考物质对一种或几种的常规测量程序不具有互通性时,其应用于参考测量系统的建立就会受到限制。因此就很有必要针对新研制的临床有证标准物质开展互通性评价。但是大部分国家计量院并不经常接触到常规测量程序,因此开展互通性评价研究需要临床检验领域如医院以及临床诊断试剂生产厂家的协助配合。
4 小 结
综观国际发展趋势,临床医学的标准化是必经之路,事关大众健康,但临床领域参考物质及参考测量程序的研究道路曲折而漫长。所幸的是,国家计量机构、卫生部以及实验室认可机构正协同合作,与国际计量届同仁一道,为临床检验领域提供了有力的技术支撑,为临床有证标准物质和参考测量程序的发展指明了道路。
[1]Dybkaer R.Metrology in laboratory medicine-reference measurement systems[J].Accred Qual Assur,2001,6(1):16-19.
[2]陈文祥.临床检验量值溯源与参考系统[J].中华检验医学杂志,2006,29(1):17-19.
[3]Thienpont LM,Van Uytfanghe K,De Leenheer AP.Reference measurement systems in clinical chemistry[J].Clin Chim Acta,2002,323(1/2):73-87.
[4]Siekmann L.Requirements for Reference(Calibration)Laboratories in Laboratory Medicine[J].Clin Biochem Rev,2007,28(4):149-154.
[5]International Organization for Standardization.International.Vocabulary of basic and general terms in metrology[M].2nd ed.Geneva,Switzerland:ISO,1993.
[6]International Organization for Standardization.Guide to the expression of uncertainty in measurement[M].Geneva,Switzerland:ISO,1993.
[7]International Organization for Standardization.ISO17511In vitro diagnostic medical devices-measurement of quantities in biological samples:metrological traceability of values assigned to calibrators and control materials[S].Geneva,Switzerland:ISO,2003.
[8]BIPM.International bureau of weights and measures[EB/OL].[2014-11-20].http://www.bipm.org/en/about-us/.
[9]Brange J,Langkjoer L.Insulin structure and stability[J].Pharm Biotechnol 1993,5(3):315-350.
[10]Thompson JA,Grunert F,Zimmermann W.Carcinoembryonic antigen gene family:molecular biology and clinical perspectives[J].J Clin Lab Anal,1991,5(5):344-366.
[11]Bunk DM,Welch MJ.Characterization of a new certified reference material for human cardiac troponin I[J].Clin Chem,2006,52(2):212-219.
[12]JCTLM-WG2.Reference measurement laboratories[EB/OL].[2014-10-24].http://www.bipm.org/en/committees/cc/wg/jctlm-wg2.html.
[13]Wielgosz RI.CCQM primary methods symposium:how far does the light shine?[J].Accred Qual Assur,2001,6(7):329-331.
[14]Shi LH,Kim BJ,Lee HS,et al.CCQM-K12.1:subsequent key comparison on the determination of creatinine in serum final report[J].Metrologia,2013,50(1):1-22.
[15]JCTLM.Joint committee for traceability in laboratory medicine[EB/OL].[2014-11-21].http://www.bipm.org/en/committees/jc/jctlm/.
[16]中国合格评定国家认可委员会.CNAS-CL32-2011 检验医学领域参考测量实验室的特定认可要求[S].北京:中国合格评定国家认可委员会,2011.
[17]International Organization for Standardization.ISO 17025:2005.General requirements for the competence of testing and calibration laboratories[S].Geneva,Switzerland:ISO,2005.
[18]Rfb.RELA-IFCC:external quality assessment scheme forreference laboratories in laboratory medicine[EB/OL].[2014-10-16].www.dgkl-rfb.de.
[19]Thienpont LM,De Leenheer AP.Efforts by industry toward standardization of serum estradiol-17beta measurements[J].Clin Chem,1998,44(3):671-674.
[20]International Organization for Standardization.Certification of reference materials:general and statistical principles[M].3rd ed.Geneva,Switzerland:ISO,2006.
[21]Myers GL,Miller WG,Coresh J,et al.Recommendations for improving serum creatinine measurement:a report from the Laboratory Working Group of the National Kidney Disease Education Program[J].Clin Chem,2006,52(1):5-18.
[22]Pauwels J,Lamberty A,Schimmel H.Quantification of the expected shelf-life of certified reference materials[J].Fresenius J Anal Chem,1998,361(5):395-399.
[23]Linsinger TP,Pauwels J,Lamberty A,et al.Estimating the uncertainty of stability of matrix CRMs[J].Fresenius J Anal Chem.2001,370(2):183-188.
[24]International Organization for Standardization..General requirements for the competence of reference material producers[M].2nd ed.Geneva,Switzerland:ISO,2000.
[25]International Organization for Standardization.ISO 15194In vitro diagnostic medical devices:measurement of quantities in samples of biological origin-Description of reference materials[M].Geneva,Switzerland:ISO,2002.
[26]Miller WG,Myers GL,Rej R.Why commutability matters[J].Clin Chem,2006,52(4):553-554.

