乳中大肠杆菌O157:H7的荧光定量PCR检测方法的建立
张微,姚笛,侯婷婷,郭瑜,佐兆杭,刘鑫
(黑龙江八一农垦大学食品学院,黑龙江大庆163319)
0 引言
肠出血性大肠杆菌是能引起人的出血性腹泻和肠炎的一群大肠埃希氏菌[1、2]。以 O157:H7 血清型为代表菌株。自美国首次分离出该菌以后[3],O157:H7的爆发和流行相继出现在20多个国家。我国近几年也通过食品安全监测,先后从牛、羊、猪等肉类食品和乳中检测到大肠杆菌O157:H7[5-7]。
目前,大肠杆菌O157:H7的检测方法主要是细菌学培养法,该方法存在耗时,过程复杂,灵敏性不强等缺点。分子生物学检测方法中应用较广泛的常规PCR技术也存在假阳性和不能定量等缺点。因此,本研究拟建立一种大肠杆菌O157:H7的荧光定量PCR检测方法,该技术具有更强的特异性和灵敏性,并能进行定量。建立的方法能够使乳中大肠杆菌的检测更为快速和准确,并为其他致病菌的快速检测提供参考。
1 实验
1.1 材料
1.1.1 菌株
大肠杆菌O157:H7标准菌株、蜡样芽孢杆菌、沙门氏菌、宋内氏志贺氏菌、大肠杆菌DH5α均为黑龙江八一农垦大学食品学院食品生物技术实验室保存。
1.1.2 试剂
LB培养基,细菌基因组DNA抽提试剂盒,质粒抽提试剂盒,胶回收试剂盒,TaKaRa ExTaqTM(5 U/μL),rTaq(5 U/μL),MgCl2(25 mmol/L),dNTPs(10 mmol/L),DL2000DNAMarker,6×Loading Buffer,10×Loading Buffer,SYBR Premix Ex TaqTM(Tli RNaseH Plus)等。
1.1.3 仪器
PCR 基因扩增仪(9700型),电泳仪(JY04S-3B),凝胶成像系统(YJ600+型),Real-Time PCR仪(Line-Gene K型),台式离心机(TGL-16B)。
1.2 方法
1.2.1 菌株的培养与DNA模板的制备
将大肠杆菌O157:H7接种于固体LB培养基中,37℃,24 h,挑取单菌落接种于液体LB培养基中,37℃,200 r/min,培养过夜。取培养液1.0 mL,置于1.5 mL的离心管中,12 000 r/min离心2 min,灭菌ddH2O洗剂两次,最后300 μL ddH2O悬浮,隔水煮沸15 min,8 000 r/min离心15 min,取上清,即为DNA模板。
1.2.2 引物的设计与合成
根据Genebank发表的大肠杆菌O157:H7的特异性基因rfbE的序列,利用Primer 5软件设计特异性引物,由上海生工生物技术有限公司合成,上游引物:5'-CATCTTTACTTTCCTTGTGGACTTG-3';下游引物:5'-AAACTATTACTACAGGTGAAGGTGG-3'。扩增片段大小为261 bp。
1.2.3 PCR扩增和纯化
以大肠杆菌O157:H7 DNA为模板,对大肠杆菌O157:H7的rfbE基因进行PCR扩增,反应体系:95℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,经30个循环;最后72℃延伸7 min。获得的PCR产物进行2%琼脂糖凝胶电泳,对扩增目的片段进行回收纯化,具体操作按照说明书进行。
1.2.4 目的基因的克隆
取纯化的PCR产物4 μL,pMD 18T载体1 μL,SolutionⅠ5 μL,轻轻混匀,16 ℃连接2 h,将连接产物加入100 μL E.coli DH5α感受态细胞中进行重组质粒的转化,取适量均匀涂布于Amp+的LB平板中,37℃培养过夜,挑取平板中的单个菌落,接种在Amp+的LB液体培养液中,37℃ 180 r/min振摇过夜。按照说明书操作提取质粒,对重组质粒进行PCR鉴定,将阳性克隆送上海生工进行序列测定。
1.2.5 荧光定量PCR扩增
测定重组质粒的浓度C值,并计算出原始拷贝数,进行倍比稀释后,取稀释度不同的质粒模板进行定量PCR扩增。反应体系为:SYBR Premix Ex Tap(2×)(Tli RNaseH Plus)12.5 μL,上、下游引物(浓度10 μmol/L)各0.5 μL,DNA模板2.0 μL,ddH2O 9.5 μL。反应条件为94℃(30 s),95 ℃(5 s)变性,60℃(20 s)退火、延伸,扩增45个循环,反应结束后,计算机自动计算,形成标准曲线。
1.2.6 灵敏性检测
用ddH2O对已知浓度的大肠杆菌O157:H7的DNA进行10倍梯度稀释,分别取质量浓度为1×10-3,1×10-4,1×10-5,1×10-6,1×10-7ng/μL 的 DNA样品2 μL进行荧光定量PCR扩增,测定其最低检测值。
1.2.7 特异性检测
利用建立的定量PCR检测方法,对大肠杆菌O157:H7、沙门氏菌、志贺氏菌、蜡样芽孢杆菌4种感染人类的食品病原细菌同时进行检测,进一步确定大肠杆菌O157:H7荧光定量PCR方法的特异性。
1.2.8 模拟标本的检测
将大肠杆菌O157:H7制备一定浓度的菌悬液,用无菌生理盐水10倍梯度稀释,测定菌落总数,将含量分别为67.0,6.70×102,6.70×103,6.70×104mL-1的大肠杆菌O157:H7掺入灭菌的牛乳中,混匀后提取DNA模板进行定量PCR扩增。
2 结果与分析
2.1 PCR扩增与测序
以提取的大肠杆菌O157:H7的DNA为模板,用特异性引物PCR扩增rfbE基因片段,扩增结果如图1所示。由图1可以看出,扩增条带的大小与预期一致,且条带单一,无引物二聚体。将扩增的PCR产物回收、连接、转化,然后提取重组质粒进行PCR鉴定,其鉴定结果如图1所示。将鉴定正确的重组质粒进行测序,测序结果进行BLAST比对,结果可知扩增产物与大肠杆菌O157:H7 rfbE基因的同源性为100%。
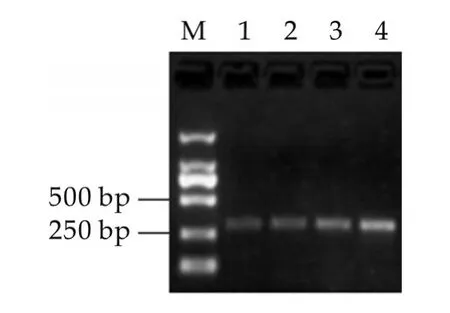
图1 rfbE基因的PCR扩增产物
2.2 荧光定量PCR扩增结果
将重组质粒进行10倍系列稀释,取浓度依次为1×105,1×106,1×107,1×108,1×109μL-1,分别以此为模板进行荧光定量PCR扩增,得到标准模板的实时PCR扩增曲线,扩增结果如图2所示。根据质粒模板的Ct值绘制标准曲线,结果如图3所示,得到线性方程为y=-3.40x+40.46,相关系数为0.991,表明在模板稀释范围内有很好的线性关系。然后进行标准模板荧光定量PCR的熔解曲线分析,结果如图4所示。由图4可以看出,不同浓度标准品的扩增产物的溶解温度均为79.5℃,说明引物的特异性很好。
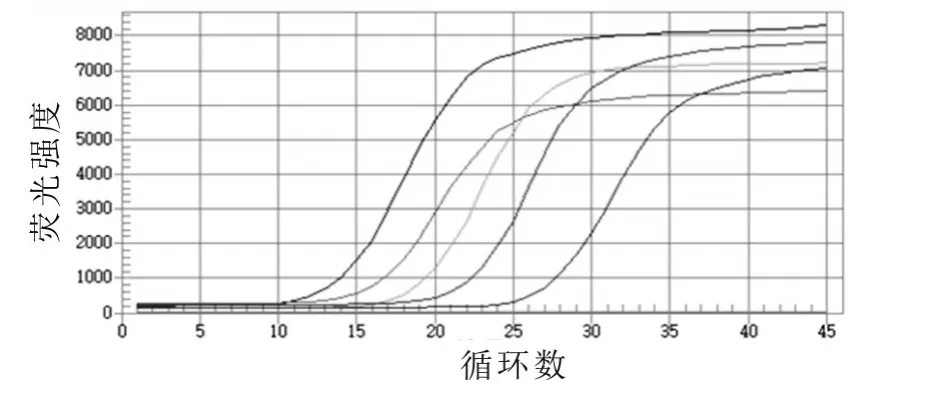
图2 标准模板的荧光定量PCR扩增曲线

图3 标准模板的标准曲线
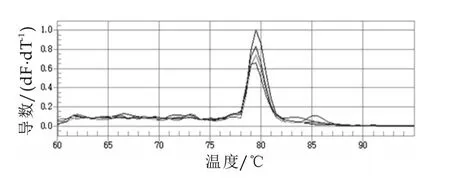
图4 标准模板的熔解曲线
2.3 荧光定量PCR的特异性实验
利用建立的荧光定量PCR方法对大肠杆菌O157:H7、蜡样芽孢杆菌、沙门氏菌、宋氏志贺氏菌同时进行荧光定量PCR方法检测,结果见图5,结果表明:大肠杆菌O157:H7出现良好的扩增曲线,结果为阳性,而其他细菌均未出现曲线扩增,结果均为阴性。说明本研究建立的方法对大肠杆菌O157:H7有很好的特异性,与其他三种细菌无交叉反应。
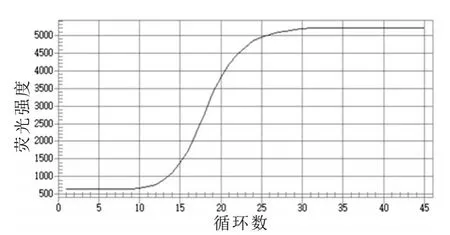
图5 大肠杆菌O157∶H7荧光定量的特异性检测
2.4 荧光定量PCR的灵敏性实验
将大肠杆菌O157:H7的DNA模板用dd H2O 10倍梯度稀释成1×10-3,1×10-4,1×10-5,1×10-6,1×10-7ng/μL的质量浓度,进行荧光定量PCR扩增,结果显示其灵敏度为1×10-6ng/μL。当DNA的质量浓度只有1×10-6ng/μL时,根据公式计算出拷贝数为3.49×103μL-1,说明建立的荧光定量PCR方法扩增大肠杆菌O157:H7的灵敏度好。
2.5 模拟标本的检测
将大肠杆菌O157:H7掺入到灭菌的牛乳中,使乳中菌的含量为 67.0,6.70× 102,6.70× 103,6.70× 104mL-1,采用荧光定量PCR方法同时进行检测,结果如图6所示。由图6可以看出:当乳中大肠杆菌O157:H7的含量只有67.0 mL-1时,依然可以检测到特异性扩增。
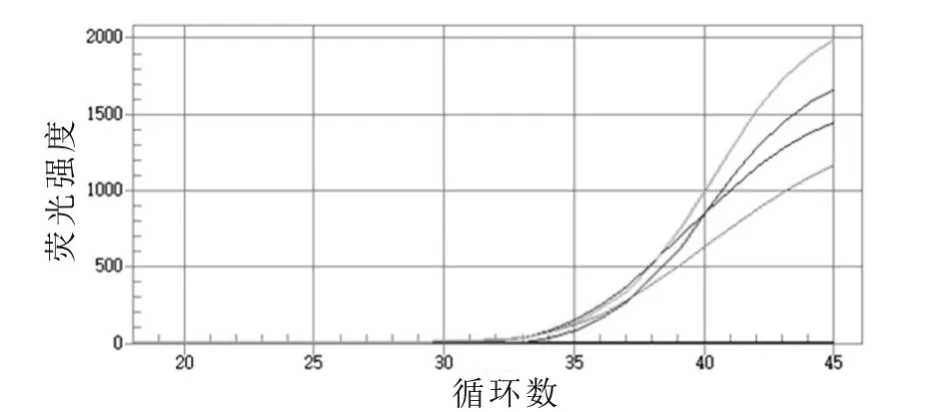
图6 模拟标本的荧光定量PCR扩增曲线
3 结论
乳制品被普遍认为是致病性大肠杆菌的污染源[8],检测方法包括细菌的分离鉴定和生化鉴定等方法。本研究以致病性强的大肠杆菌O157:H7为检测对象,建立荧光定量PCR检测方法,该技术操作过程简单、快速,全部操作过程仅需3 h左右,大大提高了工作效率,与其他方法相比灵敏度高,特异性强,检测的灵敏度可达1×10-6ng/μL,拷贝数为3.49×103μL-1,且与蜡样芽孢杆菌、沙门氏菌、志贺氏菌三种细菌均无交叉反应。利用建立的方法检测人工污染乳中的大肠杆菌 O157:H7,发现乳中大肠杆菌O157:H7的含量只有67.0 mL-1时,依然可以检测到特异性扩增,说明该方法的灵敏度很高。本研究为建立乳中大肠杆菌O157:H7的检测体系提供了一种高效、便捷、可靠的新技术,同时也为乳制品中其他致病菌的检测提供了参考,具有较高的推广和使用价值。
[1]王培育.肠出血性大肠杆菌O157:H7检测技术进展[J].国际检验医学杂志,2013,34(19):2570.
[2]LI Y,FREY E,MACKENZI A M,et al.Hu man response to Escherichi a coli 0 157:H7 infection :antibodies to secreted Vir ulence factors.Infect I mmun,2000,68(9):5090-5095.
[3]FACHP,PERELLES,GROUT J,et al.Comparison of different PCR teats for detecting Shigatoxin.Producing Escherichia coli 0157 and development of all EUSA-PCR assay for specific identification of the bacteria[J].J.Mierobiol Methods,2003,55(2):389-392.
[4]SCOTTER S,ALDRIDGE M,CAPPS K.Validation of a method for the detection of E.coli O157:H7 in foods,2000,11(2):85-95.
[5]林鹭芳,黄健利,钟凌.漳州市首次检出E.coli O157:H7[J].海峡预防医学杂志,2002,8(4):52.
[6]倪大新,汪华,顾玲.江苏省1999年大肠埃希菌O157:H7宿主动物带菌情况调查[J].中华流行病学杂志,2002,23(2):102-104.
[7]孙强,李昱洁,任科研,等.大肠杆菌O157∶H7检测技术的概况[J].吉林畜牧兽医,2013,34(7):61-62.
[8]KEASLER S P,WALTER E H.Polymerase chain reaction idemification of enteroinasive Escherichia coli seeded into raw milk[J].Food Prot,1992,55:382-384.

