吡咯列酮通过内质网应激致凋亡途径促进大鼠血管平滑肌细胞钙化
马 琦边云飞白 瑞鲁 燕肖传实*
(1 山西医科大学第一临床医学院心内科,山西 太原 030001;2 山西医科大学第二临床医学院心内科,山西 太原 030001)
吡咯列酮通过内质网应激致凋亡途径促进大鼠血管平滑肌细胞钙化
马 琦1边云飞2白 瑞2鲁 燕1肖传实1*
(1 山西医科大学第一临床医学院心内科,山西 太原 030001;2 山西医科大学第二临床医学院心内科,山西 太原 030001)
目的探讨吡咯列酮通过内质网应激致凋亡途径对大鼠血管平滑肌细胞钙化影响。方法利用β-甘油磷酸钠联合丙酮酸钠制备钙化血管平滑肌细胞模型,予不同浓度(10、50、100 μmol/L)吡咯咧酮干预。用Von Kossa染色及茜素红S染色观察细胞钙化程度,用甲基百里香酚蓝法测定各组细胞中钙含量,磷酸苯二钠法测定细胞中碱性磷酸酶(ALP)活性。采用流式细胞术及TUNEL法检测细胞凋亡率,实时荧光定量RT-PCR检测各组细胞PPAR-γ、GRP78和caspased-12表达。观察吡咯列酮通过内质网应激致凋亡对大鼠血管平滑肌细胞钙化影响及其可能的分子机制。结果钙化血管平滑肌细胞其钙含量、ALP活性较普通细胞增多(P<0.01),而吡格列酮呈剂量依赖性地促进钙化大鼠血管平滑肌细胞的钙含量、ALP活性,以及PPAR-γ、GRP78、caspase-12mRNA表达(P<0.05)。结论吡咯列酮通过内质网应激致凋亡途径作用可促进β-磷酸甘油诱导的血管平滑肌细胞钙化,其作用可能与PPAR-γ及GRP78、caspase-12表达上调有关。
血管钙化;内质网应激;血管平滑肌细胞;吡咯列酮
血管钙化(vascular calcification,VC)是动脉粥样硬化、高血压、糖尿病血管病变、血管损伤、慢性肾病和衰老等普遍存在的病理表现,主要表现为血管壁僵硬性增加,顺应性降低,进而导致心肌缺血、左心室肥大和心力衰竭,引发血栓形成,斑块破裂,是心脑血管疾病高发病率和高病死率的重要因素之一,80%血管损伤和90%冠心病患者伴有VC[1]。新近研究表明凋亡在血管平滑肌细胞钙化过程中发挥了重要作用,可能与内质网应激介导的凋亡有关[2-3]。研究发现吡格列酮(Pioglitazone,PIO)对血管平滑肌细胞凋亡具有促进作用,但吡格列酮是否通过促进内质网应激所致的细胞凋亡来促进血管钙化的发生鲜有报道。本研究在体外血管平滑肌细胞(vascular smooth muscle cells,VSMCs)钙化模型[4]基础上,探讨吡格列酮通过内质网应激致凋亡途径对血管钙化的影响。
1 材料与方法
1.1 实验动物和试剂:SD大鼠由山西医科大学动物实验中心提供。吡格列酮(沈阳施德),GW9662(sigma公司),DMEM高糖型培养基(Gibco),胎牛血清(杭州四季青公司),特异性小鼠抗大鼠α-平滑肌肌动蛋白(武汉博士德)DAB显色试剂盒(武汉博士德),钙离子定量检测试剂盒和碱性磷酸酶(ALP)检测试剂盒(南京建成生物工程研究所),TUNEL试剂盒(罗氏公司)SP免疫组化试剂盒(北京博奥森),余为市售分析纯。
1.2 实验方法
1.2.1 VSMCs培养及鉴定:采用无菌方法取160 g左右Sprague-Dawley雄性大鼠胸主动脉中膜,将中膜剪成约1 mm×1 mm大小,贴培养皿底部,放入含20%胎牛血清的DMEM培养基,置于37 ℃、5% CO2的孵箱中培养,用0.125%胰蛋白酶消化传代。实验选用第5~10代细胞。经SMα-actin免疫细胞化学染色确定为平滑肌细胞。
1.2.2 分组及处理:取上述平滑肌细胞生长至融合状态后,分别置于六孔板中进行试验。本实验分6组:①空白对照组(加入10%DMEM细胞培养液);②钙化组(加入钙化培养基,钙化培养基是在常规培养基中加入10 mmol/Lβ-甘油磷酸(β-GP)和10 mmol/L丙酮酸钠);③钙化+PPAR-γ抑制剂(加入钙化培养基、25 mmol/L GW9662);④钙化+PIO(10、50、100 μmol/L)组(加入钙化培养基中以及加入不同浓度(10、50、100 μmol/L吡格列酮)。每组设3个复孔,细胞每隔两天换液1次,连续培养15 d[4]。
1.2.3 VSMCs钙化的染色鉴定:取1.5 cm×0.5 cm的盖玻片数枚放入6孔板内,以1.2×105接种密度进行细胞爬片。分别制作实验组和对照组的细胞爬片。取出盖玻片先用预冷4 ℃的PBS缓冲液洗涤2次,浸入冰丙酮中固定20 min。①将细胞玻片放入1%茜素红S溶液内染色30 min,用0.2%醋酸溶液快速冲洗l次,滤纸吸干。系列酒精脱水,二甲苯固定、封片。显微镜下钙盐沉积处被染为橘红色。②Von Kossa染色:将细胞玻片放入5%硝酸银溶液避光孵育15 min,紫外灯照射10 min,洗涤后浸入1%硫代硫酸铵溶液1 min,洗涤后碱性品红复染。显微镜下观察钙盐沉积处为黑色。
1.2.4 VSMCs的钙含量测定:弃上层培养基,用PBS缓冲液冲洗细胞2次,加入适量0.6 N盐酸,37 ℃去钙化作用24 h。采用钙离子定量检测试剂盒测定。剩余细胞用PBS洗3次,加入0.05 mol/L NaOH/0.1% SDS细胞裂解液,30 min后提取胞质蛋白,用BCA法蛋白分析试剂盒测定总蛋白,钙含量用蛋白含量标准化。
1.2.5 VSMCs的碱性磷酸酶活性测定:弃上层培养基,用PBS缓冲液冲洗细胞2次,加入适量含1%TritonX-100的生理盐水,置于4 ℃冰箱24 h。用超声波处理25 s后反复吹打,使细胞充分破裂(倒置显微镜下观察到细胞破碎、无完整的细胞结构),离心后取上清用碱性磷酸酶(ALP)检测试剂盒测定ALP活性。测量时提取胞质蛋白并测定总蛋白含量,用其校正细胞层ALP活性。
1.2.6 流式细胞术检测VSMCs凋亡率:各组细胞用0.25%胰酶(无EDTA)消化,血清终止消化后转移至离心管,1000 rpm离心10 min,弃上清,用PBS冲洗2~3次,弃上清,每管500 μL buffer重悬,分别加入AnnexinV-FITC,PI染液各5 μL,避光反应15 min,流式细胞仪检测细胞凋亡百分率。
1.2.7 TUNEL法检测VSMCs凋亡率:弃上层培养基,收集细胞,采用细胞凋亡原位检测试剂盒,即TUNEL法进行检测,之后用DAPI染液染色封片,荧光倒置显微镜下观察。TUNEL阳性呈绿色荧光,DAPI呈蓝色荧光。每个细胞爬片观察4个独立视野,计算每100个细胞的凋亡个数,计算凋亡率。
1.2.8 RT-PCR测定GRP-78,caspase-12和PPAR-γ mRNA的表达:见表1。应用RNA提取试剂盒提取RNA,并用微量分光光度计进行检测其吸光度在1.8~2.0,其后取5 μL RNA按照反转录试剂盒制备cDNA后,进行PCR扩增。

表1 GRP78、caspase-12、PPAR-γ、β-actin引物序列
2 结 果
2.1 血管平滑肌鉴定:倒置显微镜下观察,可见原代平滑肌细胞从组织块边缘游出(图1A)血管平滑肌细胞呈梭型,逐渐呈现束状排列,出现典型的“峰谷样”样生长。经特异性免疫组化SMα-actin染色,可见胞质内SMα-actin表达丰富,细丝状排列,符合血管平滑肌细胞特征。
2.2 钙化的血管平滑肌细胞鉴定:倒置显微镜下观察,可见血管平滑肌细胞透明度下降,表现为多层生长状态,部分细胞脱死亡。空白对照组与单纯钙化组相比:茜素红S染色时,钙化组(A2)与对照组(A1)比较可见橘红色区域,散装分布,证实有钙盐沉积;Von Kassa染色时,钙化组(B2)与对照组(B1)比较可见黑色沉积区域,证实有钙盐沉积。

图1 原代培养大鼠VSMCs及鉴定(×200)A,B为原代大鼠VSMCs,C为大鼠VSMCs SMα-actin免疫细胞化学染色
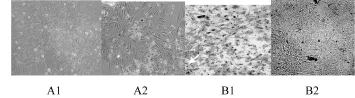
图2 茜素红S染色细胞结节处可见橘红色沉积;Von Kossa染色细胞结节处可见黑色颗粒沉积
2.3 吡格列酮对VSMCs钙含量、碱性磷酸酶活性:见表2。与对照组相比,钙化组的钙含量、ALP活性含量均升高(P<0.01);不同浓度吡格列酮组的钙含量、ALP活性与钙化组相比较均明显升高(P<0.05),且呈剂量依赖。
表2 各组细胞钙沉积含量、ALP活性比较(,n=4)
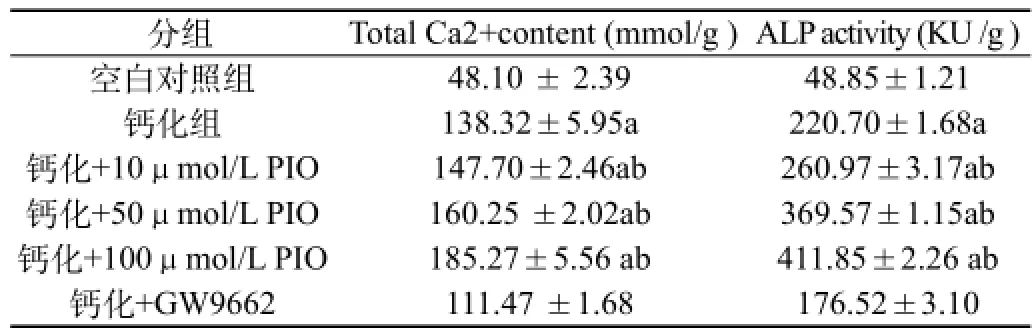
表2 各组细胞钙沉积含量、ALP活性比较(,n=4)
注:a为P<0.01,与空白对照组相比;b为P<0.05,与钙化组相比
分组 Total Ca2+content (mmol/g )ALP activity (KU /g )空白对照组 48.10 ± 2.39 48.85±1.21钙化组 138.32±5.95a 220.70±1.68a钙化+10μmol/L PIO 147.70±2.46ab 260.97±3.17ab钙化+50μmol/L PIO 160.25 ±2.02ab 369.57±1.15ab钙化+100μmol/L PIO 185.27±5.56 ab 411.85±2.26 ab钙化+GW9662 111.47 ±1.68 176.52±3.10
2.4 吡咯咧酮对VSMCs凋亡的影响:钙化组与对照组相比,出现大量细胞凋亡,差异显著(P<0.01);不同浓度吡咯列酮处理后在流式图中B4区和B2区的细胞分布均明显增多,即促进了细胞钙化造成的凋亡和坏死,凋亡率均较钙化组明显减低(P<0.05),且吡咯列酮的作用呈现剂量依赖关系(表3和图3)。
表3 各组心肌细胞凋亡率比较(,n=4)

表3 各组心肌细胞凋亡率比较(,n=4)
注:a为P<0.01,与对照组比较;b为P<0.05,与钙化组比较
分组 凋亡率(%)空白对照组 4.35±3.04钙化组 14.40±3.11a钙化+10μmol/L PIO 17.49±9.45ab钙化+50μmol/L PIO 18.75±2.19ab钙化+100μmol/L PIO 25.4±4.10ab钙化+GW9662 11.0±1.20
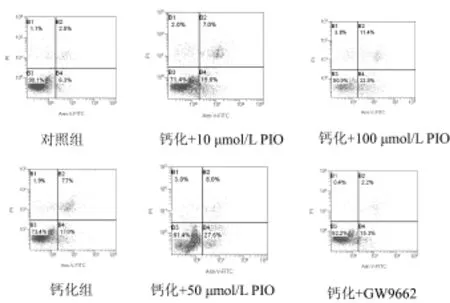
图3 各组VSMCs凋亡率的比较
2.5 TUNEL法检测各组VSMCs凋亡率:倒置荧光显微镜下观察,可见TUNEL阳性信号呈绿色荧光,而所有细胞核经DAPI荧光染料复染后,呈蓝色。与对照组相比,钙化组和钙化+PIO处理组凋亡细胞增多,差异显著(P<0.01);PIO处理组与钙化组相比,细胞凋亡率显著增高(P<0.05)。见图4。

图4 各组血管平滑肌细胞细胞凋亡率
2.6 GRP-78、caspase-12及PPAR-γ mRNA的表达:与空白组比较,钙化组和钙化组+PIO处理组,GRP-78、caspase-12及PPAR-γ mRNA表达增高,差异显著(P<0.01);与钙化组比较,钙化+PIO处理组GRP-78、caspase-12及PPAR-γmRNA表达显著增高(P<0.05),且呈剂量依赖。见图5。
3 讨 论

图5 各组VSMCs mRNA表达的比较a为P<0.01,与空白对照组相比;b为P<0.05,与钙化组相比。
血管钙化与冠心病、心肌梗死、脑卒中等多种疾病相关,是发生心、脑血管急症的重要危险因子。以往认为VC是钙盐在细胞内和细胞外基质的被动沉积,近年来研究发现VC是一种与骨发育类似的主动的、可调控的生物学过程,类似于骨和软骨形成过程中的骨化,主要特征是血管细胞尤其是血管平滑肌细胞成骨样表型转换[5-6]。随血管平滑肌细胞组织钙化的进展,原有的细胞功能发生改变,具备了骨细胞的特征和功能,呈现出骨细胞特异性蛋白及基因表达。
内质网应激是内质网内环境在外界环境影响下,内质网折叠蛋白质发生未折叠或者异常蛋白蓄积,导致“未折叠蛋白反应。”已有研究证实内质网应激参与细胞凋亡的过程,通过上调GRP78来发挥作用[7],同时GRP78被公认为内质网应激的标志。caspase-12的激活是促发内质网凋亡的重要途径。Proudfoot等[8]实验发现:人体VSMC在钙化发生前就出现细胞凋亡特征,其培养l周后出现来源于VSMC凋亡小体的基质囊泡(基质囊泡是正常软骨内骨钙化的生发中心);进而说明了凋亡小体的功能类似骨基质囊泡,其能够蓄积钙,促进VSMC骨相分化。
吡格列酮作为PPAR-γ激活剂已广泛应用于临床糖尿病的治疗,除此之外,有报道称该类药物可减轻动脉粥样硬化和促进血管平滑肌细胞凋亡的作用,其机制可能是通过快速激活TGFβ1,进而引起细胞凋亡[9]。研究发现,PPAR-γ激活时,凋亡相关基因p53和bal-2出现异常表达,促进平滑肌细胞凋亡[10]。但吡咯咧酮是否通过激活PPAR-γ,进而影响血管平滑肌细胞凋亡,促进血管平滑肌细胞钙化鲜有报道。因此,本实验采用体外BGP诱导血管平滑肌细胞钙化,观察比格咧酮对血管平滑肌细胞钙化的影响及机制。结果发现离体的血管平滑肌细胞可以形成明显的矿化结节,钙含量及ALP活性较对照组明显增加,标志着局部细胞已发生成骨细胞样化。血管平滑肌细胞钙化后,凋亡率明显增加,内质网应激指标GRP78及caspase-12mRNA水平明显增加;同时比格咧酮处理后,上述改变加重。结果证实比格咧酮可以促进PPAR-γ的表达,促进血管平滑肌细胞钙化,促使血管平滑肌细胞向成骨样细胞表型转化,其机制可能是作用于内质网,通过上调GRP78及caspase-12,促使内质网应激状态加重,引起过度内质网应激,加重细胞钙化。但抑制PPAR-γ活性作为很有前途的抗血管钙化手段,还需对其在VC中的作用做进一步研究。
[1]Parhami F,Tintut Y,Patel JK,et al.Regulation of vascular calcificationin in atherosclerosis[J].Zkaradiol,2001,90(1):27-30.
[2]Shroff R,Long DA,Shanahan C.Mechanistic Insights into Vascular Calcification in CKD[J].J Am Soc Nephrol,2013,24(2):179-189..
[3]Kapustin AN,Davies JD,Reynolds JL,et al.Calcium regulates key components of vasculμLar smooth muscle cell-derived matrix vesicles to enhance mineralization[J].Circ Res,2011,109(1):e1-12.
[4]Bear M,Butcher M,Shaughnessy SG.Oxidized low-densitylipoprotein acts synergistically with beta -glycerophosphate to induce osteoblast differentiation in primary cultures of vascular smooth muscle cells [J].Cell Biochem,2008,105(1):185-193.
[5]Sasaki T,Nakamura K,Sasada K,et al.Matrix metalloproteinase-2 deficiency impairs aortic atherosclerotic calcification in ApoE-deficient mice[J].Atherosclerosis,2013,227(1):43-50.
[6]Shimizu T,Tanaka T,Iso T,et al.Azelnidipine inhibits msx2-dependent osteogenic differentiation and matrix mineralization of vascular smooth muscle cells[J].Int Heart J,2012,53(5):331-335.
[7]Proudfoot D,Skepper JN,Hegyi L,et al.The role of apoptosis in the initiation of vascular caleification[J].Z Kardiol,2001,90(3):43-46.
[8]Xin W,Li X,Niu K,et al.Involvement of endoplasmic reticulum stress-associated apoptosis in a heart failure model induced by chronic myocardial ischemia[J].Int J Mol Med,2011, 27(4): 503-509.
[9]刘厂辉,李建平,阳辉.罗格列酮对高脂血症大鼠平滑肌细胞凋亡的影响及机制探讨[J].中国动脉硬化杂志,2012,20(3):199.
[10]王朝辉,甘琼.过氧化物酶体增生物激活物受体γ诱导的平滑肌细胞凋亡凋亡中相关基因p53和bcl-2表达的变化[J].中国病理生理杂志,2004,20(4):590-594.
Pioglitazone Increases Calcification of Rat Vascular Smooth Muscle Cells by Endoplasmic Reticulum Stress Apoptotic Pathway
MA Qi1, BIAN Yun-Fei2, BAI Rui2, LU Yan1, XIAO Chuan-Shi1*
(1 Department of Cardiology, The First Affiliated Hospital of Shanxi Medical University, Taiyuan 030001, China; 2 Department of Cardiology, The Second Affiliated Hospital of Shanxi Medical University, Taiyuan 030001, China)
ObjectiveTo explore the impact of pioglitazone by endoplasmic reticulum stress apoptotic pathway on calcification of rat vascular smooth muscle cells in vitro, and its signal transduction and molecular mechanisms.MethodsCalcification of cultured rat vascular smooth muscle cells(VSMCs)was produced by with β-glycerophosphate(β-GP) and sodium pyruvate. The vascular smooth muscle cells cells (VSMCs) were treat with (10, 50, 100 μmol/ L) pioglitazone. Von kossa staining and alizarin red staining, calcium content, alkaline phosphatase activity were analyzed to estimate the extent of calcification. The apoptoticrate was analyzed by flowcy tometry and TUNEL. The mRNA expression of peroxisome proliferator-activated receptor(PPAR-γ), glucose regulated protein 78 (GRP78)and cysteine-containing aspartate-specific proteases-12 (caspase-12) were detected by quantitative real-time RT-PCR.ResultsCompared with the normal VSMCs, the calcium content and, ALP activity of the cells of the calcified VSMCs were significantly higher (P<0.05), pioglitazone in a dose-dependent manner to promote calcified rat vascular the calcium content of the smooth muscle cells (VSMCs) ALP activity, the cell apoptotic rate and the mRNA expression of PPAR-γ, GRP78 and caspase-12.ConclusionPioglitazone can promote β-glycerophosphate-induced calcification of vascular smooth muscle cells, pioglitazone promote calcification of vascular smooth muscle cells may be though by endoplasmic reticulum stress apoptotic pathway.
Vascular calcification; Endoplasmic reticulum stress; Vascular smooth muscle cells; Pioglitazone
R54
B
1671-8194(2015)07-0013-04
*通讯作者:E-mail: ganxibaozhongxin@sina.com

