集约经营毛竹林土壤酶活性对模拟氮沉降的初期响应
宋思睿,烟亚萍,宣丹娟,翁 俊,宋新章
(浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300)
集约经营毛竹林土壤酶活性对模拟氮沉降的初期响应
宋思睿,烟亚萍,宣丹娟,翁 俊,宋新章*
(浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300)
采用典型样方法,在浙江省临安市设立毛竹(Phyllostachys heterocycla cv. pubescens)林分条件和环境状况较一致的代表性样方12个,研究了集约经营毛竹林蔗糖酶、纤维素酶、脲酶和过氧化氢酶4种土壤酶活性对不同水平的模拟氮沉降(低氮30 kgN·hm-2·a-1、中氮60 kgN·hm-2·a-1、高氮90 kgN·hm-2·a-1和对照)的初期响应。结果表明:模拟的氮沉降显著降低了集约经营毛竹林0~20 cm土壤蔗糖酶、纤维素酶、脲酶和过氧化氢酶的活性,显著抑制了> 20~40 cm土壤蔗糖酶的活性,对纤维素酶和过氧化氢酶的活性影响不显著。
氮沉降;土壤酶;毛竹林;集约经营
中国已成为继欧洲和北美之后的全球第三大氮沉降集中区[1],并呈现出进一步加重的趋势。预期到2030年将在现有基础上翻一番,成为全球氮沉降增加最快的地区[2]。多个全球氮沉降预测模型均估计今后几十年内位于中国中南部的亚热带地区将成为全球大气氮沉降最严重的区域之一[3~4],事实上,目前中南部地区的氮沉降量就已高达63.53 kgN·hm-2·a-1[5],已经成为中国氮沉降最严重的区域。氮沉降的增加将对生态系统产生广泛的影响。氮沉降可以改变微生物群落结构组成,进而改变微生物功能,降低土壤酶的活性,使微生物对底物的利用模式发生改变。
土壤酶是土壤组分中最活跃的有机成分之一,是土壤生物过程的主要调节者[6],其参与了土壤环境中的一切生物化学过程,与有机物质分解、营养物质循环、能量转移、环境质量等密切相关,并且酶的分解作用是物质循环过程的限制性步骤[7],土壤酶的分解作用参与并控制着土壤中的生物化学过程在内的自然界物质循环过程,酶活性的高低直接影响物质转化循环的速率,因而土壤酶活性对生态系统功能有很大的影响。土壤酶活性是土壤中生物学活性的总体现[8],对环境等外界因素引起的变化较敏感,因此土壤酶活性可以作为衡量生态系统土壤质量变化的预警和敏感指标。
毛竹(Phyllostachys heterocycla cv. pubescens)是中国分布最广、栽培和利用历史最悠久、经济价值最高的竹种,是中国重要的森林资源,也是中国南方山区农民经济收入的重要来源[9],主要分布在亚热带地区,该地区目前正面临着日益严重的氮沉降威胁。高强度的自然氮沉降加上经营性施肥带来的外源氮输入,势必进一步加重毛竹林的氮输入量。土壤碳氮状况是土壤酶活性的基础,对土壤酶活性有着不可忽视的影响。因此,高强度的氮沉降必将深刻影响到毛竹林土壤酶的活性。
目前国内有关氮沉降的研究主要集中在亚热带常绿阔叶林[10]、杉木林[11]、温带阔叶林[12]等方面,而毛竹林土壤酶将对氮沉降作出怎样的响应仍不清楚,亟需通过试验研究加以解答。为此,开展了模拟不同氮沉降强度对毛竹林土壤酶活性影响的野外实验,以期为解答这一科学问题提供数据和参考。
1 研究区概况
试验在浙江省临安市的毛竹林长期实验基地进行(119° 42′ E,30° 14′ N)。该区地处中亚热带季风气候区的北缘,四季分明,温和湿润,热量丰富,雨量充沛,年平均降水量约1 420 mm,年平均气温15.6℃,≥10℃年有效积温2 696.2℃,全年无霜期230 d。土壤为黄壤。地形地貌为低山丘陵。研究区内的毛竹林主要为集约经营(Intensive Management, IM)类型,经营历史10 a左右,经营措施主要为除去林下灌木和杂草,每年9月深翻1次,并结合翻耕施用化肥。本研究采用典型选样方法,在研究区设立林分条件和环境状况较一致的代表性样方12个,进行外加氮处理试验。每个样方面积为20 m×20 m,样方之间间隔20 m以上以防相互影响。样地的林分和土壤特征见表1。

表1 毛竹林样地的林分和土壤特征Table 1 Stand and soil characteristics of sample plots
2 材料与方法
2.1 实验设计
本研究通过外加氮模拟氮沉降实现对生态系统的氮控制。参考莫江明、韩士杰等氮沉降模拟研究的试验方法及欧洲NITREX项目和北美HarvardForest试验方法[10,13~16],依据我国亚热带地区的实际氮沉降量及未来增加趋势[4~5],氮沉降处理设置 4个梯度水平:对照(0 kgN·hm-2·a-1)、低氮(30 kgN·hm-2·a-1)、中氮(60 kgN·hm-2·a-1)和高氮(90 kgN·hm-2·a-1),每个梯度3个样方即3个重复。根据氮处理梯度水平,每月进行模拟氮沉降喷施一次,每年 12次。具体方法为:每月月初将每个样方所需喷施的一定量的 NH4NO3溶解在10 L自来水中(年增加水量相当于新增降水0.3 mm),以背式喷雾器人工来回均匀喷洒在林地上。对照处理样方则喷洒同样多的水但不加任何氮,以减少处理间因外加水不同而造成的影响[10,13]。
2.2 样品采集、处理和测定
喷氮处理7个月后,于2013 年7月在每个样地内沿S形用直径3.5 cm 的土钻钻取0~20 cm土层土样6个,混合后带回实验室,风干处理后用于土壤酶活性测定。采用苯酚-次氯酸钠比色法测定脲酶活性,采用高锰酸钾滴定法测定过氧化氢酶活性,采用3, 5-二硝基水杨酸比色法测定蔗糖酶和纤维素酶活性[17]。
2.3 数据处理
利用SPSS17.0软件进行统计分析,对各处理土壤酶活性数据进行重复单因素方差分析,然后以LSD多重检验法检验处理间的差异显著性。
3 结果与分析
3.1 氮沉降对土壤蔗糖酶活性的影响
由图1可知,施氮处理显著抑制了0~20 cm土壤和 > 20~40 cm土壤的蔗糖酶活性。在0~20 cm,低氮处理下蔗糖酶的活性下降幅度最大,达52.60%。在> 20~40 cm,中氮处理下蔗糖酶的活性下降幅度最大,达30.19%。除低氮处理外,其他处理条件下0~20 cm土壤的蔗糖酶活性皆高于 > 20~40 cm土壤。
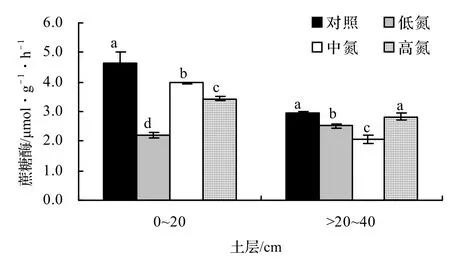
注:不同小写字母表示同一土层不同施氮水平之间土壤蔗糖酶活性的差异性显著(p < 0.05);下同。
3.2 氮沉降对土壤纤维素酶活性的影响
由图2可知,尽管低强度的施氮处理降低了0~20 cm土壤和20~40 cm土壤的纤维素酶活性,而高强度的施氮处理增加了两个土层深度的纤维素酶活性,但均未达到显著水平。在每种施氮处理条件下,0~20 cm土壤的纤维素酶活性皆大于20~40 cm土壤。3.3 氮沉降对土壤脲酶的影响
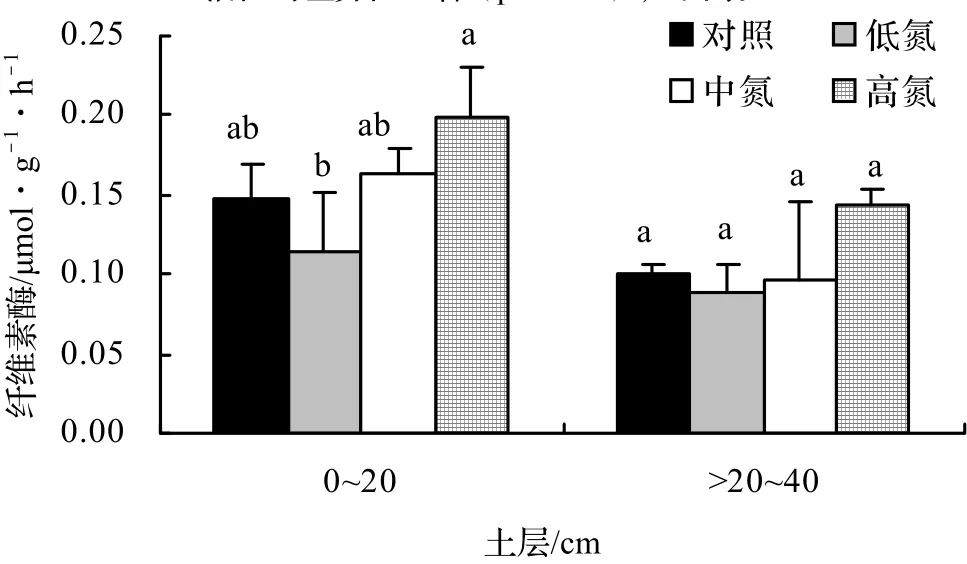
图2 施氮量对不同深度土壤纤维素酶活性的影响Figure 2 Effect of different nitrogen deposition on soil cellulase activitiesat the depth of 0-20 cm and 20-40 cm
由图3 可以看出,施氮对0~20 cm土壤和 > 20~40 cm土壤的脲酶活性的影响存在明显差异。在0~20 cm土层,除低氮处理外,均表现为抑制酶活性,且在中氮处理下作用显著,酶活性降低了42.41%。在 > 20~40 cm 土层,高氮处理显著提高了脲酶活性,达33.41%,相反,低氮处理显著抑制了脲酶活性,达16.96%。
3.4 氮沉降对土壤过氧化氢酶活性的影响
由图4可知,在0~20 cm土层,低氮处理显著抑制了过氧化氢酶的活性,酶活性降低了18.73%,中氮和高氮处理的影响不显著。在 > 20~40 cm土层,不同强度的氮处理虽然降低了过氧化氢酶的活性,但作用不显著。
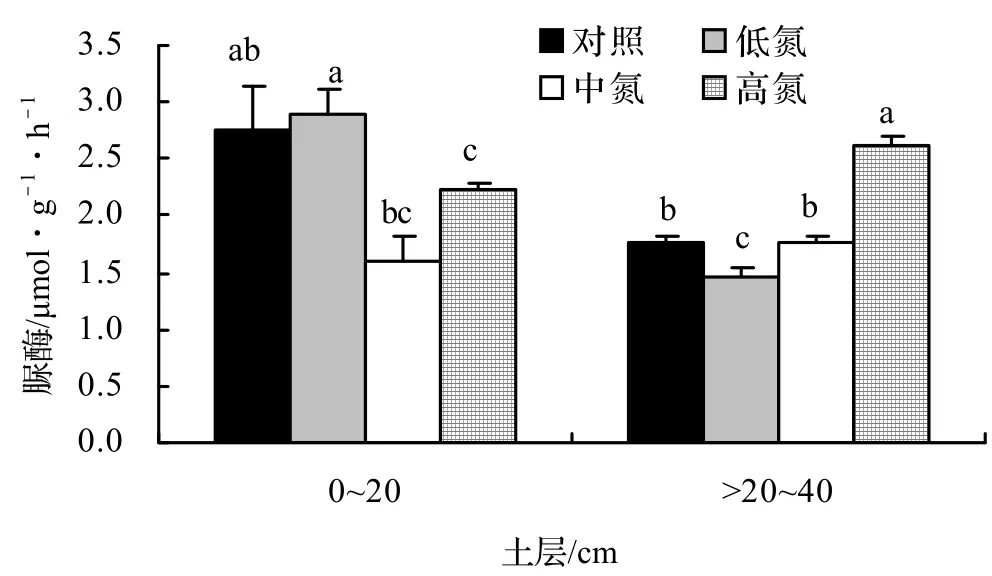
图3 施氮量对不同深度土壤脲酶活性的影响Figure 3 Effects of different nitrogen deposition on soil urease activities at the depth of 0-20 cm and 20-40 cm
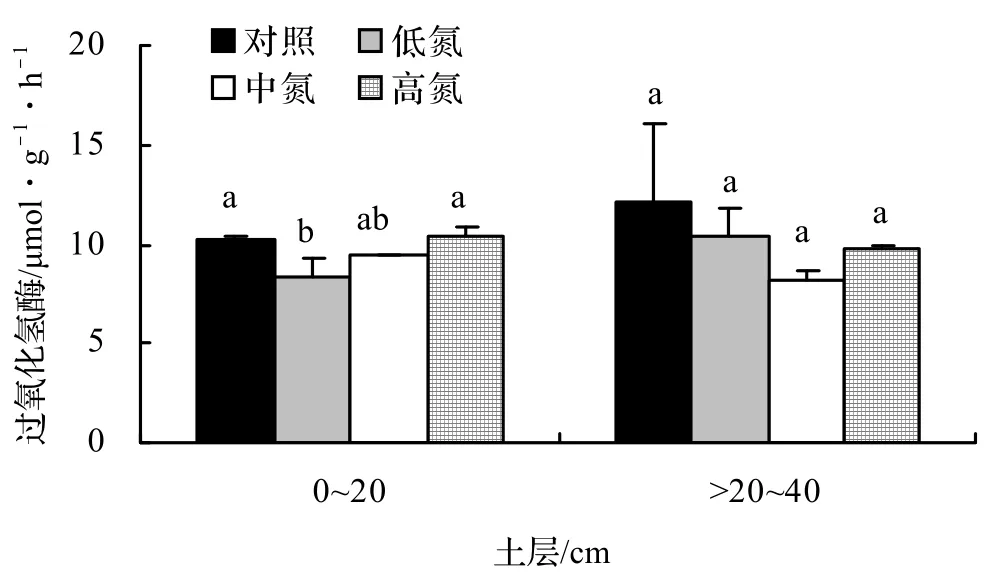
图4 施氮量对不同深度土壤过氧化氢酶活性的影响Figure 4 Effects of different nitrogen deposition on soil catalase activities at the depth of 0-20 cm and 20-40 cm
4 小结与讨论
一般来说,土壤中水解酶类活性的变化与有机质的分解过程有关,而土壤中氧化酶类的活性变化与有机质再合成过程有关[17~18]。本实验所研究的蔗糖酶、纤维素酶和脲酶属于水解酶类,而过氧化氢酶属于氧化酶类。土壤蔗糖酶广泛存在于土壤中,直接参与含碳有机物的代谢过程,对土壤微生物数量、土壤呼吸强度有直接依赖性[19]。本实验结果表明,氮沉降显著降低了集约经营毛竹林0~20 cm土壤和 > 20~40 cm土壤蔗糖酶的活性,而涂利华等[18,20]观测到模拟氮沉降促进了苦竹林和光皮桦人工林土壤蔗糖酶的活性,表明不同植被下土壤酶活性对外源氮输入的响应不同。
涂利华等[18]观测到模拟氮沉降增加了光皮桦人工林土壤纤维素酶的活性,Carreiro等[21]和Gallo等[22]报道氮沉降促进了北方温带森林中土壤纤维素酶的活性。其原因在于在氮可获得性增加后,微生物的活性提高了,使相关酶的活性增强。并且由于酶自身是一种富氮物质(蛋白质),其生产也受到活性氮的调节[23]。但也有研究发现氮沉降抑制了纤维素酶活性[19~20,24~25]。本研究也发现氮沉降显著降低了0~20 cm土壤纤维素酶的活性,这些实验结果间的差异可能是因为不同生态系统中不同的微生物区系对氮的响应各异。由于集约经营毛竹林土壤中纤维素酶活性比其余3种酶活性低2个数量级,因此该酶在土壤有机物分解过程中的作用相对较弱。
脲酶是微生物或植物进行氮获取生产的一种酶。Ajwa等[26]发现施氮抑制了高草草原土壤脲酶的活性(约15%),本研究也观测到施氮显著降低了0~20 cm土壤的脲酶活性。但Saiya-Cork等[27]、宋学贵等[24]和涂利华等[20]均观测到模拟氮沉降显著增加了脲酶的活性。这可能与微生物所处的植被类型与林下环境不同有关。脲酶、蔗糖酶和纤维素酶是三种重要的水解酶,集约经营毛竹林0~20 cm土层这三种酶活性在施氮条件下的显著下降意味着在未来氮沉降增强情景下土壤微生物将大大降低对碳元素的需求。
Sinsabaugh等[28]观测到氮沉降显著降低了北方温带森林土壤氧化酶的活性,涂利华等[18]发现氮沉降显著抑制了光皮桦人工林土壤过氧化物酶的活性,Caeeriro等[21]、Sinsabaugh等[29]和DeForest等[19]也观测到相似的研究结果。本研究发现施氮处理显著抑制了0~20 cm土壤过氧化氢酶的活性,主要原因可能在于氮的富集减少了氧化酶的基因表达量所致[30~32]。过氧化氢酶是一种重要的氧化酶,所以认为氮沉降对过氧化氢酶活性的抑制作用可能导致凋落物和土壤有机质的分解受到抑制,从而增加了土壤碳贮量。
[1] Galloway J N. Cowling E B. Reactive Nitrogen and the World: 200 Years of Change[J]. Ambio, 2002, 31(2):64-71.
[2] Zheng X H, Fu C B, Xu X K, et al. The Asian Nitrogen Case Study[J]. Ambio, 2002, 31(2):79-87.
[3] Galloway J N. Transformation of the Nitrogen Cycle: Recent Trends, Questions and Potential Solutions[J]. Science, 2008, 320(5878):889-892. [4] Reay D S, Dentener F, Smith P, et al. Global Nitrogen Deposition and Carbon Sinks[J]. Nat Geosci, 2008(1):430-437.
[5] Lv C Q, Tian H Q. Spatial and Temporal Patterns of Nitrogen Deposition in China: Synthesis of Observational Data[J]. J Geophys Res, 2007, 112(22):10-15.
[6] Marx M C, Wood M, Jarvis S C. A Microplate Fluorimetric Assay for the Study of Enzyme Diversity in Soils [J]. Soil Biol Biochem, 2001, 33 (12~13):1 633-1 640.
[7] Chrost R J. Environmental Control of the Synthesis and Activity of Aquatic Microbial Ectoenzymes[M]. New York, 1991: 29-53.
[8] Mersi W V, Schinner F. An Improved and Accurate Method for Determining the Dehydrogenase Activity of Soils with Iodonitrotetrazolium
Chloride[J]. Biol Fertil Soil, 1991, 11(3):216-220.
[9] Song X Z, Zhou G M, Jiang H, et al. Carbon Sequestration by Chinese Bamboo Forests, and Their Ecological Benefits: Assessment of Potential, Problems, and Future Challenges[J]. Environ Rev, 2011, 19(NA):418-428.
[10] Mo J M, Zhang W, Zhu W X, et al.Nitrogen Addition Reduces Soil Respiration in A Mature Topical Forest in Southern China[J]. Glob Chang Biol, 2008, 14(2):403-412.
[11] 樊后保,刘文飞,徐雷,等. 杉木人工林土壤酶活性对氮沉降的响应[J]. 林业科学,2012,48(7):8-13.
[12] 赵玉涛,李雪峰,韩士杰,等. 不同氮沉降水平下两种林型的主要土壤酶活性[J]. 应用生态学报,2008,19(12):2 769-2 773.
[13] Lu X K, Mo J M, Gilliam F S, et al. Effects of Experimental Nitrogen Additions on Plant Diversity in An Old-growth Tropical Forest[J]. GlobChang Biol, 2010, 16(10):2 688-2 700.
[14] Pregitzer K S, Burton A J, Zak D R, et al. Simulated Chronic Nitrogen Deposition Increases Carbon Storage in Northern Temperate Forests[J]. Glob Chang Biol, 2008, 14(1):142-153.
[15] Clark C M, Cleland E E, Collins S L, et al. EnvironmEntal and Plant Community Determinants of Species Loss Following Nitrogen Enrichment[J]. Ecol Lett, 2007, 10(7):596-607.
[16] Wright R F, Rasmussen L. Introduction to the NITREX and EXMAN Projects[J]. Forest Ecology and Management, 1998, 101(1-3):l-7.
[17] 关松荫. 土壤酶及其研究方法[M]. 北京:农业出版社,1986.
[18] 涂利华,胡红玲,胡庭兴,等. 模拟氮沉降对华西雨屏区光皮桦林土壤酶活性的影响[J]. 应用生态学报,2012,23(8):2 129-2 134.
[19] Deforest J L, Zak D R, Pregitzer K S, et al. Atmospheric Nitrate Deposition, Microbial Community Composition, and Enzyme Activity in Northern Hardwood Forests[J]. Soil Sci Soc Am J, 2004, 68(1):132-138.
[20] 涂利华,胡庭兴,张健,等. 华西雨屏区苦竹林土壤酶活性对模拟氮沉降的响应[J]. 应用生态学报,2009,20(12):2 943-2 948.
[21] Carreiro M M, Sinsabaugh R L, Repert D A, et al. Microbial Enzyme Shifts ExplainLitter Decay Responses to Simulated Nitrogen Deposition[J]. Ecology, 2000, 81(9):2 359-2 365.
[22] Gallo M, Aonette R, Lauber C, et al. Microbial Community Structure and Oxidative Enzyme Activity in Nitrogen-amended North Temperate Frest Soils[J]. Microb Ecol, 2004, 8(48):218-229.
[23] Keeler B L, Hobbie S E, Kelogg L E. Effects of Long-term Nitrogen Addition on Microbial Enzyme Activity in Eight Forested and Grassland Sites: Implications for Litter and Soil Organic Matter Decomposition[J]. Ecosystems, 2009, 12(1):1-15.
[24] 宋学贵,胡庭兴,鲜骏仁,等. 川南天然常绿阔叶林土壤酶活性特征及其对模拟N沉降的响应[J]. 生态学报,2009,29(3):,1 234 -1 240.
[25] Deforest J L, Zak D R, Pregitzer K S, et al. Atmospheric Nitrate Deposition and the Microbial Degradation of Cellobiose and Vanillin in A Northern Hardwood Forest[J]. Soil Biol Biochem, 2004, 36(6):965-971.
[26] Ajwa H A, Dell C J, Rice C W. Changes in Enzyme Activities and Microbial Biomass of Tallgrass Prairie Soil as Related to Burning and Nitrogen Fertilization[J]. Soil Biol Biochem, 1999, 31(5):69-77.
[27] Saiya-cork K R, Sinsabaugh R L, Zak D R. The Effects of Long Term Nitrogen Deposition on Extracellular Enzyme Activity in An Acer Saccharum Forest Soil[J]. Soil Biol Biochem, 2002, 34(9):1309-1315.
[28] Sinsabaugh R L, Zak D R, Gallo M, et al. Nitrogen Deposition and Dissolved Organic Carbon Production in Northern Temperate Forests[J]. Soil Biol Biochem, 2004, 36(9):1509-1515.
[29] Sinsabaugh R L, Carreiro M M, Repert D A. Allocation of Extracellular Enzymatic activity in Relation to Litter Composition,N deposition,and Mass Loss[J]. Biogeochemistry, 2002, 60(8):1-12.
[30] Hofmockel K S, Zak D R, Blackwood C B. Does Atmospheric NO3-deposition Alter the Abundance and Activity of Ligninolytic Fungi in Forest Soils? [J]. Ecosystems, 2007, 10(12):1 278-1 286.
[31] Lauber C L, Sinsabaugh R L, Zak D R. Laccase Gene Composition and Relative Abundance in Oak Forest Soil Is Not Affected by Shortterm Nitrogen Fertilization[J]. Microb Ecol, 2009, 57(1):50-57.
[32] Hassett J E, Zak D R, Blackwood C B, et al. Are Basidiomycete Laccase Gene Abundance and Composition Related to Reduced Lignolytic Activity under Elevated Atmospheric NO3-deposition in A Northern Hardwood forest?[J]. Microb Ecol, 2009, 57(5):728-739.
Effect of Simulated Nitrogen Deposition on Soil Enzyme Activities in Phyllostachys heterocycla cv. pubescens Stand
SONG Si-rui,YAN Ya-ping,XUAN Dan-juan,WENG Jun,SONG Xin-zhang*
(The Nurturing Station for State Key Laboratory of Subtropical Silviculture, Zhejiang A & F University, Lin’an 311300, China)
Twelve selective sample quadrats were established at Phyllostachys heterocycla cv. pubescens stands in Lin’an, Zhejiang province, with similar stand condition and environment. Experiments were conducted of simulated nitrogen deposition with three treatments of 30 kgN/ha·a-1, 60 kgN/ha·a-1, 90 kgN/ha·a-1, and no treatment(control) on soil enzyme activities. The short-term responses of soil enzymes, including invertase, cellulase, urease and catalase were detected. The results showed that simulated N deposition decreased significantly the activities of the four tested enzymes at layer of 0-20 cm, as well as invertase activities at 20-40 cm, but had no significant effect on activities of cellulase and catalase at 20-40cm.
nitrogen deposition; soil enzymes; Phyllostachys heterocycla cv. pubescens stand; intensive management
S714.3
B
1001-3776(2015)02-0062-05
2014-09-16;
2015-01-20
国家自然科学基金项目(31270517,31270497);国家林业局“948”项目(2013-4-55);浙江农林大学人才启动项目(2012FR023);浙江省教育厅项目(Y201327008)资助
宋思睿(1993-),女,云南石林人,从事森林生态、土壤生态研究;*通讯作者。

