过表达锌指蛋白A20可抑制肺泡巨噬细胞炎症反应
朱晓丹, 王 颖, 毕 晶, 童 琳, 刘 洁, 宋元林, 白春学
复旦大学附属中山医院呼吸内科,上海 200032
ZHU Xiao-dan, WANG Ying, BI Jing, TONG Lin, LIU Jie, SONG Yuan-lin, BAI Chun-xue*
Department of Respiratory Medicine, Zhongshan Hospital, Fudan University, Shanghai 200032, China
论 著
过表达锌指蛋白A20可抑制肺泡巨噬细胞炎症反应
朱晓丹, 王 颖, 毕 晶, 童 琳, 刘 洁, 宋元林, 白春学*
复旦大学附属中山医院呼吸内科,上海 200032
目的:通过建立A20过表达肺泡巨噬细胞株,研究A20对肺泡巨噬细胞炎症反应的影响及调控机制。方法:构建携带A20基因的慢病毒载体,转染大鼠肺泡巨噬细胞(NR8383),筛选出稳定过表达A20基因的细胞株并行体外培养。向培养基中加入脂多糖(LPS, 1 μg/mL)进行干预,并于刺激后0.5、1、2、4 h收集上清液及细胞。ELISA法测定上清液中细胞因子(TNF-α、IL-1β)及核因子κB(NF-κB)活性。Western 印迹方法检测A20蛋白及核内p65含量。实时荧光定量PCR法测定A20 mRNA含量。结果:LPS刺激后,A20过表达组(A20组)及正常对照组(VEC组)A20蛋白及mRNA含量都升高,并于1 h达高峰,之后逐渐下降;且A20组较VEC组A20水平明显升高(P<0.05)。与VEC组相比,A20组培养上清液中细胞因子(TNF-α、IL-1β)水平明显降低(P<0.05);NF-κB DNA结合活性及核内p65含量也降低(P<0.05)。结论:A20能够抑制肺泡巨噬细胞NF-κB活性及TNF-α、IL-1β分泌,进而抑制肺泡巨噬细胞炎症反应活性。
急性呼吸窘迫综合征;A20蛋白;肺泡;巨噬细胞;炎症反应
急性呼吸窘迫综合征(ARDS)是造成重症肺炎、重症急性呼吸综合征(SARS)、爆发性禽流感等疾病患者死亡的主要原因。ARDS病死率高,在美国,其死亡人数相当于每年因乳腺癌、结肠癌和前列腺癌死亡的人数总和[1]。其诱因主要为肺部感染和全身性感染。其中在脂多糖(LPS)导致的ARDS中,促炎及抗炎反应失衡是根本原因。肺泡巨噬细胞在其中起始动作用,并与核因子(NF-κB)炎症信号通路过度反应密切相关[2-3]。
A20蛋白,又称肿瘤坏死因子α诱导蛋白3(TNFAIP3),是一种泛素修饰酶[4]。既往研究[5-8]发现,A20基因多态性与多种炎症性疾病有关,并可负性调节NF-κB。在呼吸系统中A20基因SNP位点(rs4755453)与急性肺损伤的易感性有关[9]。A20基因敲除小鼠能产生严重的炎症反应,并在TNF-α及LPS干预之后更明显,提示A20能够抑制机体肿瘤坏死因子(TNF)诱导的NF-κB活化[10]。NF-κB在肺泡巨噬细胞炎症反应中具有重要作用,而A20能够调控NF-κB活化。因此本研究主要探讨A20蛋白对肺泡巨噬细胞炎症活性的影响。
1 材料与方法
1.1 肺泡巨噬细胞体外培养 选取NR8383大鼠肺泡巨噬细胞株(中国科学院细胞库),采用含20%胎牛血清的F12K培养基(Sigma,货号:N3520),添加NaHCO32.5 g/L、1% P/S (100 U/mL青霉素+100 μg/mL链霉素)、2 mol/LL-谷氨酰胺溶液,置于37°C、5%CO2细胞培养箱常规培养。取对数生长期细胞进行后续实验。
1.2 A20质粒转染 采用RT-PCR法(按照RevertAidTMFirst Strand cDNA Synthesis Kit试剂盒说明书进行,上游引物:5′-GTT GGC AAA GCA TAC AAC TGA AAG G-3′;下游引物:5′-GGC TGT GAC GAA GGA AGA GCT TA-3′)扩增小鼠A20 cDNA(购于康为世纪)。在EcoR Ⅰ 和BamH Ⅰ酶切位点将上述cDNA插入pCDH-CMV-MCS-EF1-copGFP载体,并进行测序验证。按照LipofectamineTM2000 (Invitrogen,11 668-019)产品说明书将上述含有A20目的基因的载体转染NR 8383肺泡巨噬细胞,并进行体外培养,荧光显微镜下观察转染是否成功。实时荧光定量PCR、Western 印迹法检测细胞中A20基因和蛋白的表达。
1.3 LPS刺激肺泡巨噬细胞 将体外培养慢病毒包装后的肺泡巨噬细胞株分为A20过表达组(A20组)和过表达空载组(VEC组)。向培养基中加入LPS(1 μg/mL)进行刺激,分别于刺激后0.5、1、2、4 h,将培养液离心,吸取上清液,并收获细胞。细胞提取细胞蛋白及总RNA,采用Western 印迹法检测A20、NF-κB蛋白表达情况,实时荧光定量PCR法检测细胞中A20 mRNA表达情况(A20引物,上游引物:5′- GCA GTG TAA AAG GCA GGC TAA C-3′,下游引物:5′-TGG GGT TCT CTC TCG TAT CTT C-3′;β-actin引物上游引物:5′-GGA GATT AGT GCC CTG GCT CCT A-3′,下游引物:5′-GAC TCA TCG TAC TCC TGC TTG CTG-3′)。
1.4 NF-κB活性及细胞因子检测 用非放射性NF-κB p65转录因子活性检测试剂盒(Active Motif)检测上清液中NF-κB活性;ELISA试剂盒(R&D)检测上清液TNF-α、IL-1β水平。
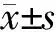
2 结 果
2.1 荧光显微镜下观察A20过表达肺泡巨噬细胞 将携带A20基因的病毒载体转染肺泡巨噬细胞(A20过表达肺泡巨噬细胞),感染24 h后,可在荧光显微镜下观察到绿色荧光(图1)。
图1 荧光显微镜下观察A20过表达肺泡巨噬细胞
A:明视野;B:荧光视野.Original magnification: ×200
2.2 A20过表达大鼠肺泡巨噬细胞的A20表达鉴定 采用Western 印迹及实时荧光定量PCR鉴定A20过表达肺泡巨噬细胞中A20的表达情况。结果显示,A20过表达肺泡巨噬细胞(A20)中A20蛋白及mRNA含量较VEC组明显升高,可用于后续研究(图2)。
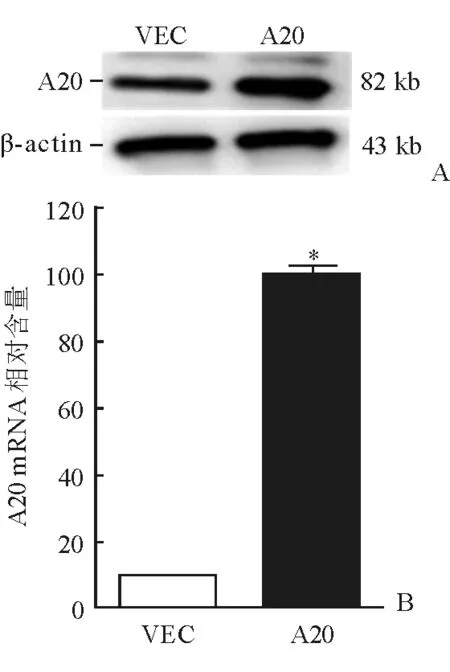
图2 A20过表达肺泡巨噬细胞中A20表达情况
2.3 LPS刺激后大鼠肺泡巨噬细胞A20表达情况 VEC组及A20组LPS刺激后A20蛋白及mRNA含量均较刺激前升高,且于1 h达高峰,之后逐渐下降;LPS刺激后A20组中A20蛋白及mRNA的含量高于VEC组,差异有统计学意义(P<0.05,图3)。
2.4 A20对LPS刺激后肺泡巨噬细胞中细胞因子分泌的影响 LPS刺激后,与0 h比较,其他各个时间点各组细胞培养上清液中的TNF-α和IL-1β均明显升高(图4);A20组各个时间点较VEC组培养上清液中的细胞因子水平(TNF-α、IL-1β)均明显降低,差异具有统计学意义(P<0.05),表明A20能抑制LPS刺激后肺泡巨噬细胞中的细胞因子分泌(图4)。
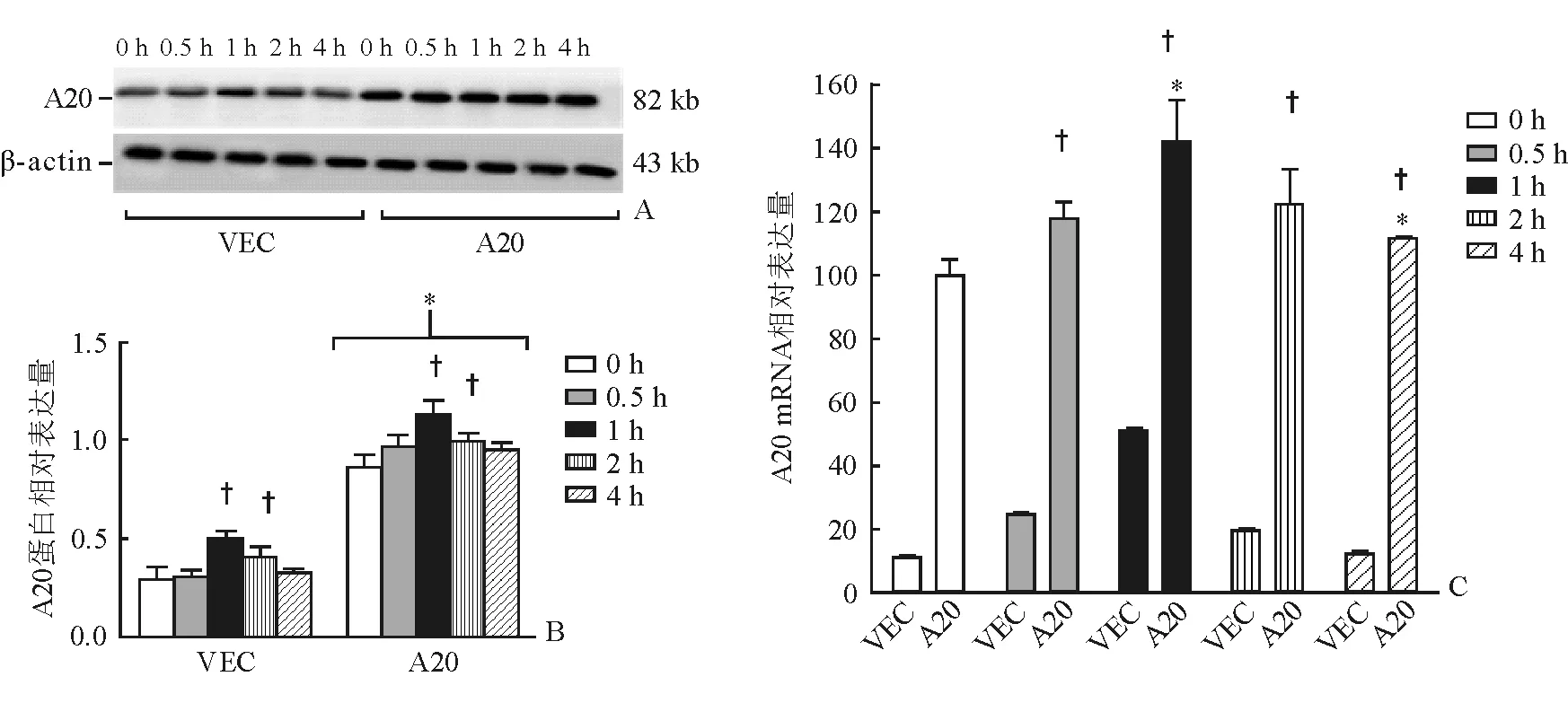
图3 各时间点肺泡巨噬细胞中A20蛋白及mRNA含量
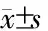

图4 ELISA法测定细胞培养上清液中TNF-α及IL-1β水平A:TNF-α水平;B:IL-1β水平.†P<0.05与0 h比较;*P<0.05与VEC组比较.n=3,
2.5 A20对LPS刺激后肺泡巨噬细胞中NF-κB的影响 给予LPS刺激后,与0 h比较,其他各个时间点各组核内p65蛋白含量(图5A、5B)及NF-κB DNA结合活性(图5C)升高;与VEC组相比,A20组各个时间点核内p65蛋白含量(图5A、5B)及NF-κB DNA结合活性(图5C)均降低,差异具有统计学意义(P<0.05),表明A20能抑制肺泡巨噬细胞NF-κB表达及活性。
3 讨 论
过度放大的炎症反应是ARDS重要的病理生理特征,而肺泡巨噬细胞在其中起始动作用。通常认为,ARDS具有双期炎症过程,晚期依赖于中性粒细胞,早期肺泡巨噬细胞为启动ARDS炎症瀑布发挥着巨大作用[11]。当外界刺激因子作用于机体时,首先激活巨噬细胞,释放并活化一系列促炎因子,如TNF、IL-1、IL-6、IL-8等,进而作用于各种效应细胞,导致炎症反应过度放大及失衡,最终造成ARDS。此外,肺巨噬细胞产生的细胞因子,因不能被血清灭活,而在肺内不断蓄积,使始动因素持续存在,造成ARDS继续。在LPS所致的ARDS中,LPS能够导致肺泡巨噬细胞中NF-κB介导的炎症信号通路过度反应,诱导上述细胞因子活化,进而造成肺损伤。因此,有效地抑制肺泡巨噬细胞中NF-κB活性可能是延缓或抑制ARDS炎症反应行之有效的方法。
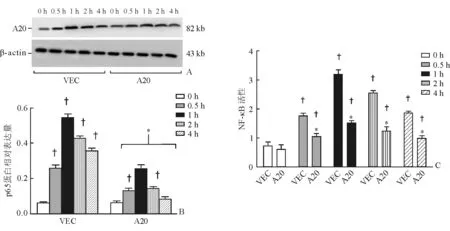
图5 LPS干预后肺泡巨噬细胞中A20、NF-κB蛋白表达及活性变化
A20是相对分子质量约80 000的胞内锌指蛋白,最早在人脐静脉内皮细胞中被发现。目前,它被认为是重要的炎症负性调节因子。多种炎症因子刺激,如LPS、IL-1β及CD40等,能够诱导A20表达。本研究中,体外LPS刺激大鼠肺泡巨噬细胞后,A20表达增加,这与以往的研究[5]相似。本研究发现,A20表达高峰期在LPS刺激后1 h,与IL-1β及TNF-α的分泌时相一致,提示A20与肺泡巨噬细胞细胞因子的分泌有关。
本研究结果显示,LPS刺激后该细胞株中A20蛋白及mRNA含量较VEC组明显升高,而IL-1β及TNF-α水平明显降低,表明A20能够抑制肺泡巨噬细胞分泌IL-1β及TNF-α。研究[11-12]认为,IL-1β及TNF-α是与ARDS有关的主要近端细胞因子,在ARDS早期主要由巨噬细胞分泌,并通过刺激肺部的各种效应细胞产生远端细胞因子,起动细胞因子瀑布。本研究中A20能抑制这两种细胞因子的分泌,提示A20可能通过抑制肺泡巨噬细胞分泌TNF-α及IL-β来调控ARDS。
NF-κB在细胞因子瀑布的调节中起重要作用[13-15]。在LPS诱导的ARDS中,NF-κB通路是主要的炎症信号通路之一,它能够调节多种促炎因子的表达及分泌,如TNF-α、IL-β、IL-6等。NF-κB的结合序列在巨噬细胞来源的很多细胞因子(包括TNF-α、IL-1β,IL-6和IL-8)启动子中被发现。既往研究[4]发现,A20能够抑制NF-κB活化及TNF-α和IL-1诱导的信号通路传导。NF-κB活化过程涉及多个蛋白的泛素化,包括MALT1、TRAF6,而A20蛋白能够脱去这些蛋白的泛素化链,从而调控NF-κB的活化。本研究中给予LPS刺激后,与VEC组相比,A20组各个时间点核内p65蛋白含量及NF-κB DNA结合活性都明显降低,表明A20能抑制肺泡巨噬细胞NF-κB表达及活性。由于NF-κB能调节TNF-α、IL-1β分泌,故综合以上研究结果,A20可能通过抑制NF-κB而调控TNF-α、IL-1β分泌,进而抑制肺泡巨噬细胞炎症反应,在ARDS炎症反应中起负性调节作用。
[1] RUBENFELD G D, CALDWELL E, PEABODY E, et al.Incidence and outcomes of acute lung injury[J].N Engl J Med, 2005,353(16):1685-1693.
[2] FUJIWARA N, KOBAYASHI K.Macrophages in inflammation[J].Curr Drug Targets Inflamm Allergy, 2005,4(3):281-286.
[3] 马杰飞,何义舟, 罗 哲,等.高迁移率族蛋白1在呼吸机相关性肺损伤大鼠中的表达变化[J].中国临床医学, 2015,22(1): 29-32.
[4] IGARASHI H, YAHAGI A, SAIKA T, et al.A pro-inflammatory role for A20 and ABIN family proteins in human fibroblast-like synoviocytes in rheumatoid arthritis[J].Immunol Lett, 2012,141(2):246-253.
[5] SHEMBADE N, MA A, HARHAJ E W.Inhibition of NF-kappaB signaling by A20 through disruption of ubiquitin enzyme complexes[J].Science, 2010,327(5969):1135-1139.
[6] SONG X, YAO Z, YANG J, et al.HCV core protein binds to gC1qR to induce A20 expression and inhibit cytokine production through MAPKs and NF-κB signaling pathways[J].Oncotarget, 2016,7(23):33796-33808.
[7] VEREECKE L, BEYAERT R, VAN LOO G.Genetic relationships between A20/TNFAIP3, chronic inflammation and autoimmune disease[J].Biochem Soc Trans, 2011,39(4):1086-1091.
[8] FAN Y, TAO J H, ZHANG L P, et al.The association between BANK1 and TNFAIP3 gene polymorphisms and systemic lupus erythematosus: a meta-analysis[J].Int J Immunogenet, 2011,38(2):151-159.
[9] SONG Z, YAO C, YIN J, et al.Genetic variation in the TNF receptor-associated factor 6 gene is associated with susceptibility to sepsis-induced acute lung injury[J].J Transl Med, 2012,10:166.
[10] LEE E G, BOONE D L, CHAI S, et al.Failure to regulate TNF-induced NF-kappaB and cell death responses in A20-deficient mice[J].Science, 2000,289(5488):2350-2354.
[11] ZHAO M, FERNANDEZ L G, DOCTOR A, et al.Alveolar macrophage activation is a key initiation signal for acute lung ischemia-reperfusion injury[J].Am J Physiol Lung Cell Mol Physiol, 2006,291(5):L1018-L1026.
[12] MATTHAY M A, ZIMMERMAN G A.Acute lung injury and the acute respiratory distress syndrome: four decades of inquiry into pathogenesis and rational management[J].Am J Respir Cell Mol Biol, 2005,33(4):319-327.
[13] MILLAR F R, SUMMERS C, GRIFFITHS M J, et al.The pulmonary endothelium in acute respiratory distress syndrome: insights and therapeutic opportunities[J].Thorax, 2016,71(5):462-473.
[14] CASTELLHEIM A, BREKKE O L, ESPEVIK T, et al.Innate immune responses to danger signals in systemic inflammatory response syndrome and sepsis[J].Scand J Immunol, 2009,69(6):479-491.
[15] FAN J, YE R D, MALIK A B.Transcriptional mechanisms of acute lung injury[J].Am J Physiol Lung Cell Mol Physiol, 2001,281(5):L1037-L1050.
[本文编辑] 廖晓瑜, 贾泽军
A20 regulates the inflammatory responses of alveolar macrophage
Objective:To study the effects of A20 on the inflammatory response of alveolar macrophages and its regulation mechanism through establishing A20 over-expressing alveolar macrophage cell lines.Methods:Lentivirus-mediated expression vector carrying A20 gene was constructed, then it was transfected into rat alveolar macrophage cell lines (NR8383), and the cell lines which stably overexpressed A20 gene were screened and culturedinvitro.Lipopolysaccharide (LPS, 1 μg/mL) was added into the medium to intervene, the culture supernatants and cells were collected 0.5, 1, 2, 4 hours after stimulation, ELISA method was used to determine the activity of cytokines (TNF-α, IL-1β) and nuclear factor (NF-κB).Western blotting method was used to detect A20 protein and nuclear p65 content, and real-time fluorescence quantitative PCR method was used to determine the content of A20 mRNA.Results:After LPS stimulation, the levels of A20 protein and mRNA in A20 overexpression group (A20 group) and the normal control group (VEC group) both increased and reached the peak at 1 h, and then gradually decreased.The A20 level of A20 group was significantly higher than that of VEC group (P<0.05).Compared with VEC group, the levels of cytokines (TNF-α, IL-1β) in culture supernatants of A20 group significantly reduced (P<0.05), and the DNA binding activity of NF-κB and nuclear p65 content of A20 group also significantly reduced (P<0.05).Conclusions:A20 can inhibit the activity of NF-κB and the secretion of TNF-α and IL -1β, and then inhibit the inflammatory reaction activity of alveolar macrophages, thereby reducing the inflammatory response of acute respiratory distress syndrome (ARDS).
acute respiratory distress syndrome; A20 protein; alveolar; macrophage; inflammatory response
2016-08-19[接受日期]2016-11-01
国家自然科学基金青年基金(81300055,81500025),国家自然科学基金重点项目(30930090).Supported by National Natural Science Youth Foundation of China (81300055,81500025) and Key Project of National Natural Science Foundation of China (30930090).
朱晓丹,博士,住院医师.E-mail: dan_yt@126.com
*通信作者(Corresponding author).Tel: 021-64041990-2963, E-mail: bai.chunxue@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2016.20160822
R 563.8
A
ZHU Xiao-dan, WANG Ying, BI Jing, TONG Lin, LIU Jie, SONG Yuan-lin, BAI Chun-xue*
Department of Respiratory Medicine, Zhongshan Hospital, Fudan University, Shanghai 200032, China

