贵妃鸡MHC-B区域微卫星位点LEI0258遗传多样性研究
黄勋和,张金枫,陈洁波,叶伟庆,李威娜,钟福生,杜炳旺*
(1.嘉应学院生命科学学院,梅州514015;2.广东海洋大学农学院,湛江524088)
贵妃鸡MHC-B区域微卫星位点LEI0258遗传多样性研究
黄勋和1,张金枫1,陈洁波1,叶伟庆2,李威娜1,钟福生1,杜炳旺2*
(1.嘉应学院生命科学学院,梅州514015;2.广东海洋大学农学院,湛江524088)
摘 要:为研究贵妃鸡的遗传多样性,试验应用主要组织相容性复合体B区域(MHC-B)复合微卫星位点LEI0258测定了贵妃鸡的等位基因信息,结合已发表的序列,进行等位基因与核苷酸多态性、单倍型中介网络图分析。40份样品中共检测到9个等位基因,长度为193~297bp,其中5个为贵妃鸡特有。观察杂合度(Ho)、期望杂合度(He)和多态信息含量(PIC)分别为0.625、0.716和0.666。3个等位基因与6种已知MHC血清型相匹配。基于侧翼区变异信息的中介网络图将等位基因分为5个进化枝,贵妃鸡9个等位基因分布于A和B进化枝中,这2个进化枝同样存在于红原鸡中。研究结果表明贵妃鸡保持着中等偏上的遗传多样性水平,可能起源于红原鸡。
关键词:贵妃鸡;多态性;主要组织相容性复合体;微卫星位点LEI0258;进化;血清型
贵妃鸡,又称贵妇鸡,原产于法国乌当,分布于法国、英国、荷兰等欧洲国家,因其头顶华丽毛冠和肉质鲜美闻名全球,是著名的观赏与肉用珍禽。贵妃鸡于20世纪90年代引入中国,21世纪初广东海洋大学家禽育种中心率先对其进行了系统的研究和品种选育,成功选育出了国内第一个饲养的商用配套系。在贵妃鸡的基础研究中,主要集中在生物学特性[1-4]、品种选育[5-7]、饲养技术与效果[8-11]等。在遗传多样性方面,线粒体控制区和细胞色素b序列分析提示贵妃鸡起源于红原鸡[12-13]。
鸡主要组织相容性复合体B区域(major histocompatibility complex B region,MHC-B)定位于16号染色体上,与宿主许多传染性疾病(如马可氏病)的抗性或易感性有关[14-15]。传统方法常采用通过B区血清反应对MHC进行血清型鉴定[16-17],但受限于血清型的鉴定来源[18],该方法在其他品种中的应用有限,不同研究也难以进行平行比较[19]。微卫星位点LEI0258定位于MHC-B[20],并与其血清型有很好的对应关系[21],因而获得了广泛的关注,前人对此微位星位点进行了大量研究[19,22-24]。本研究利用微卫星位点LEI0258分析贵妃鸡的遗传多样性与进化,探讨LEI0258等位基因与MHC血清型的对应关系,为贵妃鸡保种选育和饲养管理提供科学理论依据。
1 材料与方法
1.1材料
40只贵妃鸡血液样品来自广东海洋大学家禽育种中心。肱静脉取血0.5~1.0mL放入预先添加1mL 95%乙醇的2mL离心管中,-80℃保存。
1.2主要试剂及仪器
基因组DNA提取试剂盒、琼脂糖凝胶回收试剂盒均购自广州美基生物技术有限公司;PCR试剂、DNA Marker均购自宝生物工程(大连)有限公司。PCR扩增仪、凝胶成像系统、电泳仪和电泳槽均购自Bio-Rad公司;冷冻高速离心机购自Eppendorf公司。
1.3引物设计与合成
参考McConnell等[20]方法设计引物,微卫星位点LEI0258扩增引物序列为:LEI0258F:5′-CACGCAGCAGAACTTGGTAAGG-3′;LEI0258R:5′-AGCTGTGCTCAGTCCTCAGTGC-3′,正向引物5′端加上荧光标记FAM。引物由广州艾基生物技术有限公司合成。
1.4PCR扩增、基因分型与测序
PCR反应体系20μL:10×PCR Buffer 2μL,dNTP Mixture(2.5mmol/L)1.6μL,正、反向引物(20μmol/L)各2μL,TaqDNA聚合酶(5U/μL)0.2μL,DNA模板(50~100ng)1μL,灭菌双蒸水补足20μL。PCR扩增程序:94℃预变性4min;94℃变性30s,65℃退火1min,72℃延伸1min,35个循环;72℃延伸10min。PCR产物经2.0%琼脂糖凝胶电泳检测后送往无锡翼和应用生物技术有限公司采用ABI 3730分析仪进行基因型判定。基于毛细管凝胶电泳的基因分型结果,挑选贵妃鸡不同的等位基因进行DNA测序。每个等位基因挑选2~3个样品直接进行双向测序(广州艾基生物技术有限公司)。
1.5数据分析
等位基因数(Na)、观察杂合度(observed heterozygosity,Ho)、期望杂合度(expected heterozygosity,He)和多态信息含量(polymorphic information content,PIC)由Cervus 3.0.3[25]软件测定。DNA序列由BioEdit 7.2.5[26]软件编辑处理,并辅以人工校验。在NCBI(http://www.ncbi.nlm.nih.gov/nuccore/)中下载已发表的LEI0258序列,并根据前人研究报道确定不同等位基因的家鸡品种/原鸡[19,21,24]。根据已发表的LEI0258等位基因与血清型的对应关系确定贵妃鸡的血清。序列比对采用Mega 6.0[27]进行,使用软件SplitsTree 4.10构建基于LEI0258侧翼序列的中介网络图(medianjoining network)[28]。
2 结果与分析
2.1LEI0258PCR及基因分型结果
PCR产物进行2.0%琼脂糖凝胶电泳检测,结果见图1A。由图1A可知,目标条带清晰,片段长度为190~300bp左右,符合微卫星LEI0258的特征。LEI0258正向引物加上5′FAM荧光标记后,PCR产物在自动毛细管凝胶电泳检测中显示出很好分型效果(图1B)。

图1 LEI0258PCR产物琼脂糖凝胶电泳图(A)和基因分型图(B)Fig.1 Gel electrophoretogram(A)and genotyping(B)of LEI0258PCR products
2.2LEI0258等位基因多态性
40份贵妃鸡样品经基因分型共检测到8个等位基因,片段大小为193~300bp(表1)。等位基因275频率最高(0.45),其次是251(0.23)和242(0.19),205和298最低(0.01)。贵妃鸡保持着中等偏上的遗传多样性,观察杂合度、期望杂合度和多态信息含量均高于0.5,分别为0.625、0.716和0.666。
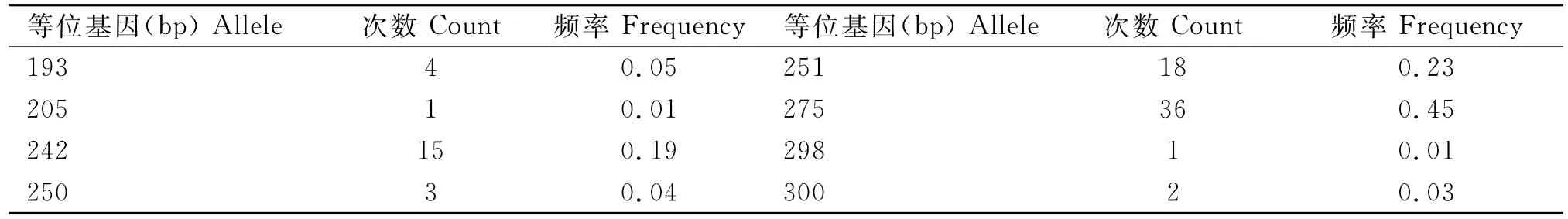
表1 贵妃鸡微卫星位点LEI0258等位基因信息Table 1 Information of microsatellite LEI0258alleles in royal chicken
2.3LEI0258核苷酸多态性
挑选28个片段进行DNA双向测序,获得9个等位基因,片段长度范围为193~297bp(表2)。通过毛细管电泳分型的等位基因193和205与测序结果大小相一致,其余均小于测序结果。LEI0258由2个重复单元R13(CTATGTCTTCTTT)和R12(CTTTCCTTCTTT)组成,重复次数分别为1和3~11。重复区上游有77bp(包括引物序列),下游76bp。上游发现2个变异位点,分别是等位基因295在-29-30缺失碱基“TT”,等位基因241在-38-39的“CC”替换原“TT”。下游发现4个变异位点,转换和颠换各出现1次,等位基因193、205和241在11—18位置缺失“ATTTTGAG”。与常规微卫星位点等位基因的定义不同,LEI0258结合了片段大小和侧翼区的变异信息,因此出现了片段大小相同但等位基因不同的情况,如249和273。在贵妃鸡的9个等位基因中,有5个为首次发现。3个等位基因找到6种对应的血清型,分别是B5、B11、B13、B15.1、B27和B61。
2.4LEI0258侧翼区序列分析
从NCBI数据库下载已发表的微卫星位点LEI0258序列,去除相同的序列,然后去除LEI0258的重复区序列,基于侧翼区变异信息构建包括贵妃鸡在内的中介网络图,结果见图2。由图2可知,94条LEI0258共分为5个进化枝,每个进化枝含8~35条序列。贵妃鸡9个等位基因分布于进化枝A和B中,2个249等位基因分布于不同的进化枝(A和B)。红原鸡分布于进化枝A、B和E中,其他地方鸡品种分布于A、B、C、D和E中。

表2 贵妃鸡微卫星LEI0258位点等位基因多态性Table 2 Polymorphisms of the microsatellite LEI0258alleles in royal chicken

图2 基于LEI0258侧翼区变异信息的中介网络图Fig.2 Median-joining network of LEI0258alleles based on variation of the flanking regions
3 讨 论
本研究利用微卫星位点LEI0258分析了贵妃鸡群体的遗传多样性。结果表明,尽管经历了多年系统的品种选育,贵妃鸡仍保持着中等偏上的遗传多样性水平。与地方鸡相比,如会宁鸡、静宁鸡,贵妃鸡的遗传变异性明显较低,但与明勤鸡基本持平。然而,与商品鸡相比,贵妃鸡遗传多样性高于洛岛红鸡而低于安卡红鸡和海兰褐鸡[29]。总体而言,地方鸡品种的遗传多样性高于商品鸡。研究表明,MHC遗传多样性丰度、重要生产指标与繁殖性能(如体重、蛋重、产蛋强度和性成熟体重等)呈显著正相关[30]。因此,后期的品种培育应注意亲代来源的多样化,减少亲缘关系较近的个体作为亲本的情况,以提高贵妃鸡群体的遗传多样性水平,达到提高生产水平和繁殖性能的目的。
在40个贵妃鸡个体中,共检测到9个LEI0258等位基因,其中5个为贵妃鸡特有。贵妃鸡LEI0258等位基因符合其基本特征,如下游位置的“ATTTTGAG”缺失现象[23-24],但与Fulton等[21]报道的“ATTTGAGG”有所不同。根据已发表的序列,94条LEI0258序列分化为5条差异显著的进化枝。贵妃鸡分布于进化枝A和B中,这两个进化枝同样有红原鸡的等位基因分布[19,24],提示贵妃鸡可能起源于红原鸡,与前人研究结论相一致[12-13]。但需要注意的是,由于微卫星位点LEI0258等位基因的界定同时包含重复单元次数和侧翼区的变异信息[31-32],因而基于侧翼区变异信息构建的中介网络图可能更多地反映了等位基因之间的关系,而非系统发生关系[19]。因此,贵妃鸡的起源还需进一步研究。
LEI0258等位基因与鸡MHC血清型类型存在较强的关联性,因而可以通过研究LEI0258来对鸡MHC血清型进行分型[21]。在9个贵妃鸡等位基因中,其中3个找到6个相对应的血清型,而剩余6个等位基因未找到匹配的血清型。研究表明鸡的抗病能力往往与MHC血清型类型的丰富程度呈正相关[19,33-34]。因此,将来需要开展贵妃鸡MHC血清型鉴定工作以及血清型与抗病能力的对应关系研究,从而为贵妃鸡抗病研究和品种选育提供科学理论依据。
4 结 论
本试验在40份贵妃鸡血液样品中共检测到9个等位基因,其中5个为贵妃鸡特有,3个等位基因与6种已知MHC血清型相匹配。基于侧翼区变异信息的中介网络图将等位基因分为5个进化枝,贵妃鸡9个等位基因分布于A和B进化枝中,这2个进化枝同样存在于红原鸡中,贵妃鸡保持着中等偏上的遗传多样性水平,可能起源于红原鸡。
参考文献:
[1] 吴 婵,李敬瑞,李 辉,等.贵妃鸡生长发育性状的测定与分析[J].广东农业科学,2011,16(16):96-98.
[2] 吴 婵,李 辉,李敬瑞,等.贵妃鸡体尺及屠宰性状的测定及相关分析[J].河南农业科学,2011,40(11):148-151.
[3] 陈洁波,陶 林,吴薇薇,等.贵妃鸡、怀乡鸡和北京油鸡肌纤维特性与肉品质相关性分析[J].中国畜牧兽医,2013,40(11):160-163.
[4] 赵忠海,李 辉,吴 婵,等.贵妃鸡肌细胞生成素基因SNPs检测及其与屠宰性状的相关性分析[J].中国畜牧兽医,2013,40(11):148-152.
[5] 杜炳旺,曹宁贤,王效京,等.中国珍禽贵妃鸡商用配套系的独有特性及发展前景[A].安全优质的家禽生产——第十五次全国家禽学术讨论会论文集[C].2011.
[6] 初 芹,张 剑,张 尧,等.北京油鸡与贵妃鸡杂交效果研究[J].中国家禽,2013,35(12):10-13.
[7] 李乃宾,杨芬霞,杜炳旺,等.贵妃鸡与麒麟鸡杂交后代主要性状的测定与分析[J].河南农业科学,2014,43(4):114-118.
[8] 王 勇,王锡香,曲全科.贵妃鸡林地放养技术关键[J].畜牧与饲料科学,2011,32(8):111-112.
[9] 陈 杰,赵鸿杰,玄祖迎,等.不同养殖模式对贵妃鸡肌纤维特性和肉品质的影响[J].中国家禽,2015,37(18):28-31.
[10] 刘胜洪,曾柳红,刘容珍.贵妃鸡的眼炎病原菌分离鉴定及敏感性药物筛选研究[J].广东农业科学,2011,38(9):128-129.
[11] Jiang R S,Xie Z,Chen X Y,et al.A single nucleotide polymorphism in the parathyroid hormone gene and effects on eggshell quality in chickens[J].Poultry Science,2010,89(10):2101-2105.
[12] 吴 婵,李 辉,李敬瑞,等.基于线粒体DNA控制区(mtDNA D-loop)序列分析贵妃鸡的遗传多样性[J].中国畜牧兽医,2012,39(12):137-139.
[13] 吴 婵,李 辉,李敬瑞,等.基于线粒体细胞色素b基因全序列分析贵妃鸡的遗传多样性[J].黑龙江畜牧兽医,2013,3:51-53.
[14] Bacon L D,Hunt H D,Cheng H H.Genetic resist-ance to Marker’s disease[J].CurrentTopMicrobiologyImmunogenetics,2001,255:121-141.
[15] Lee L F,Bacon L D,Yoshida S,et al.The efficacy of recombinant fowlpox vaccine protection against Marek's disease:Its dependence on chicken line and B haplotype[J].AvianDiseases,2004,48(1):129-137.
[16] Briles W E,Bumstead N,Ewert D L,et al.Nomenclature for chicken major histocompatibility(B)complex[J].Immunogenetics,1982,15(5):441-447.
[17] Fulton J E,Young E E,Bacon L D.Chicken MHC alloantiserum cross-reactivity analysis by hemagglutination and flow cytometry[J].Immunogenetics,1996,43(5):277-288.
[18] O’Neill A M,Livant E J,Ewald S J.The chickenBF1(classical MHC classⅠ)gene shows evidence of selection for diversity in expression and in promoter and signal peptide regions[J].Immunogenetics,2009,61(4):289-302.
[19] Chazara O,Chang C S,Bruneau N,et al.Diversity and evolution of the highly polymorphic tandem repeat LEI0258in the chicken MHC-B region[J].Immunogenetics,2013,65(6):447-459.
[20] McConnell S K,Dawson D A,Wardle A,et al.The isolation and mapping of 19tetranucleotide microsatellite markers in the chicken[J].AnimalGenetics,1999,30(3):183-189.
[21] Fulton J E,Juul-Madsen H R,Ashwell C M,et al.Molecular genotype identification of theGallusgallusmajor histocompatibility complex[J].Immunogenetics,2006,58(5-6):407-421.
[22] Izadi F,Ritland C Cheng K M.Genetic diversity of the major histocompatibility complex region in commercial and noncommercial chicken flocks using the LEI0258microsatellite marker[J].PoultryScience,2011,90(12):2711-2717.
[23] Chang C S,Chen C F,Berthouly-Salazar C,et al.A global analysis of molecular markers and phenotypic traits in local chicken breeds in Taiwan[J].Animal Genetics,2012,43(2):172-182.
[24] Han B,Lian L,Qu L,et al.Abundant polymorphisms at the microsatellite locus LEI0258in indigenous chickens[J].PoultryScience,2013,92(12):3113-3119.
[25] Kalinowski S T,Taper M L,Marshall T C.Revising how the computer program CERVUS accommodates genotyping error increases success in paternity assignment[J].MolecularEcology,2007,16(5):1099-1106.
[26] Hall T A.BioEdit:A user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J].NucleicAcidsSympSer,1999,41(2):95-98.
[27] Tamura K,Stecher G,Peterson D,et al.Mega6:Molecular evolutionary genetics analysis version 6.0[J].MolecularBiologyandEvolution,2013,30(12):2725-2729.
[28] Huson D H,Bryant D.Application of phylogenetic networks in evolutionary studies[J].MolecularBiologyandEvolution,2006,23(2):254-267.
[29] 金丽娜,韩建林.鸡MHC区域内微卫星LEI0258和MCW0312的遗传多态性[J].畜牧与兽医,2015,47(7):50-55.
[30] Nikbakht G,Esmailnejad A.Chicken major histocompatibility complex polymorphism and its association with production traits[J].Immunogenetics,2015,67(4):247-252.
[31] E G,Sha R N,Zeng S C,et al.Genetic variability,evidence of potential recombinational event and selection of LEI0258in chicken[J].Gene,2014,537(1):126-131.
[32] Fulton J E,Lund A R,McCarron A M,et al.MHC variability in heritage breeds of chickens[J].Poultry Science,2016,95(2):393-399.
[33] Rogers S L,Kaufman J.High allelic polymorphism,moderate sequence diversity and diversifying selection for B-NK but not B-lec,the pair of lectin-like receptor genes in the chicken MHC[J].Immunogenetics,2008,60(8):461-475.
[34] Wang H Z,Ma T,Chang G B,et al.Molecular genotype identification of different chickens:Major histocompatibility complex[J].JournalofScienceand Technology,2014,2:1-7.
(责任编辑 姚倩倩)
中图分类号:S831.2
文献标识码:A
文章编号:1671-7236(2016)12-3300-06
doi:10.16431/j.cnki.1671-7236.2016.12.032
收稿日期:2016-04-13
基金项目:广东省自然科学基金项目(2014A030307018);嘉应学院"创新强校工程"项目(CQX019);广东省科技计划项目(2015A020208020、2016A030303068);国家科技基础条件平台-特种动物子平台建设子课题(201520);嘉应学院重点科技计划项目(2015KJM03)
作者简介:黄勋和(1982-),男,广东河源人,博士,讲师,研究方向:中国家鸡遗传多样性与进化,E-mail:hxh826@jyu.edu.cn
通信作者:*杜炳旺(1954-),男,山西运城人,教授,硕士生导师,研究方向:家禽育种与生产,E-mail:dudu903@163.com
Genetic Diversity of Microsatellite LEI0258in MHC-B Region of Royal Chicken
HUANG Xun-he1,ZHANG Jin-feng1,CHEN Jie-bo1,YE Wei-qing2,LI Wei-na1,ZHONG Fu-sheng1,DU Bing-wang2*
(1.SchoolofLifeSciences,JiayingUniversity,Meizhou514015,China;2.CollegeofAgricultural,GuangdongOceanUniversity,Zhanjiang524088,China)
Abstract:The aim of this study was to evaluate the polymorphism and evolution in royal chicken using the tandem repeat microsatellite LEI0258located within the chicken major histocompatibility complex B region(MHC-B).Genomic DNA was extracted from forty blood samples of royal chicken and used to be genotyped and sequenced.Combining the published sequences,the analysis of allele and nucleotide polymorphism and median-joining network were carried out.A total of nine alleles ranging from 193to 297bp in 40samples were found,five of which was novel for royal chicken.The observed heterozygosity,expected heterozygosity and polymorphic information content were 0.625,0.716and 0.666,respectively.Three alleles were corresponding to six available serotypes.Alleles were classified into five clusters,based on the SNPs and indels found within the sequences flanking the repeats.The alleles of royal chicken existed in clades A and B,both of which were also found in Red junglefowl.The results suggested that royal chicken had a middle or high level of genetic diversity in microsatellite LEI0258,and that might originate from Red junglefowl.
Key words:royal chicken;polymorphism;major histocompatibility complex;microsatellite LEI0258;evolution;serotype

