基于油酸诱导的高产三萜灵芝菌丝体发酵条件优化
孙冰沁,秦可欣,王桂荣,何国庆,*
(1.浙江大学生物系统工程与食品科学学院,浙江杭州 310058;2.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076;3.杭州市原种场,浙江杭州 311115)
基于油酸诱导的高产三萜灵芝菌丝体发酵条件优化
孙冰沁1,秦可欣2,王桂荣3,何国庆1,*
(1.浙江大学生物系统工程与食品科学学院,浙江杭州 310058;2.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076;3.杭州市原种场,浙江杭州 311115)
本文对油酸促进灵芝菌丝体高产灵芝三萜发酵条件进行了优化,旨在提高三萜这一具有特殊的生物活性且对人体有益物质的产量。实验进行了碳源、氮源等单因素的筛选,利用CCD实验设计对培养基进行优化,以及对发酵条件单因素进行了优化。实验结果表明,促进灵芝菌丝体高产灵芝三萜的最优结果为:培养基成分为可溶性淀粉3.4%、鱼蛋白胨0.72%、KH2PO40.3%、MgSO40.15%、VB10.005%(m/v),pH5.5,在发酵培养第0 d加油酸4.38%(v/v);装液量为100 mL,接种量为10%(v/v),发酵天数为9 d,胞内三萜产量达到(282.75±3.76)mg/100 mL。该方法不仅大幅度提高了三萜产量,对于灵芝的工业化生产也有重要意义。
灵芝菌丝体,三萜,发酵条件,响应面
灵芝(Ganodermalucidum)是一种大型药用真菌,具有重要的保健和药用价值,在我国有着悠久的应用历史[1]。现代研究表明,灵芝中含有较多的功效成分,包括多糖类、三萜类、核苷类、幽醇类、生物碱类、吠喃衍生物、氨基酸多肽类、微量元素、脂肪酸等物质[2-6]。而灵芝三萜则是灵芝中主要的生物活性成分[7]。灵芝三萜具有保肝、抗肿瘤、抗HIV-Ⅰ、HIV-Ⅱ病毒酶活性、抑制组胺释放、抑制胆固醇合成[8-12]等生物活性,因此灵芝三萜的生产研究具有重要的意义[13]。
目前研究表明,茉莉酸甲酯、苯巴比妥、阿司匹林、铜离子和钙离子都能够诱导灵芝三萜合成[14]。但是灵芝产品作为一种食品,必须考虑其安全性和经济性。而油酸作为一种单不饱和脂肪酸,存在于动植物体内,具有食用安全性[15],不仅可以诱导灵芝三萜合成,而且价格低廉,是一个良好的选择[16]。本研究在添加油酸诱导灵芝三萜产生的前提下,优化发酵条件,大幅提高灵芝三萜产量,有利于高产三萜灵芝菌丝的工业化生产。
本文对油酸促进灵芝菌丝体高产灵芝三萜发酵条件进行了优化,实验进行了碳源、氮源等单因素的筛选,利用central composite design(CCD)实验设计对培养基进行优化,以及对发酵条件单因素进行了优化。其中CCD实验设计的优点有:实验所得的信息量大且直观,适合于探索性的实验研究;所需要的实验次数与费用并不大,有较高的实验精度,不仅具有筛选作用还具有预测指导作用,在实验设计中更具优势。
1 材料与方法
1.1 材料与仪器
美国灵芝(赤芝) 由浙江大学农业与生物技术学院陈再鸣教授馈赠;葡萄糖、磷酸二氢钾、无水硫酸镁、维生素B1、琼脂、蔗糖、乳糖、可溶性淀粉、牛肉浸膏、酵母浸出粉、冰醋酸、高氯酸、氢氧化钠 均为分析纯,国药集团化学试剂有限公司;香草醛 Sigma-Aldrich,USA;鱼蛋白胨 江苏南通东海龙生生物制品有限公司;牛骨蛋白胨 生工生物工程(上海)股份有限公司;齐墩果酸(purity≥98%) 阿拉丁试剂(上海)有限公司;斜面培养基 PDA 4.5%,琼脂1.7%,KH2PO40.3%,MgSO40.15%,VB10.005%(m/v);种子培养基:PDB 3.5%,蛋白胨0.5%,酵母浸出粉0.3%,KH2PO40.3%,MgSO40.15%,VB10.005%(m/v),pH5.5。
MULTISKAN GO新一代全波长酶标仪 Thermo,USA;JY96-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;离心机DD-5M 湘仪离心机仪器有限公司;超声波清洗器JP-040S 深圳市洁盟清洗设备有限公司;全温度恒温摇床ZHWY-2102 上海智城分析仪器制造有限公司;超净工作台SW-CJ-1D 苏州苏洁净化设备公司。
1.2 实验方法
1.2.1 菌种培养 取经试管斜面培养的菌株,挑取4~5块1cm2菌丝块接种到种子培养基中,种子培养基装在容量为250 mL的锥形瓶中,每瓶内装100 mL,置28 ℃摇床,180 r/min振荡培养8 d[17],供实验作种子用[18]。然后按10%(v/v)接种量将种子液接种到发酵培养基中(装液量同种子培养基),并在发酵初期添加一定体积分数的油酸,于28 ℃,180 r/min培养6 d。
1.2.2 菌丝生物量(Mycelia Biomass)的测定 将菌株按照上述培养方法进行发酵培养,发酵6 d后,取适量菌丝加水混匀后进行抽滤,分离菌丝体和发酵液,再将获得的菌丝体于60 ℃干燥至恒重,计算各菌株的生物量(以菌丝体干重g/100 mL发酵液计)[19]。
1.2.3 灵芝菌株液体发酵过程中胞内三萜(Intracellular Triterpenoids IT)产量的测定 采用超声波提取方法:将灵芝菌丝用95%(v/v)乙醇清洗,去除上面附着的油酸,离心,收集菌丝,取适量菌丝按1 g/50 mL加入95%(v/v)乙醇并用细胞破碎仪破碎4 min,再置于超声波清洗机中,60 ℃,400 W下提取1 h,并重复一次,合并上清液,定容后待测[20]。其三萜含量采用香草醛-高氯酸方法测定。
三萜产量(mg/100 mL)=每克菌丝胞内三萜含量(mg/g)×菌丝生物量(g/100 mL)
(1)
香草醛-高氯酸测定方法:取待测样品溶液或样品稀释液0.1 mL于试管中,70℃加热挥干溶剂,再加入5%(m/v)香草醛冰醋酸溶液0.2 mL,高氯酸0.5 mL,混匀后于60℃水浴中保温20 min,取出后置于冷水中10 min,最后加入冰醋酸5 mL,于550 nm下测定吸光值[21]。
1.2.4 灵芝液体发酵培养基的优化 以三萜产量为主要指标,菌丝生物量为次要指标,对灵芝液体发酵培养基进行优化。
1.2.4.1 碳源及碳源浓度筛选 首先进行单因素筛选。本文选取了葡萄糖,蔗糖,麦芽汁,玉米粉,乳糖,可溶性淀粉6个碳源进行筛选,筛选时保持其余条件不变,分别为鱼蛋白胨0.5%、KH2PO40.3%、MgSO40.15%、VB1 0.005%(m/v),pH5.5,在发酵培养第0 d加油酸3%(v/v);装液量为100 mL/250 mL,接种量为10%(v/v),发酵天数为6 d。选出最优碳源后进行浓度筛选,分别选取碳源浓度为1%、2%、3%、4%、5%、6%、7%进行筛选,得出最优碳源浓度。
1.2.4.2 氮源及氮源浓度筛选 本文选取了豆粕汁,牛肉膏,酵母粉,麸皮汁,鱼蛋白胨,牛骨蛋白胨6个氮源进行筛选,筛选时保持其余条件不变,分别为葡萄糖2%、KH2PO40.3%、MgSO4 0.15%、VB1 0.005%(m/v),pH5.5,在发酵培养第0 d加油酸3%(v/v);装液量为100 mL/250 mL,接种量为10%(v/v),发酵天数为6d。选出最优氮源后进行氮源浓度后进行浓度筛选,分别选取氮源浓度为0.5%、1%、1.5%、2%、2.5%、3%、3.5%进行筛选,得出最优氮源浓度。
1.2.4.3 最适pH筛选 再进行最适pH的筛选。本文选取了4.5、5、5.5、6、6.5、7、7.5这7个不同的pH进行筛选,筛选时碳源、氮源为之前筛选出的最优值,其余条件不变。
1.2.4.4 油酸添加量与添加时间筛选 为了确定灵芝液体发酵过程中油酸最佳的添加时间与添加量,选取3个不同的添加时间:接种当天(即发酵第0 d),发酵第1 d,发酵第2 d,选取5种不同体积分数(1%、2%、3%、4%、5%),同时进行不添加油酸的对照实验,来筛选油酸最佳的添加时间与添加量。筛选时碳源、氮源、pH为之前筛选出的最优值,其余条件不变。
1.2.4.5 响应面法优化灵芝液体发酵培养基 再采用CCD实验设计优化灵芝液体发酵培养基,根据单因素实验结果确定各变量的最低、最高水平,CCD实验设计因素水平表如表1所示。
1.2.5 灵芝液体发酵条件的筛选
1.2.5.1 装液量(通气量)的筛选 本文选取了50、75、100、125、150 mL 5个不同的装液量(通气量)进行筛选,筛选时培养基配方为1.2.4得出的最优配方,接种量为10%(v/v),发酵天数为6 d,各条件保持不变。
1.2.5.2 接种量的筛选 本文选取了5%、7.5%、10%、12.5%、15% 5个不同的接种量进行筛选,筛选时培养基配方同上,装液量(通气量)为之前选出的最优值,发酵天数为6 d,各条件均保持不变。
1.2.5.3 发酵天数的筛选 本文对灵芝接种后发酵12 d过程中三萜产量与生物量变化进行检测,得出其变化曲线,从而筛选出灵芝发酵最优时间。
1.3 数据处理
使用Origin和Design Expert软件处理数据并进行误差分析。
2 结果与讨论
2.1 灵芝液体发酵培养基的优化
2.1.1 碳源及碳源浓度的筛选 本文选取了葡萄糖、蔗糖、麦芽汁、玉米粉、乳糖、可溶性淀粉作为碳源。由图1可知,当碳源为可溶性淀粉时,灵芝液体发酵所得胞内三萜产量最高,而当麦芽汁作为碳源时,灵芝发酵所得生物量最高,但与可溶性淀粉相比,无明显差异。由于胞内三萜产量为所需要的主要活性物质,其产量的高低直接影响灵芝菌丝的质量,因此,选取可溶性淀粉为灵芝液体发酵的碳源,胞内三萜产量可达到(141.45±3.02) mg/100 mL。
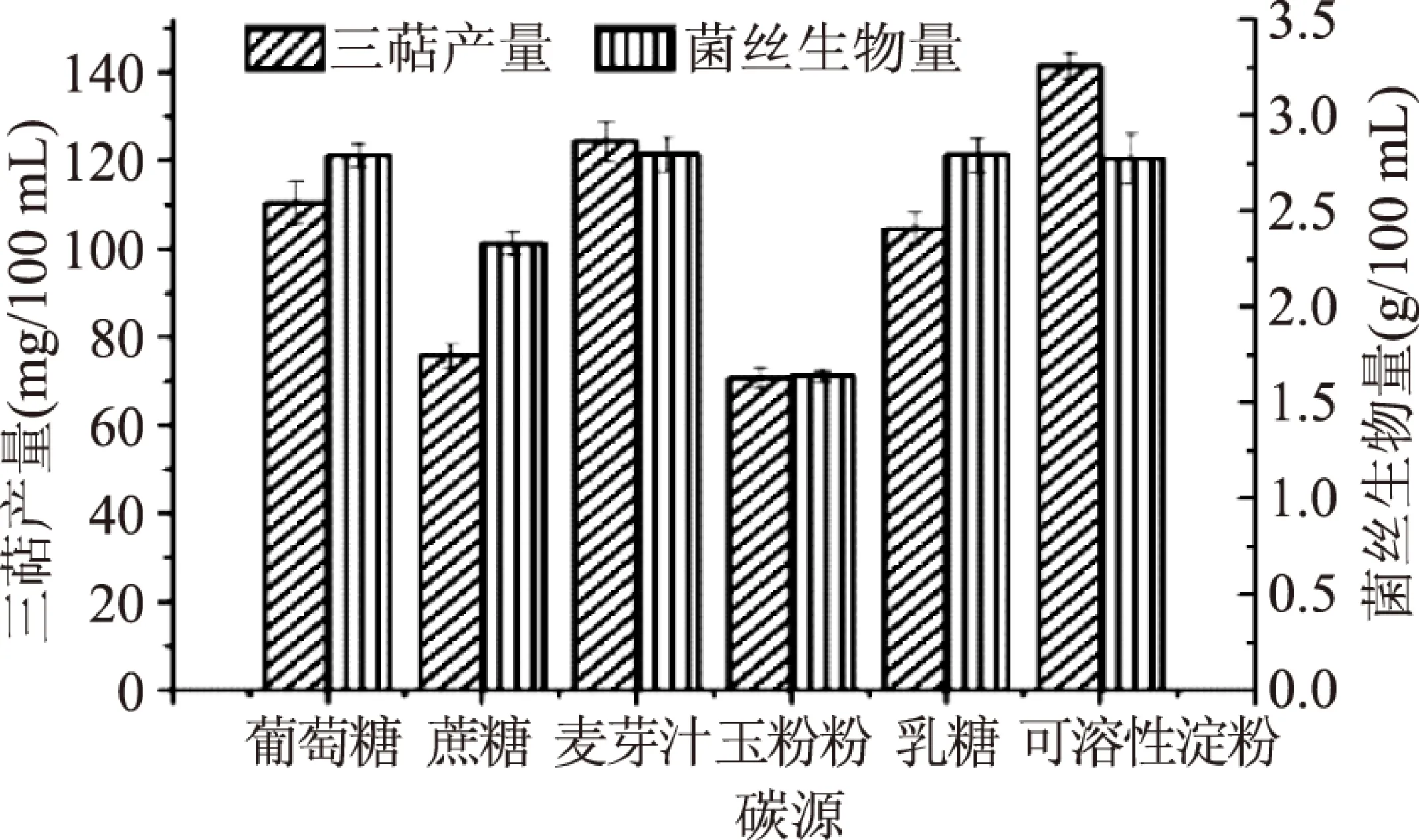
图1 最适碳源筛选Fig.1 Optimum carbon sourc screening
由图2可知,随着可溶性淀粉质量浓度的增加,胞内三萜产量有所提高,当可溶性淀粉浓度为4%(m/v)时,胞内三萜产量达到最高,但当可溶性淀粉浓度为5%(m/v)时,胞内三萜产量下降。所以选取4%(m/v)可溶性淀粉作为碳源浓度,胞内三萜产量可达到(173.16±3.92) mg/100 mL。

图2 碳源浓度筛选Fig.2 Carbon source concentration screening
2.1.2 氮源及氮源浓度筛选 本文选取了豆粕汁、牛肉膏、酵母粉、麸皮汁、鱼蛋白胨、牛骨蛋白胨(作为氮源。由图3可知,当氮源为鱼蛋白胨时,灵芝液体发酵所得胞内三萜产量最高,而当麸皮汁作为氮源时,灵芝发酵所得生物量最高。因所需的主要活性物质为胞内三萜,所以选取鱼蛋白胨为灵芝液体发酵的氮源,胞内三萜产量可达到(126.92±2.42) mg/100 mL。
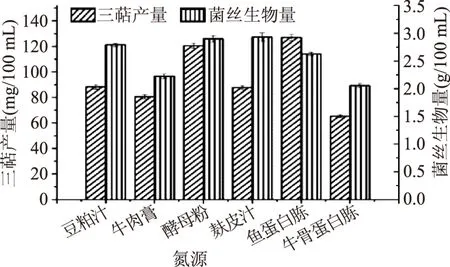
图3 最适氮源筛选Fig.3 Optimum nitrogen source screening
由图4可得,随着鱼蛋白胨质量浓度的增加,胞内三萜产量有所提高,当鱼蛋白胨浓度为1%(m/v)时,胞内三萜产量达到最高,可达(195.88±2.17) mg/100 mL,但当鱼蛋白胨浓度为1.5%(m/v)时,胞内三萜产量下降。当鱼蛋白胨浓度为1.5%(m/v)时,菌丝生物量达到最高。因所需的主要活性物质为胞内三萜,所以选取1%(m/v)鱼蛋白胨作为氮源浓度,胞内三萜产量可达到(195.88±2.17) mg/100 mL。

图4 氮源浓度筛选Fig.4 Nitrogen source concentration screening
2.1.3 最适pH的筛选 由图5可知,当发酵培养基的pH为5.5时,胞内三萜产量达到最高,而当pH增大或是减小时,胞内三萜产量降低。当pH为5时,菌丝生物量达到最高。因所需的主要活性物质为胞内三萜,所以选取5.5为灵芝液体发酵培养基的pH,胞内三萜产量可达到(206.35±2.85) mg/100 mL。
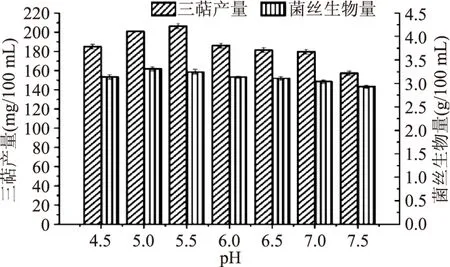
图5 最适pH筛选Fig.5 Optimum pH screening
2.1.4 油酸添加量与添加时间的筛选 由图6可得,添加油酸后灵芝三萜产量大幅度提高,其中发酵培养第0 d添加油酸最具优势,胞内三萜产量与菌丝生物量均高于第1、2 d,因此,选取发酵培养第0 d为油酸添加时间。而随着油酸添加量的增加,胞内三萜产量有所提高,当第0 d油酸添加量为4%(v/v)时,胞内三萜产量达到最高,但当油酸添加量继续增加时,胞内三萜产量下降。菌丝生物量随油酸添加量的增加而增加。因所需的主要活性物质为胞内三萜,选取4%(v/v)作为油酸添加量,胞内三萜产量达到(210.52±2.62) mg/100 mL。
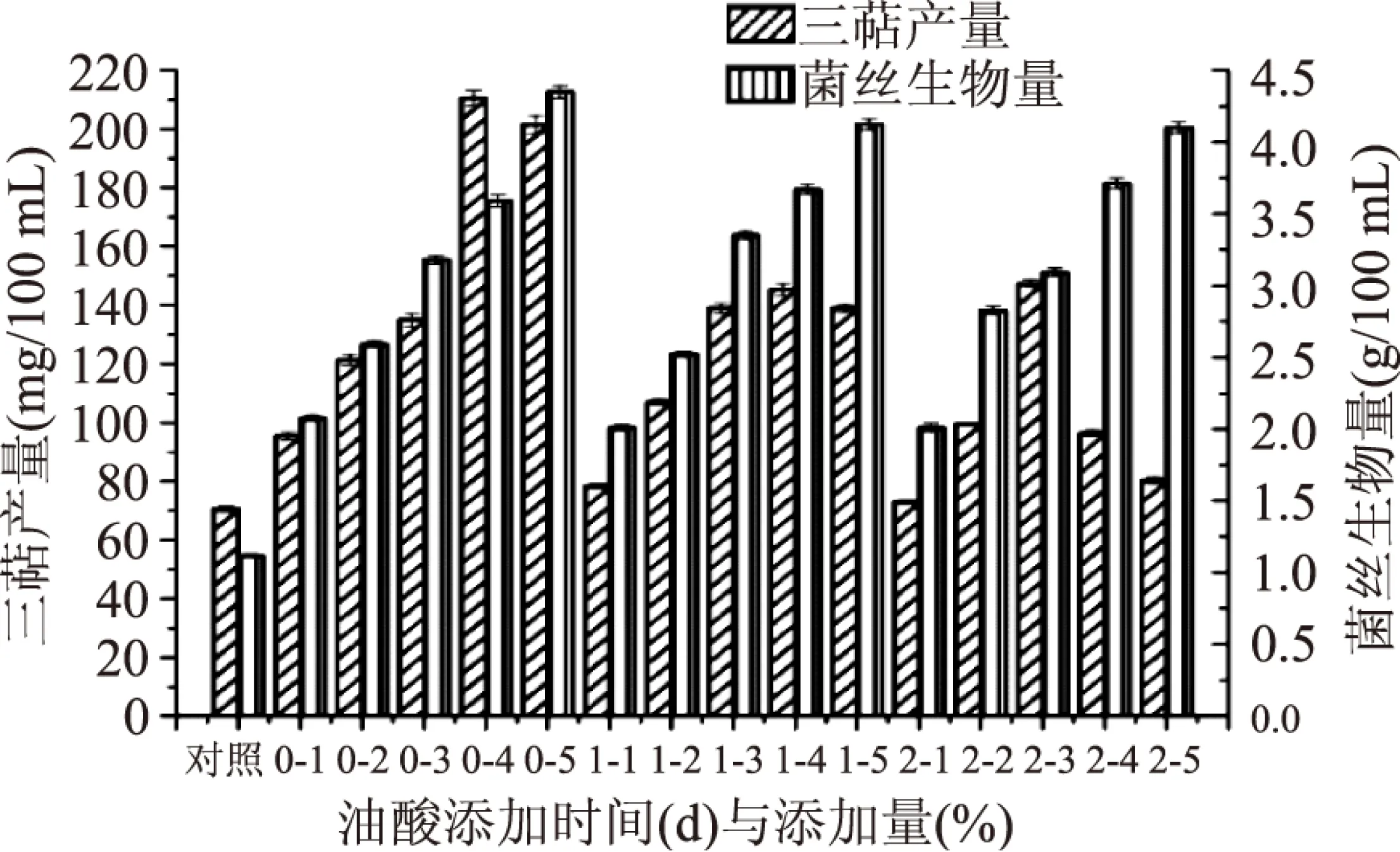
图6 最适油酸添加量与添加时间的筛选Fig.6 Oleic acid concentration and adding time screening
2.1.5 响应面法优化灵芝液体发酵培养基 采用CCD实验设计优化灵芝液体发酵培养基,CCD实验设计及结果见表2,方差分析结果见表3。

表2 CCD实验设计及结果
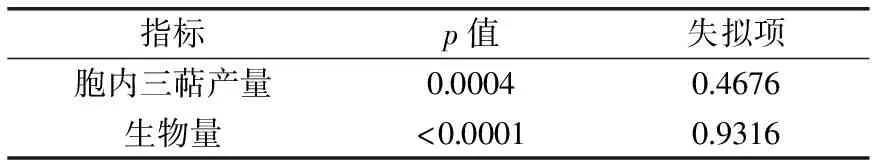
表3 方差分析表
由表3可知,对于胞内三萜产量,模型项p值为0.0004≤0.01,显著,失拟项p值为0.4676≥0.05,不显著;对于菌丝生物量,模型项p值<0.0001,显著,失拟项值为0.9316≥0.05,不显著;两者均表明回归方程关系显著,且方程与实际拟合中非正常误差所占比例小,实验设计能够很好的反映实验优化。胞内三萜产量(Y1)与菌丝生物量(Y2)的多项式回归方程如下:
Y1=211.30-11.60A-15.67B+6.82C+3.73AB-19.18AC-3.45BC-17.39A2-17.00B2-26.95C2
Y2=4.43+0.099A-0.042B+0.63C-0.058AB-4.500E-0.03AC-0.052BC+2.238E-0.04A2-0.13B2-0.045C2
固定其中一个变量,研究其他2个变量的交互作用对各响应值的影响。可溶性淀粉与鱼蛋白胨、鱼蛋白胨与油酸添加量的交互作用对胞内三萜的产量影响并不显著。可溶性淀粉与油酸添加量的交互作用影响较为显著,其对胞内三萜产量影响的曲面图如图7所示。由图7可知,随着可溶性淀粉浓度和油酸添加量的增加,胞内三萜产量会先随之增加,再随之降低。3个变量两两之间的交互作用对菌丝生物量的影响并不显著。
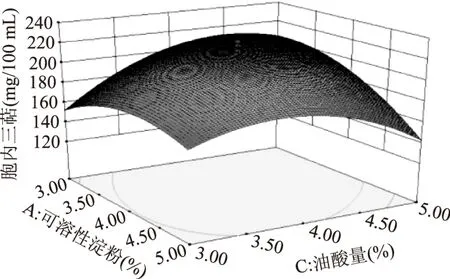
图7 可溶性淀粉与油酸交互作用对IT产量的影响Fig.7 The contour(a)and surface(b)plots of the combined effects of soluble starch and oleic acid on the IT production
实验模型预测:当以重量百分数计,可溶性淀粉浓度为3.40%(m/v),鱼蛋白胨浓度为0.72%(m/v),油酸添加量为4.38%(v/v)时,胞内三萜产量可达到220.502 mg/100 mL。将预测结果进行验证实验(3次重复),所得胞内三萜产量为(223.73±2.17) mg/100 mL,与预测值接近,表明该模型对于优化灵芝发酵培养基具有可行性。因此,最优培养基条件为可溶性淀粉3.4%、鱼蛋白胨0.72%、KH2PO40.3%、MgSO40.15%、VB10.005%(m/v),pH5.5,并在发酵培养第0 d添加4.38%(v/v)的油酸。
2.2 灵芝液体发酵条件的筛选
2.2.1 装液量(通气量)的筛选 由图8可得,随着装液量的增加,胞内三萜产量随之增加,当装液量为100 mL时,胞内三萜产量达到最高,但当装液量继续增加时,胞内三萜产量下降。菌丝生物量随装液量的增加而降低。因所需的主要活性物质为胞内三萜,所以选取装液量为100 mL,胞内三萜产量可达(225.21±2.23) mg/100 mL。
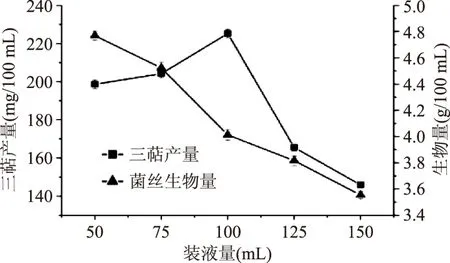
图8 装液量(通气量)筛选Fig.8 Liquid loading screening
2.2.2 接种量的筛选 由图9可知,当接种量从5%(v/v)增加到10%(v/v)时,胞内三萜产量随接种的增加而增加,而当接种量从10%(v/v)增加到15%(v/v)时,胞内三萜产量趋于平稳并略有下降。菌丝生物量在接种量为7.5%(v/v)时达到最大。综合考虑,选取得接种量为10%(v/v),胞内三萜产量可达(241.01±2.42) mg/100 mL。

图9 接种量的筛选Fig.9 Inoculum concentration screening
2.2.3 发酵天数的筛选 由图10可知,随着发酵天数的增加,各指标均随之增加。胞内三萜产量在发酵9 d时达到最高,可达(287.67±3.77) mg/100 mL,此时菌丝生物量达到(4.755±0.041) g/100 mL;而菌丝生物量在发酵10 d时达到最大,为(4.93±0.043) g/100 mL,其胞内三萜产量达到(282.75±3.76) mg/100 mL。综合考虑,选择发酵时间为9 d。
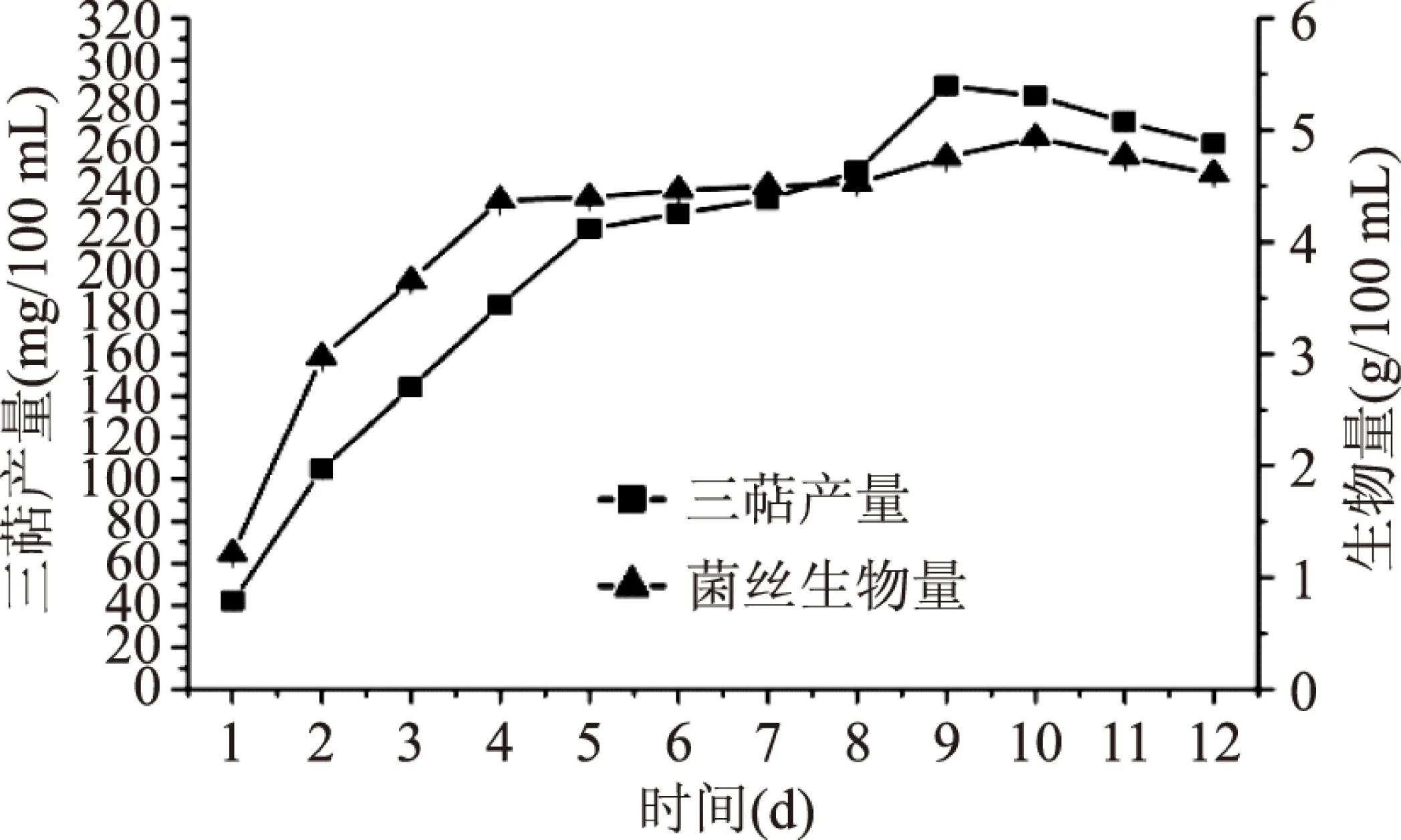
图10 发酵天数的筛选Fig.10 Fermentation time screening
3 结论
通过以上的筛选优化,得到油酸促进灵芝菌丝体高产三萜的最优发酵条件:培养基成分为可溶性淀粉3.4%、鱼蛋白胨0.72%、KH2PO40.3%、MgSO40.15%、VB10.005%(m/v),pH5.5,并在发酵培养第0 d添加4.38%(v/v)的油酸;装液量为100 mL/250 mL,接种量为10%(v/v),发酵天数为9 d。在此条件下,灵芝菌丝体胞内三萜产量可达282.75 mg/100 mL,而不添加油酸时胞内三萜产量一般只能达到90~100 mg/100 mL[17]。该发酵条件可大幅度提高灵芝菌丝中灵芝三萜的产量,提高生产效率,有利于高产三萜灵芝菌丝的工业化生产。由于现今对灵芝三萜的生物合成途径研究较少,油酸是如何诱导灵芝三萜合成这一关键点无从得知。所以,下一步将研究油酸是如何影响灵芝三萜的代谢途径从而达到促进其产量的提高的效果,根据探索出的作用机制改进灵芝三萜合成的代谢途径,从而获得灵芝三萜的高产。
[1]方庆华. 灵芝真菌发酵生产灵芝酸和灵芝多糖的研究[D].上海:华东理工大学,2000.
[2]TANG Y J,J J ZHONG. Modeling the kinetics of cell growth and ganoderic acid production in liquid static cultures of the medicinal mushroom Ganoderma lucidum[J]. Biochemical Engineering Journal,2004,21(3):259-264.
[3]WANG X M,M YANG,S H GUAN,et al. Quantitative determination of six major triterpenoids in Ganoderma lucidum and related species by high performance liquid chromatography[J]. J Pharm Biomed Anal,2006,41(3):838-844.
[4]QIAO Y,X M ZHANG,M H QIU. Two novel lanostane triterpenoids from ganoderma sinense[J]. Molecules,2007,12(8):2038-2046.
[5]KEYPOUR S,H RAFATI,H RIAHI,et al. Qualitative analysis of ganoderic acids in Ganoderma lucidum from Iran and China by RP-HPLC and electrospray ionisation-mass spectrometry(ESI-MS)[J]. Food Chemistry,2010,119(4):1704-1708.
[6]林志彬. 灵芝的现代研究[M]. 北京:北京大学医学出版社,2015:14-29.
[7]余素萍. 灵芝深层发酵生产生物活性物质的研究[D]. 南京:南京农业大学,2004.
[8]Kim H M,S Y Paik,K S Ra,et al. Enhanced production of exopolysaccharides by fed-batch culture of Ganoderma resinaceum DG-6556[J]. Journal of Microbiology,2006,44(2):233-242.
[9]ZHAO W,J W XU,J J ZHONG. Enhanced production of ganoderic acids in static liquid culture of Ganoderma lucidum under nitrogen-limiting conditions[J]. Bioresour Technol,2011,102(17):8185-8190.
[10]KANG D,M MUTAKIN,J LEVITA. Computational Study of Triterpenoids of Ganoderma lucidum with Aspartic Protease Enzymes for Discovering HIV-1 and Plasmepsin Inhibitors[J]. International Journal of Chemistry,2015,7(1):61-62.
[11]TRAN H B,A YAMAMOTO,S MATSUMOTO,et al. Hypotensive Effects and Angiotensin-Converting Enzyme Inhibitory Peptides of Reishi(Ganoderma lingzhi)Auto-Digested Extract[J]. Molecules,2014,19(9):13473-13485.
[12]Fang X,Shi L,Ren A,et al. The cloning,characterization and functional analysis of a gene encoding an acetyl-CoA acetyltransferase involved in triterpene biosynthesis in Ganoderma lucidum[J]. Mycoscience,2013,54(2):100-105.
[13]徐晓兰. 灵芝三萜和金银花绿原酸生物合成途径关键酶基因的挖掘及分析[D]. 北京:北京协和医学院,2013.
[14]任昂. 茉莉酸甲酯对灵芝三萜生物合成的影响及其灵芝应答基因的差异表达研究[D]. 南京:南京农业大学,2012.
[15]刘真,卢义和,宫素芝,等. 我国油酸的生产现状及展望[J]. 河北化工,2006(9):18-20.
[16]冯杰,张劲松,杨焱,等. 一种提高灵芝液体深层发酵菌丝体中灵芝三萜含量的方法:中国,CN104017852A[P]. 2014-09-03.
[17]崔美林. 高产三萜灵芝菌株液体发酵及生物转化大豆异黄酮的研究[D]. 杭州:浙江大学,2015.
[18]高建莉,禹志领,李绍平,等. 灵芝三萜类成分研究进展[J]. 中国食用菌,2005,4:6-11.
[19]许海燕,侯敏娜,刘剑. 灵芝总三萜提取工艺研究[J]. 陕西中医学院学报,2007,30(3):43-44.
[20]CUI Meilin,HE Guoqing. Optimization of the Submerged Fermentation Conditions of Ganoderma lucidum with High Triterpenoids Production by Response Surface Analysis[J]. Advanced Materials Research,2012,621:259-262.
[21]AHMAD M F,B P PANDA,Z A A AZAD. Simultaneous Bioprospecting of Ganoderma lucidum OE 52 with Ganoderic Acid B and C2 by Submerged Fermentation Process[J]. Advanced Science Focus,2013,1(3):258-261.
Optimization ofGanodermalucidummycelium’s fermentation conditions with high triterpenoids production based on oleic acid induce
SUN Bing-qin1,QIN Ke-xin2,WANG Gui-rong3,HE Guo-qing1,*
(1.College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China; 2.Food Science and Engineering College,Harbin University of Commerce,Harbin 150076,China; 3.Seed Field of Hangzhou,Hangzhou 310058)
We optimize theGanodermalucidummycelium’s fermentation conditions of high triterpenoids production with adding oleic acid,to induce the synthesis of triterpenoids and boost production,which has special biological activity and beneficial to the human body.In this research,we screened the single factors such as carbon source and nitrogen source,and the optimization of the culture medium was optimized by CCD experiment,we also screened the single factors of fermentation conditions. This research shows that the optimal results is:soluble starch 3.4%,fish peptone 0.72%,KH2PO40.3%,MgSO40.15%,VB10.005%(m/v),pH5.5,and adding 4.38%(v/v)of oleic acid at the first day of the fermentation. The liquid loading is 100 mL,the inoculation concentration is 10%(v/v),and the fermentation time is 9 d. And the production of triterpenoids was up to(282.75±3.76)mg/100 mL. This method not only induce the synthesis of triterpenoids and boost production,but also has important significance for the industrial production ofGanodermalucidum.
Ganodermalucidummycelia;triterpenoids;fermentation conditions;response surface
2016-06-15
孙冰沁(1991-),女,硕士,研究方向:食品微生物,E-mail:sbqyjyjv@sina.cn。
*通讯作者:何国庆(1957-),男,博士,教授,研究方向:食品生物技术及发酵工程,E-mail:gqhe@zju.edu.cn。
TS201.3
A
1002-0306(2016)24-0000-00
10.13386/j.issn1002-0306.2016.24.000

