生物转化制备红参Rh1皂苷组及成分分析
王 肖 冰, 刘 春 莹, 王 上, 鱼 红 闪, 金 凤 燮
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
生物转化制备红参Rh1皂苷组及成分分析
王 肖 冰,刘 春 莹,王 上,鱼 红 闪,金 凤 燮
( 大连工业大学 生物工程学院, 辽宁 大连116034 )
摘要:利用TLC和超高效液相色谱-质谱(UPLC-MS)分析已制备的Rh1组异构体,利用HPLC分析其异构体的质量比。Rh1组在TLC图谱中显2个斑点,经UPLC-MS的分析,确认红参皂苷Rh1组含有4种异构体,分别是20(S)-Rh1、20(R)-Rh1、Rk3和Rh4;高效液相色谱检测结果表明红参皂苷Rh1组中4种异构体20(S)-Rh1、20(R)-Rh1、Rk3、Rh4的质量比为25.0∶18.8∶15.5∶40.7,4种异构体总质量分数在90%以上。
关键词:红参皂苷Rh1组;异构体;高效液相色谱;高效液相色谱-质谱联用

0引言
人参为五加科多年生植物的干燥块根和茎,其根茎均可入药[1]。人参皂苷Rh1组由20(S)-Rh1、20(R)-Rh1、Rk3、Rh4等4种异构体所组成,且Rh1组皂苷由于4种异构体的协同作用,活性远高于Rh1单体[2]。Rh1具有抗肿瘤、抑制癌细胞的作用[3-4],可诱导癌细胞的分化逆转[5],有抑制体外培养人胃癌细胞生长速度和分裂能力的作用[6]。人参皂苷Rh1组还有很强的保护肝细胞、保护脑神经细胞、防止老年痴呆、增强机体对病毒的抵抗力等疗效[7-9]。
生晒人参中,80%以上的人参皂苷为20(S)的Rb1、Rb2、Rb3、Rc、Re、Rg1[10],这些皂苷活性低、吸收率低,总皂苷平均吸收率只有5%[11-12]。但是红参稀有皂苷Rg3、Rh2、Rg2、Rh1,Rg5和Rk1,Rh3和Rk2,Rg4(F4)和Rg6,Rh4和Rk3吸收率高,具有很好的生理功能[13-14]。
红参加工过程中,在人参自身的酶、其他物质的作用下,主要人参皂苷为20(S)的Rb1、Rb2、Rb3、Rc、Re、Rg1的20(S)-O-R2的糖基水解,生成20(S)-OH和20(R)-OH的Rg3、Rh2、Rg2、Rh1、Rs3皂苷的两种异构体[15];20(S)-OH和20(R)-OH 的皂苷进一步脱水形成反式、顺式异构体Rg5和Rk1、Rh3和Rk2、Rg4(F4)和Rg6、Rh4和Rk3、Rs4和Rs5[16];但是Rs皂苷失掉有机酸基,稳定的红参皂苷共16种,可分为4种异构体的Rg3组、Rg2组、Rh2组、Rh1组[17];这些红参皂苷群在传统红参中的含量很低,而且Rg3组、Rg2组、Rh2组、Rh1组的16种皂苷交织在一起,无法从红参中分离提取红参皂苷[18]。
为此,本实验室田桐等[19]研究了Rg3组的制备和分离;刘飞等[20]研究了生物转化制备Rg2组;何丹[21]研究了F2制备并由F2制备Rh2组。本实验主要研究了生物转化制备的Rh1组成分。
1试验
1.1材料与仪器
人参皂苷20(S)-Rh1、20(R)-Rh1、Rk3和Rh4混合物标准品,由本实验室提供;红参皂苷Rh1组,本实验室制备。
薄层层析板Silica gel 60-F254,德国Merck公司;高效液相色谱仪,美国Waters公司;超高效液相色谱质谱联用仪,美国Waters公司。
1.2试验方法
1.2.1薄层层析法(TLC)
用刻度毛细管吸取标准品及样品,点样于薄层层析板上。展开剂配比按氯仿-甲醇-水体积比7∶2.5∶0.5,10%硫酸加热显色。
1.2.2超高效液相色谱-质谱(UPLC-MS)
色谱柱,BEH shield RP18(2.1 mm×100 mm,1.7 μm)。流动相为0.1%甲酸-乙腈(A)与0.1% 甲酸-水(B)混合物。梯度洗脱:0~5 min,5%~95% A线性梯度;5~10 min,95% A等度。进样量,10 μL;体积流量,0.5 mL/min;柱温,30 ℃;检测波长,203 nm。
毛细管电压,2.5 kV;样品孔电压,35 V;离子源温度,100 ℃,脱溶剂气温度,350 ℃;锥孔气体积流量,50 L/h,脱溶剂气体积流量,1 000 L/h;质量扫描范围,100~1 000 Da。
1.2.3高效液相色谱法
Waters 2996二极管阵列检测器及Empower色谱工作站;Knauer C18色谱柱(5 μm,250 mm×3 mm);样品进样量,10 μL;柱温,35 ℃;体积流量,0.6 mL/min;检测波长,203 nm;乙腈(A)-水(B)梯度洗脱:0~20 min,20% A等度;20~31 min,20%~32% A线性梯度;31~40 min,32%~43% A线性梯度;40~70 min,43%~100% A线性梯度。
2结果与讨论
2.1Rh1组的薄层层析(TLC)检测结果
利用薄层层析法(TLC)初步分析红参皂苷Rh1组异构体组成,结果如图1所示。从图1中可以看到,Rh1组有2个斑点,上斑点可能为Rk3和Rh4重叠,显示为一个斑点;下斑点可能为20(S)-Rh1和20(R)-Rh1重叠,显示为一个斑点。TLC检测结果初步证明,Rh1组产品中可能含有4种异构体20(S)-Rh1、20(R)-Rh1、Rk3和Rh4。

1,Rg1;2,Rh1标准品;3,Rk3、Rh4混合物标准品;
2.2超高效液相色谱-质谱(UPLC-MS)分析Rh1组分
采用超高效液相色谱法对Rh1组人参稀有皂苷进行检测,结果如图2所示。从图2中可以看出,Rh1组有4个明显的紫外吸收峰,其保留时间依次为2.92,2.98,3.64,3.71 min,与人参稀有皂苷20(S)-Rh1、20(R)-Rh1、Rk3和Rh4标准品的UPLC谱图一致,说明Rh1组产品中含有这4种人参皂苷成分。
采用串联质谱法对Rh1组的4种人参皂苷的相对分子质量进行测定。在负离子模式下,串联质谱(Q/TOF)检测得到Rh1组样品的总离子流图,如图3所示。从图3中可以看出,Rh1组中4种人参皂苷在总离子流图中的保留时间依次为2.95,3.02,3.68,3.74 min,与UPLC图中各组分的保留时间相符。
再通过对总离子流峰进行一级质谱分析,确定Rh1组样品中各物质的相对分子质量。首先对ESI-模式下的Rh1组中保留时间为2.95和3.02 min 的人参稀有皂苷的离子峰进行一级质谱分析,如图4所示。

图3 ESI-模式下Rh1组样品总离子流图谱


(a) 20(S)-Rh1

(b) 20(R)-Rh1
图420(S)-Rh1和20(R)-Rh1在ESI-模式下的一级质谱图
Fig.4Thechromatogramoflevel1of20(S)-Rh1and20(R)-Rh1inESI-mode
从图4可以看出,这2种人参稀有皂苷在ESI-模式下通过Q/TOF均得到离子峰m/z=683。该离子峰为[Rh1+HCOOH]-离子峰,而负离子模式下又减少一个H;因此,这2种物质的相对分子质量均为638,与人参稀有皂苷20(S)-Rh1和20(R)-Rh1的相对分子质量相同。由此证明,Rh1组中含有人参稀有皂苷20(S)-Rh1和20(R)-Rh1。
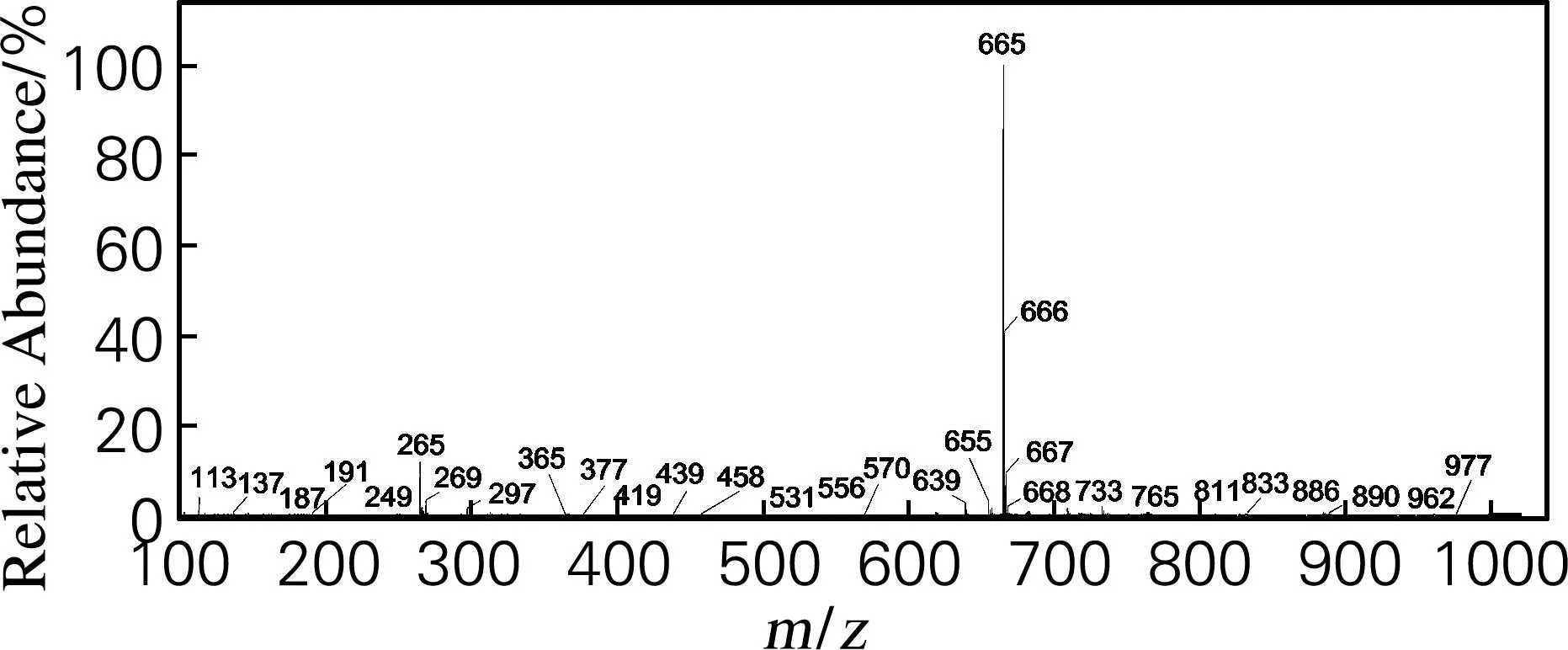
再对ESI-模式下的Rh1组人参稀有皂苷中保留时间为3.68和3.74min的离子峰进行一级质谱分析,如图5所示。
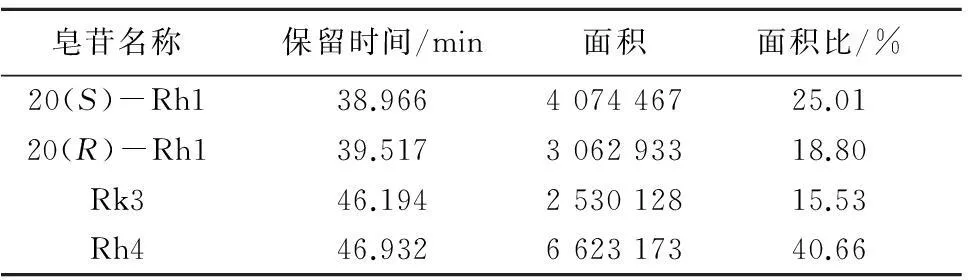
皂苷名称保留时间/min面积面积比/%20(S)-Rh138.966407446725.0120(R)-Rh139.517306293318.80Rk346.194253012815.53Rh446.932662317340.66
(a) Rk3

(b) Rh4
图5Rk3、Rh4在ESI-模式下的一级质谱图
Fig.5Chromatogram of level 1 of Rk3 and Rh4 in
ESI-mode
从图5可以看出,这2种人参稀有皂苷在ESI-模式下通过Q/TOF均得到离子峰m/z=665。该离子峰为[Rk3+HCOOH]-离子峰,而负离子模式下又减少一个H;因此,这2种物质的相对分子质量均为620。与人参稀有皂苷Rk3和Rh4相对分子质量相同。由此证明,Rh1组样品中含有人参稀有皂苷Rk3和Rh4。
由图4和5可知,Rh1组中含有预测的4种人参稀有皂苷异构体20(S)-Rh1、20(R)-Rh1、Rk3、Rh4。
2.3高效液相色谱分析Rh1组分
利用HPLC确定Rh1组中4种异构体或质量比,结果如图6所示。

图6 红参皂苷Rh1组的HPLC检测图谱
从图6中可以看出,Rh1组中有4种人参皂苷,通过与标准品的保留时间对照,可初步判断Rh1组中含有人参皂苷20(S)-Rh1、20(R)-Rh1、Rk3、Rh4;保留时间依次为38.966,39.517,46.194,46.932 min;4种异构的总质量分数在90%以上,具体数据见表1。
表1 Rh1组HPLC图的数据分析
Tab.1 Data analysis of Rh1 group in HPLC

从图6、表1中可以看出,Rh1组中含有4种人参皂苷20(S)-Rh1、20(R)-Rh1、Rk3、Rh4,质量比为25.0∶18.8∶15.5∶40.7。
3结论
红参皂苷Rh1组在TLC图谱中有2个斑点,推测上斑点可能为Rk3和Rh4皂苷的混合物,下斑点可能为20(S)-Rh1和20(R)-Rh1异构体的混合物;经UPLC-MS分析,进一步确认红参皂苷Rh1组含有4种异构体,分别是20(S)-Rh1、20(R)-Rh1、Rk3和Rk4;高效液相色谱检测结果表明,红参皂苷Rh1组中4种异构体20(S)-Rh1、20(R)-Rh1、Rk3、Rh4的质量比为25.0∶18.8∶15.5∶40.7,4种异构体总质量分数在90%以上。
参考文献:
[1] 金凤燮.天然产物生物转化[M].北京:化学工业出版社,2009:80-130.
[2] PARK E K, CHOO M K, HAN M J, et al. Ginsenoside Rh1 possesses antiallergic and anti-inflammatory activities[J]. International Archives of Allergy and Immunology, 2004, 133(2): 113-120.
[3] WANG Y, HAO Y, LOU J, et al. Effect of ginsenoside Rg1 and Rh1 on the anti-tumor activity of dendritic cell[J].中国病理生理杂志, 2004, 20(10): 1759-1764.
[4] 陈声武,王岩,王毅,等.人参皂苷Rg1和Rh1抗肿瘤作用的研究[J].吉林大学学报,2003,29(1):25-28.
[5] 杨世杰,张文杰,马兴元.西洋人参茎叶皂苷对培养大鼠心肌细胞动作电位的影响[J].白求恩医科大学学报,1992,18(2):126.
[6] 贾林森,王淑兰,李淑莲.人参茎叶皂苷对体外培养胃癌细胞的影响[J].白求恩医科大学学报,1992,18(1):27.
[7] 沈思钰,干振华,付晓东,等.人参皂苷对神经系统作用的研究现状及分析[J].安徽中医学院学报,2004,23(1):62-64.
[8] HASEGAWA H, MASTUMIYA S, UCHIYAMA M, et al. Inhibitory effect of some triterpenoid saponins on glucose transport in tumor cells and its application toinvitrocytotoxic and antiviral activities[J]. Planta Medica, 1994, 60(3): 240-243.
[9] 褚秀玲,苏建青,韦旭斌.人参皂苷免疫调节和抗病毒作用研究进展[J].中兽医医药杂志,2008(5):20-23.
[10] 窦德强,靳玲,陈杰英.人参的化学成分及药理活性的研究进展与展望[J].沈阳医科大学学报,1999,16(2):151-156.
[11] 刘春莹,宋建国,李鹏飞,等.3种人参中的皂苷的组成[J].大连工业大学学报,2011,30(2):79-82.
[12] KOBASHI K. Glycosides are natural prodrugs:evidence using germfree and gnotobiotic rats associated with a human intestinal bacterium[J]. Traditional Medicine, 1998, 15(1): 1-13.
[13] TAWAB M A, BAHR U, KARAS M, et al. Degradation of ginsenosides in humans after administration[J]. Drug Metab Dispos, 2003, 3(1): 1065-1071.
[14] 张南生,张秀华,李文峰.人参皂苷Rg3的研究进展[J].医药导报,2006,25(7):687-689.
[15] PARK I H, PIAO L Z, KWON S W, et al. Cytotoxic dammarane glycosides from processed ginseng[J]. Chemical and Pharmaceutical Bulletin, 2002, 50(4): 538-540.
[16] 杨博.人参三醇类皂苷生物转化的研究[D].大连:大连工业大学,2009:29-31.
[17] KO S R, CHOI K J, SUZUKI K, et al. Enzymatic preparation of ginsenosides Rg2, Rh1, and F1[J].Chemical and Pharmaceutical Bulletin, 2003, 51(4): 404-408.
[18] JIN F X, YU H S, FU Y, et al. Biotransformation of ginsenosides[J]. Journal of Pharmaceutical and Biomedical Science, 2012(6): 33-44.
[19] 田桐,宋建国,赵慕,等.人参皂苷Rg3与Rg5的分离及Rg3异构体的拆分[J].大连工业大学学报,2011,30(2):109-112.
[20] 刘飞,王东明,刘春莹,等.制备色谱技术对Rg2组的分离效果[J].大连工业大学学报,2013,32(5):313-315.
[21] 何丹.生物转化法制备人参皂苷F2的研究[D].大连:大连工业大学,2013:24-35.
Preparation and analysis of ginsenoside Rh1 products from biotransformation
WANGXiaobing,LIUChunying,WANGShang,YUHongshan,JINFengxie
( School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China )
Abstract:After analysis using TLC, UPLC-MS and HPLC, Rh1 group showed two bands in TLC plate, one of which might be a mixture of Rk3 and Rh4 saponins, and other of which might be a mixture of 20(S)-Rh1 and 20(R)-Rh1. UPLC-MS showed that the red ginseng ginsenoside Rh1 group contained four isomers such as 20(S)-Rh1, 20(R)-Rh1, Rk3 and Rk4, the mass fraction of which was 25.0∶18.8∶15.5∶40.7. The total mass fraction in the Rh1 products was more than 90%.
Key words:ginsenoside Rh1 group; isomers; HPLC; UPLC-MS
作者简介:王肖冰(1991-),女,硕士研究生;通信作者:金凤燮(1945-),男,教授.
基金项目:国家科技重大专项“新药研究开发关键技术研究”(2012ZX09503001-003).
收稿日期:2014-12-23.
中图分类号:TS201.2;Q284.2
文献标志码:A
文章编号:1674-1404(2016)01-0011-04

