阿魏酸钠对肝纤维化大鼠脂肪干细胞移植存活率及治疗作用的影响
岳冒易,刘广益,邹礼乐,韩艺,王巧稚
(四川医科大学基础医学院,四川泸州446000)
阿魏酸钠对肝纤维化大鼠脂肪干细胞移植存活率及治疗作用的影响
岳冒易,刘广益,邹礼乐,韩艺,王巧稚
(四川医科大学基础医学院,四川泸州446000)
摘要:目的观察阿魏酸钠对肝纤维化大鼠脂肪干细胞(ASCs)移植存活率及治疗作用的影响。方法选取小鼠50只,予CCl4腹腔注射8周制作肝纤维化模型,将造模成功的40只随机分为A、B、C、D组各10只。A组生理盐水灌胃并经尾静脉注射细胞培养基,B、D组予阿魏酸钠100 mg/kg灌胃1次/d,C、D组经尾静脉行绿色荧光蛋白标记的ASCs移植5×105/只,B、C组分别给予尾静脉注射细胞培养基、生理盐水灌胃,另取10只(E组)不造模且不做任何处理。4周后,检测血清肝功能指标,行Masson染色观察肝组织病理,免疫组化法检测肝组织中的转化生长因子β1(TGF-β1)、α肌动蛋白(α-SMA),荧光显微镜下计数肝组织内存活ASCs数量。结果 血清ALT、AST水平A组>B、C、D组>E组,ALB水平E组>A~D组、B组>A组,P均<0.05;A组胶原沉积最多,B、C组较多,D组次之,E组最少;肝组织TGF-β1和α-SMA表达量A组>B组>C组>D组>E组,P均<0.05;C、D组ASCs存活数量比较,P>0.05。结论ASCs移植联合阿魏酸钠不能明显增加肝内ASCs存活数量,但较单一治疗肝纤维化效果更好。
关键词:肝纤维化;脂肪干细胞;阿魏酸钠;转化生长因子 β1
肝纤维化是各种慢性肝损伤常见的可逆病理过程,肝星状细胞(HSCs)活化、增殖并生成大量胶原是其中心环节[1]。脂肪干细胞(ASCs)是间充质干细胞(MSCs)的一种,具有与骨髓MSCs相似[2]的分化能力和分泌功能,且易于获取。有研究证实,ASCs移植对肝纤维化具有较好的治疗作用[3~5]。阿魏酸是中药当归的主要单体成分之一,具有抗炎、抑制血小板聚集等作用。阿魏酸钠作为阿魏酸的成品药物,临床已广泛用于心血管疾病的治疗。有研究证实,阿魏酸钠具有抗纤维化、抗炎、抗氧化作用[6~9]。研究表明,损伤部位的炎症、氧化应激微环境是影响MSCs体内存活的重要因素。如行ASCs移植的同时应用阿魏酸钠治疗,可否同时提高抗纤维化作用以及ASCs肝内的存活率,尚不明确。2015年2~10月,我们观察了两者联合应用对肝纤维化的治疗作用以及对ASCs存活情况的影响。现报告如下。
1材料与方法
1.1材料SPF级雄性昆明种小鼠60只,体质量(25±3)g,由四川医科大学实验动物中心提供;绿色荧光蛋白(GFP)标记的小鼠ASCs及其完全培养基,均购自赛业(广州)公司;阿魏酸钠(AR级)购自西亚试剂公司,CCl4(AR级)、橄榄油(AR级)购自成都科龙化工试剂厂; ALT、AST、ALB分析试剂盒购自南京建成生物工程研究所;免疫组化转化生长因子β1(TGF-β1)、α肌动蛋白(α-SMA)一抗购自Bioworld公司,免疫组化二抗、染色试剂盒购自北京博奥森生物技术有限公司;Masson三色染色试剂盒购自北京索莱宝科技有限公司。
1.2方法
1.2.1实验分组与造模处理选取小鼠50只,予40% CCl4腹腔注射2 mL/kg,2次/周,共8周。造模中死亡3只,第8周末随机处死7只,取肝脏相同部位,Masson三色染色及免疫组化检查提示建模成功[10]。将剩余40只随机分为A、B、C、D组各10只,A组生理盐水灌胃并经尾静脉注射培养基,B、D组予阿魏酸钠100 mg/kg灌胃1次/d[11],C、D组经尾静脉行绿色荧光蛋白标记的ASCs移植5×105/只,B、C组分别给予尾静脉注射培养基、生理盐水灌胃。另取10只(E组)不造模且不做任何处理。
1.2.2肝功能检测细胞移植后第4周,心脏穿刺取血制备血清,并检测血清ALT、AST、ALB。
1.2.3肝组织病理检查 取血后处死小鼠,取肝脏组织;多聚甲醛固定,石蜡切片。按试剂盒操作行Masson染色,光镜下观察各组胶原纤维增生情况。
1.2.4肝组织TGF-β1、α-SMA检测取小鼠肝脏组织,多聚甲醛固定,石蜡切片;一抗稀释100倍,按试剂盒说明书行TGF-β1、α-SMA免疫组化染色。光镜下随机选取5个视野,相同条件下拍照;使用IPP 6.0软件行图片分析,测量积分光密度值(IOD),以此表示蛋白表达量。
1.2.5ASCs存活情况观察分别取C、D组新鲜肝组织冰冻,OTC胶水包埋后行冰冻切片;荧光显微镜下(×100)每张切片随机选取5个视野,计数带绿色荧光的细胞数量,并求取均数,即为ASCs存活数量。

2结果
2.1各组血清ALT、AST、ALB比较 见表1。
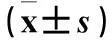
表1 各组血清ALT、AST、ALB比较
注:与E组比较,*P<0.05;与A组比较,#P<0.05。
2.2肝组织病理检查结果A组坏死扩大的门管区缩小,胶原沉积最多,部分胶原沉积部位有肝细胞填补。B组扩大的门管区缩小,门管区及纤维间隔的胶原量相比A组明显减少。C组胶原已不呈连续条带状,变细、变短,散在分布于门管区和小叶间。D组门管区缩小,胶原量较C组进一步减少,小叶间纤维间隔基本消失,仅见门管区有少量胶原沉积。E组小鼠肝脏肝小叶结构完整,小叶内及门管区未见纤维沉积。
2.3各组肝组织TGF-β1、α-SMA表达比较 见表2。

表2 各组肝组织TGF-β1、α-SMA表达(IOD值)
注:与E组比较,*P<0.05;与A组比较,#P<0.05;与B组比较,△P<0.05;与D组比较,○P<0.05。
2.4C、D组ASCs肝内存活情况C、D组ASCs数量分别为(65.2±15.68)、(62.9±20.06)个/HP,P>0.05。
3讨论
在各种有害刺激作用下,HSCs活化增殖,大量合成胶原纤维,导致肝内胶原合成与降解的平衡被打破,是肝纤维化病理的中心环节。多种细胞因子在肝纤维化的进展中起作用,而TGF-β1是最重要的促进HSCs活化增殖的细胞因子。在各种肝脏损伤因素作用下,TGF-β1被大量分泌,通过TGF-β1/Samd信号通路活化并促进HSCs的增殖;活化后的HSCs表达α-SMA,使α-SMA 成为重要的活化后HSCs的标志物[1]。活化后的HSCs能自分泌和旁分泌TGF-β1,继续这一活化增殖过程;即使去除最初的肝损伤因素,也能维持纤维化发展[1]。MSCs移植对肝纤维化的治疗作用主要包括[2]:①MSCs可分化为有功能的肝细胞,补充肝细胞数量;②MSCs通过分泌多种生长因子和细胞因子起到保护肝细胞、促进肝细胞再生,抑制HSCs活化增殖并促进其凋亡的作用。因此,如何提高移植后干细胞存活率和增强其旁分泌作用具有重要意义。
研究发现,阿魏酸钠具有抗细胞膜脂过氧化、降低肝硬化患者门脉压力、抑制HSCs增殖和胶原合成的作用[12~14]。CCl4腹腔注射是经典的肝纤维化模型制备方法,但停药后肝纤维化可自发逆转,且与停药时间呈正相关[15]。本研究显示,B、C、D组与A组相比,血清肝功能及肝组织纤维沉积量、TGF-β1、α-SMA表达量均有所下降,且D组变化更明显。表明两种处理都具有一定的治疗作用,且联合治疗的作用优于单独治疗。有文献显示,MSCs移植能降低肝内TGF-β1表达量和活化HSCs数量[2],而阿魏酸钠能够减少肝内α-SMA表达量[6]。因HSCs是肝纤维化时TGF-β1的重要来源,故阿魏酸钠稍微降低TGF-β1的作用可能通过减少活化HSCs数量来间接实现的。但本研究发现,D组较C组肝内ASCs 存活数量并未明显提高。我们推断,阿魏酸钠灌胃联合ASCs移植对肝纤维化的治疗作用可能并不是最初设想的通过提高ASCs的存活率来实现,而可能仅是两种治疗作用的单纯叠加,或通过复杂的过程提高了ASCs的旁分泌作用,这需要进一步的研究来证实。但是,即使只是单纯的治疗作用的叠加,对于未来可能的临床肝纤维化ASCs移植治疗,仍然具有积极的意义。
参考文献:
[1] 党双锁,李亚萍.TGF-1在肝纤维化研究中的新进展 [J] .世界华人消化杂志,2010,18(16):1630-1636.
[2] Eom YW, Shum KY, Baik SK. Mesenchymal stem cell therapy for liver fibrosis [J]. Korean J Intern Med, 2015,30(5):580-589.
[3] Okura H, Soeda M, Morita M, et al. Therapeutic potential of human adipose tissue-derived multi-lineage progenitor cells in liver fibrosis[J]. Biochem Biophys Res Commun, 2015,456(4):860-865.
[4] Yu F, Ji S, Su L. Adipose-derived mesenchymal stem cells inhibit activation of hepatic stellate cells in vitro and ameliorate rat liver fibrosis in vivo[J]. J Formos Med Assoc, 2015,114 (2):130-138.
[5] Harn HJ, Lin SZ, Hung SH, et al. Adipose-derived stem cells can abrogate chemical-induced liver fibrosis and facilitate recovery of liver function[J]. Cell Transplant, 2012,21(12):2753-2764 .
[6] 杨娟,徐胜南,王敏,等.阿魏酸钠对大鼠肝纤维化的作用[J].世界华人消化杂志,2014,22(12):1676-1681.
[7] 赵琪,马咏梅.阿魏酸钠的药理作用与临床应用[J].中国水电医学,2011(4):253-254.
[8] Huang Z, Wei W, Zhong Q. Effect of sodium feru-late on hemodynamics in hepatic cirrhosis patients with portal hypertension[J]. Zhongguo Zhong Xi Yi Jiehe Zazhi, 2008,28(7):640-642 .
[9] Liu J, Peng L, Yang J, Wang M, et al. Sodium ferulate reduces portal pressure through inhibition of rhoa/rho-kinase and activation of endothelial nitric oxide synthase in cirrhotic rats[J]. Dig Dis Sci, 2015,60(7):2019-2029.
[10] 叶霖财,肖智勇,周文霞,等.四氯化碳致肝纤维化动物模型实验条件的优化[J].军事医学科学院院刊,2010,34(4):340-344.
[11] 计一平.阿魏酸钠抗肝纤维化体内作用研究[D].上海:第二军医大学,2001.
[12] 叶静,刘清华,王璐璐.抗肝纤维化药物治疗的研究进展[J].山东医药,2014,54(42):101-103.
[13] 潘冬梅,郑勇,刘清华,等.大蒜素辅助治疗肝纤维化效果观察[J].山东医药,2013,53(20):48-50.
[14] 刘鸿,高元智,田菁菁,等.牛磺酸对小鼠肝纤维化的抑制作用[J].山东医药,2015,55(21):17-19.
[15] 朱纲,刘海林,黄欣.实验性四氯化碳诱致的大鼠肝纤维化自发逆转研究[J].上海医学,2006,29(10):741-743.
Influence of sodium ferulate on survival rate of adipose-derived stem cell transplantation and therapeutic effect in mice with hepatic fibrosis
YUEMaoyi,LIUGuangyi,ZOUliyue,HANYi,WANGQiaozhi
(SichuanMedicalUniversity,Luzhou446000,China)
Abstract:ObjectiveTo observe the influence of sodium ferulate on the survival rate of the transplanted adipose tissue-derived stem cells (ASCs) and the therapeutic effect in mice with hepatic fibrosis. MethodsFifty mice were selected to make the liver fibrosis models through CCl4 injection intraperitoneally for 8 weeks, and then 40 mice with hepatic fibrosis were randomly divided into groups A, B, C and D. Mice in the group A were administered with saline daily by gavage and then injected with cell culture medium by tail vein. Mice in the groups B and D were given 100 mg/kg sodium ferulate by lavage. Mice in the groups C and D received the GFP labeled ASCs (5×105) injection. The groups B and D were injected to the caudal veins of mice with cell culture medium and were also gavaged with normal saline. Ten mice (group E) were selected as the control group without any treatment. After 4 weeks, the liver function index was detected, the pathology of liver tissues was observed by Masson staining, the expression of transforming growth factor-β1 (TGF-β1), α-smooth muscle actin (α-SMA) in the liver tissues was determined by immunohistochemistry, and the number of ASCs in liver were detected by fluorescence microscope. ResultsALT and AST serum levels: group A >groups B, C and D > group E (P<0.05). ALB serum levels: group E > groups A, B, C and D, group B>group A (P<0.05). Collagen deposition: group A >groups B and C > group D > group E. Expression of TGF-β1 and α-SMA: group A > group B >group C>group D > group E (P<0.05). There was no significant difference in survival rate between group C and group D (P>0.05). ConclusionThe combined application of sodium ferulate and ASCs can not significantly increase the survival rate of transplanted ASCs in liver, but has a better therapeutic effect as compared with the separated application.
Key words:liver fibrosis; adipose-derived stem cell; sodium ferulate; transforming growth factor-β1
(收稿日期:2015-10-24)
中图分类号:R575
文献标志码:A
文章编号:1002-266X(2016)10-0010-03
doi:10.3969/j.issn.1002-266X.2016.10.004
通信作者简介:王巧稚(1978-),女,副教授,主要研究方向为干细胞应用。E-mail: wqz416@163.com
作者简介:第一岳冒易(1987-),男,硕士研究生在读,主要研究方向为干细胞应用。E-mail: 759840575@qq.com
基金项目:四川省科技厅市校联合项目(2014TSX-0119)。

