陕北花马盐湖1株产纤维素酶真菌的鉴定及产酶条件研究
张 波,刘开辉,2,陈文强,2,杨方玉,丁小维,2,邓百万,2
(1 陕西理工学院 生物科学与工程学院,陕西 汉中 723000;2 陕西省食药用菌工程技术研究中心,陕西 汉中 723000)
陕北花马盐湖1株产纤维素酶真菌的鉴定及产酶条件研究
张波1,刘开辉1,2,陈文强1,2,杨方玉1,丁小维1,2,邓百万1,2
(1 陕西理工学院 生物科学与工程学院,陕西 汉中 723000;2 陕西省食药用菌工程技术研究中心,陕西 汉中 723000)
[摘要]【目的】 对从陕北花马盐湖嗜盐真菌中筛选出的1株产纤维素酶菌株进行鉴定,研究该菌株的产酶条件,为嗜盐纤维素酶资源的利用提供理论依据。【方法】 利用刚果红培养基从陕北花马盐湖嗜盐真菌中筛选产纤维素酶菌株,并对其进行形态学和ITS序列鉴定,在单因素试验基础上,采用L9(34)正交试验,优化该产酶菌株的最佳培养基配方和最佳发酵条件,并研究该产酶菌株的NaCl耐受性。【结果】 从陕北花马盐湖嗜盐真菌中筛选出1株高产纤维素酶菌株6MA1,根据形态学和ITS序列系统发育分析,将该菌鉴定为黑曲霉(Aspergillus niger)。菌株产纤维素酶的最佳培养基配方是,玉米芯粉22.0 g/L,蛋白胨6.0 g/L, NaCl 4.0 g/L,MgSO4·7H2O 0.55 g/L,K2HPO4 0.5 g/L;最佳发酵条件是,发酵温度28 ℃,发酵时间6 d,起始pH 6.0,种子液接种量18%(体积分数),在此条件下菌株6MA1的CMCase活力为47.8 U/mL。此外,该菌株在含0~15.0%(体积分数)NaCl的培养基中仍具有产纤维素酶活力。【结论】 从陕北花马盐湖筛选出1株产纤维素酶菌株6MA1,并得到了该菌株产酶的最佳条件。
[关键词]陕西花马盐湖;纤维素酶;嗜盐真菌;产酶条件
纤维素酶是生物降解含β-1,4 糖苷键纤维素生成葡萄糖的一类复合酶的总称[1],广泛用于能源化工、食品、纺织、饲料、酿酒、石油勘探、中药成分提取等众多领域,特别是在生物能源、纺织业、造纸业和洗涤业等工业领域中具有重要的应用价值[2]。其作用底物——纤维素类物质是地球上最丰富的可再生资源之一[3]。据报道,全世界每年通过陆地生物合成的再生纤维素总量为560~1 200亿t[4],占植物界碳含量的50%以上,但是这些资源并未被人类所充分利用,而大多数是被燃烧处理,造成了大气污染及黑碳气溶胶严重超标[5],并破坏了土壤微生物群落结构、改变了土壤理化性质及有机成分[6]。因此,有效利用纤维素资源对于解决当前能源危机及环境污染等问题有重要作用。
纤维素酶广泛存在于自然界的生物体中,细菌、真菌及动物体内都能产生纤维素酶,一般用于生产的纤维素酶多来自于真菌。目前报道能够降解天然纤维的微生物主要是木霉、青霉、曲霉和白腐菌等真菌[7-9],而且大多数菌分离自低盐环境中,关于盐湖微生物产纤维素酶的研究报道较少[10],在盐湖高盐环境中,真菌在长期适应性进化过程中常会形成功能独特、多样的酶系,这类耐(嗜)盐酶系在高盐条件下一般仍具有较好的活力,因此在工业高盐环境中仍能发挥作用;此外,这类真菌发酵所需的高浓度NaCl可抑制大多数微生物生长繁殖,防止纤维素酶生产过程中的杂菌污染[11]。本研究从陕北花马盐湖菌株中筛选得到1株产纤维素酶的菌株,对该菌株的产酶条件进行了探究,以期为嗜盐纤维素酶资源的利用奠定基础。
1材料与方法
1.1材料
1.1.1供试菌种陕北花马盐湖嗜盐真菌菌株(37株)分离自陕北花马盐湖水泽沉积物。
1.1.2培养基刚果红培养基[12](g/L):(NH4)2SO42.0,MgSO4·7H2O 0.5,K2HPO41.0,NaCl 0.5,纤维素粉2.0,刚果红0.4,琼脂 22.0,pH自然;查氏培养基(g/L):蔗糖30.0,NaNO32.0,K2HPO41.0,KCl 0.5,MgSO4·7H2O 0.5,FeSO40.01,琼脂12.0,pH自然;种子培养基(g/L):葡萄糖10.0,麦秸 10.0,(NH4)2SO41.5,pH 5.5~6.0;基础培养基(g/L):玉米芯粉20.0,蛋白胨6.0,K2HPO40.5,MgSO4·7H2O 0.5,NaCl 5.0,pH 5.5。
1.2方法
1.2.1菌株筛选将37株待试菌株接种于刚果红培养基上,28 ℃恒温培养7 d,待菌落长成后,测量透明圈直径与菌落直径差,可初步判断产酶活性大小,从中筛选出产酶活性最高的菌株。
1.2.2菌株鉴定将筛选出的产纤维素酶活性最高的菌株接种到查氏培养基上,并在接种位点旁斜插入无菌盖玻片,28 ℃倒置培养7~14 d,观察菌落形态,待菌丝爬满盖玻片后,取出盖玻片并在尼康高级光学显微镜下观察菌丝的形态特征及产孢结构,参照《真菌鉴定手册》[13]进行初步鉴定。
利用CTAB法提取真菌基因组DNA,用真菌ITS1和ITS4[14]扩增ITS基因。PCR反应体系(25 μL)为:10×buffer 2.5 μL,dNTP 2.0 μL,模板DNA 1.0 μL(约20 ng),上下游引物(10 mmol/L)各1.0 μL,Taq酶0.3 μL,加去离子水至 25 μL。PCR扩增条件为:94 ℃预变性4 min;94 ℃变性 30 s,52 ℃退火45 s,72 ℃延伸2 min,36个循环;72 ℃延伸10 min。扩增产物切胶回收并送上海生工进行测序。所得序列在GenBank中比对并下载相似度高的序列,组成数据集,利用Bio-Edit和Mega5软件构建NJ树[15]。
1.2.3产酶菌株培养基组分的优化(1)种子培养。取活化的斜面菌株约0.5 cm2的小块,接种于种子培养基中,28 ℃、160 r/min条件下培养1 d,作为种子液。
(2)碳源的筛选。将种龄为1 d的种子液按摇瓶装液量10%(体积分数)接入含2%(体积分数)供试碳源(玉米芯粉、木屑、麦秸、纤维素粉、米糠)及0.6%(体积分数)蛋白胨的基础培养基中,28 ℃、160 r/min条件下培养72 h,测定羧甲基纤维素酶(CMCase)活力,筛选最佳碳源。
(3)氮源的筛选。将种龄为1 d的种子液按摇瓶装液量10%(体积分数)接入含2%(体积分数)最佳碳源及0.6%(体积分数)供试氮源(蛋白胨、牛肉膏、黄豆粉、酵母粉、(NH4)2SO4)的培养基中,28 ℃、160 r/min条件下培养72 h,测定CMCase活力,筛选最佳氮源。
(4)正交法优化培养基组分。在培养基单因素试验的基础上,选取基础培养基碳源(玉米芯粉)、氮源(蛋白胨)、NaCl、MgSO4·7H2O 4个因素作为影响筛选菌株产纤维素酶的培养基组分,设计四因素三水平的正交试验如表1所示。

表 1 产纤维素酶菌株培养基组分优化的正交试验方案
1.2.4产酶菌株发酵条件的优化(1)发酵条件对CMCase活力的影响。考察发酵时间(2,3,4,5,6,7,8 d)、发酵温度(24,26,28,30,32 ℃)、起始pH(4.5,5.5,6.5,7.5,8.5)、种子液接种量(体积分数5%,10%,15%,20%,25%)对菌株产CMCase活力的影响,初步确定发酵条件。
(2)正交法优化发酵条件。在发酵条件单因素试验基础上,选取发酵温度、发酵时间、起始pH、接种量4个因素作为筛选产纤维素酶菌株过程中发酵条件优化的因素,设计四因素三水平的正交试验如表2所示。
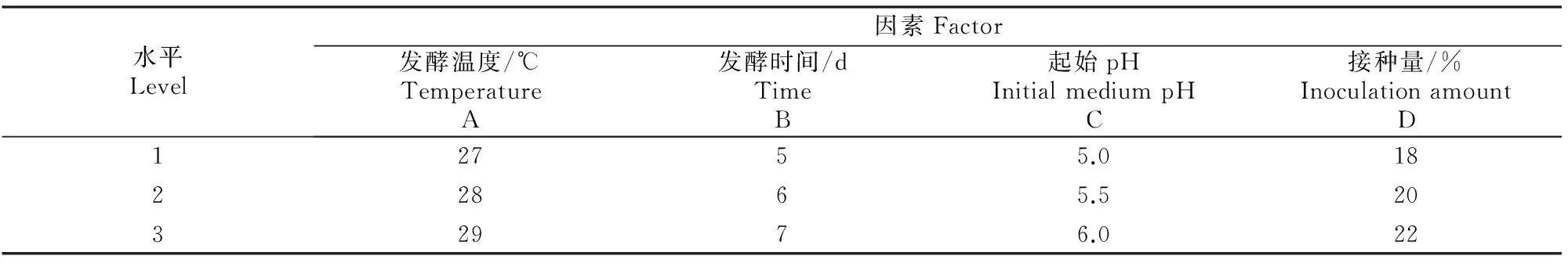
表 2 产纤维素酶菌株发酵条件优化的正交试验方案
1.2.5NaCl体积分数对菌株产酶活力的影响在优化培养基中分别添加0,2.5%,5.0%,7.5%,10.0%,12.5%,15.0%(体积分数)的NaCl,在优化培养条件下培养,测定菌株的CMCase活力,考察NaCl体积分数对菌株产酶活力的影响。
1.2.6纤维素酶活力的测定(1)葡萄糖标准曲线的绘制。葡萄糖质量浓度与吸光度的标准曲线参照文献[16]的方法绘制,葡萄糖标准曲线为Y=13.948 3X-0.067 4,r2=0.995(Y代表葡萄糖质量浓度(mg/mL);X代表酶解反应产物显色后的吸光度)。
(2)CMCase活性的测定。将1.0 mL粗酶液加入9.0 mL 0.05 mol/L柠檬酸缓冲液(pH 4.8)中,混匀获得稀释酶液。在试管中分别加入0.5 mL稀释酶液(对照为灭活酶液)和1.5 mL体积分数 0.5%羧甲基纤维素钠(CMC)溶液,50 ℃水浴30 min,加入3.0 mL DNS试剂终止反应,沸水浴5 min,冷却至室温,定容后测OD540 nm吸光值[17]。以1 mL酶液1 min水解生成1 μg葡萄糖的酶量为1个活力单位(U/mL)。
2结果与分析
2.1陕北花马盐湖产纤维素酶菌株的筛选
利用刚果红培养基从37株嗜盐真菌中筛选出2株产纤维素酶的菌株8MB15和6MA1。菌株8MB15透明圈直径为12 mm,菌落直径为10 mm。菌株6MA1透明圈直径为20 mm,菌落直径为16 mm(表3)。根据透明圈直径与菌落圈直径差,确定菌株6MA1为产纤维素酶活性高的菌株。
2.2菌株6MA1的鉴定
2.2.1菌株形态特征菌株6MA1在查氏培养基上培养4 d后(图1A),菌落正面绒毛状,外侧呈白色,中部呈灰黑色;菌落反面淡黄褐色,有褶皱。菌落产生放射状向外延伸的白色菌丝,菌丝与培养基结合较牢,菌丝宽度为9.5~12.5 μm,在气生菌丝顶端膨大形成大小均一的顶囊,并形成黑色分生孢子头,孢子大小为2.5 μm×2.5 μm(图1B)。根据其形态特征,初步鉴定该菌为曲霉属(Aspergillus)真菌。

表 3 陕北花马盐湖产纤维素酶菌株的筛选

图 1 菌株6MA1的菌落形态(A)及显微观察(10×)(B)
2.2.2ITS序列系统发育分析构建嗜盐真菌6MA1 ITS序列的NJ系统发育树,结果(图2)表明,菌株6MA1 ITS序列与GenBank数据库中曲霉属的Aspergillusniger(JF436883)、Aspergillusniger(KF496080)和Aspergillusniger(KC341970)等序列的相似性≥98%,6MA1与黑曲霉聚于同一分支上,其步长值为100%。因此将该菌株鉴定为黑曲霉(Aspergillusniger)。
2.3菌株6MA1培养基组分优化的单因素试验结果
2.3.1碳源由图3可知,纤维素粉、玉米芯粉、麦秸、木屑和米糠这5种碳源均能诱导菌株6MA1产生纤维素酶,且不同种类碳源对菌株产酶活性影响显著。菌株6MA1对碳源利用程度的大小顺序依次是玉米芯粉>麦秸>纤维素粉>木屑>米糠,对应CMCase活力分别是25.1,18.7,14.5,13.4,11.8 U/mL,所以可确定玉米芯粉为最佳碳源。
2.3.2氮源由图4可知,(NH4)2SO4、黄豆粉、牛肉膏、酵母粉和蛋白胨这5种氮源均能诱导菌株6MA1产生纤维素酶,且不同种类氮源对菌株产酶活性影响差异较大。菌株6MA1对氮源利用程度的大小顺序依次是蛋白胨>(NH4)2SO4>黄豆粉>酵母粉>牛肉膏,对应CMCase活力分别是23.1,19.7,16.9,14.4,12.6 U/mL,所以可确定蛋白胨为最佳氮源。
2.4菌株6MA1产酶培养基组分的正交试验优化
表4结果表明,玉米芯粉在3水平,蛋白胨在2水平,NaCl在1水平,MgSO4·7H2O在3水平时菌株产CMCase活力最高,其CMCase活力是38.7 U/mL。因此,各因子的最佳水平组合为:A3B2C1D3。极差分析结果表明:各因子对CMCase活力影响的大小顺序为A>B>D>C。所以,最终确定菌株6MA1产纤维素酶培养基的最佳配方为:玉米芯粉22.0 g/L,蛋白胨6.0 g/L,NaCl 4.0 g/L,MgSO4·7H2O 0.55 g/L,K2HPO40.5 g/L。

图 2菌株6MA1的ITS序列系统发育树
Fig.2ITS phylogenetic tree of 6MA1 strain

图 3碳源对菌株6MA1产CMCase活力的影响
Fig.3Effects of carbon source on CMCase of 6MA1
图 4氮源对菌株6MA1产CMCase活力的影响
Fig.4Effects of nitrogen source on CMCase of 6MA1

表 4 菌株6MA1产酶培养基组分优化的正交试验结果

续表 4 Continued table 4
2.5菌株6MA1产酶发酵条件的单因素试验结果
2.5.1发酵温度的影响由图5可知,温度对菌株6MA1产酶的影响较大,随着温度的逐渐升高,CMCase活力呈现先上升后下降的趋势。24~28 ℃时CMCase活力保持升高状态,28 ℃时达到最大值32.5 U/mL,之后CMCase活力开始呈现下降状态。因此,发酵温度初步确定为28 ℃。
2.5.2发酵时间的影响由图6可知,发酵时间对菌株6MA1产酶影响较大,随着发酵时间的延长,CMCase活力呈现先保持平稳后迅速上升再急剧下降并趋于稳定的趋势。在2~5 d时CMCase活力基本保持平稳缓慢上升状态,6 d时,CMCase活力达到最大值28.7 U/mL,此后CMCase活力急剧下降后又保持平稳。因此,发酵时间初步确定为6 d。

图 5 发酵温度对菌株6MA1产CMCase活力的影响
2.5.3起始pH的影响由图7可知,不同起始pH对菌株6MA1产酶影响较大,随着pH的增大,CMCase活力呈现先上升后急剧下降的趋势,pH 4.5~5.5时,CMCase活力迅速升高,在pH为5.5时,CMCase活力达到最大值31.2 U/mL,pH 5.5~6.5时急剧下降,此后保持缓慢下降的趋势。因此,起始pH初步确定为5.5。
2.5.4接种量的影响由图8可知,不同接种量对菌株6MA1产酶影响较明显,随着接种量的增加,CMCase活力呈现先缓慢上升后下降的趋势,在接种量为20%(体积分数)时,CMCase活力达到最大值28.9 U/mL。因此,接种量初步确定为20%。

图 7 起始pH对菌株6MA1产CMCase活力的影响
2.6菌株6MA1产酶发酵条件的正交试验优化
表5结果表明,发酵温度在2水平,发酵时间在2水平,起始pH在3水平,接种量在1水平时,菌株产CMCase活力最高,其CMCase活力可达47.8 U/mL。因此,各因子的最佳水平组合为:A2B2C3D1。极差分析结果表明,各因子对CMCase活力影响的大小顺序为A>C>B>D。所以,最终确定菌株6MA1产纤维素酶发酵条件的最佳组合为:发酵温度28 ℃,发酵时间6 d,起始pH 6.0,种子液接种量18%(体积分数)。

表 5 菌株6MA1产酶发酵条件优化的正交试验结果
2.7NaCl体积分数对菌株6MA1产酶活力的影响
由图9可知,在NaCl体积分数为0~15.0%时,菌株6MA1均可产生纤维素酶,随着NaCl的逐渐增大,CMCase活力呈现先上升后下降的趋势,当NaCl体积分数为2.5%时,CMCase活力达到最大值55.2 U/mL。因此,在培养基中添加体积分数2.5%的NaCl对菌株6MA1产纤维素酶具有促进作用。

图 9NaCl体积分数对菌株6MA1产CMCase活力的影响
Fig.9Effects of NaCl concentration on CMCase of 6MA1
3讨论
本研究从陕北花马盐湖嗜盐真菌中筛选出1株产纤维素酶活性较高的菌株6MA1,根据形态学和ITS序列分析将该菌株鉴定为黑曲霉(Aspergillusniger)。菌株6MA1产纤维素酶的最佳培养基配方是,玉米芯粉22.0 g/L,蛋白胨6.0 g/L,NaCl 4.0 g/L,MgSO4·7H2O 0.55 g/L,K2HPO40.5 g/L。菌株6MA1产纤维素酶的最佳发酵条件是,发酵温度28 ℃,发酵时间6 d,起始pH 6.0,种子液接种量18%(体积分数),CMCase活力可达47.8 U/mL。
目前,产纤维素酶菌株的研究主要集中在一些常规环境的微生物上,对于极端环境微生物产纤维素酶的研究报道较少,极端盐碱环境微生物所产酶系可在普通微生物无法生存的高盐碱环境中仍保持酶活性。因此,这类极端微生物产纤维素酶的筛选、基因克隆及高效表达已成为国内外研究热点。严芬等[18]从造纸厂污泥中筛选出1株产高温纤维素酶的土曲霉菌株XM5,其最适反应温度为65 ℃,最适pH为4.0,CMCase活力为4.3 U/mL;李忠玲等[19]从造纸厂碱性土壤中分离出1株产碱性纤维素酶兼性厌氧菌株LZ-5,其最适反应温度为40 ℃,最适pH为9.0,CMCase活力为5.8 U/mL;穆春雷等[20]从秸秆还田土壤中分离出1株低温分解纤维素酶的草酸青霉菌株M11,其最佳发酵时间为9 d,最适反应温度为20 ℃,最适pH为5.0,CMCase活力为33.08 U/mL。本研究从陕北花马盐湖嗜盐真菌中筛选出的产纤维素酶菌株6MA1发酵周期短,发酵温度与起始pH符合一般真菌培养条件,且CMCase活力高,可达47.8 U/mL,显著高于草酸青霉菌株M11产CMCase活力,提高了44.5%[20],且菌株6MA1可在含0~15.0% NaCl的培养基中生长并产生纤维素酶,具有较强的NaCl耐受力。这些特性表明该菌株产生的纤维素酶在工业高盐环境中有一定的应用前景,值得进一步研究开发与利用。
[参考文献]
[1]吴发远.黑曲霉发酵生产纤维素酶条件的研究 [J].中国农学通报,2009,25(9):74-77.
Wu F Y.Study on the condition of fermentation producing cellulase byAspergillusniger[J].Chinese Agricultural Science Bulletin,2009,25(9):74-77.(in Chinese)
[2]张丽影,汪涵涵,潘婷,等.产纤维素酶菌株的筛选及产酶条件优化 [J].纤维素科学与技术,2015,23(2):1-7.
Zhang L Y,Wang H H,Pan T,et al.Isolation of cellulase-producting strains and optimization of cellulase-producting conditions [J].Journal of Cellulose Science and Technology,2015,23(2):1-7.(in Chinese)
[3]刘松,李祝,周礼红,等.响应面法优化黑曲霉产纤维素酶的发酵条件 [J].食品科学,2013,34(17):225-229.
Liu S,Li Z,Zhou L H,et al.Optimization of fermentation conditions for cellulase production byAspergillusnigerusing response surface methodology [J].Food Science,2013,34(17):225-229.(in Chinese)
[4]Berr C,Reichestein,Tomelleri E,et al.Terrestrial gross carbon dioxide uptake:Global distribution and convariation with climate [J].Science,2010,329:834-838.
[5]兰春剑.长三角地区秸秆焚烧所引起的黑碳气溶胶排放及环境影响研究 [D].杭州:浙江农林大学,2012.
Lan C J.Study on black carbon aerosol emissions from crop straw open burning and its environmental impact on the Yangtze River Delta region [D].Hangzhou:Zhejiang A&F University,2012.(in Chinese)
[6]陈亮,赵兰坡,赵兴敏.秸秆焚烧对不同耕层土壤酶活性、微生物数量以及土壤理化性状的影响 [J].水土保持学报,2012,26(4):118-122.
Chen L,Zhao L P,Zhao X M.Effect of straw burning on soil enzyme activity,soil microbial quantity and physical and chemical properties of soil in different plough layer [J].Journal of Soil and Water Conservation,2012,26(4):118-122.(in Chinese)
[7]钟桂芳,翟莉莉,樊攀,等.里氏木霉产纤维素酶的条件优化及酶学性质研究 [J].食品与发酵科技,2013,49(4):10-13.
Zhong G F,Zhai L L,Fan P,et al.Optimization of culture conditions for cellulose production byTrichodermareeseiand study on the enzymatic properties [J].Food and Fermentation Technology,2013,49(4):10-13.(in Chinese)
[8]杨茜,李维尊,鞠美庭,等.微生物降解木质素类生物质固废的研究进展 [J].微生物学通报,2015,42(8):1569-1583.
Yang Q,Li W Z,Ju M T,et al.Advances in microbial degradation of lignocelluloses biomass solid waste:A review [J].Microbiology China,2015,42(8):1569-1583.(in Chinese)
[9]蔡晶晶,段学辉,谢亮,等.三菌混合固态发酵产纤维素酶 [J].中国生物工程杂志,2013,33(7):57-63.
Cai J J,Duan X H,Xie L,et al.Production of cellulases by soild state fermentation with three strains mixed [J].China Biotechnology,2013,33(7):57-63.(in Chinese)
[10]郭庆兰,刘开辉,丁小维,等.内蒙古鄂尔多斯一古盐湖真菌多样性及其功能酶的初步研究 [J].微生物学通报,2014,41(8):1547-1555.
Guo Q L,Liu K H,Ding X W,et al.Preliminary investigation of diversity and functional enzymes of fungi from Erdos a paleo salt lake in Inner Mongolia [J].Microbiology China,2014,41(8):1547-1555.(in Chinese)
[11]韩笑,闫培生,史翠娟,等.海洋微生物产纤维素酶及其应用研究进展 [J].生物技术进展,2015,5(3):191-195.
Han X,Yan P S,Shi C J,et al.Research progress on cellulase producing by marine microorganisms and its application [J].Current Biotechnology,2015,5(3):191-195.(in Chinese)
[12]方尚玲,杨丹丹,钱志伟,等.高产纤维素酶生产菌的筛选及诱变育种 [J].食品与发酵科技,2010,46(1):13-17.
Fang S L,Yang D D,Qian Z W,et al.Screening and mutagenesis of high cellulase activity strain [J].Food and Fermentation Technology,2010,46(1):13-17.(in Chinese)
[13]魏景超.真菌鉴定手册 [M].上海:上海科技出版社,1979:495-499.
Wei J C.Fungal identification manual [M].Shanghai:Shanghai Science and Technology Press,1979:495-499.(in Chinese)
[14]White T J,Bruns T,Lee S,et al.Amplication and direct sequencing of fungal ribosomal RNA genes for phylogenetics [M]//Innis M A,Gelfand D H,Sninsky J J,et al.PCR protocols:A guide to methods and application.San Diego:Academic Press Inc,1990:315-322.
[15]Tamura K,Peterson D,Stecher N,et al.Phylogenetic and molecular evolutionary analyses were conducted using MEGA version 5 [J].Mol Biol Evol,2011,28(10):2731-2739.
[16]刘杰凤,薛栋升,何可可,等.一株耐盐纤维素酶海洋曲霉的筛选及产酶条件研究 [J].食品与生物技术学报,2012,31(7):711-718.
Liu J F,Xue D S,He K K,et al.Screening of a cellulase producing halotolerant strain marineAspergillusp and its fermentation conditions [J].Journal of Food Science and Biotechnology,2012,31(7):711-718.(in Chinese)
[17]甄静,王继雯,谢宝恩,等.一株纤维素降解真菌的筛选、鉴定及酶学性质分析 [J].微生物学通报,2011,38(5):709-714.
Zhen J,Wang J W,Xie B E,et al.Isolation,identification of a cellulase-producing strain and characterization of its cellulase-prodcuing capability [J].Microbiology China,2011,38(5):709-714.(in Chinese)
[18]严芬,李源涛,李丽莎,等.一株产高温纤维素酶真菌的筛选、鉴定及酶学性质研究 [J].福州大学学报,2013,41(3):397-402.
Yan F,Li Y T,Li L S,et al.Isolation and identification of hot-resisitant cellulase fungus and study on enzymic properties [J].Journal of Fuzhou University,2013,41(3):397-402.(in Chinese)
[19]李忠玲,王卫卫,任平,等.产碱性纤维素酶兼性厌氧菌株的筛选和酶学性质的初步研究 [J].微生物学通报,2008,35(6):851-854.
Li Z L,Wang W W,Ren P,et al.Screening of facultative anaerobic strain producing alkaline cellulase and study on enzymatic properties [J].Microbiology China,2008,35(6):851-854.(in Chinese)
[20]穆春雷,武晓森,李术娜,等.低温产纤维素酶菌株的筛选、鉴定及纤维素酶学性质 [J].微生物学通报,2013,40(7):1193-1201.
Mu C L,Wu X S,Li S N,et al.Screening and identification of a cold-adapted cellulase-producing strains and characterization of cellulase [J].Microbiology China,2013,40(7):1193-1201.(in Chinese)
Identification and fermentation conditions of a cellulase-producing fungus from Huama Salt Lake in northern Shaanxi
ZHANG Bo1,LIU Kai-hui1,2,CHEN Wen-qiang1,2,YANG Fang-yu1,DING Xiao-wei1,2,DENG Bai-wan1,2
(1SchoolofBiologicalScience&Engineering,ShaanxiUniversityofTechnology,Hanzhong,Shaanxi723000,China;2ShaanxiProvincialEngineeringResearchCenterofEdibleandMedicinalFungi,Hanzhong,Shaanxi723000,China)
Abstract:【Objective】 One cellulase-producing fungus screened from fungi in Huama Salt Lake in northern Shaanxi was identified and its fermentation conditions were tested to provide theoretical basis for the utilization of halophilic cellulase resources.【Method】 First,Congo red medium was used to screen cellulase producing strain from halophilic fungi in Huama Salt Lake in northern Shaanxi and it was identified through morphology and ITS sequence.Then,the optimized medium and liquid-fermented conditions were obtained by L9(34) orthogonal design.The NaCl tolerance of obtained enzyme producing strain was studied as well.【Result】 The cellulose-producing strain,6MA1,was isolated from halophilic fungi in Huama Salt Lake in northern Shaanxi.This isolate was classified as Aspergillus niger.The optimal medium contained the following components (g/L):corncob powder 22.0,peptone 6.0,NaCl 4.0,MgSO4·7H2O 0.55,and K2HPO4 0.5.The optimal liquid-fermented conditions were:initial medium pH 6.0,inoculum 18%,at 28 ℃ for 6 days.Its CMCase activity reached 47.8 U/mL.In addtion,6MA1 still produced cellulase when submergerd in liquid media with 0-15.0% NaCl.【Conclusion】 The study screened out a cellulase-producing strain from Huama Salt Lake in northern Shaanxi and optimized its fermentation conditions.
Key words:Huama Salt Lake in northern Shaanxi;cellulase;fungi;enzyme production conditions
DOI:网络出版时间:2016-03-1408:4510.13207/j.cnki.jnwafu.2016.04.021
[收稿日期]2015-10-16
[基金项目]国家自然科学基金青年基金项目(31100017);陕西省青年科技新星科研计划项目(2013KJXX-76)
[作者简介]张波(1989-),女,陕西安康人,硕士,主要从事微生物资源保育及开发利用研究。 E-mail:13474315539@163.com[通信作者]刘开辉(1979-),男,陕西旬阳人,副教授,主要从事特殊环境微生物资源开发与利用研究。
[中图分类号]Q935
[文献标志码]A
[文章编号]1671-9387(2016)04-0149-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160314.0845.042.html
E-mail:kaihhui168@hotmail.com

