立普妥对高糖诱导的HUVEC凋亡及PI3K/ AKT/ eNOS信号通路的影响
刘志辉(江西省景德镇市第一人民医院心内科,江西景德镇 333000)
立普妥对高糖诱导的HUVEC凋亡及PI3K/ AKT/ eNOS信号通路的影响
刘志辉
(江西省景德镇市第一人民医院心内科,江西景德镇 333000)
【摘要】目的 探讨立普妥对高糖诱导的人脐静脉内皮细胞(HUVEC)的凋亡及对磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/内皮型一氧化氮(eNOS)信号通路的影响。方法 实验分为正常组,模型组(33. 3 mol/ L葡萄糖),立普妥组(33. 3 mol/ L葡萄糖+0. 1,1,10 μmol/ L);MTT法检测各组HUVEC活力;倒置显微镜拍照检测各组HUVEC形态;Annexin V-FITC/ PI流式双染法检测各组HUVEC凋亡;Gries法检测各组HUVEC上清NO含量;Western blot分析PI3K/ AKT激活状况及eNOS的表达情况。结果 与正常组比较,高糖组中HUVEC皱缩,变圆变亮,细胞活力降低,细胞早期凋亡和晚期凋亡率显著提高,NO含量及eNOS、PI3K表达量及AKT磷酸化程度降低,差异均具有显著性(P<0. 05);与模型组比较,1,10 μmol/ L立普妥组中HUVEC形态恢复,细胞活力上升,PI3K表达量提高,差异均具有显著性(P<0. 05);0. 1,1,10 μmol/ L立普妥组HUVEC凋亡程度下降,NO含量、eNOS表达量提高,AKT磷酸化水平上升,差异均具有显著性(P<0. 05)。结论 立普妥可抵抗高糖诱导的HUVEC凋亡,是通过激活PI3K/ AKT/ eNOS信号通路实现的。
【关键词】立普妥;人脐静脉内皮细胞(HUVEC);凋亡;PI3K/ AKT/ eNOS信号通路
糖尿病(diabetes mellitus)是一种以慢性高血糖为特征的内分泌疾病,其并发症涉及心,眼,肾,糖尿病足和神经病变,这些都和血管损伤有关[1]。血管内皮在维持正常的血流速度及血管张力,氧化应激,抑制血管炎症等方面具有重要作用。且糖尿病的预后及并发症的发生和发展与整体血糖水平的升高密切相关[2]。因此,进一步深入研究高血糖引起的内皮细胞凋亡的机制对防治糖尿病血管病变具有重要的临床意义。
立普妥,又称阿托伐他汀钙片,是3-羟基-3甲基戊二酰辅酶A还原酶选择性抑制剂,可通过降低肝脏中胆固醇及脂质蛋白合成量来达到调节脂代谢目的,已大量用于临床糖尿病,冠心病的治疗。如立普妥通过调节脂代谢对2型糖尿病合并急性脑梗死患者具有治疗作用[3]。立普妥可通过提高维生素D水平及骨密度含量来治疗老年2型糖尿病患者[4]。通过超声能观察到立普妥可以逆转2型糖尿病患者动脉粥样硬化斑块[5]。不同剂量立普妥对老年急性冠状动脉综合征患者有显著治疗作用[6]。并且立普妥对同型半胱氨酸[7],氧化型低密度脂蛋白(ox-LDL)[8],肿瘤坏死因子-α[9],高糖[10]诱导的HUVEC凋亡,但具体机制未知,因此本文在此基础探讨立普妥对高糖诱导的HUVEC凋亡抑制作用的机制。
1 材料和方法
1.1材料与试剂
人脐静脉内皮细胞(HUVEC)购自美国标准生物品收藏中心,货号:C-1161,培养于含10%胎牛血清的DMEM培养基中。立普妥,由辉瑞制药提供,批号:95837021。葡萄糖购自阿拉丁,批号:G116307;兔抗eNOS,AKT,p-AKT,PI3K,GADPH单克隆抗体购自杭州Epitmics公司;NO检测试剂盒,Annexin V-FITC流式细胞检测试剂盒购自碧云天生物技术研究所,批号分别为:S0021,C1063;胎牛血清,DMEM培养基,四甲基偶氮唑盐(MTT)购自美国Gibco公司。
1.2分组方法
将HUVEC分为3组,即正常组:正常HUVEC,模型组:33. 3 mol/ L葡萄糖,立普妥组:33. 3 mol/ L葡萄糖+0. 1,1,10 μmol/ L立普妥。
1.3细胞活力检测(MTT法)
将处于生长对数期的HUVEC消化,并调整细胞浓度,接种于96孔板,按1. 2分组方法进行给药,继续培养24 h,并倒置显微镜下拍照,后每孔加MTT(5 mg/ mL)20 μL,4 h后,弃上清,并每孔加入DMSO 150 μL,10 min后,酶标仪570 nm处测定OD值。
1.4Annexin V-FITC流式细胞法检测细胞凋亡
将处于生长对数期的HUVEC,消化,细胞浓度调整为8×103个细胞/ ml,接种于6孔板,按1. 2分组方法进行给药,继续培养48 h后,按照Annexin VFITC/ PI细胞凋亡检测试剂盒说明书的方法,用0. 25%的胰蛋白酶(不含EDTA)消化,PBS洗涤,2000 r/ min离心5 min,收集细胞;加入Binding Buffer 500 μL悬浮细胞,随后加入Annexin V-FITC 5 μL混匀后,加入PI 5 μL,混匀,于室温避光反应5~15 min,在1 h内进行流式细胞仪检测。
1.5细胞内NO含量
将处于生长对数期的HUVEC,消化,细胞浓度调整为8×103个细胞/ mL,接种于6孔板,按1. 2分组方法进行给药,培养48 h,后离心收集细胞,反复冻融,使细胞内容物流出,取上清检测NO含量,按照试剂盒说明书进行操作。
1.6Westernblotting
将处于生长对数期的HUVEC,消化,细胞浓度调整为8×103个细胞/ mL,接种于6孔板,按1. 2分组方法进行给药,培养48 h。收集细胞样本,加入RAPI裂解液裂解细胞,离心,获得蛋白样品。用BCA试剂盒检测蛋白浓度。蛋白上样,跑SDS凝胶电泳,湿法转膜,脱脂奶粉封闭,加入一抗4℃孵育过夜,PBS洗涤三次。次日加二抗室温孵育2 h,PBS洗涤三次,Biorad系统曝光。用“Quantity one”软件对蛋白灰度值进行分析。
1.7统计学分析
数据通过SPSS17. 0进行统计分析。数据以x-± s表示,t检验分析组间差异的显著性。P<0. 05表示两组间差异有统计学意义。
2 结果
2.1立普妥对高糖诱导的HUVEC细胞形态及活力的影响
如图1所示,与正常组比较,模型组中HUVEC细胞皱缩,细胞变圆变亮;与模型组比较,1,10 μmol/ L立普妥组中细胞形态恢复。如图2所示,与正常组比较,模型组中HUVEC细胞活力下降,具有显著性差异(P<0. 01);与模型组比较,1,10 μmol/ L立普妥组细胞活力提高,具有显著性差异(P< 0. 05)。说明1,10 μmol/ L立普妥能显著抑制高糖诱导的HUVEC细胞形态异常及活力下降。
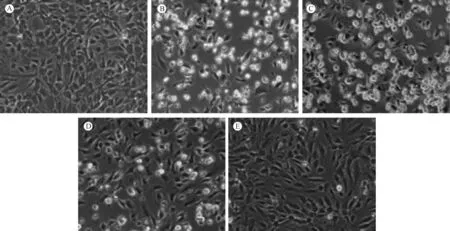
图1 立普妥对高糖诱导的HUVEC细胞形态的影响Note:A:normal group;B:model group;C:0. 1 μmol/ L lipitor;D:1 μmol/ L lipitor;E:10 μmol/ L lipitor.Fig. 1 Effect of lipitor on morphology of HUVEC
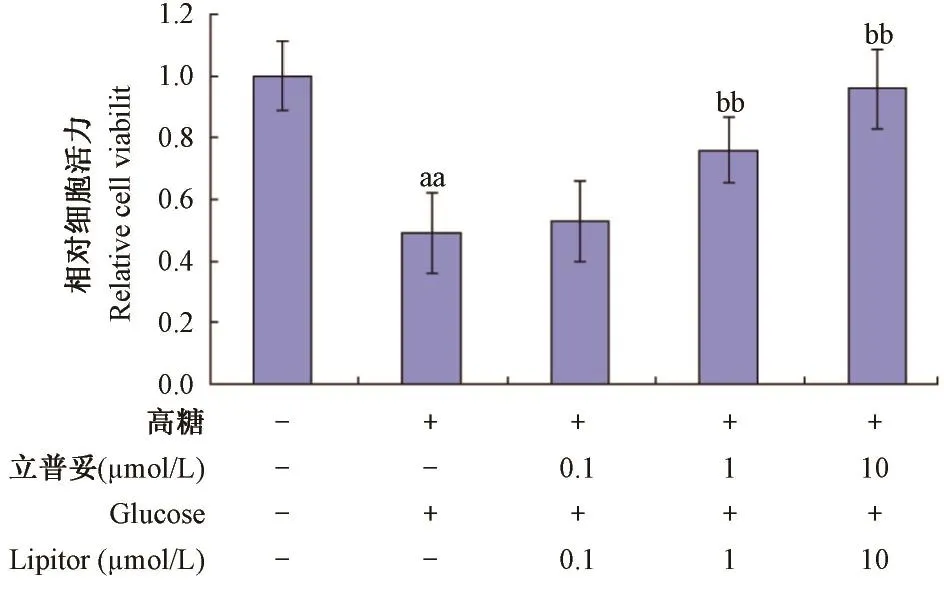
图2 立普妥对高糖诱导的HUVEC活力的影响Note:Compared with normal group,aaP<0. 01;Compared with model group,bbP<0. 01.Fig. 2 Effect of lipitor on viability of HUVEC induced by high glucose
2.2立普妥对高糖诱导的HUVEC凋亡的影响
如表1所示,与正常组比较,模型组中HUVEC早期凋亡和晚期凋亡细胞数目显著提高,具有显著性差异(P<0. 01);与模型组比较,0. 1,1,10 μmol/ L立普妥组HUVEC早期凋亡和晚期凋亡数目都显著降低,具有显著性差异(P<0. 05)。
表1 立普妥对高糖诱导的HUVEC凋亡的影响(±s)Tab. 1 Effect of lipitor on apoptosis of HUVEC

表1 立普妥对高糖诱导的HUVEC凋亡的影响(±s)Tab. 1 Effect of lipitor on apoptosis of HUVEC
注:与正常组比较,aaP<0. 01;与模型组比较,bP<0. 05,bbP<0. 01。Note:Compared with normal group,aaP<0. 01;Compared with model group,bP<0. 05,bbP<0. 01.
induced by high glucose(±s)组别 剂量(μmol/ L)早期凋亡(%)晚期凋亡(%)正常组组 - 0. 52±0. 13 2. 57±0. 19模型组(33. 3 M) - 8. 78±0. 55aa34. 41±3. 09aa0. 1 7. 98±1. 21b 26. 22±2. 99b立普妥组 1 6. 59±0. 59bb15. 84±1. 67bb10 3. 22±0. 30bb 9. 78±0. 55bb
2.3立普妥对高糖诱导的HUVEC中NO含量的影响
如图3所示,与正常组比较,模型组中NO含量下降,具有显著性差异(P<0. 01);与模型组比较,0. 1,1,10 μmol/ L立普妥组中NO含量显著提高,具有显著性差异(P<0. 05)。
2.5立普妥对高糖诱导的HUVEC中PI3K/ AKT信号通路的影响
如图4所示,与正常组比较,模型组中PI3K表达及AKT磷酸化程度降低,具有显著性差异(P<0. 01);与模型组比较,1,10 μmol/ L立普妥组PI3K表达量显著提高,具有显著性差异(P<0. 01);0. 1,1,10 μmol/ L立普妥组AKT磷酸化水平显著提高,具有显著性差异(P<0. 05)。
2.6立普妥对高糖诱导的HUVEC中eNOS表达量的影响
如图5所示,与正常组比较,模型组中eNOS表达量降低,具有显著性差异(P<0. 01);与模型组比较,0. 1,1,10 μmol/ L立普妥组中eNOS表达量显著提高,具有显著性差异(P<0. 01)。
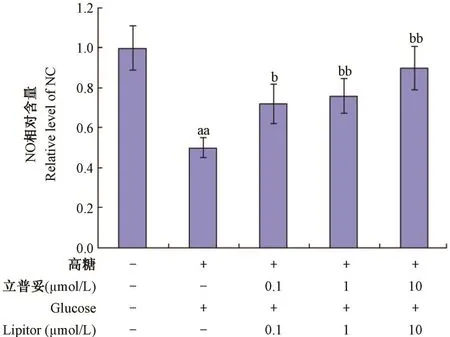
图3 立普妥对高糖诱导的HUVEC中NO含量的影响Note:Compared with normal group,aaP<0. 01;Compared with model group,bP<0. 05,bbP<0. 01.Fig. 3 Effect of lipitor on level of NO in HVEC induced by high glucose
3 讨论
糖尿病心血管病变始于内皮细胞功能紊乱,内皮细胞功能紊乱以内皮细胞凋亡加速,内皮细胞分泌因子失衡,内皮细胞与白细胞反应增多等主要表现。内皮细胞作为血管的机械屏障受损,成为内皮细胞功能紊乱的主要表现。并且糖尿病患者大血管病变危险性增高与高糖所导致的血管内皮细胞功能受损及内皮细胞凋亡有关。细胞凋亡具有典型的生化和形态学改变,主要表现为细胞膜出现囊泡、膜磷脂不对称消失、细胞膜皱缩、核固缩、DNA有序片段化等。Song[11],Chen等[12]实验发现在高糖环境下,HUVEC细胞凋亡显著。本实验发现与上述报告一致,即高浓度葡萄糖作为诱导剂,可使HUVEC细胞皱缩,细胞变圆变亮,细胞凋亡率提高。立普妥对同型半胱氨酸[7],氧化型低密度脂蛋白(ox-LDL)[8],肿瘤坏死因子-α[9]诱导的HUVEC凋亡。立普妥能立普妥亦能减轻ox-LDL诱导的人微血管内皮细胞损伤[13]。本实验也发现一定剂量立普妥能显著抑制高糖诱导的HUVEC细胞凋亡,并改善细胞形态,与谢彬等[10]观点一致。

图4 立普妥对高糖诱导的HUVEC中PI3K/ AKT信号通路的影响Note:Compared with normal group,aaP<0. 01;Compared with model group,bP<0. 05,bbP<0. 01.Fig. 4 Effect of lipitor on PI3K/ AKT signal pathway in HVEC induced by high glucose
高糖会使血管内皮依赖性血管舒张功能减退,血流速度下降,且血管舒张功能与血糖浓度负相关,提示高浓度的葡萄糖可诱导血管内皮细胞功能的异常[2]。NO是源于内皮细胞一种血管保护因子,广泛分布于各种组织,在信息传递,心肺功能,脏器血流调节等方面具有重要作用。正常生理条件下,由内皮型一氧化氮合酶(eNOS)催化产生,在高糖等条件下所产生的大量超氧阴离子可抑制eNOS的生物活性,使NO生成减少,抑制NO生物活性,使NO的血管保护作用减弱,因此改善血管内皮形态及NO及其合酶的含量具有重要意义。替米沙坦联合立普妥能改善糖尿病大鼠内皮形态及功能[14]。立普妥可通过提高NO含量来保护ox-LDL诱导的HUVEC缝隙连接,从而发挥抗动脉粥样硬化作用[8]。立普妥联合氨氯地平能抑制ox-LDL诱导的HUVEC内皮细胞损伤,与上调eNOS表达有关[15]。立普妥能通过提高NO含量来抑制ox-LDL诱导的HUVEC损伤[16]。立普妥能够促进eNOS蛋白及mRNA表达,减少ox-LDL诱导的副作用,并可以选择性地维持NO介导的内皮依赖性动脉松弛[17]。与上述报告一致,本实验也发现高糖诱导使NO及eNOS含量显著下降,给予一定剂量立普妥能使NO含量及eNOS表达量显著上升,说明立普妥可通过刺激NO表达来改善内皮功能。
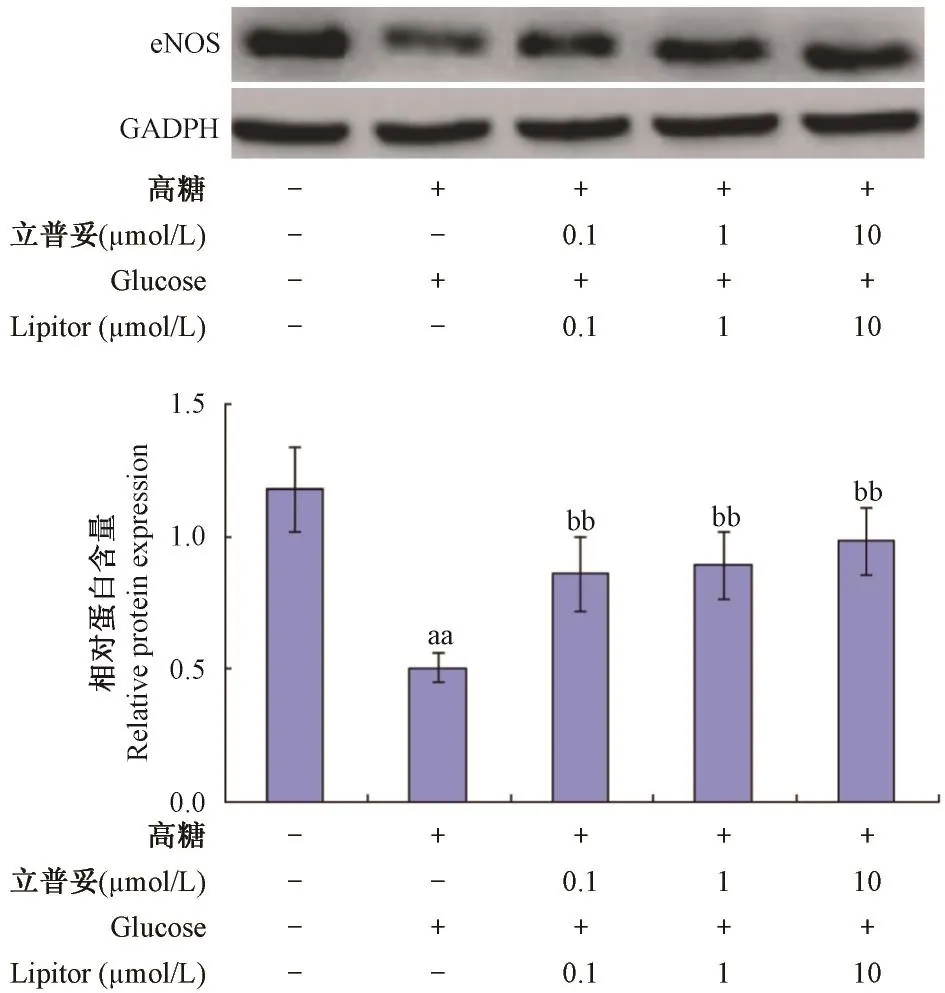
图5 立普妥对高糖诱导的HUVEC中eNOS表达量的影响Note:Compared with normal group,aaP<0. 01;Compared with model group,bbP<0. 01.Fig. 5 Effect of lipitor on the expression of eNOS in HVEC induced by high glucose
磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路参与内皮细胞增殖、分化、凋亡、NO分泌等多种细胞功能的调节。HUVEC的凋亡与PI3K/ AKT信号通路密切相关[18]。高糖诱导的HUVEC凋亡是通过PI3K/ AKT信号通路实现的[19-20]。因此激活PI3K/ AKT信号通路一定程度上可维持HUVEC细胞活性。并且已报道立普妥可以通过激活PI3K/ AKT通路来抑制谷氨酸诱导的大鼠神经元损伤[21]。立普妥可通过激活PI3K/ AKT信号通路来GK大鼠心肌缺血再灌注损伤[22]。立普妥可通过激活PI3K/ AKT/ GSK3β信号通路来减轻缺血复合冷应激诱导的大鼠心肌损伤[23]。立普妥可以通过激活PI3K/ AKT/ mTOR通路来刺激大鼠皮质神经元突起生长[24]。与上述报告类似,本实验也发现高糖诱导使PI3K表达量及AKT磷酸化水平显著降低,给予一定剂量立普妥能使PI3K表达量及AKT磷酸化水平显著提高,说明立普妥可通过激活PI3K/ AKT信号通路来维持内皮细胞存活。
糖尿病造成PI3K/ AKT信号级联的失活,eNOS是调控内皮源性一氧化氮产生的关键酶,亦受PI3K/ AKT信号通路调控。高胰岛素可通过PI3K/ AKT/ eNOS信号通路损伤HUVEC,产生胰岛素抵抗等代谢综合征及2型糖尿病[25]。胰高血糖素样肽-1能减轻高糖引起的HUVEC凋亡,与激活PI3K/ AKT/ eNOS信号通路有关[26]。骨钙蛋白可通过激活PI3K/ AKT/ eNOS通路减轻高脂饮食诱导的内皮依赖性舒张损伤[27]。罗格列酮[28],α-亚麻酸[29]可通过PI3K/ AKT/ eNOS信号通路抑制高糖诱导的HUVEC凋亡。从而进一步说明,立普妥也是通过PI3K/ AKT/ eNOS信号通路减轻高糖诱导的HUVEC凋亡。
综上所述,立普妥可抑制高糖诱导的HUVEC细胞凋亡,并提高细胞活力改善细胞形态,与激活PI3K/ AKT/ eNOS信号通路有关。
参考文献:
[1] Sardar P,Udell JA,Chatterjee S,et al. Effect of intensive versus standard blood glucose control in patients with type 2 diabetes mellitus in different regions of the world:systematic review and meta-analysis of randomized controlled trials[J]. J Am Heart Assoc,2015,4(5).
[2] Stubbs B,Vancampfort D,De Hert M,et al. The prevalence and predictors of type two diabetes mellitus in people with schizophrenia:a systematic review and comparative meta-analysis [J]. Acta Psychiatr Scand,2015.
[3] 李运成.阿托伐他汀对2型糖尿病合并急性脑梗死患者血清内脂素的干预作用[J].中国实用医药,2014,9(31):131 -132.
[4] 郭雅卿,赵丹宁,巩建萍,等.不同剂量阿托伐他汀对老年2型糖尿病患者维生素D和骨密度的影响[J].中国全科医学,2011,14(7A):2169-2171.
[5] 张建宁.超声观察立普妥逆转2型糖尿病患者动脉硬化斑块的疗效评价[J].中国医学工程,2012,20(10):148-149.
[6] 刘骁.不同剂量阿托伐他汀对老年ACS患者血浆hs-CRP及NT-proBNP表达的影响[J].重庆医学,2014,43(12):1532 -1533.
[7] 李录,邱荣荣,贾绍斌,等.阿托伐他汀调节Bcl-2/ Bax蛋白表达抑制同型半胱氨酸诱导内皮细胞凋亡[J].中国现代医学杂志,2014,24(30):24-27.
[8] 张秀梅,于晓玲,申玉超,等.阿托伐他汀对ox-LDL诱导的人脐静脉内皮细胞缝隙连接的影响[J].中国药房,2013,24 (5):412-415.
[9] 牛荣华,毛德军,臧运华,等.阿托伐他汀下调肿瘤坏死因子-α诱导的人脐静脉内皮细胞CD40配体的表达[J].现代免疫学,2014,34(3):237-241.
[10] 谢彬,吕湛,苟连平,等.阿托伐他汀通过调节Bcl-2/ Bax蛋白表达抑制高糖诱导的人脐静脉内皮细胞凋亡[J].中国动脉硬化杂志,2010,18(12):943-947.
[11] Song H,Wu F,Zhang Y,et al. Irisin promotes human umbilical vein endothelial cell proliferation through the ERK signaling pathway and partly suppresses high glucose-induced apoptosis [J]. PLoS One,2014,9(10):e110273.
[12] Hou Q,Lei M,Hu K,et al. The effects of high glucose levels on reactive oxygen species-induced apoptosis and involved signaling in human vascular endothelial cells[J]. Cardiovasc Toxicol,2015,15(2):140-146.
[13] 李敏,孙玲,李红玲,等.阿托伐他汀减轻氧化型低密度脂蛋白导致的人微血管内皮细胞活化和损伤[J].中国药理学通报,2014,30(5):679-683.
[14] 吴仕平,陈明.替米沙坦联合阿托伐他汀对糖尿病大鼠内皮细胞形态、功能的影响[J].中国动脉硬化杂志,2010,18(7):542-546.
[15] 高艳芳,汤嘉宁.阿托伐他汀与氨氯地平对ox-LDL损伤的人脐静脉内皮细胞LOX-1和eNOS表达的影响[J].中国药物与临床,2012,12(7):884-886.
[16] 李艳伟,于晓玲,申玉超.阿托伐他汀对ox-LDL诱导的人脐静脉内皮细胞中Wnt信号通路及相关因子表达的影响[J].中国药房,2014,25(17):1574-1577.
[17] Wassmann S,Laufs U,Baumer AT,et al. HMG-CoA reductase inhibitors improve endothelial dysfunction in normocholesterolemic hypertension via reduced production of reactive oxygen species[J]. Hypertension,2001,37(6):1450 -1457.
[18] Li P,Guo X,Lei P,et al. PI3K/ Akt/ uncoupling protein 2 signaling pathway may be involved in cell senescence and apoptosis induced by angiotensin II in human vascular endothelial cells[J]. Mol Biol Rep,2014,41(10):6931-6937.
[19] Chen HF,Liu SJ,Chen G. Heat shock protein 27 phosphorylation in the proliferation and apoptosis of human umbilical vein endothelial cells induced by high glucose through the phosphoinositide 3kinase/ Akt and extracellular signalregulated kinase 1/2 pathways[J]. Mol Med Rep,2015, 11(2):1504-1508.
[20] Sheu ML,Ho FM,Yang RS,et al. High glucose induces human endothelial cell apoptosis through a phosphoinositide 3-kinaseregulated cyclooxygenase-2 pathway[J]. Arterioscler Thromb Vasc Biol,2005,25(3):539-545.
[21] 丁奇,董燕,金英,等.阿托伐他汀对谷氨酸引起大鼠神经元损伤保护作用机制的研究[J].中国药理学通报,2010,26 (12):1635-1640.
[22] 程振东,吴灵振,郭进建,等.阿托伐他汀后处理对GK大鼠心肌缺血再灌注损伤的保护作用[J].中国动脉硬化杂志,2012,20(8):709-713.
[23] 黄茶花,谢遥,黄晓,等.阿托伐他汀减轻缺血复合冷应激诱导的大鼠心肌损伤[J].基础医学与临床,2011(11):1200 -1204.
[24] 屈文慧,郁盛雪,隋海娟,等.阿托伐他汀通过激活PI3K/ Akt/ mTOR信号转导而促进神经元突起生长[J].中国药理学与毒理学杂志,2013,27(2):150-155.
[25] Madonna R,De Caterina R. Prolonged exposure to high insulin impairs the endothelial PI3-kinase/ Akt/ nitric oxide signalling [J]. Thromb Haemost,2009,101(2):345-350.
[26] Yuan X,Chen K,He H,et al.[Effect of GLP-1 on high glucose-induced human umbilical vein endothelial cell apoptosis and mechanism][J]. Zhongnan Daxue Xuebao Yixue Ban,2013,38(10):1029-1034.
[27] Dou J,Li H,Ma X,et al. Osteocalcin attenuates high fat dietinduced impairment of endothelium-dependent relaxation through Akt/ eNOS-dependent pathway[J]. Cardiovasc Diabetol,2014,13:74.
[28] Wu J,Lei MX,Xie XY,et al. Rosiglitazone inhibits high glucose-induced apoptosis in human umbilical vein endothelial cells through the PI3K/ Akt/ eNOS pathway[J]. Can J Physiol Pharmacol,2009,87(7):549-555.
[29] Zhang W,Wang R,Han SF,et al. Alpha-linolenic acid attenuates high glucose-induced apoptosis in cultured human umbilical vein endothelial cells via PI3K/ Akt/ eNOS pathway [J]. Nutrition,2007,23(10):762-770.
〔修回日期〕2016-01-10
Effect of lipitor on high glucose-induced HUVEC apoptosis and PI3K/ AKT/ eNOS signal pathway
LIU Zhi-hui
(Department Cardiovascular of the First People’s Hospital,Jingdezhen,Jiangxi Jingdezhen 333000,China)
【Abstract】Objectives To explore effect of lipitor on apoptosis and phosphatidyl inositol-3-kinase(PI3K)/ protein kinase B(AKT)/ endothelial nitric oxide synthase(eNOS)signal pathway in high glucose-induced human umbilical vein endothelial cell(HUVEC). Methods The cases were randomly divided into normal control group,model control group(33. 3 mol/ L glucose),lipitor low,medium,high-dose group(0. 1,1,10 μmol/ L lipitor). The viability of HUVEC was detected by MTT assay. The morphology of HUVEC was photographed by inverted microscope. The apoptosis of HUVEC was examed by Annexin V-FITC/ PI flow dual-staining method. The concertration of NO in HUVEC supernatant was exmaed by Gries method. The activation of PI3K/ AKT and expression of eNOS was assayed by western blot. Results HUVEC was shrinkage,rounded and brighten,the viability of HUVEC decreased,early and late apoptosis rate of HUVEC increased significantly,the level of NO,eNOS,PI3K and AKT phosphorylation also reduced in model control group(P<0. 01). 1,10 μmol/ L lipitor improved HUVEC morphology,increased HUVEC’viability and expression of PI3K(P<0. 05). 0. 1,1,10 μmol/ L lipitor suppressed HUVEC’apoptosis,increased the concentration of NO,expression of eNOS and phosphorylation of AKT(P<0. 05). Conclusion These results suggested lipitor exert anti-apoptosis in high glucose -induced HUVEC,which might be related to PI3K/ AKT/ eNOS signal pathway.
【Key words】Lipitor;HUVEC;Apoptosis;PI3K/ AKT/ eNOS signal pathway
【中图分类号】R-332
【文献标识码】A
【文章编号】1671-7856(2016)03-0058-06
doi:10. 3969. j. issn. 1671-7856. 2016. 03. 012

