纳米胶束共同递送DOX和Bcl-2 siRNA对MCF-7乳腺癌细胞的杀伤作用
锁爱莉,王何静,钱军民,刘茸茸,姚 煜
(西安交通大学:1. 第一附属医院肿瘤内科,陕西西安 710061;2. 金属材料强度国家重点实验室,陕西西安 710049)
◇基础研究◇
纳米胶束共同递送DOX和Bcl-2 siRNA对MCF-7乳腺癌细胞的杀伤作用
锁爱莉1,王何静1,钱军民2,刘茸茸2,姚煜1
(西安交通大学:1. 第一附属医院肿瘤内科,陕西西安710061;2. 金属材料强度国家重点实验室,陕西西安710049)
摘要:目的制备能同时装载阿霉素(DOX)和Bcl-2 siRNA的纳米胶束,利用MCF-7人乳腺癌细胞探讨其细胞毒性和摄取效果。方法还原胺化法和碳二亚胺法合成共聚物聚乙二醇-聚乙烯亚胺-聚L-谷氨酸-γ-苄酯(PEG-PEI-PBLG),核磁共振氢谱确认其化学结构。透析法制备空白和载药纳米胶束,透射电子显微镜和动态光散射法表征其形貌和粒径分布;凝胶电泳方法确定纳米胶束压缩Bcl-2 siRNA的能力;荧光光谱和透析法探讨纳米胶束释药行为;共聚焦激光扫描显微镜观察纳米胶束被细胞摄取情况;MTT比色法检测细胞毒性。结果PEG-PEI-PBLG的临界胶束质量浓度约为4 mg/L,自组装形成的空白和载药纳米胶束粒径均小于200 nm;纳米胶束包埋DOX的载药效率和载药量分别为88.7%和15.1%,载DOX纳米胶束在N/P≥64时可有效压缩Bcl-2 siRNA;载DOX和Bcl-2 siRNA的纳米胶束的zeta电位为+30 mV;DOX和Bcl-2 siRNA释放行为具有pH敏感性,其中Bcl-2 siRNA释放pH敏感性更强;纳米胶束可将DOX和Bcl-2 siRNA同时递送进MCF-7细胞,其细胞毒性高于DOX(P<0.05)。结论PEG-PEI-PBLG纳米胶束能同时装载并递送DOX和Bcl-2 siRNA进入MCF-7细胞,显著增强了DOX的细胞毒性,提示该纳米胶束是化疗药和基因物质共同递送的潜在优良载体。
关键词:纳米胶束;化疗;Bcl-2小干扰RNA;联合治疗;乳腺癌;MCF-7细胞;细胞摄取
乳腺癌是全球女性最常见的恶性肿瘤。据世卫组织国际癌症研究中心估计,每年全球新发女性乳腺癌病例达115万,占女性恶性肿瘤发病的22.7%。我国虽属低发国家,但上升趋势明显,2014年我国乳腺癌新发数量和死亡数量分别占全世界的12.2%和9.6%。作为乳腺癌治疗的重要手段的化疗,存在肿瘤细胞易产生耐药性、化疗药物肿瘤选择性差、毒副作用大等缺点[1]。近年来,小干扰RNA(siRNA)被视为潜在的肿瘤高效治疗新技术,受到研究者的广泛重视。将siRNA与化疗联合施用,通过沉默妨碍化疗药物发挥作用的特定基因/蛋白质表达[2],可有效降低化疗的毒副作用和克服肿瘤细胞的耐药性,从而提高化疗效果[3]。然而,裸露的siRNA呈负电性,存在易被核酸酶降解、细胞膜穿透能力差、半衰期短、非特异性免疫刺激等不足,极大地限制了其临床应用。为此,开发能在体内保护siRNA并实现其安全递送的纳米载体就成了纳米医学领域的研究热点之一。目前,纳米药物载体研究多集中于脂质体、聚合物胶束、纳米凝胶、功能性无机纳米粒等形式,这些纳米载体可经肿瘤组织增强渗透滞留效应(EPR)实现在肿瘤处的聚集,提高药物的利用率[4]。其中,聚合物纳米胶束因具有核壳结构、合成方法灵活、功能多、载药量大等优点,成为研究的重点[5]。本研究制备一种新型聚合物纳米胶束,用其作为载体将阿霉素(DOX)和Bcl-2 siRNA共同递送至MCF-7乳腺癌细胞,评价Bcl-2 siRNA和DOX协同杀伤MCF-7细胞的能力。
1材料与方法
1.1材料与试剂聚乙二醇单甲醚(mPEG,2 ku)、聚乙烯亚胺(PEI,1.8 ku)、NaBH3CN和N,N’-羰基二咪唑购自Sigma-Aldrich公司;阿霉素盐酸盐(DOX·HCl)购自浙江海正药业股份有限公司;Bcl-2 siRNA购自上海吉玛制药技术有限公司,正义链:5′-GUACAUCCAUUAUAAGCUGdTdT-3′,反义链:5′-CAGCUUAUAAUGGAUGUAC-dTdT-3′;高糖DMEM培养基购自北京寰宇科创生物科技发展有限公司;胎牛血清购自杭州四季青生物工程材料公司;胰蛋白酶购自北京格源天润生物技术有限公司;人乳腺癌细胞株MCF-7由西安交通大学第一附属医院转化医学中心提供。
1.2方法
1.2.1PEG-PEI-PBLG共聚物的合成首先根据文献[6-7]合成出醛基化聚乙二醇和端氨基聚(L-谷氨酸-γ-苄酯)(PBLG-NH2,Mn=6 ku);接着,将1 g PEI和3 g醛基化聚乙二醇溶于25 mL水中,用盐酸将pH值调至6~7.5,随后加入186 mg NaBH3CN进行还原胺化反应,反应液经透析(截留分子质量为3.5 ku,以下相同)和冷冻干燥后得到淡黄色固体PEG-PEI;另外,将3.2 g经N,N’-羰基二咪唑活化的PBLG-NH2溶于30 mL DMF中,将该溶液与含1.6 g PEG-PEI的15 mL DMF溶液混合,室温反应12 h后进行透析和冷冻干燥,得到PEG-PEI-PBLG共聚物,收率为87.5%。共聚物化学结构用1H NMR谱(Bruker 400 MHz,瑞士BRUKER公司)表征。
1.2.2PEG-PEI-PBLG纳米胶束的制备采用透析法制备纳米胶束,即将质量浓度为2 mg/mL的PEG-PEI-PBLG共聚物的DMSO溶液装于透析袋中,对蒸馏水透析并定时换水,得到纳米胶束溶液。纳米胶束粒径分布/zeta电位和形貌分别用动态光散射法(DLS,Nano-ZS90纳米粒度仪,英国马尔文公司)和透射电子显微镜(TEM,JEM-200CX,日本JEOL公司)表征。为评估共聚物形成纳米胶束的能力,采用芘荧光探针法(LS55型荧光分光光度计,美国Perkin Elmer公司)检测临界胶束浓度。共聚物质子缓冲能力测试在0.15 mol/L的氯化钠溶液中进行,以吸收盐酸量来评价。
1.2.3DOX和Bcl-2 siRNA在纳米胶束中的装载和释放行为采用透析法,通过共聚物和DOX共同自组装过程,将DOX包埋于纳米胶束内核中[8],即将30 mg共聚物和10 mg脱除HCl的DOX溶于DMSO中,用pH 7.4的磷酸盐缓冲液(PBS)透析,冻干后得到载DOX的纳米胶束。纳米胶束装载DOX的能力用载药效率(包埋进纳米胶束的DOX占初始添加DOX的百分比)和载药量(纳米胶束中DOX含量百分比)表征[9],其中DOX量根据DOX浓度-荧光强度关系的标准曲线确定(y=154.48x-1.622,R2=0.998 6,线性范围为0.01~2 μg/mL)。利用琼脂糖凝胶电泳实验评价纳米胶束经静电作用复合Bcl-2 siRNA的能力。主要过程为:在一系列特定浓度的纳米胶束溶液(DMSO/DEPC水混合溶剂,体积比1/9)中分别加入Bcl-2 siRNA溶液(1 μL),混合均匀后静置40 min;接着,在每个样品溶液中加入2.5 μL上样缓冲液,混合均匀后各取10 μL进行电泳实验(80 mV,35 min),用溴化乙锭进行荧光染色;最后,用凝胶成像系统(美国Bio-rad公司)对凝胶板进行观察并拍照。载DOX和siRNA后的纳米胶束用纳米粒度仪和TEM表征。
利用透析法研究纳米胶束中DOX和Bcl-2 siRNA的释放行为,其中Bcl-2 siRNA用羧基荧光素(FAM)进行标记,记作FAM-siRNA。主要过程为:将载DOX的纳米胶束分散于DEPC水中,得到6 mL、质量浓度为1 mg/mL的纳米胶束悬浮液,再按N/P=64复合FAM-siRNA;随后,将悬浮液分成2等份,分别在pH 7.4和5.0、温度37 ℃、浓度2 mmol/L的60 mL PBS中透析,摇床转动速度为100 r/min;在透析期间预定时间点,吸取透析液3 mL(取后补充相应体积PBS,以维持透析液体积不变),用荧光分光光度计检测其中DOX和FAM-siRNA的荧光强度,与各自标准曲线对照获得对应浓度数值。FAM-siRNA的标准曲线为y=0.455 3x+0.218 7(R2=0.999,线性范围为1~200 nmol/L)。DOX激发光波长为480 nm,发射光波长为590 nm;FAM-siRNA激发光为488 nm,发射光波长为520 nm。
1.2.4载DOX/siRNA纳米胶束的细胞摄取和细胞毒性在用共聚焦激光显微镜(CLSM)观察纳米胶束细胞摄入时,将处于对数生长期的MCF-7人乳腺癌细胞经胰蛋白酶消化,以5×104个/孔的细胞密度种于激光共聚焦玻底培养皿中,经过夜培养、细胞贴壁生长后,利用新鲜培养液或含纳米胶束的培养液置换原培养液,再培育4 h或24 h。培养结束后,吸弃培养液,用PBS洗涤细胞3次以除去未被细胞摄入的纳米胶束。清洗后的细胞依次经40 g/L多聚甲醛溶液固定30 min、PBS洗涤3次、DAPI染色液染色5 min、PBS洗涤3次,得到待观察样品。将这些样品放置于共聚焦激光扫描显微镜(FV-1000,日本Olympus公司)下用油镜观察。其中,蓝色为DAPI染色细胞核的荧光,红色为DOX的荧光,绿色为FAM-siRNA的荧光。
用MTT比色法测试空白和载药纳米胶束的细胞毒性,具体实验过程如下:将单细胞悬液以3×103个/孔的密度种植于96孔板中,在含100 mL/L胎牛血清的高糖培养基中培养过夜,然后用含不同纳米胶束的新鲜培养液置换培养板孔中原培养液,培养24 h或48 h后向培养孔中加入20 μL MTT溶液(5 mg/mL),继续培养4 h后去除培养液并加入150 μL DMSO,以溶解甲臜晶体,摇床震荡10 min后用酶标仪测量每孔的吸光度值,以未加纳米胶束的孔为对照组计算细胞成活率。
2结果
2.1共聚物PEG-PEI-PBLG的化学结构及其纳米胶束表征为验证合成共聚物的化学结构,用1H NMR对PEG-PEI和PEG-PEI-PBLG进行了表征,结果发现在PEG-PEI-PBLG的1H NMR谱中,除PEG和PEI的质子化学位移峰外(图1A),还在化学位移为7.24、5.09和4.0处观察到PBLG中不同基团中质子的信号(图1B),这些信息确认了PEG-PEI-PBLG的成功合成。PEG-EPI-PBLG具有在水相中自组装形成纳米胶束的能力,其临界胶束浓度约为4 mg/L。PEG-PEI-PBLG纳米胶束粒径分布较窄,集中于20~100 nm范围内,平均粒径为55 nm,zeta电位+47.8 mV,形状为近球形(图1C、1D)。TEM照片中粒径比DLS法测得的要小一些,这是由亲水性成分(PEG和PEI)在TEM样品制备中干燥收缩造成的。
2.2PEG-PEI-PBLG纳米胶束装载DOX和Bcl-2 siRNA的性能纳米胶束装载DOX的载药量和载药效率分别为15.1%和88.7%,装载DOX后纳米胶束粒径增大,平均粒径约为114 nm,形貌维持不变(图2A、2B)。凝胶电泳实验结果表明,空白和载DOX纳米胶束压缩Bcl-2 siRNA的能力均随N/P比增加而增强,完全阻滞时的N/P比分别为32和64(图2C)。装载DOX后,纳米胶束压缩siRNA的能力略有下降。与对照NaCl溶液相比,PEG-PEI-PBLG溶液具有很强的质子缓冲能力,表明其PEI组分保持了PEI优异的“质子海绵效应”(图2D)。按N/P比为64装载siRNA后,近球形的纳米胶束平均粒径降至93 nm(图2E、2F),zeta电位降至+30 mV。

图1共聚物PEG-PEI-PBLG及其纳米胶束表征
Fig.1 Characterizations of PEG-PEI-PBLG copolymer and its self-assembled nanomicelles
A:PEG-PEI的1H NMR谱;B:PEG-PEI-PBLG的1H NMR谱;C:纳米胶束粒径分布;D:纳米胶束TEM照片。
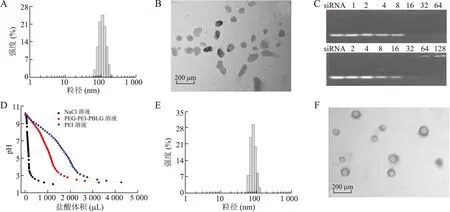
图2PEG-PEI-PBLG纳米胶束装载DOX和Bcl-2 siRNA的能力
Fig.2 Loading capacity of DOX and Bcl-2 siRNA by the PEG-PEI-PBLG nanomicelles
A:载DOX纳米胶束的粒径分布;B:载DOX纳米胶束的TEM照片;C:空白胶束(上)和载DOX胶束(下)复合siRNA后的凝胶电泳结果;D:PEG-PEI-PBLG质子缓冲能力;E:载DOX/siRNA纳米胶束的粒径分布;F:载DOX/siRNA纳米胶束的TEM照片。
2.3载DOX/siRNA纳米胶束的体外药物释放行为为探究载DOX/siRNA纳米胶束的药物释放动力学,测试了正常生理pH值(7.4)和模拟肿瘤细胞内酸性pH值(5.0)时的释放速度(图3)。结果发现,DOX和Bcl-2 siRNA的释放行为均具有pH敏感性,即pH 5.0时的释放速度均大于pH 7.4时的,其中Bcl-2 siRNA释放速度对pH值的敏感性更大。
2.4载DOX/siRNA纳米胶束被MCF-7乳腺癌细胞摄取情况为探究载DOX/Bcl-2 siRNA纳米胶束被MCF-7细胞摄取情况,MCF-7细胞经载DOX/Bcl-2 siRNA的纳米胶束处理4 h和24 h后用CLSM观察(图4)。结果发现,细胞处理4 h后就能在细胞核及其周围观察到DOX的红色荧光和FAM-siRNA的绿色荧光,说明纳米胶束能被细胞有效摄取;处理24 h后,红色荧光和绿色荧光明显增强并已分开,细胞核上聚集的DOX增多,表明DOX和Bcl-2 siRNA已从纳米胶束中释放出来。
2.5载DOX/Bcl-2 siRNA纳米胶束的细胞毒性为评价DOX和Bcl-2 siRNA的协同抗癌作用,用MTT比色法比较了空白、载DOX和载DOX/Bcl-2 siRNA三种纳米胶束对MCF-7细胞的毒性(图5)。主要结果为空白、载DOX和载DOX/Bcl-2 siRNA三种纳米胶束处理24 h后细胞存活率分别为(99.4±2.5)%、(82.3±3.1)%和(56.7±2.8)%,而处理48 h后细胞存活率分别为(101.6±3.2)%、(62.2±4.3)%和(38.6±2.2)%。通过对相同处理时间(24 h 或48 h)不同纳米胶束组细胞存活率统计发现,载DOX纳米胶束组细胞存活率小于空白纳米胶束组(P<0.05),而载DOX/Bcl-2 siRNA纳米胶束组细胞存活率小于空白和载DOX纳米胶束组(P<0.05)。通过比较空白纳米胶束组24 h和48 h时的细胞存活率发现,二者没有统计学差异(P>0.05),说明空白胶束没有明显的细胞毒性。这些结果表明Bcl-2 siRNA和DOX共同递送可以增强DOX的细胞毒性。
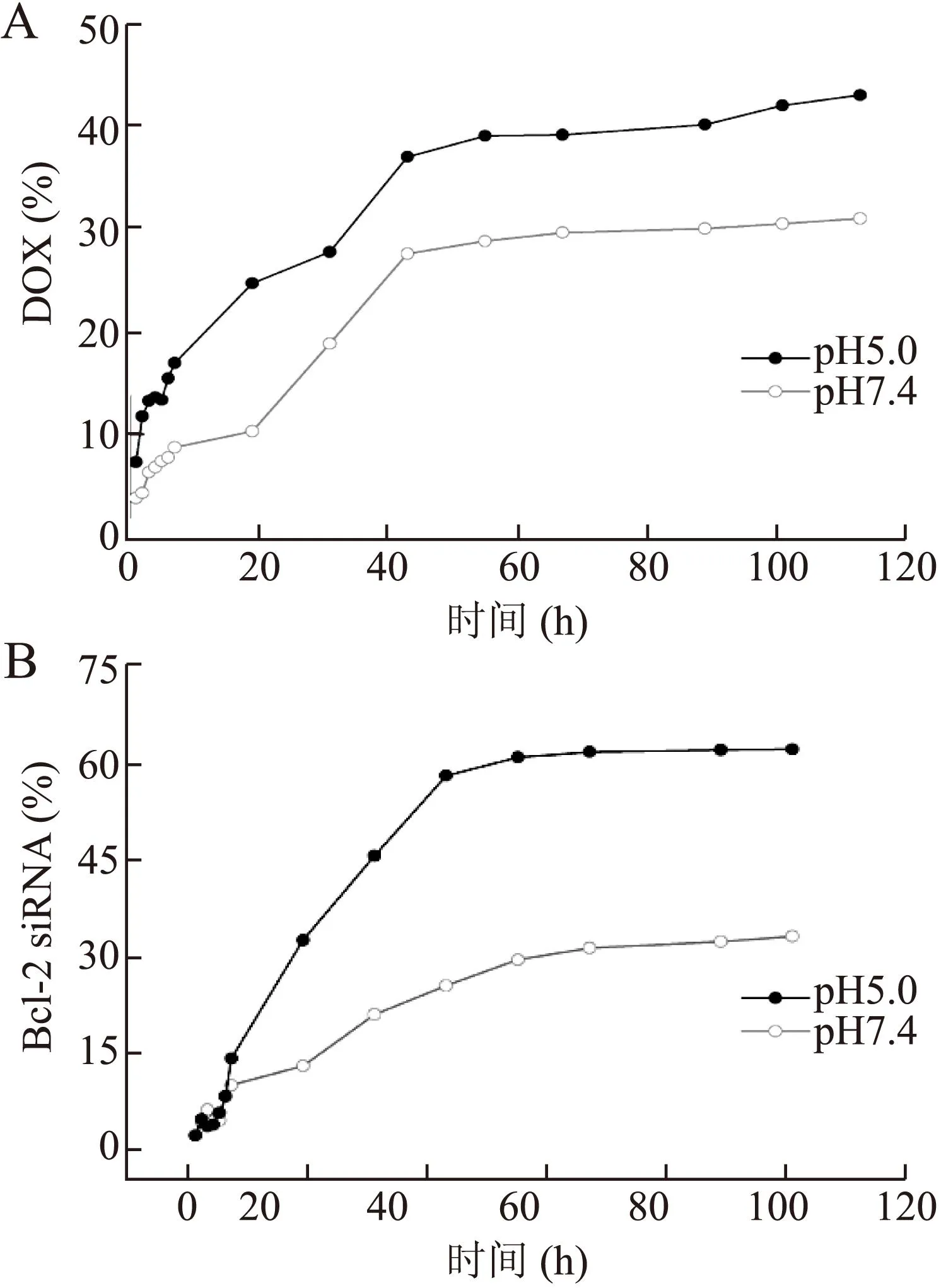
图3载DOX/Bcl-2 siRNA纳米胶束在pH7.4和5.0时的药物释放曲线
Fig.3 Release profiles of DOX and Bcl-2 siRNA from DOX/siRNA-loaded nanomicelles
A:DOX释放行为;B:Bcl-2 siRNA释放行为。

图4MCF-7乳腺癌细胞被载DOX/siRNA纳米胶束处理4 h和24 h后的CLSM图
Fig.4 CLSM images of MCF-7 cells treated with DOX/siRNA-loaded nanomicelles for 4 h and 24 h
3讨论
乳腺癌是危害女性健康的主要致命性疾病之一,化疗在其治疗中占据重要地位。化疗是通过具有抗癌作用的化学药物杀死癌细胞达到治疗目的的,然而绝大多数化疗药物存在难溶于水、缺乏肿瘤选择性、体内半衰期短等问题,造成毒副作用大,难以直接通过大幅提高剂量增强治疗效果。化疗的另一个重要问题是,肿瘤细胞在化疗过程中易产生多重耐药性,极大限制了化疗效果。为克服上述缺点,开发纳米药物载体被视为很有前景的技术手段,这些纳米载体以物理或化学方式高效装载药物,在提高化疗药水溶性、延长体内循环时间、改善体内药物代谢动力学和增强肿瘤组织靶向性等方面具有重要作用。另一方面,人们现已认识到癌症属于基因病,针对癌细胞的基因治疗已成为新的研究热点,它有望从源头上克服肿瘤多药耐药性,被认为是攻克癌症最有效的途径之一。siRNA作为一种高效基因沉默技术,已成为癌症治疗研究中的热点之一。然而,制约siRNA临床应用的最大障碍是体内半衰期极短(仅为几分钟)和无法穿透细胞膜。尽管目前已建立起电穿孔法、超声微泡法和注射法等,但疗效并不理想。siRNA治疗成功的关键是开发适用于siRNA的输送体系,不仅能在体内血液循环中保护siRNA,还要能被癌细胞有效内化并实现细胞内转运。阳离子型脂质体和聚合物为其提供了可能,与转染效率较高的病毒类载体相比,它们在装载能力和安全性方面优势突出,已成为基因物质递送的主要研究方向。最经典的非病毒类基因递送载体是PEI和脂质体2000,其中PEI稳定性更好。由于它们固有的阳离子表面性质使其不能直接用于体内,需要对其表面进行修饰如PEG化,以屏蔽表面电荷和增强稳定性[10]。一些研究表明,将化疗药和siRNA同时装载于纳米载体中,可有效克服肿瘤耐药性和提高化疗疗效[11]。然而,开发此类纳米载体富有挑战性,其中制备阳离子型纳米胶束是一个重要方向。
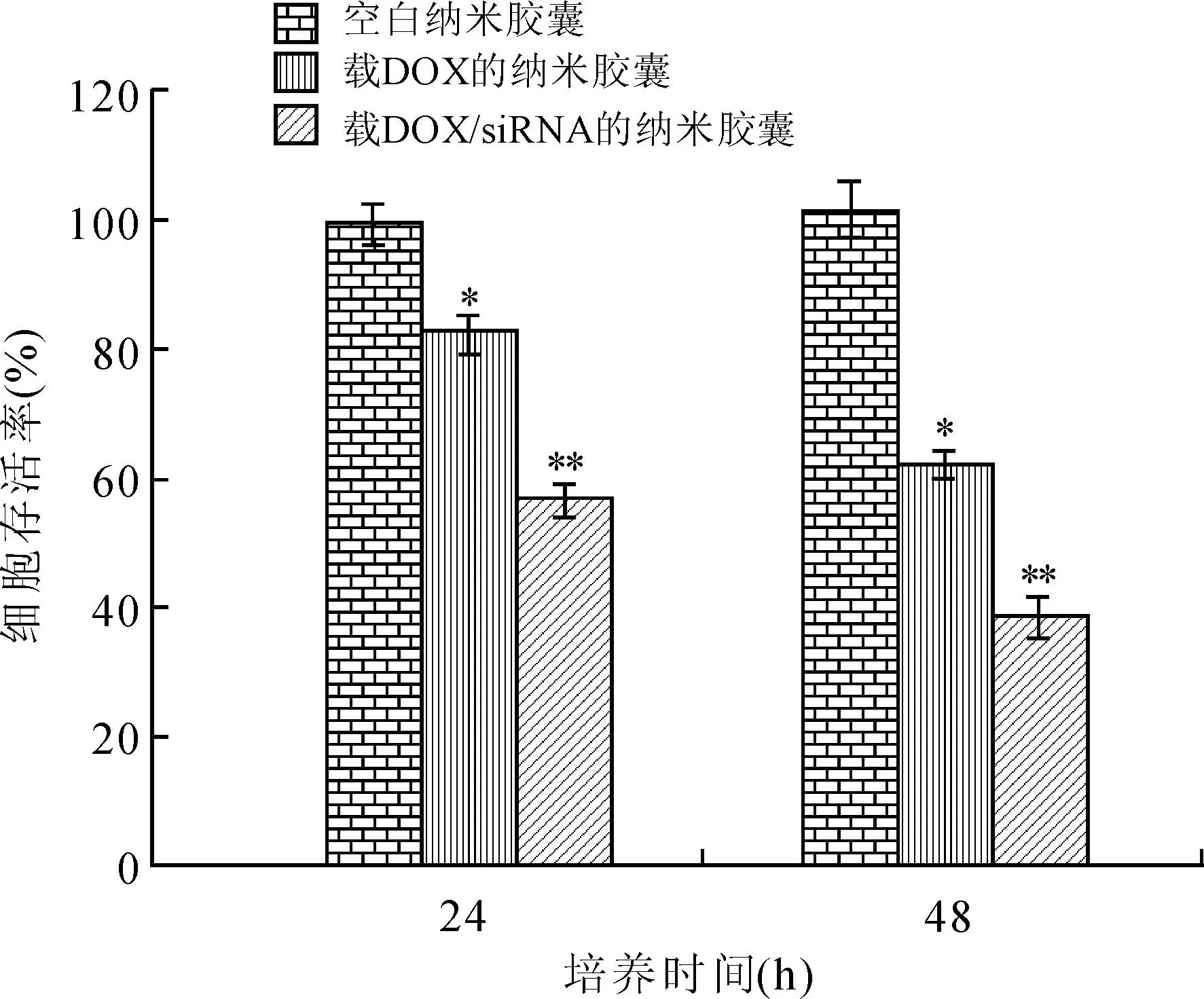
图5用空白、载DOX和载DOX/siRNA 3种纳米胶束处理MCF-7细胞24 h和48 h后的MTT结果
Fig.5 Cell viability of MCF-7 cells cultured with blank, DOX-loaded and DOX/siRNA-loaded nanomicelles for 24 and 48 h measured by MTT assayDOX等量浓度为2 μg/mL,N/P比为64;与空白纳米胶束组比较,*P<0.05;与空白纳米胶束组和载DOX组比较,**P<0.05。
本文旨在利用阳离子型聚合物(PEG-PEI-PBLG)纳米胶束同时装载化疗药DOX和Bcl-2 siRNA并将其递送至MCF-7乳腺癌细胞中,实现协同抗癌作用。1H NMR谱证实了合成共聚物的化学结构,主要化学位移与文献值一致[12-13]。在该纳米胶束中,疏水段PBLG与DOX经疏水作用自组装形成内核,阳离子成分PEI与Bcl-2 siRNA经静电作用形成复合层覆盖于内核上,而PEG段起到稳定胶束和屏蔽电荷作用。判断聚合物形成纳米胶束能力及胶束稳定性的一个重要指标是临界胶束浓度,其值越小意味着聚合物形成纳米胶束的能力越强,在水相中的稳定性越好。本文合成聚合物的临界胶束浓度约为4 mg/L,说明其形成的纳米胶束在浓度很低时仍能稳定存在,在实际用作药物载体时不会因注射时稀释而释放药物。聚合物纳米胶束的理化性质如粒径、表面电荷、化学结构等,对药物装载效果、药物释放行为、细胞摄取行为等均有重要影响。本研究结果表明,聚合物纳米胶束装载DOX的载药量和装载效率分别为15.1%和88.7%,如此高的载药效果是因为聚合物疏水成分PBLG和DOX均含有芳环,增强了自组装过程中PBLG和DOX之间的相互作用;在N/P≥64时,纳米胶束即可有效压缩siRNA,说明纳米胶束中PEI组分保持了原始PEI优异的“质子海绵效应”[14],这也从聚合物具有良好的质子缓冲能力得到印证。该质子缓冲能力主要源自PEI含有高密度的伯胺、仲胺和叔胺三种阳离子基团,这种性质有助于纳米胶束从内涵体/溶酶体逃逸进入细胞质,提高药物疗效和细胞转染效率[15]。纳米胶束装载DOX和siRNA后呈近球形形貌,最大粒径小于150 nm,粒径分布范围很窄,zeta电位为+30 mV。此时,zeta电位小于空白胶束的zeta电位,这是因为壳层中阳离子PEI复合Bcl-2 siRNA后,会降低壳层电荷暴露程度[16]。有研究证实,粒径为20~150 nm的纳米药物载体,可在大部分实体瘤中经EPR效应实现被动靶向效果[17],而正表面电位的纳米载体更容易被细胞摄取。可见,本文中的阳离子纳米胶束将具有这样的优点。
纳米药物载体到达靶点后释放药物的速度影响其疗效。理想情况下,药物释放越快越好,这样可以短时间内提高靶细胞内药物的有效浓度,充分发挥杀伤肿瘤细胞作用。相对于正常细胞,肿瘤细胞在缺氧环境中旺盛的糖酵解代谢作用,致使肿瘤细胞内和肿瘤微环境呈酸性,它与肿瘤生长转移密切相关[18]。目前,正常细胞和肿瘤细胞之间pH值的差异已被用以控制纳米载体中药物的释放[19]。在本研究中,探讨了纳米胶束在正常生理环境(pH 7.4)和模拟肿瘤细胞内酸性环境(pH 5.0)中的药物释放行为。结果发现,DOX和Bcl-2 siRNA的释放行为均具有pH敏感性,即酸性环境中的释放速度大于正常生理环境中的;与DOX相比,Bcl-2 siRNA释放对酸性更加敏感。分析认为,DOX和Bcl-2 siRNA释放的pH敏感性分别源自疏水内核中PBLG酸降解和壳层中PEI质子化过程。这一结果也表明,纳米胶束一旦进入肿瘤细胞,将可快速释放DOX和Bcl-2 siRNA,提高抗肿瘤效果。
为了探究纳米胶束共同递送DOX和Bcl-2 siRNA的效果,我们利用CLSM和MTT比色法分别研究了纳米胶束被MCF-7乳腺癌细胞摄取情况和细胞毒性,发现纳米胶束可被MCF-7细胞有效内化,在用纳米胶束处理4 h的细胞中就能明显看到DOX和FAM-siRNA的荧光信号;延长处理时间,荧光信号显著增强,且红色荧光和绿色荧光分离明显,红色荧光主要集中于细胞核上。这说明,本研究的纳米胶束不仅可将DOX和Bcl-2 siRNA同时递送至MCF-7细胞内,而且能将它们释放出来,利于DOX到达作用靶点细胞核。近年来,siRNA和化疗联合已成为一种新的肿瘤治疗方式[20]。它主要是将能下调或沉默药物外排转运蛋白如P-糖蛋白和抗凋亡蛋白如抗Bcl-2的siRNA与化疗药联合施用,以增加肿瘤细胞内药物积累或恢复肿瘤细胞对化疗药物敏感性,从而克服肿瘤耐药性和提高治疗效果[21-22]。本研究MTT结果提示,空白纳米胶束具有良好的细胞相容性,Bcl-2 siRNA与DOX共同递送显著增强了DOX的细胞毒性(P<0.05),二者之间具有协同抗癌作用。
综上所述,本研究制备的聚合物纳米胶束可同时装载化疗药DOX和Bcl-2 siRNA,其药物释放行为具有pH敏感性;载药纳米胶束呈近球形形貌,粒径小于150 nm,具有正的表面电位,可被MCF-7乳腺癌细胞有效内化;纳米胶束本身无细胞毒性,而其递送的DOX和Bcl-2 siRNA具有协同抗癌作用,细胞毒性高于DOX。可见,该聚合物纳米胶束有望成为共同递送化疗药和基因物质的优良载体。
参考文献:
[1] KRISHNA R, MAYER LD. Multidrug resistance MDR in cancer-mechanisms, reversal using modulators of MDR and the role of MDR modulators in influencing the pharmacokinetics of anticancer drugs[J]. Eur J Pharm Sci, 2000, 11(4):265-283.
[2] DACHS GU, DOUGHERTY GJ, STRATFORD IJ, et al. Targeting gene therapy to cancer:a review[J]. Oncol Res, 1997, 9(6-7):313-325.
[3] PATIL YB, SWAMINATHAN SK, SADHUKHA T, et al. The use of nanoparticle-mediated targeted gene silencing and drug delivery to overcome tumor drug resistance[J]. Biomaterials, 2010, 31(2):358-365.
[4] LASIC DD. Recent developments in medical applications of liposomes: sterically stabilized liposomes in cancer therapy and gene deliveryinvivo[J]. J Control Release, 1997, 48(2-3):203-222.
[5] BARTLETT DW, DAVIS ME. Physicochemical and biological characterization of targeted, nucleic acid-containing nanoparticles[J]. Bioconjug Chem, 2007, 18(2):456-468.
[6] XU MH, QIAN JM, SUO AL, et al. Reduction/pH dual-sensitive PEGylated hyaluronan nanoparticles for targeted doxorubicin delivery[J]. Carbohyd Polym, 2013, 98 (1): 181-188.
[7] XU MH, QIAN JM, SUO AL, et al. A reduction-dissociable PEG-b-PGAH-b-PEI triblock copolymer as a vehicle for targeted co-delivery of doxorubicin and P-gp siRNA[J]. Polym Chem, 2015, 6(13):2445-2456.
[8] YIN HQ, LEE ES, KIM D, et al. Physicochemical characteristicsof pH-sensitive poly(L-Histidine)-b-poly(ethylene glycol)/poly(L-lactide)-b-poly(ethylene glycol) mixed micelles[J]. J Control Release, 2008, 126(2):130-138.
[9] LEE ES, KYUNG TO, KIM D, et al. Tumor pH-responsive flower-like micelles of poly(L-lactic acid)-b-poly(ethyleneglycol)-b-poly(L-histidine)[J]. J Control Release, 2007, 123(1):19-26.
[10] TARATULA O, GARBUZENKO OB, KIRKPATRICK P, et al. Surface-engineered targeted PPI dendrimer for efficient intracellular and intratumoral siRNA delivery[J]. J Control Release, 2009, 140(3):284-293.
[11] RYU JH, KOO H, SUN IC, et al. Tumor-targeting multi-functional nanoparticles for theragnosis: New paradigm for cancer therapy[J]. Adv Drug Deliver Rev, 2012, 64(13):1447-1458.
[12] PETERSEN H, FECHNER PM, MARTIN AL, et al. Polyethylenimine-graft-poly(ethylene glycol) copolymers: influence of copolymer block structure on DNA complexation and biological activities as gene delivery system[J]. Bioconjug Chem, 2002, 13(4):845-854.
[13] PETERSEN H, FECHNER PM, FISCHER D, et al. Synthesis, characterization, and biocompatibility of polyethylenimine-graft-poly(ethylene glycol) block copolymers[J]. Macromolecules, 2002, 35(18):6867-6874.
[14] AKINC A, THOMAS M, KLIBANOV AM, et al. Exploring polyethylenimine-mediated DNA transfection and the proton sponge hypothesis[J]. J Gene Med, 2004, 7(5):657-663.
[15] URBAN-KLEIN B, WERTH S, ABUHARBEID S, et al. RNAi-mediated gene-targeting through systemic application of polyethylene (PEI)-complexed siRNAinvitro[J]. Gene Ther, 2005, 12(5):461-466.
[16] POURJAVADI A, HOSSEINI SH, ALIZADEH M, et al. Magnetic pH-responsible nanocarrier with long spacer length and high colloidal stability for controlled delivery of doxorubicin[J]. Colloids Surf B Biointerfaces, 2014, 116(1):49-54.
[17] PERRAULT SD, WALKEY C, JENNINGS T, et al. Mediating tumor targeting efficiency of nanoparticles through design[J]. Nano Lett, 2009, 9(5):1909-1915.
[18] CARDONE RA, CASAVOLA V, RESHKIN SJ. The role of disturbed pH dynamics and the Na+/H+exchanger in metastasis[J]. Nat Rev Cancer, 2005, 5(10):786-795.
[19] DING JX, ZHUANG XL, XIAO CS, et al. Preparation of photo-cross-linked pH-responsive polypeptide nanogels as potential carriers for controlled drug delivery[J]. J Mater Chem, 2011, 21(30):11383-11391.
[20] LIU P, YU H, LUO S, et al. mPEG-PLGA-b-PLL copolymer carrier for adriamycin and siRNA delivery[J]. Biomaterials, 2012, 33(17):4403-4412.
[21] SHEN J, WANG QW, HU QD, et al. Restoration of chemosensitivity by multifunctional micelles mediated by P-gp siRNA to reverse MDR[J]. Biomaterials, 2014, 35(30):8621-8634.
[22] YIN TH, WANG P, LI JG, et al. Tumor-penetrating codelivery of siRNA and paclitaxel with ultrasound-responsive nanobubbles hetero-assembled from polymeric micelles and liposomes[J]. Biomaterials, 2014, 35(22):5932-5943.
(编辑卓选鹏)
收稿日期:2015-08-24修回日期:2016-03-07
基金项目:陕西省科学技术研究发展计划项目(No.2013K09-27, 2011K13-01-09);中央高校基本科研业务费学科综合交叉项目(No.XJJ2013130)
通讯作者:锁爱莉. E-mail: ailisuo@mail.xjtu.edu.cn
中图分类号:R737.9
文献标志码:A
DOI:10.7652/jdyxb201604013
In vitro killing effect of doxorubicin and Bcl-2 siRNA co-delivered by polymeric nanomicelles on MCF-7 human breast cancer cells
SUO Ai-li1, WANG He-jing1, QIAN Jun-min2, LIU Rong-rong2, YAO Yu1
(1.Department of Oncology, the First Affiliated Hospital of Xi’an Jiaotong University,Xi’an 710061; 2. State Key Laboratory for Mechanical Behavior of Materials, Xi’an Jiaotong University, Xi’an 710049, China)
ABSTRACT:ObjectiveTo prepare polymeric nanomicelles capable of simultaneously loading doxorubicin (DOX) and Bcl-2 small interfering RNA (Bcl-2 siRNA), and to explore their in vitro cytotoxicity and cellular uptake in MCF-7 human breast cancer cells. MethodsCopolymer poly(ethylene glycol)-g-polyethylenimine-g-poly(γ-benzyl-L-glutamate) was synthesized by the combination of reductive amination and carbodiimide methods, and its chemical structure was verified by1H NMR. Empty and drug-loaded copolymeric nanomicelles were prepared by dialysis method and characterized by transmission electron microscope and dynamic light scattering. The ability of the nanomicelles to compress Bcl-2 siRNA was measured by by agarose gel electrophoresis method. The release profiles of DOX and Bcl-2 siRNA from the nanomicelles were explored by means of fluorescence spectrometry and dialysis method. The in vitro cytotoxicity and cellular uptake of DOX and Bcl-2 siRNA co-loaded nanomicelles in MCF-7 human breast cancer cells were characterized by MTT assay and confocal laser scanning microscopy, respectively. ResultsThe critical micelle concentration of the copolymer was about 4 mg/L, and the sizes of self-
assembled empty and drug-loaded nanomicelles were smaller than 200 nm. The drug-loading efficiency and drug-loading content of DOX in the nanomicelles were 88.7% and 15.1%, respectively. The DOX-loaded nanomicelles could efficiently compress Bcl-2 siRNA when an N/P ratio was ≥64. The zeta potential of DOX and Bcl-2 siRNA co-loaded nanomicelles was +30 mV. The release behavior of the cargoes from the nanomicells was pH-sensitive, and the release of Bcl-2 siRNA was more sensitive to acidic pH than that of DOX. The nanomicelles could simultaneously deliver DOX and Bcl-2 siRNA into MCF-7 cells, and the co-delivered DOX and Bcl-2 siRNA significantly increased the cytotoxicity of DOX (P<0.05). ConclusionThe polymeric nanomicelles can co-load DOX and Bcl-2 siRNA and deliver them into MCF-7 cells, and DOX in combination with Bcl-2 siRNA can synergistically inhibit the growth of MCF-7 cells and promote cell apoptosis, suggesting that the nanomicells may be a promising carrier for the co-delivery for chemotherapeutics and genes.
KEY WORDS:nanomicelle; chemotherapy; Bcl-2 siRNA; combination therapy; breast cancer; MCF-7 cell; cellular uptake
Supported by the Scientific and Technological Research and Development Project of Shaanxi Province (No.2013K09-27, 2011K13-01-09) and the Fundamental Research Funds for the Central Universities (No.XJJ2013130)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160615.0849.004.html(2016-06-15)

