雌激素缺乏条件下MiR-133通过调控间充质干细胞成骨分化参与骨质疏松形成的机制
谢楚海 史群伟 郭剑鸿 范子文 李菊根 陈斌伟 曹燕明 吴波以
(广州医科大学附属第二医院骨外科,广东 广州 510260)
雌激素缺乏条件下MiR-133通过调控间充质干细胞成骨分化参与骨质疏松形成的机制
谢楚海史群伟郭剑鸿范子文李菊根陈斌伟曹燕明吴波以
(广州医科大学附属第二医院骨外科,广东广州510260)
〔摘要〕目的探究MiR-133在雌激素缺乏条件下在骨质疏松中的表达情况及对间充质干细胞成骨分化的影响。方法从绝经后骨质疏松患者处分离间充质干细胞,利用qRT-PCR检测MiR-133的mRNA表达水平;利用荧光素酶和Western印迹检测MiR-133对其靶基因SLC39A1表达的调控;通过检测碱性磷酸酶和RUNX2表达情况,显示MiR-133和SLC39A1对间充质干细胞成骨分化产生的影响。结果MiR-133在雌激素缺乏的患者中显著升高,并且负性调控间充质干细胞成骨分化能力;MiR-133直接靶向负性调控SLC39A1启动子活性,降低SLC39A1的蛋白表达水平;SLC39A1能够上调碱性磷酸酶的活性,上调RUNX2的表达水平。结论MiR-133的过表达与雌激素缺乏具有显著相关性,MiR-133通过抑制SLC39A1的表达弱化间充质干细胞成骨分化能力,进而促使绝经后骨质疏松的发生。
〔关键词〕MicroRNAs;间充质干细胞;雌激素缺乏;骨质疏松
绝经后的骨质疏松作为一种常见的骨科疾病,主要发病机制在于成骨细胞的骨重建和破骨细胞的骨吸收之间的平衡遭到了破坏〔1〕。骨吸收增多和骨重建不足与雌激素缺乏具有密切的相关性〔2,3〕。然而,对于雌激素缺乏在绝经后骨质疏松中起到的具体机制现在还没有明确报道。间充质干细胞(MSCs)是骨形成的重要来源。雌激素受体的缺乏可以对MSCs的分化产生影响〔4,5〕。但是,雌激素缺乏是如何调控MSCs向成骨细胞分化的机制尚处于未知领域。根据现有文献报道,miRNAs可能参与了间MSCs的分化过程,如miR-20增强了MSCs的成骨分化能力,而miR-141则具有相反的功能〔6~9〕。也存在几种miRNAs,如 miR-503发生能够异常调控在绝经后的骨质疏松〔10〕,但是,其在绝经后骨质疏松中的主要发生机制依旧没有一个清楚的解释结果。本实验阐明MiR-133在绝经后骨质疏松患者中的表达,并且直接靶向SLC39A1,从而弱化MSCs的成骨分化能力。
1材料与方法
1.1细胞与试剂人间充质干细胞(hMSC)由本实验室保存,DMEM高糖培养基购自美国Sigma公司;胎牛血清购自以色列Biolnd公司;胰蛋白酶购自研科生物公司;一抗及二抗购自武汉三鹰公司;细胞培养板购自Costar公司;BCA蛋白浓度检测试剂盒购自美国Pierce Chemical公司,5倍SDS蛋白上样缓冲液、SDS、Tris、甘氨酸、TEMED、30%Acr-Bis(29∶1)、Glycine、Tween20、过硫酸铵、脱脂奶粉购自北京鼎国昌盛生物技术有限责任公司;D-Hank缓冲液为自行配制。
1.2仪器倒置显微镜购自日本OLYMPUS公司;CO2培养箱购自美国Forma公司;-80℃冰箱为中国海尔集团产品;板式酶标仪购自北京市新风机电技术公司;电泳仪及转膜仪购自美国Bio-Rad公司;单光子仪。
1.3方法
1.3.1细胞培养将从绝经患者体内获取的hMSC用含有15%胎牛血清的DMEM 培养基培养,置于37℃、5% CO2的细胞培养箱中常规培养。用含0.02%EDTA 的0.25%胰酶消化液消化细胞,并进行传代,传至4、5代左右,选取生长状态良好、增殖旺盛的细胞用于试验研究。
1.3.2建立稳定干扰MiR-133的细胞系取对数生长期的细胞做实验。在六孔板中种入生长状态良好的细胞,当细胞密度达到50%~60%时进行转染细胞,分3组:(1)hMSC细胞:常规培养,不做任何处理;(2)anti-MiR-NC/hMSC细胞:瞬时转染插入空载质粒;(3)干扰MiR-133的hMSC细胞(anti-MiR-133):瞬时转染插MiR-133目标片段5′-GAAGTTTTATTCACATGCT-3′和 5′-CATCAGCTCTGATTCTGTG-3′。同时用脂质体2000进行平行转染,6 h以后换液,用G418进行筛选,利用Western印迹进行鉴定。
1.3.3MiR-133 SLC39A1 mRNA表达的检测首先用TRIzol提取细胞总RNA,将总RNA逆转录合成cDNA。反应条件:42℃ 60 min,70℃ 10 min。以逆转录反应产物cDNA 为模板,使用实时PCR检测SLC39A1 mRNA 的相对表达量,每个样品设置3个复孔。内参照为GAPDH。各引物序列:SLC39A1正向序列 5′-GTCACCTCTGGAGGAAACAAG-3′ 和反向序列5′-TCTGGAGGACCTGGTAGAGG-3′;GAPDH 正向序列5′-ACCCAGAAGACTGTGGATGG-3′和反向序列5′-TCTAGACGGCAGGTCAGGTC-3′。实时PCR反应条件:95℃ 30 s,95℃ 15 s,60℃ 30 s,共39个循环。溶解曲线条件:95℃ 15 s,60℃ 60 s,95℃15 s。根据反应结束后的Ct值(每个反应管内的荧光信号达到设定的阈值时对应的循环数),通过2-△△Ct法计算样品中多种mRNA 的相对表达量,所得产物经1 %琼脂糖凝胶电泳验证。
1.3.4荧光素酶活性检测将hMSC细胞接种于24孔培养板中,待细胞生长至70%~85%融合度时,共转染荧光素酶报告载体及negative control mimics,anti-MiR-NC和anti-MiR-133。以转染pRL-TK作为标准内质控。转染48 h后,收获细胞。按Promega公司双荧光素酶活性检测试剂盒说明书检测细胞荧光素酶活性:弃去细胞培养液,PBS清洗3次,然后每孔加入已稀释的1×PLB裂解细胞10 min。将细胞刮下,收集至1.5 ml EP管中,12 000 r/min离心3 min,取上清。取25 μl上清,加入荧光素酶检测试剂LARll 100 μl,记录萤火虫荧光素酶活性值;然后加入stop&Glo试剂100 μl,记录海肾荧光素酶活性值。计算相对荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.3.5成骨分化相关蛋白表达的检测采用Western印迹法。
1.3.5.1蛋白样品的获得(1)蛋白裂解液的配制(100 μl体系):100×蛋白酶抑制剂1 μl;蛋白裂解液加至100 μl。(2)蛋白抽提:用预冷的D-Hank液清洗3次,每一个孔加入蛋白裂解液,将其置于冰上裂解30 min,用细胞刮刀将孔中细胞小心刮下并收集到1.5 ml EP管中,在4℃ 离心机中以12 000 r/min的速度离30 min,离心完毕后将其取出置于冰上,分装备用。
1.3.5.2BCA法蛋白定量采用Pierce公司的BCA Protein Assay Reagent Kit进行。
1.3.5.3蛋白变性按比例加入5×SDS蛋白上样缓冲液,置于金属浴中95℃孵育10 min后立即置于冰上冷却,最后放于-20℃冰箱保存备用。
1.3.5.4Western印迹分析(1)电泳:根据待检测蛋白质的大小选择合适浓度的SDS-聚丙烯酰胺凝胶,每泳道上样40 μg,先70 V电泳30 min,再130 V电泳至溴酚蓝染料跑出胶后停止电泳,冰上进行。(2)转膜。(3)封闭:5%脱脂牛奶,用TBST稀释,室温封闭1 h。(4)一抗孵育:按照抗体说明书用TBST将一抗稀释到适合的比例。 (5)洗膜:将PVDF膜转入洗膜盒中,置于摇床上上下洗涤3次,每次10 min。(6)二抗孵育:根据实验所用一抗的种属选择对应的二抗,并用TBST将二抗稀释到适合的比例,并将其置于摇床上室温孵育1 h。(7)洗膜:将PVDF膜转入洗膜盒中,加入适量的TBST液体,置于摇床上上下洗涤3次,每次10 min。(8)显影:在膜表面滴入适量的HRP化学显影液,使之覆盖膜的整个表面,在凝胶成像系统中拍照保存。
1.4统计学方法采用SPSS18.0软件行t检验。
2结果
2.1hMSC中MiR-133的表达情况绝经后骨质疏松患者的hMSC中MiR-133 mRNA的表达水平(3.09±0.79)比对照组(1.57±0.67)异常升高(P<0.05)。
2.2稳定转染干扰抑制MiR-133的hMSC细胞系的鉴定通过实时荧光定量检测mRNA水平上,干扰效率达到80%以上,结果可信。正常未处理组、miR-NC组、anti-miR-133组分别为1.2±0.45,1.17±0.34,0.25±0.79。
2.3荧光素报告分析结果通过在线靶基因软件预测,MiR-133可能与SLC39A1 mRNA的3′-UTR片段4 834~4 840 bp相结合,且该结合位点在多物种间高度保守。构建报告载体后,通过荧光素活性检测,结果显示,与转染NC组相比较,MiR-133能够明显抑制pSLC39A1-Mt报告载体的荧光素酶活性(P<0.05),但是对突变型的pSLC39A1-Mut无明显抑制作用;而转染anti-MiR-133能够明显恢复pSLC39A1-Mt报告载体的活性;表明miR-133特异性与SLC39A1 mRNA的3′-UTR结合。见图1。
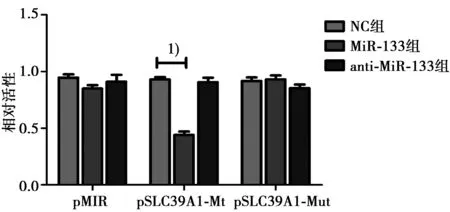
与NC组比较:1)P<0.05图1 miR-133对SLC39A1 mRNA 3′-UTR的调控情况
2.4利用已经鉴定成功构建的anti-MiR-133 hMSC细胞系进行恢复实验当MiR-133过表达时SLC39A1和成骨分化的标志分子RUNX2的mRNA都发生显著下降(P<0.05),转入anti-MiR-133 inhibitionor细胞和干扰细胞系中SLC39A1和RUNX2的mRNA水平有所恢复,与正常hMCSs没有明显差异。见图2。
2.5利用已经成功构建的anti-MiR-133 hMSC细胞系进行恢复实验当MiR-133过表达时,SLC39A1和成骨分化的标志分子RUNX2的蛋白表达水平(0.75±0.25,0.68±0.35)都发生显著下降(miR-NC组分别为1.17±0.34,1.27±0.14,P<0.05),转入anti-MiR-133 inhibitionor细胞和干扰细胞系中SLC39A1和RUNX2的mRNA水平(1.25±0.79,1.15±0.29)有所恢复,与正常未处理组hMSCs(1.2±0.45,1.13±0.35)没有明显差异,见图3。
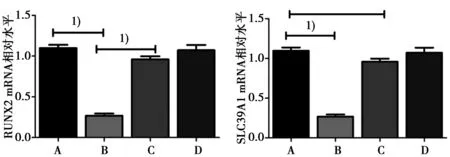
A:正常未处理组;B:MiR-133组;C:anti-MiR-133组;D:anti-MiR-133 inhibitor组;1)P<0.05图2 miR-133影响SLC39A1和RUNX2的mRNA表达水平
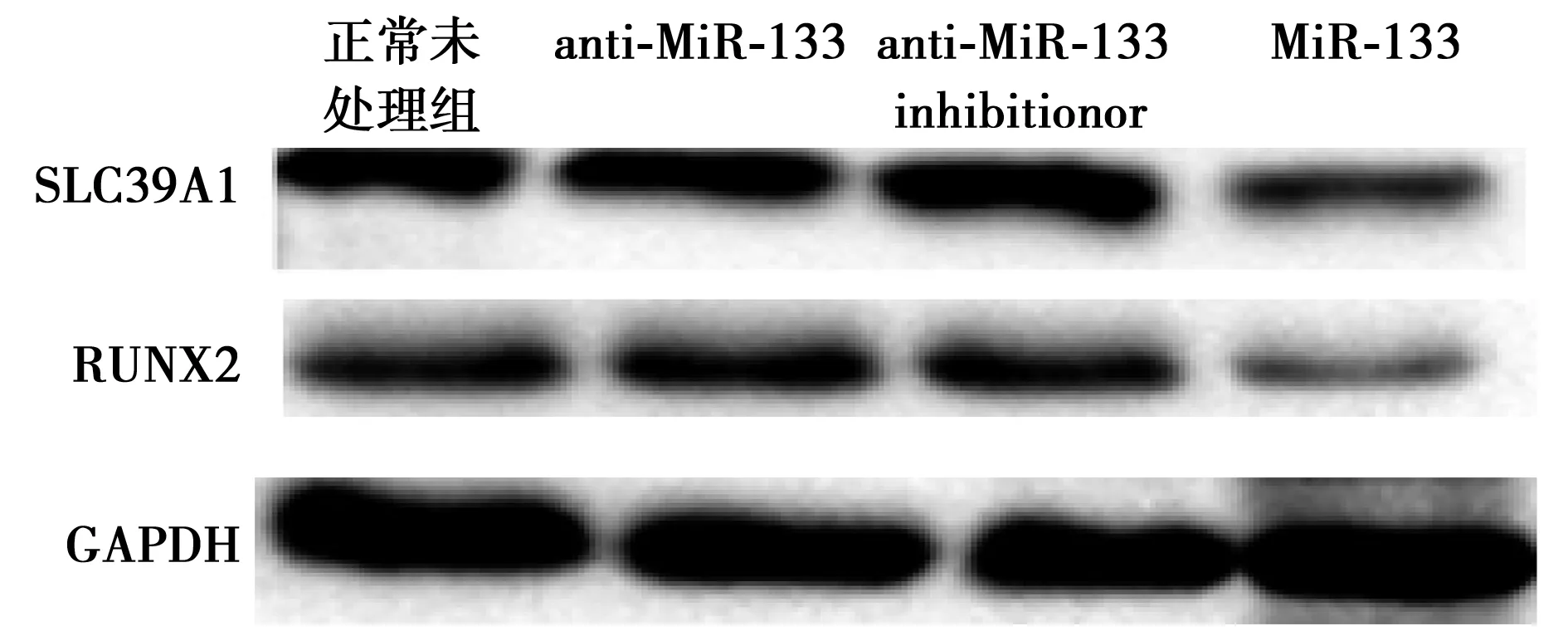
图3 miR-133的变化对SLC39A1和RUNX2蛋白水平的影响
3讨论
绝经后妇女非常容易患骨质疏松,在一定程度上是由于雌激素缺乏引起过度的骨吸收和骨形成不足〔11,12〕。然而,缺乏雌激素在绝经后骨质疏松的确切作用不太明显。hMSCs具有分化为成骨细胞和骨细胞的能力,在骨代谢方面具有重要作用。现有报道证明减少hMSCs分化为成骨细胞可能导致骨质疏松〔13〕。最近的一些研究表示,在雌激素缺乏的情况下,microrNA会发生表达水平的异常性变化,而这些异常性变化可能会对参与成骨分化的hMSCs产生影响〔14,15〕。事实上,microRNA可以抑制或促进hMSCs成骨细胞的分化〔16〕。
本研究发现,MiR-133在雌激素缺乏介导的骨质疏松患者体内处于一种高表达状态,提示我们,MiR-133在雌激素缺乏的骨质疏松中可能是作为一种癌基因在行使功能。我们进一步探究发现,MiR-133的沉默能够明显提高hMSCs成骨分化能力。通过荧光素酶报告实验发现,MiR-133特异性与SLC39A1 mRNA的3′-UTR结合,从而降低SLC39A1的转录活性,并且MiR-133能够降低SLC39A1 mRNA表达水平,而且沉默MiR-133后SLC39A1和RUNX2表达升高,说明成骨分化进一步发生和加强。
综上,雌激素缺乏介导的骨质疏松与Mir-133过表达有关。MiR-133可以通过削弱成骨分化诱导绝经后骨质疏松的发生,至少部分是通过抑制SLC39A1表达,进一步抑制hMSCs成骨分化的发生,从而为雌激素缺乏介导的骨质疏松的诊治提供新的思路,有望成为雌激素缺乏介导的骨质疏松治疗的新靶点。
4参考文献
1Khosla S,Melton LJ,Riggs BL.The unitary model for estrogen deficiency and the pathogenesis of osteoporosis:is a revision needed〔J〕? J Bone Miner Res,2011;26(3):441-51.
2Epstein S.Update of current therapeutic options for the treatment of postmenopausal osteoporosis〔J〕.Clin Ther,2006;28(2):151-73.
3Heiss C,Govindarajan P,Schlewitz G,etal.Induction of osteoporosis with its influence on osteoporotic determinants and their interrelationships in rats by dexa〔J〕.Med Sci Monit,2012;18(6):BR199-207.
4Zhao JW,Gao ZL,Mei H,etal.Differentiation of human mesenchymal stem cells:The potential mechanism for estrogen-induced preferential osteoblast versus adipocyte differentiation〔J〕.Am J Med Sci,2011;341(6):460-68.
5Yao W,Guan M,Jia J,etal.Reversing bone loss by directing mesenchymal stem cells to bone〔J〕.Stem Cells,2013;31(9):2003-14.
6Guan M,Yao W,Liu R,etal.Directing mesenchymal stem cells to bone to augment bone formation and increase bone mass〔J〕.Nat Med,2012;18(3):456-62.
7Eskildsen T,Taipaleenmaki H,Stenvang J,etal.Microrna-138 regulates osteogenic differentiation of human stromal (mesenchymal) stem cells in vivo〔J〕.Proc Natl Acad Sci USA,2011;108(15):6139-44.
8Zhang JF,Fu WM,He ML,etal.Mirna-20a promotes osteogenic differentiation of human mesenchymal stem cells by co-regulating bmp signaling〔J〕.RNA Biol,2011;8(5):829-38.
9Qiu W,Kassem M.Mir-141-3p inhibits human stromal (mesenchymal) stem cell proliferation and differentiation〔J〕.Biochim Biophys Acta,2014;1843(9):2114-21.
10Tang P,Xiong Q,Ge W,etal.The role of micrornas in osteoclasts and osteoporosis〔J〕.RNA Biol,2014;11(11):1355-63.
11Liao L,Yang X,Su X,etal.Redundant mir-3077-5p and mir-705 mediate the shift of mesenchymal stem cell lineage commitment to adipocyte in osteoporosis bone marrow〔J〕.Cell Death Dis,2013;4:e600.
12Wang Y,Li L,Moore BT,etal.Mir-133a in human circulating monocytes:a potential biomarker associated with postmenopausal osteoporosis〔J〕.PloS One,2012;7:e3464.
13Li H,Wang Z,Fu Q,etal.Plasma mirna levels correlate with sensitivity to bone mineral density in postmenopausal osteoporosis patients〔J〕.Biomarkers,2014;19(2):553-6.
14Gaither LA,Eide DJ.Functional expression of the human hzip2 zinc transporter〔J〕.J Biol Chem,2000;275(18):5560-4.
15Klarner A,von Stengel S,Kemmler W,etal.Effects of two different types of whole body vibration on neuromuscular performance and body composition in postmenopausal women〔J〕.Dtsch Med Wochenschr,2011;136(42):2133-9.
16Iwamoto J,Sato Y,Takeda T,etal.Whole body vibration exercise improves body balance and walking velocity in postmenopausal osteoporotic women treated with alendronate:Galileo and Alendronate Intervention Trail (GAIT)〔J〕.Musculoskelet Neuronal Interact,2012;12(1):136-43.
〔2015-12-06修回〕
(编辑李相军)
基金项目:国家自然科学基金项目(81574002);广东省自然科学基金项目(S2012010009190)
〔中图分类号〕R605
〔文献标识码〕A
〔文章编号〕1005-9202(2016)13-3105-03;
doi:10.3969/j.issn.1005-9202.2016.13.006
MiR-133 is involved in estrogen deficiency induced osteoporosis by modulating osteogenic differentiation of mesenchymal stem cell
XIE Chu-Hai, SHI Qun-Wei, GUO Jian-Hong, et al.
Department of Orthopedics,the Second Hospital Affiliated to Guangzhou Medical University, Guangzhou 510260,Guangdong,China
【Abstract】ObjectiveTo investigate the relationships among MiR-133 (estrogen deficiency induced osteoporosis and osteogenic differentiation of mesenchymal stem cells).MethodsThe osteogenic differentiation of mesenchymal stem cells ability of miR-133 on hMSC cells was detected by qRT-PCR. The binding between miR-133 and predicted target SLC39A1 were verified by dual luciferase assay and Western blot analysis. RUNX2 related proteins were detected using Western blot. ResultsmiR-133 expression was significantly enhanced as a result of estrogen deficiency. Its overexpression was negatively correlated to osteogenic differentiation of hMSCs. SLC39A1 showed an inverse expression trend to miR-133 during the differentiation. Western blot test showed osteogenic differentiation of mesenchymal stem cells related proteins RUNX2 were obvious changed. ConclusionsmiR-133 overexpression is associated with estrogen deficiency. MiR-133 could induce postmenopausal osteoporosis by weakening osteogenic differentiation of hMSCs, at least partly through repressing SLC39A1 expression.
【Key words】MicroRNAs; Mesenchymal stromal cells; Estrogen deficiency; Osteoporosis
第一作者:谢楚海(1978-),男,博士,主治医师,主要从事骨折及老年骨质疏松研究。

