NIH3T3细胞中miR-29b表达变化对mPer1和Egr2的影响*
徐涛 后望 汪宇辉 成姝婷 刘延友 江舟 肖静 郭慧玲 王正荣
(四川大学华西基础医学与法医学院·卫生部时间生物学重点实验室,四川 成都 610041)
·论著·
NIH3T3细胞中miR-29b表达变化对mPer1和Egr2的影响*
徐涛后望汪宇辉成姝婷刘延友江舟肖静郭慧玲王正荣
(四川大学华西基础医学与法医学院·卫生部时间生物学重点实验室,四川 成都 610041)
【摘要】目的探讨NIH3T3细胞中miR-29b对血清诱导的立早基因Egr2 mRNA表达的影响及其机制。方法将体外培养NIH3T3细胞分为实验组、阴性对照组和空白对照组。实验组用miR-29b转染,阴性对照组空转,而空白对照组则不做任何处理。RT-qPCR检测近日节律基因mPer1与立早基因Egr2 mRNA的表达水平。结果实验结果显示,mPer1和Egr2的表达均发生了较明显的变化。与阴性对照组相比,空白对照组中mPer1和 Egr2的mRNA表达水平无明显差异;而实验组中mPer1的mRNA表达降低了42%,Egr2的mRNA表达升高了49%。结论miR-29b能上调 Egr2的表达,其途径可能是通过抑制NIH3T3细胞近日节律基因mPer1的表达实现。
【关键词】mPer1;miR-29b;Egr2;NIH3T3细胞
近日节律系统是生物体的基本系统之一[1]。它能够帮助生物体与每日外界环境的变化相协调,保证生物体的生理活动正常进行[2]。该系统由一系列基因及其表达产物相互作用形成的负反馈环路构成。其中Pers、Bmal1、Clock和Crys是其核心组成[3]。在维持生物节律稳定的同时,不同的核心节律基因在诸如细胞分化、生物发育等领域都扮演了重要角色[4]。
MicroRNAs(miRNAs)是一类广泛存在于生物体内、长度在19~25核苷酸(nt)之间、高度保守的非编码小RNA,是包括细胞增殖、分化、凋亡、发育、免疫调节等在内的众多生物学进程的重要调节因子[5-6]。目前,越来越多的研究发现miRNA对近日钟系统有非常重要的调节作用。例如,miR192/194和miR-29b基因簇可以负性调节per1、per2和per3的表达[6-7]。miR-142-3p 能够直接作用于Bmal1的3′UTR区域抑制Bmal1的表达[8]。这些发现提示我们,miRNA可能是近日钟调节的重要组成部分。
早期生长应答基因2(early growth response 2,Egr2)是20世纪80年代在果蝇胚胎发育分节现象的研究中发现的一种转录因子[9]。它包括一个C2H2型的锌指结构,在中脑的发育中起着非常重要的作用[10]。研究显示,Egr2受节律基因Per2和Dbp的调控且具有节律性[11]。而我们的前期实验提示miR-29b可能调节节律基因per1的表达。这种在调节区域和参与的生物学事件的高度重合提示了miR-29b可能通过影响Egr2表达水平,从而对上述生理活动发挥调节作用。
1材料与方法
1.1PCR引物合成PCR引物由英潍捷基(上海)贸易有限公司和广州锐博生物科技有限公司合成。引物序列,见表1。
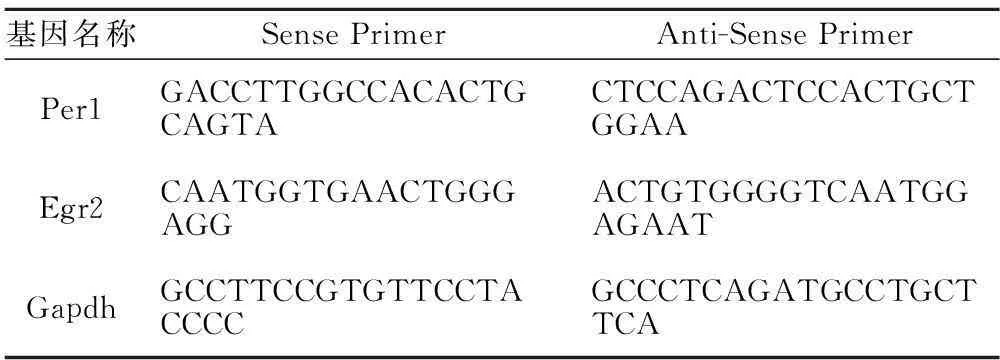
表1 PCR引物序列
1.2细胞培养细胞培养条件:选取NIH3T3细胞,用DMEM高糖培养基加入10%新生牛血清作为完全培养基,5% CO2和37℃条件下进行培养。在对数生长期用胰酶消化后以5×105/孔接种到六孔板中,待生长到对数生长期时进行细胞转染。细胞转染:选取对数生长期的NIH3T3细胞,用Opti-MEM无血清培养基清洗两次;加入1.5ml的Opti-MEM无血清培养基待用。对照组:直接加入0.5ml的Opti-MEM无血清培养基;阴性对照组:配制0.5ml的只含lipo 2000的转染液,孵育20min后加入待用的六孔板中;实验组:配制0.5ml的含有miR-29b和lipo 2000的转染液,孵育20min后加入待用的六孔板中。孵育5~6小时后更换含有血清的培养基,48小时后提取总RNA。
1.3实时荧光定量PCR根据Eastep®Super总RNA提取试剂盒说明书提取NIH3T3细胞的总RNA,用微量分光光度计NanoDrop 2000检测RNA的浓度和纯度。分别取1μg的RNA用逆转录试剂盒反转录合成cDNA。合成的cDNA稀释成5倍的量待用。RT-qPCR反应体系:9μl的SYBR Green Mix,1μl上游引物,1μl下游引物,2μl cDNA模板,补加高压灭菌蒸馏水至总体积20μl。反应条件,预变性:95℃,10min,扩增条件:95℃,10s;55~65℃,20s;72℃,20s;40个循环;融解曲线:65~95℃,5s。其中Gapdh、mPer1和Egr2各自的退火温度分别为56.9℃、62.5℃和62℃。而miRNA的逆转录反应需要用特定的RT引物,反转录合成的cDNA不需要稀释。RT-qPCR反应体系及反应条件同上。以U6作为检测的内参基因。
1.4统计学分析mPer1与Egr2基因的mRNA相对表达水平以2-△△Ct方法计算。数据用SPSS 13.0软件分析,采用单因素方差分析法,当P<0.05为差异有统计学意义。
2结果
2.1miR-29b转染NIH3T3细胞前后细胞状态的变化转染前细胞的状态正常(见图1);转染期的细胞空白对照组的细胞状态正常(见图2A),阴性对照组(见图2B)和实验转染组(见图2C)的细胞都出现了明显的死亡,触角变短。
2.2miR-29b显著抑制了NIH3T3细胞内mPer1基因的表达以U6为内参基因(锐博公司提供),采用RT-qPCR法检测空白对照组、阴性对照组和实验转染组中miR-29b mRNA的相对表达。实验组(29b):脂质体转染试剂加miR-29b转染NIH3T3 细胞;阴性对照组(NC):脂质体转染试剂加阴性对照miRNA转染NIH3T3 细胞;空白对照组(Blank):正常生长的NIH3T3细胞。结果显示,相对于空白对照组和阴性对照组,实验组miR-29b的相对表达明显升高(P<0.001),而两个对照组则没有显著差异(见图3)。其中空白对照组miR-29b的相对表达量为0.22,阴性对照组miR-29b的相对表达量为0.11,实验组miR-29b的相对表达量为1.04。
图1转染前NIH3T3细胞的状态
Figure 1State NIH3T3 cells before transfection
注:A.为空白对照组;B.为阴性对照组;C.为实验转染组

图2转染后NIH3T3细胞的状态
Figure 2State NIH3T3 cells after transfection
注:A.为空白对照组;B.为阴性对照组;C.为实验转染组
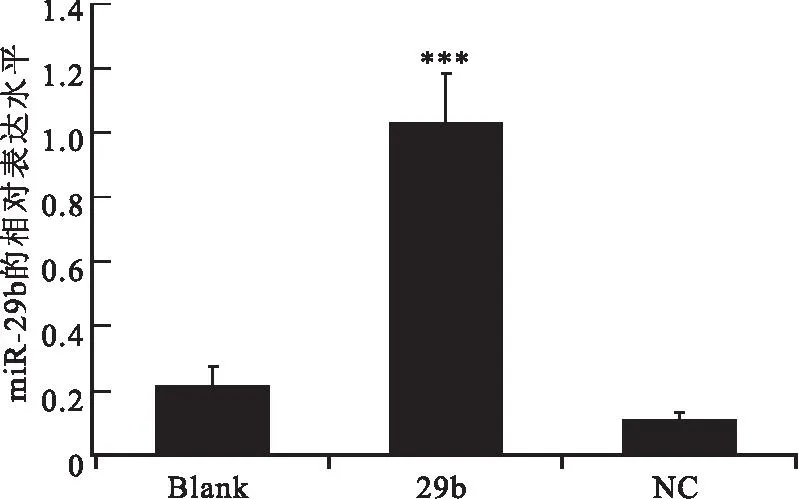
图3miR-29b在NIH3T3细胞中的相对表达
Figure 3The relative expression of miR-29b in NIH3T3 cells
注:miR-29b的表达明显升高(P<0.001),其中Blank为空白对照组,NC为阴性对照组,29b为实验组
以Gapdh为内参基因,RT-qPCR证实相对于空白对照组和阴性对照组,实验组mPer1的相对表达明显降低(P<0.05),而空白对照组和阴性对照组之间没有差异(见图4)。其中空白对照组mPer1的相对表达量为1.07,阴性对照组mPer1的相对表达量为1.05,实验组mPer1的相对表达量为0.63。
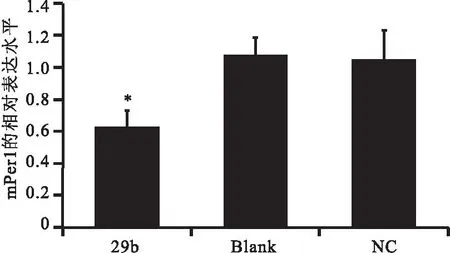
图4mPer1在NIH3T3细胞中的相对表达
Figure 4The relative expression of mPer1 in NIH3T3 cells
注:mPer1的表达明显降低(P<0.05),其中Blank为空白对照组,NC为阴性对照组,29b为实验组
2.3miR-29b上调Egr2基因表达以Gapdh为内参基因,采用RT-qPCR法检测阴性对照组、空白对照组和实验组Egr2基因的mRNA的相对表达水平。实验组(29b):脂质体转染试剂加miR-29b转染NIH3T3 细胞;阴性对照组(NC):脂质体转染试剂加阴性对照miRNA转染NIH3T3 细胞;空白对照组(Blank):正常生长的NIH3T3细胞。结果显示,相对于空白对照组和阴性对照组,实验组Egr2的相对表达明显升高(P<0.05),而两个对照组之间则不存在显著性差异(见图5)。其中空白对照组Egr2的相对表达量为0.80,阴性对照组Egr2的相对表达量为0.96,实验组Egr2的相对表达量为1.45。

图5Egr2在NIH3T3细胞中的相对表达
Figure 5The relative expression of Egr2 in NIH3T3 cells
注:Egr2的表达明显升高(P<0.05),其中Blank为空白对照组,NC为阴性对照组,29b为实验组
3讨论
miRNA是一类非编码的小RNA分子,能在转录后水平上改变基因的表达[12]。最近的研究表明,miRNA能够调控近日节律系统。miR-219能够调控近日周期的长短和速度,敲除体内miR-219能够延长昼夜周期[13]。miR-132能够调节近日钟基因的表达和光诱导重置近日节律的过程[14]。这些研究结果表明,miRNA可以作为近日节律系统的一项重要的效应器。miR-29s家族可以结合Per1的3′UTR区域来抑制Per1的表达[15]。同时已有报道证实mPer1也在动物代谢调节和生物发育及细胞分化方面扮演了重要角色[16]。
Egr2的表达受多个信号通路如Wnt、FGF等信号通路的调控[17],进而对动物脂肪细胞的分化及神经系统的发育产生影响[18]。有研究报道,Egr2表达呈现出节律性,并且与近日节律基因Per2和Dbp的变化趋势类似[11]且由于Egr2在中脑的发育过程中至关重要,而生物节律的中央调控位于下丘脑的SCN区域,加之二者所参与的生物学事件高度重合,由此可以推测,Per1和 Egr2之间可能存在一定的关系。但是Per1是通过何种机制来刺激Egr2的表达却没有研究。而近日节律基因的紊乱与某些细胞增殖与凋亡的发生息息相关,Per1作为核心的近日钟基因能够参与到该过程之中[4]。实验结果表明,miR-29b转染NIH3T3细胞影响了Per1和Egr2的表达,具体表现为Per1的表达降低,而Egr2的表达升高。这提示miR-29b能上调Egr2的表达,而这种改变有可能是通过Per1来介导的。但这还需要实验进一步证实。
4结论
本研究证实,通过miR-29b抑制NIH3T3细胞内mPer1基因表达同时显著上调Egr2的表达。该结果提示了miR-29b可通过影响Egr2基因表达的方式在诸多生理活动中发挥调控作用,这将有助于相关疾病的检测、预防与治疗,为病理性疾病的预防和治疗提供了新的思路和理论基础。
【参考文献】
[1] Oike H,Oishi K,Kobori M.Nutrients,Clock Genes,and Chrononutrition[J].Current Nutrition Reports,2014,3(3):204-212.
[2]Mohammed S,Harrison D A.The clocks that time us are not the same:A theory of temporal diversity,task characteristics,and performance in teams [J].Organ Behav Hum Dec,2013,122(2):244-256.
[3]Albrecht,Urs.Timing to Perfection:The Biology of Central and Peripheral Circadian Clocks[J].Neuron,2012,74(2):246-260.
[4]Bae K,Jin X,Maywood ES,et al.Differential Functions of mPer1,mPer2,and mPer3 in the SCN Circadian Clock[J].Neuron,2001,30(2):525-536.
[5]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[6]Zhao Xiyan,Zhu Xueqiang,Cheng Shuting,et al.MiR-29a/b/c regulate human circadian gene hPER1 expression by targeting its 3′UTR[J].Acta Biochim Biophys Sin,2014,46 (4):313-317.
[7]Nagel R,Clijsters L,Agami R.The miRNA-192/194 cluster regulates the Period gene family and the circadian clock [J].The FEBS journal,2009,276(19):5447-5455.
[8]Shende V R,Neuendorff N,Earnest D J.Role of miR-142-3p in the post-transcriptional regulation of the clock gene Bmal1 in the mouse SCN [J].PloS one,2013,8(6):e65300.
[9]Weger N,Schlake T.Igf-I signalling controls the hair growth cycle and the differentiation of hair shafts [J].Invest Dermatol,2005,125(5):873-882.
[10] Shampa D,Jack E,Turman,Jr.Krox-20 gene expression:Influencing hindbrain-carniofacial developmental interaactions[J].Arch Histol Cytol,2005,68(4):227-234.
[11] Alvarez JD,Dechun Chen,Elizabeth Storer,et al.Non-cyclic and Developmental Stage- Specific Expression of Circadian Clock Proteins During Murine Spermatogenesis[J].Biology of Reproduction,2003,69(1):81-91.
[12] Cheng H-YM,Papp JW,Varlamova O,et al.microRNA modulation of circadian clock period and entrainment[J].Neuron,2007,54(5):813-829.
[13] Kocerha J,Faghihi M A,Lopez-toledano M A,et al.MicroRNA-219 modulates NMDA receptor-mediated neurobehavioral dysfunction [J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(9):3507-3512.
[14] Alvarez-saavedra M,Antoun G,Yanagiya A,et al.miRNA-132 orchestrates chromatin remodeling and translational control of the circadian clock [J].Human molecular genetics,2011,20(4):731-751.
[15] Nicola Amodio,Marco Rossi,Lavinia Raimondi,et al.miR-29s:a family of epi-miRNAs with therapeutic implications in hematologic malignancies[J].Oncotarget,2015,6(15):12837-12861.
[16] Ansari N,Agathagelidis M,Lee C,et al.Differential maturation of circadian rhythms in clock gene proteins in the suprachiasmatic nucleus and the pars tuberalis during mouse ontogeny[J].The European journal of neuroscience,2009,29(3):477-489.
[17] Gabet Y,Baniwal SK ,Leclerc N,et al.Krox20/EGR2 deficiency accelerates cell growth and differentiation in the monocytic lineage and decreases bone mass[J].Blood,2010,116(19):3964-3971.
[18] Zhu C,Javier I,Bruce M,et al.Krox20 stimulates adipogenesis via C/EBPβ-dependent and -independent mechanisms[J].Cell Metab,2005,1(2):93-106.
基金项目:国家自然科学基金(31371180);国家自然科学青年基金(3150035)
通讯作者:汪宇辉,Email:wangyuhui1972@163.com
【中图分类号】R 392;R 393
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.07.003
(收稿日期:2016-01-19;编辑:母存培)
The effects of miR-29b expression change on mPer1 and Egr2 in NIH3T3 cells
XU Tao,HOU Wang,WANG Yuhui,et al
(Key Laboratory of Chronobiology,Ministry of Health (Sichuan University) ,West China School of Preclinical and Forensic Medicine,Sichuan University,Chengdu 610041,China)
【Abstract】ObjectiveTo investigate the effects of miR-29b on serum-induced immediate early gene Egr2 mRNA expression in NIH3T3 cells.MethodsNIH3T3 cells cultured in vitro were divided into experiment group,negative control group and blank control group.Experimental group transfected with miR-29b,negative control group idling,while the control group received no treatment.The expression of mPer1 and Egr2 were detected by RT-qPCR.ResultsThe experimental results show that mPer1 and Egr2 expressions were more obvious changes.Compared with the negative control group,the mRNA expression level of mPer1 and Egr2 were not obvious difference in the blank control group; but,the mRNA expression of mPer1 was reduced 42%,the mRNA expression of Egr2 was increased 49% in the experimental group.ConclusionmiR-29b can increase Egr2 expression,the approach is probably achieved by inhibiting circadian gene mPer1 expression in NIH3T3 cells.
【Key words】mPer1; mir-29b; Egr2; NIH3T3 cells

