结缔组织病相关性间质性肺病90例临床分析*
张静 梁宗安 杨阳 杨诚
(1.四川省人民医院呼吸内科,四川 成都 610072;2.四川大学华西医院呼吸内科,四川 成都 610041;3.四川省人民医院放射科,四川 成都 610072)
结缔组织病相关性间质性肺病90例临床分析*
张静1梁宗安2杨阳1杨诚3
(1.四川省人民医院呼吸内科,四川 成都 610072;2.四川大学华西医院呼吸内科,四川 成都 610041;3.四川省人民医院放射科,四川 成都 610072)
【摘要】目的探讨继发于结缔组织病(CTD)的间质性肺病(ILD)的临床特点、影像学特征、治疗选择和预后判断的意义。方法收集2013年6月~2015年5月四川省人民医院内科收治的90例结缔组织病相关性间质性肺病(CTD-ILD)病例,回顾性分析患者的一般资料、临床表现、胸部影像学、血气分析、肺功能以及治疗情况,分析CT影像学特点和肺间质疾病的病理类型之间的联系,以及不同CT表现特点在判断疾病对治疗的反应性的预测作用。结果在90例患者中,诊断类风湿性关节炎(RA)19例、干燥综合征(SS)14例 、皮肌炎(DM)和多发性肌炎(PM)共20例、系统性硬化症(SSc)14例,系统性红斑狼疮5例,其他结缔组织病共18例。结缔组织病相关性肺病(CTD-ILD)临床症状主要表现为咳嗽、进行性呼吸困难者占71.1%和62.2%。以肺部病变为首发表现的CTD患者占5.6%,其余病例均CTD诊断先于ILD。CT表现以胸膜下弧线状影、不规则线状网状影、小结节影、囊性变、蜂窝状影、磨玻璃样改变中的一种或多种。64例住院期间未使用抗菌药物治疗的患者糖皮质激素的使用剂量中位数为38mg/天,另26例使用了抗菌药物的CTD-ILD患者糖皮质激素剂量中位数为54mg/天。结论在肺间质病患者中进行结缔组织病筛查,将有利于指导临床治疗。了解各种结缔组织病相关的肺间质病的影像学、病理学特点,有助于对疾病的诊断、治疗方案选择及预后的判断。
【关键词】间质性肺病;结缔组织病;临床特点分析
结缔组织病(connective disease,CTD)是一系列免疫介导的系统功能紊乱疾病,常常有肺部受累[1]。其中间质性肺病(interstitial lung disease,ILD)是CTD最严重的肺部并发症,具有高死亡率和高致残率[2]。本文就我院内科2013年6月~2015年5月期间收治的90例结缔组织病相关性间质性肺病(CTD-ILD)相关临床资料,分析总结CTD-ILD患者构成比、影像学和治疗等临床特点。
1资料与方法
1.1一般资料收集2013年6月~2015年5月共90例我院内科已确诊CTD-ILD的住院患者资料。年龄31~93岁,平均(60.5±10.5)岁。男性21例,女性69例。诊断标准:诊断间质性肺病主要参照2011年对特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)诊断和治疗指南[3]。间质性肺疾病诊断依据病史、临床症状体征和辅助检查为主要诊断条件,其中辅助检查主要包括:肺功能检查、动脉血气分析、纤维支气管镜、胸CT或HRCT检查等。所选病例应符合 2009 年美国风湿病学会(ACR)和欧洲抗风湿病联盟(EULAR)提出的 RA 诊断标准、1997 年ACR 推荐的 SLE 诊断标准、1975 年 Bohan 提出的PM/DM 诊断标准、2002 年干燥综合征(SS)国际诊断标准、1980 年 ACR 提出的 SSc 诊断标准。
1.2纳入和排除标准①检索我院病例系统病例资料,于2013年6月~2015年5月期间在四川省人民医院内科住院患者;出院诊断包含任何一种结缔组织病诊断名称。②手工检索要求:影像学表现为双肺弥漫性病变,出现胸膜下弧线状影、不规则线状影、不规则线状网状影、小结节影、囊性变、蜂窝状影、磨玻璃样改变中的一种或多种。临床资料完整,包括详细病史、影像学、肺功能、肺血管彩超及实验室检查结果。排除标准:①病变仅累及部分肺组织,间质或实质。②未确诊任一种结缔组织病者。③临床资料不完整。④入院时即存在严重肺部感染患者,排除肺部病变对ILD分类的干扰。
1.3方法对入选的90例CTD-ILD患者,分析其一般资料,包括性别、年龄、吸烟情况,病程,临床诊断,HRCT结果,肺功能、动脉血气分析结果,住院期间应用糖皮质激素治疗和预后情况。

2结果
2.1临床表现90例患者年龄32~93岁,平均(60.6±12.8)岁,中位年龄65岁;男性21例,女性69例。最常见的呼吸系统临床症状为咳嗽64例(71.1%),其次是进行性加重的呼吸困难56例(62.1%),咯痰39例(43.3%),多为白色粘痰。均无喘息症状。21例有间断发热(23.3%),12例出现过咯血(13.3%),伴有紫绀24例(26.7%),7例出现杵状指(7.8%)。肺部查体存在肺部爆裂音(VELCRO音)51例(56.7%)。主要呼吸系统症状和体征分布情况,见图1。
2.2临床诊断病例诊断构成分别为皮肌炎(dermatomyositis,DM)或多发性肌炎(polymyositis,PM)共20例、类风湿性关节炎(rheumatoid arthritis,RA)19例、干燥综合征(sjögen syndrome,SS)14例、系统性硬化症(Systemic sclerosis,SSc)14例,ANCA相关性血管炎8例,系统性红斑狼疮(SLE)5例,抗JO-1综合征3例,确诊其他结缔组织病7例。平均病程为43.0月。吸烟24例,吸烟>400支/年者10例。病例分布、年龄及男女性别比例情况,见表1。
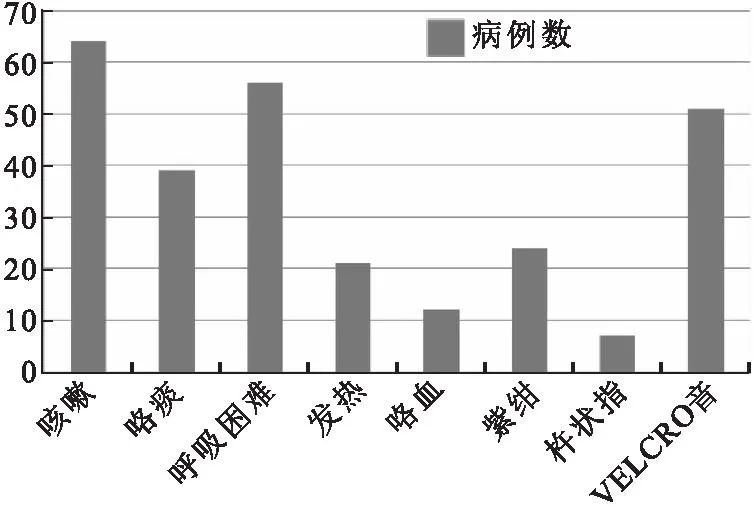

图1 90例CTD-ILD患者主要呼吸系统症状和体征分布图
2.3病程特点间质性肺病可以是结缔组织病的首发临床表现,90例CTD-ILD患者中,肺部症状或肺部影像学病变为首发表现者仅为5例(占5.6%)。
CTD诊断先于ILD诊断占多数,共计64例,从确诊CTD到明确诊断ILD的病程间隔平均为4.1年,其中病程间隔最长的是30年,是1例RA患者;病程间隔最短的是5个月,为1例皮肌炎患者。各类CTD患者从诊断CTD到ILD明确诊断时间:RA至ILD发病间隔为6个月~30年,平均时间为6.7年;PM/DM至ILD发病间隔为6个月~20.6年,平均为6个月;SS患者诊断SS至ILD发病间隔病程为6个月~12.8年,平均为4.2年;ANCA相关性血管炎至ILD发病间隔时间1.2~3.7年,平均2.8年;SLE至ILD发病时间间隔1~4年,平均2.4年;SSc至ILD发病时间间隔为6个月~18年,平均为6.6年;抗JO-1综合征至ILD病程间隔1.6~3年,平均为2.2年;其他类型CTD到ILD间隔时间为6个月~2年,平均为5.7年。从确诊结缔组织病到诊断ILD平均间隔时间最长的CTD类型为RA,其次为SSc、PM/DM、SS、ANCA、SLE,平均间隔时间最短的是抗JO-1综合征,其余21例是CTD和ILD同时确诊。
2.4影像学特点美国胸科协会(ATS) 及欧洲呼吸病协会(ERS)一致认为特发性间质性肺炎(IIP)的分型也适用于结缔组织病合并肺纤维化,IIP 的明确诊断需从临床-影像-病理综合分析,但因本研究中所有患者均缺乏外科肺活检病理,故仅根据临床-影像学特征,由我科两位呼吸专业主任医师协助阅片,根据既往临床-影像-病理分型经验对此 90例 CTD-ILD 患者进行了可能分类,见表2。
所有病例均进行了高分辨率CT(high resolution computed tomography,HRCT)检查,HRCT主要表现为肺部磨玻璃影、网状或蜂窝状改变,小叶内、小叶间隔增厚,纤维条索影。病变多位于中下肺野周边部。不同的病种患者肺CT表现不尽相同,却又有相似的表现部分。
本研究收集的病例数前四位的病种:DM和PM、RA、SS、SSc,统计各病种CT表现特点,其中19例RA患者肺部病变CT表现最常见为蜂窝样囊腔和网格影为52.6%(见图2);本研究中收集SS病例数14例,CT表现多为磨玻璃影为28.5%和纤维化性蜂窝囊性变为14.2%,与既往报告相似(见图3);DM/PM表现CT影像首要表现多见为胸膜下的纤维条索及网格状为40%(见图4);SSc相关性肺病CT表现磨玻璃影和纤维化为42.8%(见图5)。
2.5肺功能检查90例患者中61例完成肺功能检查,根据肺功能检查结果分为三级,分别为限制性通气功能障碍38例(62.3%),以限制为主的通气障碍5例(8.2%),弥散功能轻度降低者6例(9.8%)。49例肺功能异常患者的CTD至ILD平均病程为4.7年。动脉血气提示PH正常62例,PH>7.45的12例,PH<7.35的7例,Ⅰ型呼衰和低氧血症各29例和36例(72.2%),无Ⅱ型呼衰,PaCO2<35mmHg者27例。间质性肺病的典型肺功能特点为肺容积减少,肺弥散功能降低,肺顺应性下降,与本研究中以限制性通气功能障碍和弥散功能降低为主的肺功能改变结果一致。而其他12例无类似肺功能改变者平均CTD至ILD发病时间为3.7年,因此肺功能没有典型表现考虑与CTD至ILD发病病程短有关。同时分析完成肺功能且有异常结果的49例病例,肺功能严重程度与病程长短无相关性(P=0.325)。肺功能和病程的相关性比较,见表3。

表2 CTD-ILD患者可能的临床-影像-病理类型

图2类风湿关节炎患者HRCT表现
Figure 2CT image of RA
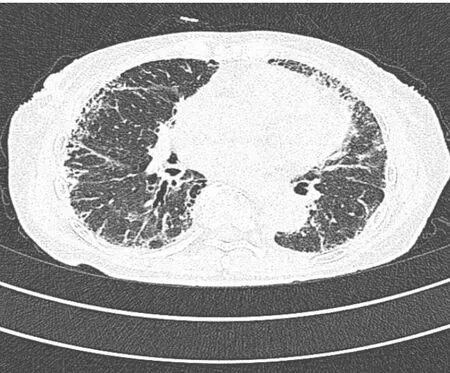
图3干燥综合征患者CT表现
Figure 3CT image of SS

图4多发性肌炎患者CT表现
Figure 4CT image of PM

图5系统性硬化患者CT表现
Figure 5CT image of SSc
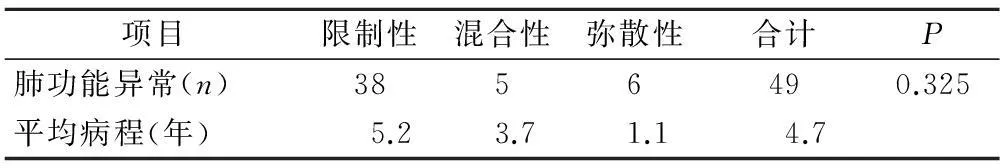
表3 49例肺功能异常患者分级与病程相关性
2.6治疗与转归90例患者中有67例入院时或初次确诊后使用静脉或口服糖皮质激素,急性期危重病例多采用甲基强的松龙40~240mg/天 静脉滴注,维持3~5天,病情稳定后改为口服糖皮质激素。使用口服糖皮质激素组多给予强的松30~90mg/天 起始剂量,根据病情逐渐减量至维持剂量后维持较长时间。其中11例联合免疫抑制剂治疗。67例使用糖皮质激素的患者中有26例因合并细菌或真菌感染使用抗菌药物治疗,这部分患者中从住院使用糖皮质激素(口服或静脉)到开始使用抗菌治疗期间,糖皮质激素的平均使用量(相当于甲基强的松龙剂量)为54mg/天,平均累积量1.67g/例,另41例住院期间未使用抗菌药物治疗患者的糖皮质激素剂量中位数38mg/天,平均累及剂量为0.78g。
继发感染的26例病例的糖皮质激素平均日使用量和平均例累积量明显大于未发生继发感染的41例病例糖皮质激素平均日使用量和平均例累积量。使用抗菌药物的患者与未使用抗菌药物的患者糖皮质激素累积剂量的相关性比较,见表4。
结缔组织病相关性肺间质病与大多数结缔组织病发病的性别特点一致,女性发病明显居多(76.6%)。90例患者中症状好转62例,症状无明显改善12例,死亡7例,均死于呼吸衰竭,其中DM-ILD患者死亡4例,SLE-ILD患者死亡2例,SSc-ILD 死亡1例。发生死亡的CTD-ILD病例构成(见表5)。7例死亡患者从诊断ILD到死亡的平均病程为8个月。其中2例死亡患者为单用糖皮质激素治疗,分别为1例SSc和1例DM患者。联合治疗患者死亡5例,从诊断ILD到死亡平均病程3.4年。死亡病例的治疗方案与病程相关性。
表467例患者初诊使用糖皮质激素剂量与抗菌药使用相关性
Table 4Correlation of glucocorticoids doses and antibiotics consumption

抗菌使用n平均使用剂量(mg/d)累积量(g)有26541.67无41380.78

表5 不同预后的CTD-ILD病例构成
3讨论
文献报道,15%~25%的间质性肺炎患者患有基础CTD[4],目前CTD- ILD受到越来越多的研究者关注。与其他类型的ILD比较,CTD-ILD的预后相对较好,但由于CTD-ILD的临床表现、影像学特点、病理改变与其他类型ILD有许多相似之处,并且当在诊断CTD前出现肺部表现时,临床医师容易忽视对CTD的诊断。因此,加强对CTD-ILD的认识在临床工作中具有重要意义。
3.1一般情况据既往统计资料显示,CTD-ILD患者平均年龄51岁,女性患者所占比例为 65%。本研究中CTD-ILD组患者平均年龄65岁,女性患者占76.7%,与文献结果基本一致。
本研究显示,CTD-ILD可见于多种CTD,其中较多的为PM/DM (22.2%) 和RA(21.1%)、SSc和SS (各15.6%),与既往文献报道的CTD- ILD最常见于SSc、RA、 SS、PM/DM 相一致[5-7]。ILD常见的临床症状体征前三位分别为咳嗽、呼吸困难、肺部VELCRO音,这与ILD的病理生理特点有关,肺泡内早期炎性反应后累及间质,炎性渗出减少,除非合并感染一般不会出现大量咯痰。间质性损害导致肺泡通气功能障碍,患者出现缺氧症状、呼吸困难,血气分析以低氧为主二氧化碳分压多正常,典型肺功能变化为通气功能的异常和气体交换功能的降低。通气功能是以限制性通气障碍为主、肺活量减少、残气量随病情进展而减少,随之肺总量也减少,但此时已不在疾病的早期。
3.2肺部影像CTD首发表现可以是肺部间质性病变,因此在因间质性肺病入院的患者中建议常规筛查CTD,以便早期确诊ILD病因,能早期进行针对性治疗。但部分患者首次筛查CTD不能确诊者,也应该定期随访观察有无出现其他系统受累的临床表现、监测复查自身免疫疾病相关抗体谱。而因为以ILD为首发临床表现病例数太少,如本研究中有5.6%的患者以肺部疾病为首发表现,无法判断哪类CTD疾病在其中更容易发生。因此尽早行HRCT和肺功能、甚至肺活检检查,做到早期诊断、早期治疗。
3.3本文纳入的90例患者均行胸部CT或HRCT检查,但遗憾的是均未有组织病理学资料。我们对CTD-ILD四类疾病PM/DM、RA、SSc和SS的影像、病理和治疗方案选择的相关性进行文献回顾和进一步讨论分析。
3.3.1皮肌炎和多发性肌炎相关性肺病(DM-ILD 和PM-ILD)多发性肌炎患者HRCT表现为胸膜下的纤维条索及网格状。病理类型报道不一致,有研究认为OP和UIP比例(分别为40%和33%)更高[8],也有报道显示NSIP(40~80%)更常见[9]。抗JO-1抗体阳性临床可表现为急性间质性肺炎,因此在皮肌炎和多发性肌炎患者中早期发现抗JO-1抗体及早期干预,可防止肺间质病恶化。此次纳入患者中有3例诊断抗JO-1合成酶综合征,在两个小型研究中,抗JO-1阳性抗合成酶综合征患者中抗SSA阳性,与HRCT扫描检查发现纤维化增加相关[10]。DM-ILD 和PM-ILD多需要大剂量糖皮质激素联合免疫抑制剂,另外有报道他克莫司效果对DM-ILD 和PM-ILD较好。
3.3.2系统性硬化症相关性肺病(SSc-ILD)SSc-ILD患者常见的病理类型为NSIP,影像学表现是磨玻璃影和纤维化[11]。本文纳入的90例患者中SSc-ILD患者肺部CT未出现纤维化改变,考虑与病例数少(14例)、病程较短(1.7年,远远短于平均2.6年的病程)有关。有回顾性研究发现HRCT表现为网格影的患者可能更能从CTX治疗中获益[12]。免疫抑制剂可以改善患者呼吸系统症状、肺功能及影像学异常[13]。
3.3.3类风湿性关节炎相关性肺病(RA-ILD)RA合并ILD占RA患者的25~30%[14,15],RA-ILD患者多种影像学和组织病理学改变对预后有提示作用。RA患者通常在HRCT中表现为寻常型间质性肺炎(UIP)者,蜂窝样囊腔和网格影多见,较非特异性间质性肺炎(NSIP型)患者生存率低[16],有研究发现UIP型RA-ILD 5年生存率为15%。RA-ILD病理类型不同对糖皮质激素的反应不同,对病理类型为OP的RA-ILD糖皮质激素效果较好,可予以冲击治疗而无需联合免疫抑制剂。其他类型RA-ILD多需要联合环磷酰胺、硫唑嘌呤等免疫抑制剂治疗。有证据表明NSIP型RA-ILD可能从免疫抑制剂治疗中获益,但UIP型RA-ILD患者是否也能受益尚无证据[17]。一项研究提出RA-ILD患者若为UIP病理型证实较特发性肺纤维化(IPF)生存率更高[18]。
3.3.4干燥综合症相关性肺病(SS-ILD)SS-ILD常见的组织病理类型为LIP,另有UIP、NSIP, 常见的影像学改变有磨玻璃影(45-92%)和纤维化性蜂窝囊性变(13-43%)[19-21]。虽然薄壁囊性变比SS-ILD中并非最常见影像学表现(7-17%)[20-22],但若CTD-ILD患者中HRCT发现肺大泡则仍应该提高对诊断SS-ILD的警惕性,因有文献报道CTD-ILD合并肺大泡的病例中SS为主,占84.6%[23]。SS-ILD病理特点使得其对糖皮质激素治疗反应性较好,若支气管肺泡灌洗也中中性粒细胞明显增多,则对糖皮质激素反应不佳,则需要联合免疫抑制剂。
在CTD-ILD患者中目前几乎没有确切证据指导哪些患者应该对无症状的ILD接受免疫抑制剂治疗。但建议需要连续观察症状和复查肺功能。当我们需要评价:CTD疾病类型及严重度,疾病进展的速度,肺部受累的严重程度,影像学类型和组织病理资料判断对糖皮质激素治疗的反应性,以决定一个患者是否会从免疫抑制治疗中获益。
4结论
在肺间质病患者中进行结缔组织病筛查,有利于指导临床治疗。了解各种结缔组织病相关的肺间质病的影像学、病理学特点,有助于对疾病诊断、治疗方案的选择以及预后进行判断。与特发性间质性肺病比较,CTD-ILD相对预后更好,可能因为CTD患者会对激素和免疫抑制剂治疗产生应答。对呼吸科医生而言评估ILD患者有无隐匿的CTD表现至关重要。需要在诊断ILD的患者中排查CTD并长期随访。了解有无新出现其他器官受累。对治疗和预后判断都有重要意义。而胸部 HRCT 对于及早发现CTD并发ILD 敏感性高,是疑有ILD的CTD患者的重要诊断工具。
【参考文献】
[1]陈灏珠. 《 实用内科学》.结缔组织病[M].第12 版. 北京:人民卫生出版社, 2009:1745-1746.
[2]Castlino FV, Varga J. Interstitial lung disease in connective tissue diseases:evolving concepts of pathogenesis and management[J]. Arthritis Res Therapy, 2010,12(4):213-224.
[3]蔡后荣.2011年特发性肺纤维化诊断和治疗循证新指南解读[J].中国呼吸与危重监护杂志,2011(4):313-316.
[4]Travis WD,Hunninghake G,King TE Jr,et al. Idiopathic nonspecific interstitial pneumonia:report of an American Thoracic Society project[J]. Am J Respir Crit CareMed, 2008,177(12):1338- 1347.
[5]Marie I, Hachulla E, Chérin P, et al. Interstitial lung disease inpolymyositis and dermatomyositis[J]. Arthritis Rheum, 2002,47(6):614-622.
[6]Parambil JG, Myers JL, Lindell RM, et al. Interstitial lung disease inprimary Sjogren syndrome[J]. Chest, 2006,130:1489- 1495.
[7]Kim DS. Interstitial lung disease in rheumatoid arthritis:recentadvances[J]. Curr Opin Pulm Med, 2006,12:346- 353.
[8]Tazelaar HD,Viggiano RW,Pickersqill J,et al.Interstitial lung disease in polymyositis and dermatomyositis.Clinical features and prognosis as correlated with histologic findings[J].Am Rev Respir Dis,1990,141(3):727-733.
[9]Marie I,Dominique S.Pulmonary damage during polymyositis and dermatomyositis:interstitial lung disease[J].Press Med,2006,35(4):683-695.
[10] Váncsa A,Csípo I,Németh J,et al.Characteristics of interstitial lung disease in SS-A posi tive/Jo-1 positive infl ammatory myopathy patients[J].Rheumatol Int,2009,29 (9):989-994.
[11] Clements PJ,Roth MD,Elashoff R,et al.Scleroderma Lung Study Group .Scleroderma Lung Study (SLS):differences in the presentation and course of patients with limited versus diffuse systemic sclerosis[J].Ann Rheum Dis,2007,66(12):1641-1647.
[12] Roth MD,Tseng CH,Clements PJ,et al.Scleroderma Lung Study Research Group.Predicting treatment outcomes and responder subsets in scleroderma-related interstitial lung disease[J].Arthritis Rheum,2011,63 (9):2797-2808.
[13] White B,Moore WC,Wigley FM,et al.Cyclophosphamide is associated withpulmonaru function and survival benefit in patients with scleroderma and alveolitis[J].Ann Intern Med,2000,132(112):947-954.
[14] Bestaev DV,Karateev DE,Nasonov EL.Diagnosis and problems in therapy of interstitial lung disease associated with rheumatoid arthritis[J].Ter Arkh,2013,85(5):84-91.
[15] Froidevaux-Janin S,Dudler J,Nicod LP,et al.Interstitial lung disease in rheumatoid arthritis [J].Rev Med Suisse,2011,7(318):2272-2277.
[16] Kim EJ,Elicker BM,Maldonado F,et al.Usual interstitial pneumonia in rheumatoid arthritis-associated interstitial lung disease[J].Eur Respir J,2010,35(6):1322-1328.
[17] Kim EJ,Collard HR,King TE Jr.Rheumatoid arthritis-associated interstitial lung disease:the relevance of histopathologic and radiographic pattern[J].Chest,2009,136 (5):1397-1405.
[18] Song JW,Do KH,Kim MY,et al.Pathologic and radiologic differences between idiopathic and collagen vascular disease-related usual interstitial pneumonia[J].Chest,2009,136 (1):23-30.
[19] Ito I,Nagai S,Kitaichi M,et al.Pulmonary manifestations of primary Sjögren’s syndrome:a clinical,radiologic,and pathologic study[J] .Am J Respir Crit Care Med,2005,171 (6):632-638.
[20] Yazisiz V,Arslan G,Ozbudak IH,et al.Lung involvement in patients with primary Sjögren’s syndrome:what are the predictors[J].Rheumatol Int ,2010,30(10):1317-1324.
[21] Parambil JG,Myers JL,Lindell RM,et al.Interstitial lung disease in primary Sjögren syndrome[J].Chest,2006,130 (5):1489-1495.
[22] Uffmann M,Kiener HP,Bankier AA,et al.Lung manifestation in asymptomatic patients with primary Sjögren syndrome:assessment with high resolution CT and pulmonary function tests[J].J Thorac Imaging,2001,16(4):282-89.
[23] 徐东,张奉春,李景云.结缔组织病合并肺大泡十例临床分析[J].中华风湿病学杂志,2004,8(11),680-681.
基金项目:四川省卫生厅科研课题 (30305030135)
通讯作者:梁宗安,教授,本刊常务编委,E-mail:liangzongan@hotmail.com
【中图分类号】R 563.1+3
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.07.014
(收稿日期:2015-09-02;编辑:陈舟贵)
Clinical characteristics of connective tissue disease -associated interstitial lung disease:90 cases analysis
ZHANG Jing1,LIANG Zong’an2,YANG Yang1,et al
(1.Department of Respiratory Medicine,Sichuan Provincial People's Hospital,Chengdu 610072,China;2.Department of Respiratory Medicine,West China Hospital,Sichuan University,Chengdu 610041,China;3.Department of Radiology,Sichuan Provincial People's Hospital,Chengdu 610072,China)
【Abstract】ObjectiveTo assess the clinical characteristics and radiologic characteristic of patients with connective tissue disease -associated interstitial lung disease (CTD-ILD).Methods90 patients with CTD-ILD were involved in the present study.The clinical courses,symptoms,physical signs,chest radiography features,CT or HRCT of the chest,blood gas analysis and pulmonary function were analyzed.ResultsThere were 19 patients with rheumatoid arthritis (RA),14 patients with sicca syndrome(SS),20 patients with dermatomyositis (DM) and polymyositis (PM),14 patiets with systemic sclerosis(SSc),5 patients with systemic lupus erythematosus and 18 patients with other diseases.The main symptoms of CTD-ILD were cough and progressive breathing difficulties.The early performance of CTD-ILD with lung was 5.6%,and the other cases were diagnosed CTD before ILD been diagnosed.Manifestations in CT were including the subpleural shadow,irregular reticular lines,nodules,etc.The median dose in 64 cases of hospitalized patients without using antibacterial drugs during the use of glucocorticoids was 38 mg/day.In the other 26 patients with antimicrobial agents,the CTD-ILD glucocorticoids median dose was 54 mg/day.ConclusionScreening interstitial lung disease in patients with connective tissue disease will be conductive to guide the direction of treatment.
【Key words】Interstitial lung disease; Connective tissue disease; Clinical characteristics analysis1

