皮肤结核实验室检测方法的比较研究*
张全华 李桂霞 白洁 张晓霞 崔莉 頡玉胜
(兰州军区总医院安宁分院,1.检验科;2.皮肤科,甘肃 兰州 730070)
皮肤结核实验室检测方法的比较研究*
张全华1李桂霞1白洁1张晓霞1崔莉1頡玉胜2
(兰州军区总医院安宁分院,1.检验科;2.皮肤科,甘肃 兰州 730070)
【摘要】目的比较和分析涂片抗酸染色法(AFS)、γ-干扰素(IFN-γ)释放试验(TB-IGRA)、实时荧光定量PCR(qRT-PCR)、TB-IGRA联合基因芯片法(TB-IGRA-GC,GC基因芯片法检测分枝杆菌菌种及耐药基因)在皮肤结核实验室诊断中的性能,筛选较为准确诊断皮肤结核的实验室方法。方法以34例皮肤结核病患者为阳性对照组,16例非皮肤结核住院患者为阴性对照组。比较AFS、TB-IGRA、qRT-PCR及TB-IGRA-GC检测皮肤结核的敏感性及菌种鉴定和耐药基因检测,并进行统计学分析和评价。 结果TB-IGRA-GC与TB-IGRA法检测皮肤结核的敏感性均为88.2%,qRT-PCR法与AFS法的敏感性分别为82.4%和23.5%,TB-IGRA-GC 、TB-IGRA、qRT-PCR与AFS在灵敏度上相比均有显著差异(P<0.05)。TB-IGRA-GC在50例标本中共检测出结核分枝杆菌复合群30例,非结核分枝杆菌1例(金色分枝杆菌)。30例结核分枝杆菌阳性标本耐药基因检测显示有3例发生耐药基因突变,其中2例为利福平耐药,1例为异烟肼耐药,没有检测到多重耐药菌株。结论TB-IGRA-GC在皮肤结核诊断上具有简便快速、灵敏度高、特异性好的优点,同时能进行分枝杆菌菌种鉴定和耐药基因检测,更有利于皮肤结核的发现、防控以及准确治疗,可作为临床皮肤结核实验室诊断的常规标准方法。
【关键词】皮肤结核;实验室检测;TB-IGRA-GC;基因芯片;耐药基因检测
皮肤结核是由结核杆菌引起的肺外部慢性皮肤病,临床表现具有多样性,症状不典型,临床误诊、漏诊率高[1]。当前我国皮肤结核的发病率处于回升趋势,同时在疑似结核病的临床病例中,非结核分枝杆菌感染所占比例较高(11.1%),而非结核分枝杆菌对结核病一线药物异烟肼和利福平等的不敏感率达83.7%,且结核分枝杆菌耐药性呈逐年上升趋势[2],尽早确诊皮肤结核病及菌种和耐药基因,对防控和治疗皮肤结核病尤为关键[3]。目前,临床实验室用于结核病诊断的方法有细菌培养法、抗结核抗体检测法(PPD)、抗酸染色涂片法及分子生物学检测法等[4]。痰菌培养是实验室检测结核分枝杆菌的金标准,但需耗时数周,这在很大程度上耽误了疾病的治疗,不利于结核病的防控;抗结核抗体检测法虽相对快速,但常出现假阳性和假阴性;抗酸染色涂片法简单、快速,但灵敏度差[5]。开发新的诊断结核病方法是世界卫生组织遏制结核病全球计划(2006~2015)的一部分[4],同时每年有近10亿美元花费在结核病诊断上[6]。近年来,随着分子生物学检测技术在结核分枝杆菌诊断中的应用,除克服了传统方法的诸多不足外,还能更快速、敏感、特异地鉴定结核分枝杆菌[7,9]。本文将TB-IGRA-GC、干扰素酶联免疫法(TB-IGRA)、qRT-PCR法、抗酸染色涂片法用于皮肤结核患者的诊断中,并对4种方法的性能及优缺点进行比较,以选取实验室检测皮肤结核的最佳方法。
1资料与方法
1.1一般资料选取2013年2月~2014年12月期间我院临床确诊为皮肤结核的患者34例为阳性对照组,男12例,女22例。14~40岁8例(23.53%);40~60岁20例(58.82%),60岁以上6例(17.65%)。其中面部寻常狼疮22例,8例初始误诊为湿疹、皮炎;颜面栗粒性狼疮4例,2例初始误诊为湿疹、皮炎;结核性红斑2例;左下脚丘疹坏死、皮肤性结核2例;下肢皮肤结核2例;皮肤结核2例,初始误诊率为29.41%。选取同期非皮肤结核住院患者16例为阴性对照组。标本类型有静脉血和创面分泌物。
1.2方法
1.2.1仪器与试剂主要仪器:XSP-36双目生物显微镜(江西凤凰光学公司),Allegra X-15R台式冷冻离心机(美国贝克曼库尔特公司),iMark多功能酶标仪(美国Bio-Rad公司),CFX96 TouchTM荧光定量 PCR 检测系统(美国Bio-Rad公司),LuxScan10K-B微阵列芯片扫描仪(北京博奥公司)等。试剂:抗酸杆菌染色液(珠海贝索生物技术公司),结核感染T细胞检测试剂盒(北京万泰生物公司),结核分支杆菌核酸扩增荧光检测试剂盒(达安基因公司),晶芯分枝杆菌菌种鉴定试剂盒、晶芯结核分枝杆菌耐药基因检测试剂盒(北京博奥生物公司)等。
1.2.2AFS检测收集患者创面分泌物,121℃高压灭菌15min,待冷却后,取0.2 ml于体积为1.5ml的无菌EP管中,加水至1.0ml,12 000rpm离心10min,取沉淀物涂片,后按抗酸杆菌染色液试剂盒说明书操作,以油镜视野中观察到抗酸杆菌为阳性。
1.2.3TB-IGRA检测采集患者肝素抗凝静脉血5ml,在2h内各分装1ml到N、T、P 3个培养管中,37℃恒温培养箱培养22h ± 2h,以3000r/min 离心10min,吸取上清,ELISA按照结核感染T细胞检测试剂盒说明书操作。
1.2.4qRT-PCR检测蘸取患者创面处分泌物于1.5ml EP管中,加入250μl结核杆菌DNA提取液,封口膜封口,振荡混匀,95℃加热20min,12000rpm离心10min,上清转移至新的1.5ml EP管中。按照结核分支杆菌核酸扩增荧光检测试剂盒进行基因检测操作。
1.2.5基因芯片检测将方法1.2.4提取的上清液按照晶芯分枝杆菌菌种鉴定试剂盒、晶芯结核分枝杆菌耐药基因检测试剂盒说明书分别进行菌种鉴定、耐药基因检测。
1.3统计学分析采用SPSS 19.0软件进行统计学分析。用t检验和2检验比较TB-IGRA-GC与TB-IGRA、qRT-PCR、AFS法在皮肤结核实验室诊断上的差异,P<0.05为差异有统计学意义。
2结果
2.1IFN-γ检测阳性对照组血浆IFN-γ水平显著高于阴性对照组,差异有统计学意义(P<0.05),见表1。

表1 两组患者IFN-γ检测结果比较
注:与阴性对照组比较,①P<0.05
2.24种检测方法敏感性比较TB-IGRA-GC与常规的TB-IGRA、 qRT-PCR法在皮肤结核分枝杆菌检测中,其敏感性接近,均为88.2%,但TB-IGRA-GC检测的特异性为100%,说明TB-IGRA-GC法在皮肤结核分枝杆菌检测中敏感性优于其它方法,见表2。
2.34种方法对结核分枝杆菌菌种和耐药基因检测TB-IGRA-GC法对两组50例标本进行检测,结果显示,30例为结核分枝杆菌复合群阳性,非结核分枝杆菌1例(金色分枝杆菌),见图1。30例结核分枝杆菌阳性标本耐药基因检测显示有3例发生耐药基因突变,其中2例为利福平耐药,1例为异烟肼耐药,没有检测到多重耐药菌株(见图2)。TB-IGRA、qRT-PCR、AFS法均不能进行非结核分枝杆菌菌种鉴定和耐药基因检测,见表3。
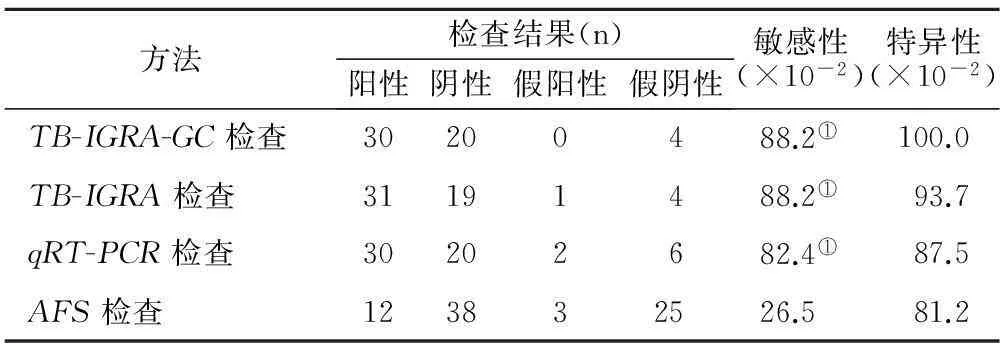
表2 4种方法对两组50例患者敏感性比较
注:与AFS检查比较,① P<0.05

图1TB-IGRA-GC法结核分枝杆菌菌种检测
Figure 1Strains detection of mycobacterium tuberculosis by TB-IGRA-GC
注:a.基因芯片检测显示为结核分枝杆菌复合群阳性;b.基因芯片检测显示为金色分枝杆菌
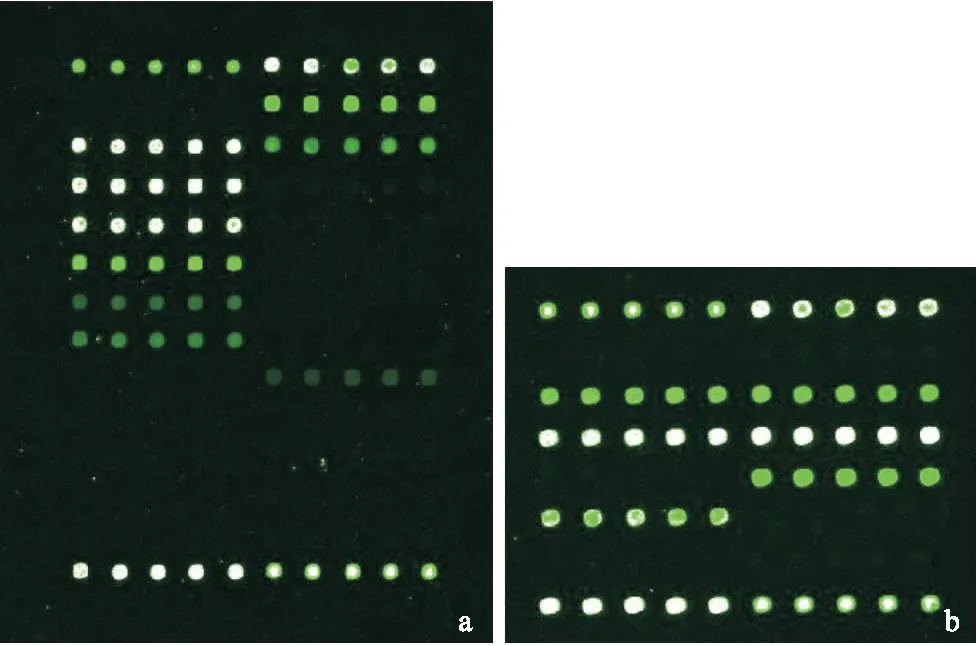
图2TB-IGRA-GC法结核分枝杆菌耐药基因检测
Figure 2Resistance genes detection of mycobacterium tuberculosis by TB-IGRA-GC
注:a.基因芯片检测显示为利福平耐药;b.基因芯片检测显示为异烟肼耐药
表34种检查方法对两组50例患者标本的菌种和耐药基因检测(n)
Table 3Detecting of strains and resistance genes in 50 clinical cases by 4 methods
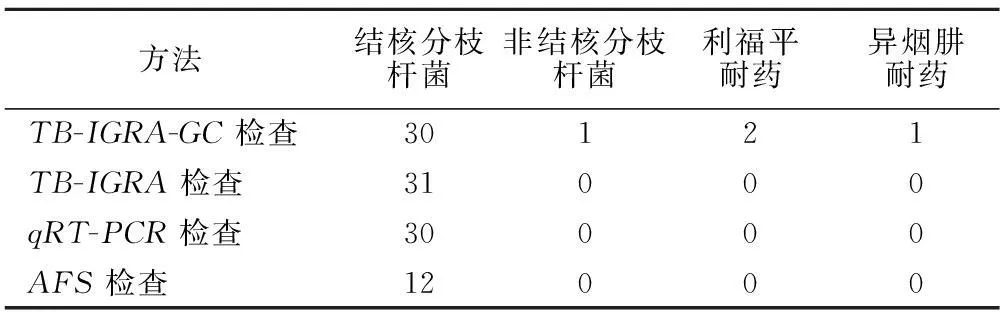
方法结核分枝杆菌非结核分枝杆菌利福平耐药异烟肼耐药TB-IGRA-GC检查30121TB-IGRA检查31000qRT-PCR检查30000AFS检查12000
3讨论
皮肤结核是一种由结核分枝杆菌引起的慢性皮肤病,致病原因是人体自身免疫力下降时,结核杆菌通经血液和淋巴回流途径感染皮肤所引起。该病临床表现隐袭(发病过程缓慢,往往一年到数年之久)、不典型(皮肤结核早期一般无自觉症状,有些患者仅仅在感染后才伴有局部疼痛、搔痒等临床表现)、多样性(根据结核杆菌毒性、数量和机体免疫力以及侵入途径不同,其临床表现症状也不同,主要的表现症状为丘疹、斑块、脓疱、伴感染的结节溃疡或孢子丝菌病样皮损,可波及大片皮肤损坏、鼻耳口唇眼睑等处形成瘢痕甚至毁容等)、易误诊(与多种皮肤疾病相似)。近年来我国皮肤结核的发病率处于上升趋势,由非结核分枝杆菌 (NTM) 与结核分枝杆菌 (TB) 所引发的疾病临床表现十分相似,而治疗方案又不相同,且结核杆菌的耐药程度每年呈上升趋势,为了提高对皮肤结核病的诊断、治疗和疫情防控,筛选出准确有效的实验室诊断皮肤结核的方法显得尤为重要。
实验室诊断皮肤结核病的检测方法是防患和治疗该病的基础。常见的结核分枝杆菌诊断方法有结核杆菌微生物培养方法、结核菌素皮肤试验、抗酸染色镜检方法等。痰菌培养作为结核杆菌判定的金标准,但因其耗时长(需8周左右)、P2级以下实验室不允许做、培养基不固定(常用的培养基有Löwenstein-Jensen培养基、Middlebrook 7H10或7H11半合成培养基、BACTEC 460、BACTEC MGIT 960等)等方面的局限,使其应用范围大大受限[10,11]。结核菌素皮肤试验法是用5个单位的结核菌素(0.1 ml)进行皮内注射,在48~72小时内,局部有超过5mm的硬结即为阳性。此法最为常见,但其灵敏度不稳定为33%~96%;特异性为62.5%[12]。同时,2个月以下的婴儿、孕妇、糖尿病患者、肾衰竭、免疫受损患者会出现假阴性;艾滋病患者、1年以内接种过疫苗并感染了非典型结核分枝杆菌的儿童、长期在结核杆菌环境中生活的人会显示出假阳性反应。较低的敏感性、特异性及假阴性和假阳性结果使该方法不能准确诊断皮肤结核,从而耽误了治疗皮肤结核的最佳时间,给患者带来了更大的痛苦。抗酸染色涂片法以其操作简便、价格低廉而被广泛应用于皮肤结核实验室诊断。它是基于结核分枝杆菌厚厚的脂肪壁能被染色,包括萋-泥染色法(Ziehl-Neelsen staining)、金永染色法(Kinyoun staining)和金胺-罗丹明荧光染色法(auramine-rhodamine fluorochrome staining),其中萋-泥染色法是最常用的。但每毫升需超过104菌量才能被确定为阳性,同时诺卡氏菌、棒状杆菌、非结核分枝杆菌也能被染色,这影响 降低了该方法的检出率和准确性[3]。面对上述方法存在的各种弊端及现实情况的需求,选择一种快速、敏感、特异、适合于实验室诊断皮肤结核的方法迫在眉睫。
近年来,由于TB-IGRA、qRT-PCR法在结核病和分枝杆菌检测中快速、敏感、高效等特点,使其初步应用在皮肤结核的实验室诊断中。与以往的常规方法相比,TB-IGRA通过检测结核分枝杆菌特异性重组抗原刺激感染者的特异性T淋巴细胞释放的IFN-γ,此法操作简便、灵敏度高,同时能检出潜伏性皮肤结核,排除卡介苗及其他致病性非结核分枝杆菌的干扰,降低假阳性率[13]。qRT-PCR是一种在DNA扩增反应中,以荧光化学物质实时测每次聚合酶链式反应(PCR)循环后产物总量的方法,此法操作快速、灵敏度高[14]。但上述两种方法均不能对结核杆菌进行菌种和耐药基因检测。
本文利用TB-IGRA-GC、TB-IGRA、qRT-PCR、AFS法分别对50例患者进行皮肤结核检测,结果显示:AFS操作简单、快速,实验室准入门槛低,但敏感性仅为23.5%,与肖作汉等[15]报道结果一致;TB-IGRA检测血浆中的IFN-γ,间接反映人体中结核分枝杆菌感染情况,其对结核病的准确性达88.2%,同时结核患者的IFN-γ水平明显高于非结核病患者,差异具有统计学意义(P<0.05);qRT-PCR的敏感性为82.4%,与AFS相比,qRT-PCR的敏感性显著高于AFS,差异有统计学意义(P<0.05),但它不能进行潜伏性皮肤结核检测,同时上述三种方法均不能进行菌种和耐药基因检测。而TB-IGRA-GC法,对TB-IGRA判定为阳性的患者再进行基因芯片法分枝杆菌菌种鉴定和耐药基因检测,在保证较高的确诊率时,同时还能在感染早期快速、准确地对分枝杆菌进行菌种和耐药基因检测,对疾病的诊断、准确治疗和控制具有重要意义。
4结论
研究结果显示,采用TB-IGRA-GC与TB-IGRA、PCR、AFS进行皮肤结核检测比较,从临床上验证了TB-IGRA联合基因芯片法在皮肤结核检出率、菌种鉴定以及耐药基因检测方面明显优于其它检查方法、可将其作为皮肤结核在实验室诊断的常规标准方法。
【参考文献】
[1]彭卫生,王英年,肖成志.新编结核病学[M].第2版.北京:中国医药科技出版社,2003:289-292.
[2]Hu Y,Hoffner S,Jiang W,et al.Genetic characterisation of drug-resistant Mycobacterium tuberculosis in rural China:a population-based study[J].The International Journal of Tuberculosis and Lung Disease,2010,14(2):210-216.
[3]Almaguer-Chavez J,Ocampo-Candiani J and Rendon A.Current panorama in the diagnosis of cutaneous tuberculosis[J].Actas Dermosifiliogr,2009,100(7):562-570.
[4]代旭磊,柳爱华,宝福凯,等.结核分支杆菌的分子检测技术研究进展[J].现代预防医学,2012,39(8):2032-2034.
[5]王震,龚玉华,钱彩娣,等.5 种结核杆菌检测方法的临床应用价值[J].检验医学与临床,2015,12(3):334-336.
[6]Farina MC,Gegundez MI,Pique E,et al.Cutaneous tuberculosis:a clinical,histopathologic,and bacteriologic study[J].J Amer Acad Dermatology,1995,33(3):433-440.
[7]Santos JBd,Figueiredo AR,Ferraz CE,et al.Cutaneous tuberculosis:diagnosis,histopathology and treatment - part II[J].An Bras dermatol,2014,89(4):545-555.
[8]赵连爽,代娣,陈昕,等.基因芯片在分枝杆菌菌种鉴定及结核耐药基因检测的诊断价值[J].检验医学与临床,2014,11(12):1595-1598.
[9]石玉玲,陈建芸,李林海,等.应用基因芯片快速检测分枝杆菌[J].生物技术通讯,2011,22(3):419-423.
[10] Caminero Luna JA,Casal Roman M,Ausina Ruiz V,et al.Tuberculosis diagnosis[J].Archivos Bronconeumologia,1996,32(2):85-99.
[11] Cruciani M,Scarparo C,Malena M,et al.Meta-analysis of BACTEC MGIT 960 and BACTEC 460 TB,with or without solid media,for detection of mycobacteria[J].J Clinical Microbiology,2004,42(5):2321-2325.
[12] Ramam M,Malhotra A,Tejasvi T,et al.How useful is the Mantoux test in the diagnosis of doubtful cases of cutaneous tuberculosis?[J].Intl J Dermatology,2011,50(11):1379-1382.
[13] 王睿,施焕中.干扰素-γ释放试验在结核病诊断中的价值[J].中国科学生命科学,2015,45(3):320-324.
[14] 张为民,龚文波.荧光定量 PCR 检测结核杆菌 DNA 与涂片抗酸染色结果的比较[J].实用医学杂志,2010,26(23):4272-4274.
[15] 肖作汉,孟冈,孙文锦,等.结核分枝杆菌感染者 TB-IGRA 试验检测IFN-γ的临床意义[J].检验医学与临床,2015,12(4):549-550.
基金项目:兰州军区科研面上项目(LZP2012035)
通讯作者:白洁,E-mail:262717254@qq.com
【中图分类号】R 529.4
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.07.029
(收稿日期:2015-09-11;编辑:陈舟贵)
The comparative study of laboratory detection methods on cutaneous tuberculosis
ZHANG Quanhua1,LI Guixia1,BAI Jie1,et al
(1.Department of Clinical Laboratory,Anning Branch Hospital,General Hospital of Lanzhou Military Area Command,Lanzhou 730070,China; 2.Department of Dermatology,Anning Branch Hospital, General Hospital of Lanzhou Military Area Command,Lanzhou 730070,China)
【Abstract】ObjectiveTo analyze and compare the laboratory detection methods of cutaneous tuberculosis,including smear acid-fast stain (AFS),interferon-gamma release assay (TB-IGRA),real-time quantitative polymerase chain reaction (qRT-PCR),TB-IGRA combined with gene chip (TB-IGRA-GC,GC identification of mycobacterium and detection of drug-resistant genes by gene chip) and discuss their clinic efficacy,and select the most reasonable laboratory diagnosis method for cutaneous tuberculosis.Methods34 cutaneous tuberculosis patients were used as positive control.16 noncutaneous tuberculosis patients were used as negative control.Collecting the information about the sensitivity and identification of mycobacterium and the drug-resistant genes detecting of AFS,TB-IGRA,qRT-PCR,TB-IGRA-GC,and then statistically analyzed and compared the results of the four groups.ResultsThe results showed that the sensitivity of TB-IGRA-GC and TB-IGRA for the detection of cutaneous tuberculosis were both 88.2%,But qRT-PCR and AFS were 82.4% and 23.5%.There were significant differences between AFS and other methods (P<0.05).Among the 50 cases,TB-IGRA-GC found that 30 cases were mycobacterium tuberculosis complex.1 case was nontuberculous mycobacteris (Mycobacteria aurum).30 Mycobacterium positive samples showed drug-resistant genes.3 cases showed drug-resistant genes mutation.2 cases were rifampicin.1 case was isoniazid.The multiple resistant strains were not detected.ConclusionCompared with AFS,TB-IGRA,qRT-PCR and TB-IGRA-GC are the most convenient,rapid,sensitive and specificity laboratory method for diagnosing cutaneous tuberculosis.Meanwhile,they can identify the mycobacterium strains and detect drug resistance gene.This is conducive to detect,prevent and treat cutaneous tuberculosis.
【Key words】Cutaneous tuberculosis; Laboratory detection; TB-IGRA-GC; Gene chip; Drug-resistant genes detecting

