右旋美托咪啶对福尔马林炎性痛大鼠吗啡耐受的调节及机制
何 莉,郭静雯
右旋美托咪啶对福尔马林炎性痛大鼠吗啡耐受的调节及机制
何莉,郭静雯
目的观察右旋美托咪啶(Dex)对福尔马林炎性痛大鼠吗啡耐受的调节及机制。方法选取雄性SD大鼠40只,采用5%福尔马林建立急性炎性疼痛模型,随机分为4组,各10只。Ⅰ组(空白组)、Ⅱ组(吗啡耐受组)、Ⅲ组(Dex组)、Ⅳ组(Dex+NMDA组)。观察脊髓背角神经元型一氧化氮合酶(nNOS)、信使核糖核酸(mRNA)的表达及一氧化氮(NO)含量与一氧化氮合酶(NOS)活性。结果脊髓背角nNOS及mRNA在Ⅰ~Ⅳ组均有表达,组间脊髓背角nNOS及mRNA比较,差异具有统计学意义(P<0.01);其中Ⅲ组nNOS及mRNA相对表达量与Ⅰ组无明显差异(P>0.05),但均低于Ⅱ、Ⅳ组(P<0.05)。组间脊髓背角NO含量及NOS活性比较,差异具有统计学意义(P<0.01);其中Ⅲ组大鼠的脊髓背角NO含量和NOS活性与Ⅰ组比较无明显差异(P>0.05),但均低于Ⅱ、Ⅳ组(P<0.05)。结论在福尔马林炎性痛大鼠模型中,Dex可抑制脊髓背角nNOS、mRNA表达及NO产生,使吗啡耐受得到逆转。
右旋美托咪啶;天冬门氨酸;神经元型一氧化氮合酶;福尔马林;吗啡
福尔马林致痛模型是常用的炎症性疼痛模型,其可产生局部炎性疼痛和脊髓背角介导功能变化引起的伤害性疼痛[1]。近年来,吗啡作为最基本的药物常用于慢性疼痛的临床治疗中,但其长时间应用会诱导产生吗啡耐受情况,严重影响慢性疼痛患者的生活质量[2]。有研究发现,N-甲基-D-天冬门氨酸(N-Methyl-D-Aspartic Acid,NMDA)受体及其下游信号传导分子NO的激活是导致吗啡耐受形成和维持的主要原因[3]。右旋美托咪啶(Dex)为高选择性α2肾上腺素能受体(Alpha-2 adrenergic receptor,α2-AR)激动剂,其可抑制NMDA受体介导,具有镇静、镇痛作用[4],故笔者推测Dex可能会通过抑制NO的产生进而逆转吗啡耐受。本实验通过对吗啡耐受模型大鼠的鞘内注射Dex,观察其对吗啡耐受模型的行为学及脊髓背角nNOS、mRNA表达的影响,阐明其对吗啡耐受的调节及可能的机制,为临床防治吗啡耐受提供新思路。
1 资料与方法
1.1动物分组选取雄性SD大鼠40只,体重260~310 g,采用5%福尔马林100 μl注入大鼠左侧后爪掌心皮下建立急性炎性疼痛模型,随机分为4组,各10只。Ⅰ组(空白组)、Ⅱ组吗啡耐受组(吗啡耐受组)、Ⅲ组(Dex组)、Ⅳ组(Dex+NMDA组)。
1.2行为学测试Ⅱ~Ⅳ组大鼠注射福尔马林后立即出现疼痛反应,表现为咬舌、舔足等,在注射25 min后,大鼠行为反应更明显,且持续时间较长。注射部位数分钟后出现红肿等炎性反应,炎性反应在注射后1~3 d为高峰。
1.3鞘内置管在大鼠腹腔注射戊巴比妥钠(40 mg/kg)后将PE-10导管按照Yaksh法置入大鼠鞘内至脊髓腰段处。所有大鼠均单独饲养5 d,即可用于实验。
1.4模型建立40只大鼠均行鞘内置管,Ⅰ组连续6 d,2次/d行鞘内注射生理盐水20 μl;Ⅱ~Ⅳ组连续6 d,2次/d行鞘内注射吗啡10 μg,逐步建立吗啡耐受模型;Ⅲ组在每次给予吗啡前3 h给予Dex(5 μg/kg);Ⅳ组给予Dex 0.5 h再给予NMDA,待Ⅱ、Ⅲ组吗啡耐受模型建立完成并出现阳性结果后,Ⅳ组开始进入实验。经以上处理后观察各组大鼠在注射后1 h内的疼痛行为学变化。吗啡耐受模型的建立采用行为学(热平板痛域、机械压痛域)变化进行确认。
1.5观察指标①观察鞘内注射Dex后大鼠脊髓背角nNOS及mRNA的表达情况;②观察Dex对脊髓背角NO含量和NOS活性的影响。nNOS及mRNA的表达采用RT-PCR检测。
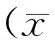
2 结 果
2.1脊髓背角nNOS及mRNA在各组中的表达情况见表1。脊髓背角nNOS及mRNA在Ⅰ~Ⅳ组均有表达,组间脊髓背角nNOS及mRNA比较,差异具有统计学意义;其中Ⅲ组nNOS及mRNA相对表达量与Ⅰ组无明显差异(P>0.05),但均低于Ⅱ、Ⅳ组(P<0.05)。

表1 脊髓背角nNOS及mRNA在各组中的表达情况
2.2Dex对脊髓背角NO含量及NOS活性的影响情况见表2。组间脊髓背角NO含量和NOS活性比较,差异具有统计学意义;其中Ⅲ组大鼠的脊髓背角NO含量和NOS活性与Ⅰ组比较无明显差异(P>0.05),但均低于Ⅱ、Ⅳ组(P<0.05)。
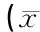
表2 Dex对脊髓背角NO含量及NOS活性的影响情况±s)
3 讨 论
Dex是一种高度特异选择性α2肾上腺素受体激动剂,其分布半衰期为6 min,消除半衰期为2 h,较短的分布半衰期使其成为一种理想的麻醉辅助药物[5]。Dex主要作用于脑和脊髓的α2-AR,能产生抑制交感活性、镇静、镇痛等作用。当机体处于应激状态时,应激原的刺激会作用于脑干的蓝斑,引起交感肾上腺髓质系统的兴奋及交感神经活动增强[6]。α2受体激动剂能激活交感神经末梢或心脏的突触前α2受体,从而达到抑制肾上腺素释放的目的。
NO是一种小分子的生物活性气体,能参与有关伤害性信息的传递,与痛觉的形成和发展相关[7]。有研究证明,当NOS抑制剂与吗啡联合给药时,镇痛耐受会明显延迟。提示,可能是由于在脊髓的胶质区或中央管周围的神经细胞有NOS分布,而NO的合成与NOS的活性密切相关,故NO参与了脊髓中的痛觉传导[8]。此外,NMDA受体的兴奋能引起Ca2+进入细胞,刺激NOS,使NO合成。所以,要阻止NO的合成必须先抑制NMDA受体的兴奋。相关研究显示,NMDA受体拮抗剂MK-801不仅能阻止吗啡耐受的产生而且还逆转了原先存在的吗啡耐受,降低了吗啡的依赖性[9],由此可见,NMDA受体拮抗剂在治疗吗啡耐受方面具有潜力。Dex是一种能抑制NMDA受体介导具有刺激伤害性传入的新型药物,现已逐渐应用于临床治疗中。
本研究结果显示,脊髓背角nNOS及mRNA在Ⅰ~Ⅳ组均有表达,组间脊髓背角nNOS及mRNA比较,差异具有统计学意义(P<0.01);其中Ⅲ组nNOS及mRNA相对表达量与Ⅰ组无明显差异(P>0.05),但均低于Ⅱ、Ⅳ组(P<0.05)。组间脊髓背角NO含量及NOS活性比较,差异具有统计学意义(P<0.01);其中Ⅲ组大鼠的脊髓背角NO含量和NOS活性与Ⅰ组比较无明显差异(P>0.05),但均低于Ⅱ、Ⅳ组(P<0.05)。提示,在福尔马林炎性痛大鼠模型中,Dex可抑制脊髓背角nNOS、mRNA表达及NO产生,使吗啡耐受得到逆转。
综上所述,鞘内注射Dex可抑制福尔马林炎性痛大鼠脊髓背角nNOS及mRNA的表达,产生明显的镇痛作用,还能抑制NO的产生使其原有吗啡耐受得到逆转,为临床麻醉、术后镇痛等方面提供了一种新的药物选择,具有良好的应用前景。
[1]张玲,佘守章,谢晓青.不同浓度右美托咪定对术后罗哌卡因与吗啡硬膜外自控镇痛效应的影响[J].广东医学,2014,35(11):1680-1683.
[2]张惠,王国年.右美托咪啶的镇痛机制及临床应用[J].西部医学,2012,24(9):1828-1829,1833.
[3]苏靖心,董铁立.右旋美托咪啶临床应用[J].中华实用诊断与治疗杂志,2012,26(6):521-522.
[4]沈杨,金立红,张马忠.右美托咪定增强小儿外科手术后芬太尼的镇痛效果[J].上海医学,2014,37(10):827-830.
[5]佟凯.右美托咪定辅助全身麻醉患者的镇静及全身麻醉药物的节俭作用[J].中国当代医药,2014,21(1):122-123.
[6]周兴.右美托咪啶的药理作用及在临床中的应用[J].医学综述,2012,18(10):1552-1555.
[7]傅璐,郭瑞鲜,莫利求,等.脊髓c-Jun在NMDA受体NR2B亚基介导的大鼠吗啡镇痛耐受中的作用[J].中国药理学通报,2011,27(2):248-252.
[8]张葆,胡兴国,刘祖才,等.鞘内氯胺酮或(和)吗啡注射对切口痛大鼠脊髓NOS活性和NO含量的影响[J].医学临床研究,2005,22(4):433-436.
[9]Roh DH,Yoon SY,Seo SH,etal.Intrathecal injection of carbenoxolone,a gap junction decoupler,attenuates the induction of below-level neuropathic pain after spinal cord injury in rats[J].Exp Neurol,2010,224(1):123-132.
(2016-03-29收稿2016-05-21修回)
(本文编辑贡树基)
Reverse regulation and mechanism of dexmedetomidine on formalin inflammatory pain and morphine tolerance in rats
HE Li,GUO Jingwen.
Department of Anesthesiology,the First People’s Hospital of Guangzhou,Guangdong510180,China
ObjectiveTo observe the effects of Dex on formalin inflammatory pain and morphine tolerance in rats and its mechanism.MethodsSelected forty male SD rats, using 5% formalin to establish acute inflammatory pain model, were randomly divided into 4 groups, 10 rats in each group. Group I (blank group), morphine tolerance group (morphine tolerance group), group III (group Dex), group IV (group Dex+NMDA). Expression of neuronal nitric oxide synthase (nNOS), messenger RNA (mRNA) and nitric oxide (NO) content and nitric oxide synthase (NOS) activity in spinal dorsal horn neurons were observed.ResultsThe expression of nNOS in spinal dorsal horn and mRNA in group I, group II, group III, IV group were, the group III of nNOS mRNA and the relative expression quantity and group I had no significant difference(P>0.05)but lower than that of group II and group IV(P<0.05);group III rats spinal cord dorsal horn of no content and NOS activity and group I no statistical significance(P>0.05), but compared with group II and IV group, no content were reduced 74.5% and 40%, NOS activity were decreased by 55.0% and 31.4%(P<0.05).ConclusionAmong rats of the formalin inflammatory pain model, DEX can inhibit nNOS in spinal dorsal horn, mRNA expression and NO production, so morphine tolerance has been reversed.
Dex;NMDA;nNOS;Formalin;Morphine
广州市医药卫生科技项目(编号:20151A010001)
510180广州市第一人民医院麻醉科
[中国图书资料分类号]R 96A
10.16485/j.issn.2095-7858.2016.03.004

