云南特有火把梨UFGT基因片段的克隆与序列分析
孟富宣 周 军 王大玮 陶 磅 董 娇 徐世宏 段淋渊
(1.云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2.云南省农业科学院热区生态农业研究所,云南 元谋 651300;3.西南山地森林资源保育与利用省部共建教育部重点实验室,云南 昆明 650224;4.西南林业大学林学院,云南 昆明 650224;5.云南省农业科学院园艺作物研究所,云南 昆明 650000;6. 中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223)
云南特有火把梨UFGT基因片段的克隆与序列分析
孟富宣1,2,3,4周军1,3,4王大玮3,4陶磅5董娇6徐世宏3,4段淋渊3,4
(1.云南省高校林木遗传改良与繁育重点实验室,云南 昆明 650224;2.云南省农业科学院热区生态农业研究所,云南 元谋 651300;3.西南山地森林资源保育与利用省部共建教育部重点实验室,云南 昆明 650224;4.西南林业大学林学院,云南 昆明 650224;5.云南省农业科学院园艺作物研究所,云南 昆明 650000;6. 中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223)
为研究UFGT基因对红皮梨花色素苷合成的调控机制,以云南特有火把梨为试材,克隆得到UFGT的基因片段,运用生物信息学分析软件对该基因序列进行分析。结果表明:UFGT基因片段长1 440 bp,编码479个氨基酸的蛋白质;该氨基酸序列与沙梨、西洋梨、白梨、苹果和樱桃李的同源性分别为99%、96%、94%、91%和72%;蛋白无跨膜结构,不存在导肽和信号肽,属于非分泌蛋白,定位在胞液;结构功能域分析显示该片段含典型的GT1_Gtf_Like功能域和1个GTB型超家族蛋白的典型结构。
火把梨;UFGT;基因克隆;生物信息学
火把梨(Pyruspyrifoliacv.‘Huobali’)是云南本地沙梨品种,云南当地所有红皮梨的统称。火把梨具有稳定遗传的红色果皮表型,原产于云南大理和周边丘陵山地地区,其适应性较强,耐低温,抗晚霜,抗黑星病、腐烂病,对梨木虱也有较强抗性,因其品质优、营养保健作用明显而受到植物学家的重视。
UFGT是花色素苷合成途径中最后一个酶(黄酮-3-葡萄糖基转移酶)的基因[1],负责将糖基连接到不稳定的花青素上,从而使花青素变成稳定的花色素苷[2-3]。花色素苷属于类黄酮合成途径中一个有色末端产物,是存在于植物体内的一大类重要次生物质;此外,花色素苷广泛存在于被子植物表皮细胞的液泡中,赋予植物花、叶、果实等器官各种色泽。
Kondo等人认为UFGT与花色素苷的表达密切相关[4]。目前,对于UFGT的克隆、表达及功能分析,国内外学者作了很多工作,已经从苹果(Malussylvestrisvar.domestica)[5]、葡萄(Vitisamurensis)[6]、海棠(Maluscrabapple)[7]、马铃薯(Solanumtuberosum)[8-9]、荔枝(Litchichinensis)[10-11]中克隆得到了UFGT基因,并进行了相应的表达分析。目前,已经证明UFGT是葡萄[12]和苹果花色素苷合成的关键基因[5,13]。对葡萄的研究显示,白皮葡萄及其红色突变种中均有UFGT基因,且编码区结构相同;黄皮葡萄中也存花色素苷合成相关基因,只是其表达丰度较红色品种弱[2]。胡福初等[14]对‘糯米糍’荔枝研究发现,绿果果皮中未检测到UFGT基因的表达,转黄期少量表达,果实成熟时该基因表达量增加,并初步确定UFGT在荔枝果皮花色素苷合成过程中起着重要的作用。李俊才等[15]从红巴梨果皮中克隆了UFGT基因,发现随着果实的成熟该基因的表达强度降低,成熟期是幼果期的50%,在果肉中则不表达。Fischer等人[16]从西洋梨(Pyruscommunis)中克隆到了花色素苷合成途径中的部分基因。而有关火把梨UFGT基因克隆的研究还鲜有报道。
本试验以云南火把梨为试材,采用同源克隆的方法克隆得到了UFGT基因片段,并进行生物信息学分析,以期为UFGT全长的克隆、结构功能分析以及该基因在火把梨花色素苷生物合成途径中的作用等研究奠定基础。
1 材料与方法
1.1植物材料
试验所需植物材料采自云南安宁市清水河红皮梨种质基地和昆明市团结镇大河果园,采摘成熟且着色均匀的火把梨带回实验室后立即用刀削下果皮,用液氮作保鲜处理,并保存于-80 ℃冰箱备用。
1.2试验方法1.2.1RNA的提取与cDNA合成采用购自Sigma公司的OMEGA提取试剂盒(E.Z.N.A.TMPlant RNA Kit) 对火把梨总RNA进行提取;cDNA第一链的合成使用北京天根生化科技有限公司的TIANscript cDNA 第一链合成试剂盒。
1.2.2引物设计与基因克隆通过对GenBank中多个UFGT同源基因序列进行比对后设计引物,UFGT(f1):5’- ATGCTACTTCAAAAGGGTCGGCTC -3’,UFGT(r1):5’-CTATGCTTTCTTGGATCCTGATAT-3’;UFGT(f2):5’-ATGGCAGCGCCGCTGCCCATCG-3’,UFGT(r2):5’-CTATGCTTTCTT GGATCCTG-3’。PCR反应程序为:94 ℃预变性3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃延伸10 min。1.2.3序列分析UFGT基因测序由上海生物工程股份有限公司完成,序列的生物信息学分析软件见表1。

表1 序列分析相关软件及分析内容
2 结果与分析
2.1总RNA的提取
本试验提取了火把梨果皮的总RNA,电泳检测结果见图1。从图1可看出:所提取RNA的25S和18S条带均清晰可见,将RNA于-80 ℃冰箱保存,用于cDNA第1链的合成。

2.2UFGT基因片段的克隆
以火把梨果皮的cDNA为模板进行PCR扩增,得到PCR扩增产物约为1 500 bp(图2),该片段大小与预期一致。PCR产物经测序结果拼接后得到1 440 bp的片段,编码479个氨基酸的蛋白质(图3)。与其他物种的氨基酸序列进行BLAST同源比对结果显示:与沙梨(Pyruspyrifolia,AFQ92055)、西洋梨(AGL81353)、白梨(Pyrusbretschneideri, AGZ15304)、苹果(Malusdomestica,XP_008357063)、樱桃李(Prunuscerasifera,AKV89253)的同源性分别是99%、96%、94%、91%、72%;与桃(Prunuspersica,XP_007217952)和梅(Prunusmume,XP_008234582)的同源性均为71%;与甜樱桃(Prunusavium,AHL45018)、野草莓(Fragariavesca,XP_004307876)、美洲葡萄(Vitislabrusca,ABR24135)、荔枝(Litchichinensis,AED02461)和拟南芥(Arabidopsisthaliana,NP_197207)的同源性为70%、61%、56%、53%、52%。


2.3序列生物信息学分析
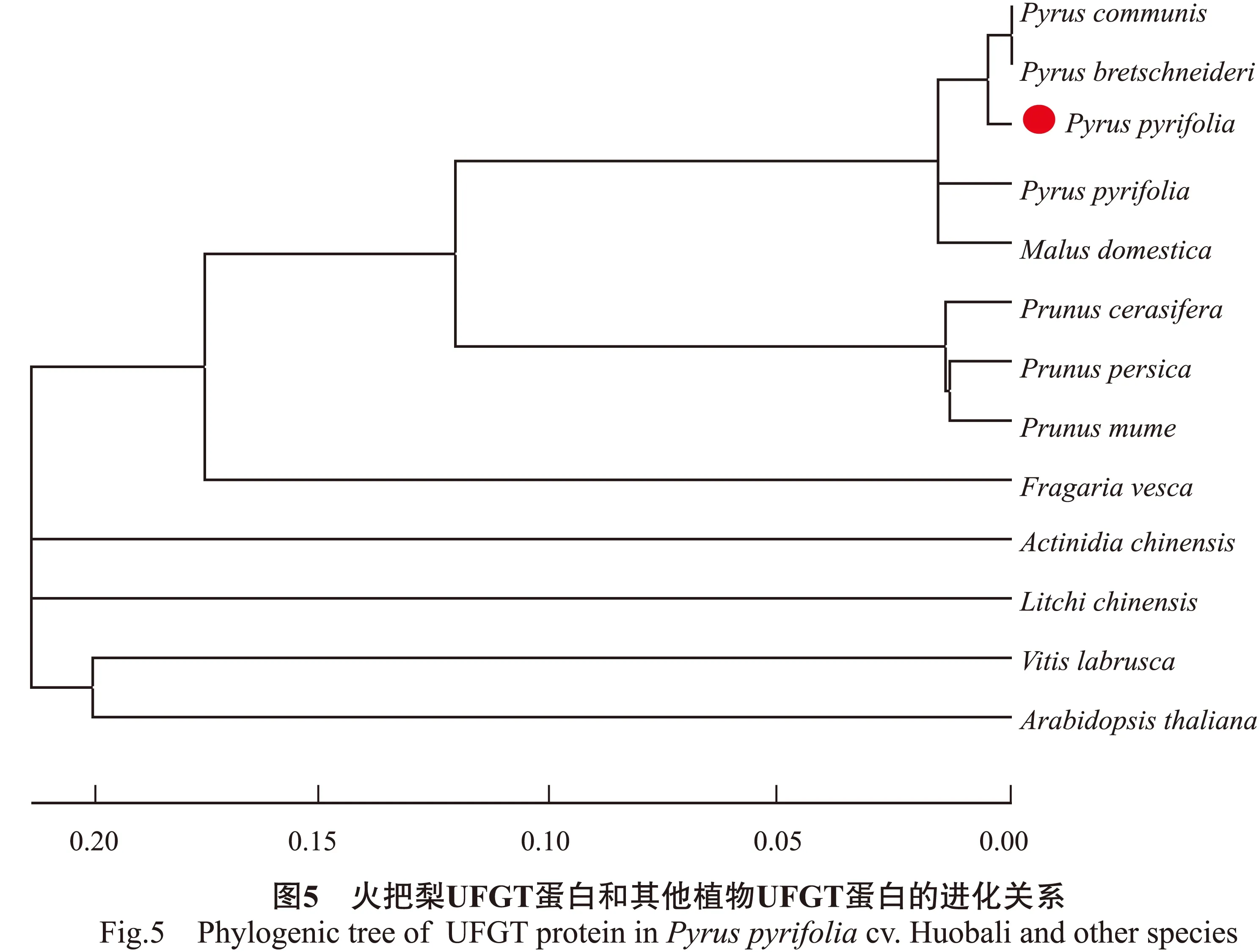
2.3.1UFGT序列的多重比对与聚类分析用Clustal W2软件将克隆得到的火把梨UFGT氨基酸序列与沙梨、西洋梨、中国白梨、苹果、桃、梅子的氨基酸序列进行多重比对,结果见图4。采用软件MEGA5构建系统进化树,确定UFGT的进化地位(图5)。从图5可知:火把梨与沙梨、西洋梨、中国白梨、苹果、樱桃李、桃、梅、草莓均在一个大类群中;同科植物梨和苹果在一个亚类上,其亲缘关系较近;猕猴桃(Actinidiachinensis)、荔枝单独聚为一类,美洲葡萄、拟南芥聚在同一类群中,这与分类学上的结论相符合。
2.3.2UFGT蛋白一级结构的的预测ProtParam分析显示,UFGT蛋白的分子量大约为52.0 kDa,等电点为6.08。溶液中的不稳定指数是38.11,低于域值40,因此,在体外UFGT可能属于稳定蛋白。此外,预测显示,UFGT的脂肪系数、平均疏水性分别为98.68、0.018。UFGT有负电荷残基(Asp+Glu)50个,正电荷残基44个。在线软件SignalP 4.1分析结果显示,UFGT无信号肽,属于非分泌蛋白。WoLF PSORT亚细胞定位显示,UFGT为细胞质蛋白,分析认为UFGT蛋白极有可能合成于细胞质,通过信号肽定位于细胞液。
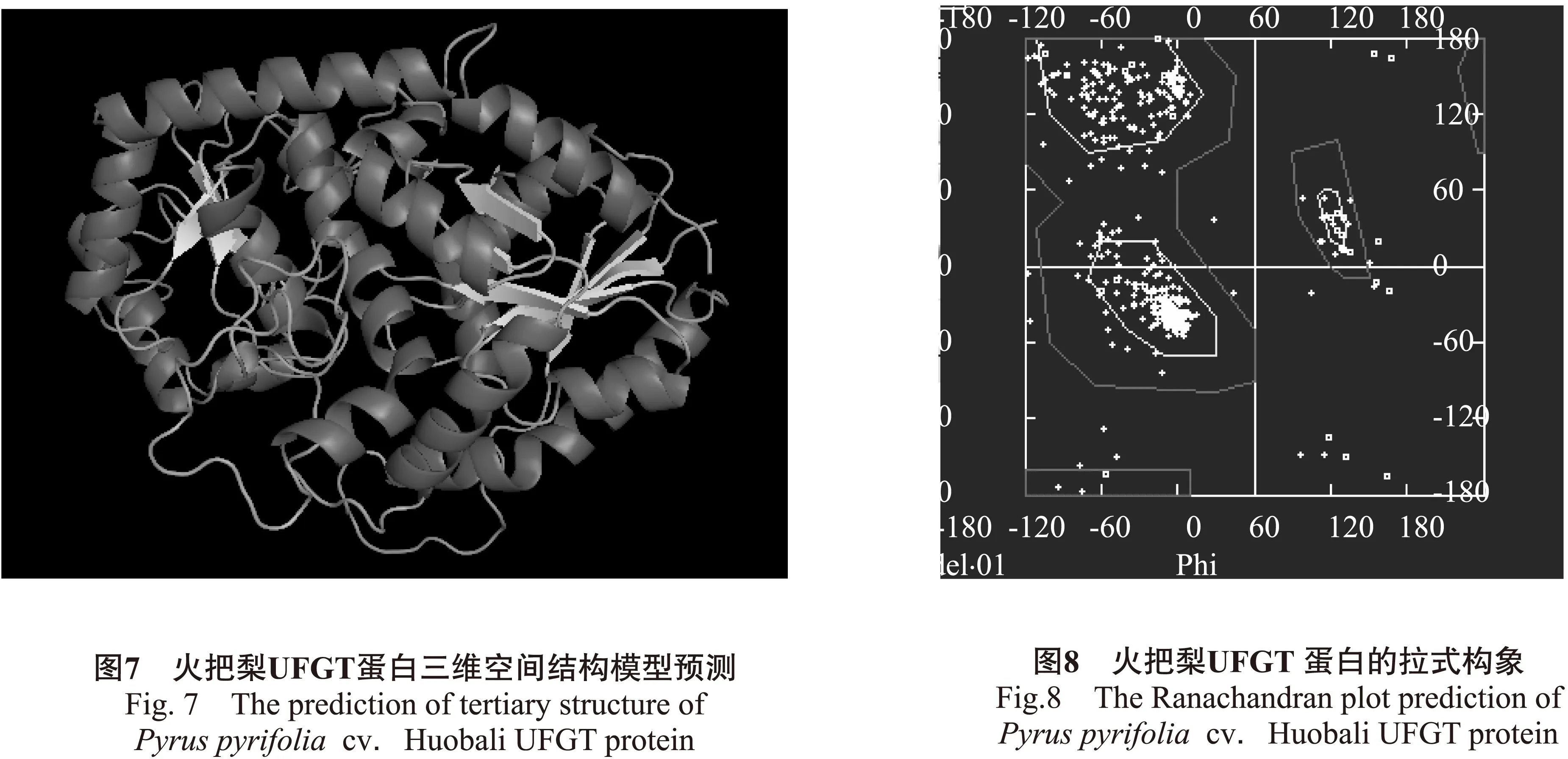
2.3.3UFGT蛋白二级结构和三级结构预测用PredictProtein在线服务器对云南火把梨UFGT氨基酸序列的二级结构进行预测(图6),结果显示:UFGT基因所编码的蛋白由39.33%的α-螺旋(alpha helix)、13.18%的β-转角(beta turn)和47.49%的无规则卷曲(random coil) 组成;α-螺旋和无规则卷曲是云南火把梨UFGT蛋白质二级结构的主要结构元件,β-转角散布于整个蛋白质序列中。由于蛋白质的高级结构与其功能紧密相关,采用Swiss-Model Workspace同源建模预测火把梨UFGT的三级结构(图7),结果处理采用Pymol软件。基于Swiss Model的Ramachandran图(图8)表明,预测的UFGT蛋白质残基,有90%以上的二面角是位于黄色的核心区域内,推测其空间结构较稳定,且空间障碍较小。

2.3.2UFGT蛋白功能域预测用NCBI提供的Conserved Domains Search service对云南火把梨UFGT蛋白功能域进行预测,结果见图9。结果表明:该蛋白含有1个GT1_Gtf_Like功能域和1个GTB型超家族蛋白的典型结构。GT1_Gtf_Like功能域包括Gtfs等一类糖基转移酶,参与生物合成的最后阶段,Gtfs催化1个被活化的NDP-糖供体转移一部分糖受体分子,形成糖苷;GTB型超家族蛋白家族拥有相同的GTP拓扑结构,GTB蛋白有不同的N-和C-末端结构域,且都包含1个典型的Rossman折叠,2个结构域序列同源性较低,但具有较高的结构同源性,一个呈‘V’字的凹陷把它们分割成催化中心和一个灵活多变的区域。

3 结论与讨论
类黄酮糖基转移酶(UFGT)是花色素苷生物合成途径中的最后一个酶,且必不可少,负责将糖基连接到不稳定的花色素上,从而使花色素变成稳定的花色素苷[17],花色素苷具有潜在的抗氧化、抗癌与抗动脉硬化功能[16]。试验通过同源克隆的方法得到了云南火把梨UFGT基因片段,经生物信息学分析认为该基因片段是UFGT的一部分,该UFGT片段与沙梨UFGT的同源性高达99%,BLAST分析表明,此蛋白是糖基转移酶家族的一员。系统进化分析显示,与火把梨亲缘关系最近的是沙梨,其次是西洋梨和白梨,亲缘关系最远的是拟南芥。该片段含典型的GT1_Gtf_Like功能域和一个GTB型超家族蛋白的典型结构。
目前,已经从红巴梨[15]、葡萄[6]、荔枝[18]、玉米(Zeamays)[19-20]、野草莓[21]、葡萄[22]、小麦(Triticumaestivum)[23]以及矮牵牛(Petuniahybrid)[24]等植物中克隆得到了UFGT基因。在葡萄[25]、苹果[5]、荔枝[26]等果树上对UFGT基因的功能研究已经比较深入。研究显示UFGT是决定苹果花色素苷积累的重要酶类[27],也是葡萄果肉色素合成的关键酶[28];研究PAL、CHI、DFR和UFGT 4种酶在‘妃子笑’荔枝果实成熟过程中的活性变化,只有UFGT与花色素苷含量的变化趋势吻合,其他3种均没有明显的相关性[29]。在观赏海棠的研究中发现叶片中的McUFGT对其叶色的形成具有重要作用,主要通过催化无色的矢车菊色素生成红色的矢车菊色素苷,使植物叶片出现红色表型。对不同品种观赏海棠花色素苷物质含量变化的研究发现,色素沉积与基因UFGT表达有明显一致性[7]。对柑橘(Citrusreticulata)的研究显示,在红色柑橘果汁囊泡中检测到UFGT基因的表达,但在黄色柑橘中没有检测到[30]。上述研究显示,UFGT既是花色素苷合成的重要酶类,又是关键酶,表达量与花色素苷积累量呈正相关关系,而花色素苷的积累量与植物叶片及果实的着色程度相关,因此,研究UFGT基因的调控模式对品种着色不良和果实品质偏差有重要意义。
云南火把梨花色素苷合成途径中UFGT基因调控方式及其功能尚不明确。本研究仅从云南特有火把梨中克隆到了UFGT基因片段,应进一步进行火把梨UFGT全长序列的克隆,研究该基因在火把梨各个发育时期的表达量、表达模式,开展火把梨花色素苷生物合成关键基因研究,以及后续应用于红皮梨的转基因育种上。
致谢:在本试验进行中得到唐军荣老师、付海辉先生的帮助,谨此致谢!
[1]Nakajima J, Tanaka Y, Yamazaki M, et al. Reaction mechanism from leuco-anthocyanidin to anthocyanidin 3-glucoside, a key reaction for coloring in anthocyanin biosynthesis [J]. The Journal of Biological Chemistry, 2001, 276(28):25797-25803.
[2]Kobayashi S, Ishimaru M, Ding C, et al. Comparison of UDP-glucose: Flavo-noid 3-O-glucosyltransferase (UFGT) gene sequences between white grapes (Vitisvinifera) and their sports with red skin [J]. Plant Science, 2001, 160(3):543-550.
[3]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTMethod [J]. Methods, 2001, 25(4): 402-408.
[4]Kondo S, Hiraoka K, Kobayashi S, et al. Changes in the expression of anthocyanin biosynthetic genes during apple development [J]. Journal of the American Chemical Society, 2002, 127: 971-976.
[5]Honda C, Kotoda N, Wada M, et al. Anthocyanin biosynthetic genes are coordinately expressed during red coloration in apple skin [J]. Plant Physiology and Biochemistry, 2002, 40(11):955-962.
[6]刘海峰,杨成君,于淼,等.山葡萄UDP-葡萄糖:类黄酮-3-O-葡萄糖基转移酶基因(3GT)cDNA的克隆和分析[J].植物生理学通讯,2009,45(8):748-752.
[7]韩振云, 宋婷婷, 田佶, 等. 苹果属观赏海棠McUFGT的克隆及其在不同叶色品种间的表达差异分析[J]. 园艺学报, 2014, 41(2):301-310.
[8]卢其能, 杨清, 沈春修. 马铃薯类黄酮-3-O-葡萄糖基化酶基因的克隆与表达分析[J], 华北农学报,2009,24(4): 11-16.
[9]Hu Chaoyang, Gong Yifu, Jin Si, et al. Molecular analysis of a UDP-glucose: flavonoid 3-O-glucosyl- transferase (UFGT) gene from purple potato (Solanumtuberosum)[J]. Mol Biol Rep, 2011,38:561-567.
[10]赵志常, 胡福初, 胡桂兵,等. 荔枝类黄酮糖基转移酶(UFGT)基因的克隆及其原核表达研究[J]. 广西师范大学学报(自然科学版), 2011,29(4):104-110.
[11]Zhao Zhichang, Hu Guibing, Hu Fuchu, et al. The UDP glucose: flavonoid-3-O-glucosyltransferase (UFGT) gene regulates anthocyanin biosynthesis in litchi (LitchichinesisSonn.) during fruit coloration[J]. Mol Biol Rep, 2012, 39: 6409-6415.
[12]Kobayashi S,Ishimaru M,Hiraoka K,et al. Myb-related genes of the Kyoho grape(Vitislabruscana)regulate anthocyanin biosynthesis[J]. Planta,2002, 215(6):924-933.
[13]Kim S H, Lee J R, Hong S T, et al. Molecular cloning and analysis of anthocyanin biosynthesis genes preferentially expressed in apple skin [J]. Plant Science, 2003, 165(2): 403-413.
[14]胡福初, 魏永赞, 秦永华, 等. 荔枝果皮花色素苷生物合成相关结构基因的克隆和表达特性研究[C]//中国园艺学会. 第二届全国果树分子生物学学术研讨会论文集.北京:[出版者不详],2009:303.
[15]李俊才, 李天忠, 王志刚, 等. ‘红巴梨’果皮UFGT基因的克隆及表达分析[J], 西北植物学报, 2010, 30(1): 30-34.
[16]Fischer T C, Gosch C, Pfeiffer J, et al. Flavonoid genes of pear(Pyruscommunis)[J]. Trees, 2007, 21(5): 521-529.
[17]Springob K, Nakajima J, Yamazaki M, et al. Recent advances in the biosynthesis and accumulation of anthocyanins [J]. Natural Product Reports, 2003, 20: 288-303.
[18]魏永赞, 胡福初, 秦永华, 等.实时荧光定量PCR检测荔枝果皮中基因表达方法的建立[J].热带作物学报,2010,31(8):1253-1259.
[19]Gerats A G M, Groot S P C, Peterson P A, et al. Regulation of UFGT activity in thebz-m4 allele ofZeamays: A possible case of gene fusion [J]. Molecular and General Genetics, 1983, 190(1):1-4.
[20]Gerats A G M, Bussard J, Coe J E H, et al. Influence of B and Pl on UDPG: Flavonoid-3-O-glucosyltransferase inZeamaysL.[J]. Biochemical Genetics, 1984,22(11/12):1161-1169.
[21]陈琼娥. 草莓果实cDNA-AFLP技术体系构建及UFGT基因克隆[D]. 福州:福建农林大学, 2012.
[22]Poudel P R, Goto-yamamoto N, Mochioka R, et al. Expression analysis of UDP-glucose: flavonoid 3-O-glucosyltransferase(UFGT)gene in an interspecific hybrid grape betweenVitisficifoliavar.ganebuandVitisviniferacv.Muscatof Alexandria[J]. Plant Biotechnology Reports, 2008, 2(4): 233-238
[23]吴亮. 小麦花青素合成相关基因TaUFGT的分离及其生物学功能分析[D].泰安:山东农业大学, 2014.
[24]Gerats A G M, Vrijlandt E, Wallroth M, et al. The influence of the genesAn1,An2, andAn4 on the activity of the enzyme UDP-glucose: Flavonoid 3-O-glucosyltransferase in flowers ofPetuniahybrid[J]. Biochemical Genetics, 1985, 23(7/8): 591-598.
[25]Ford C M, Boss P K, Hoj P B. Cloning and characterization ofVitisviniferaUDP-Glucose: Flavonoid 3-O-glucosyl transferase, a homologue of the enzyme encoded by the maize bronze-1 locus that may primarily serve to glucosylate anthocyanidins in vivo [J]. The Journal of Biological Chemistry, 1998, 273(15): 9224-9233.
[26]赵志常, 胡福初, 胡桂兵, 等. 荔枝类黄酮糖基转移酶(UFGT)基因的克隆及其原核表达研究[J]. 广西师范大学学报(自然科学版), 2011, 29(4): 104-110.
[27]Wang H Q, Arakawa O, Motomura Y. Influence of maturity and bagging on the relationship between anthocyanin accumulation and phenylalanine ammonialyase(PAL)activity in‘Jonathan’apples[J]. Postharvest Biology and Technology, 2000.19 (2):123-128.
[28]Kobayashi S, Ishimaru M, Hiraoka K, et al. Myb-related genes of the Kyoho grape(Vitislabruscana)regulate anthocyanin biosynthesis[J]. Planta, 2002, 215(6):924-933.
[29]王惠聪, 黄旭明, 胡桂兵, 等. 荔枝果皮花青苷合成与相关酶的关系研究[J]. 中国农业科学, 2004, 37 (12): 2028-2032.
[30]Lo Piero A R, Consoli A, Puglisi I, et al. Anthocyaninless cultivars of sweet orange lack to express the UDP-glucose flavonoid 3-O-glucosyl transferase[J]. Journal of Plant Biochemistry Biotechnology, 2005, 14(1):9-14.
(责任编辑张坤)
Cloning and Analysis of UFGT Gene Sequence fromPyruspyrifoliacv. Huobali of Specific in Yunnan
Meng Fuxuan1,2,3,4,Zhou Jun1,3,4,Wang Dawei3,4,Tao bang5,Dong Jiao6,Fu Haihui7,Xu Shihong3,4,Duan Linyuan3,4
(1. Key Laboratory for Forest Genetic and Tree Improvement & Propagation in Universities of Yunnan Province, Kunming Yunnan 650224, China;2. Institute of Tropical Eco-agricultural Sciences, Yunnan Academy of Agricultural, Yuanmou Yunnan 651300, China;3. Key Laboratory for Forest Resource Conservation and Use in the Southwest Mountains of China, Kunming Yunnan 650224, China;4. College of Forestry, Southwest Forestry University, Kunming Yunnan 650224, China;5.Horticultural Research Institute Yunnan Acudemy of Agricultural Sciences,Kunming Yunnan,650000,China;6. Kunming Edible Fungi Institute, All China Federation of Supply and Marketing Cooperatives, Kunming Yunnan 650223, China)
In order to researchUFGTgene for regulation mechanism of anthocyan synthesis in red pear,Pyruspyrifolia cv. Huobali of specific in Yunnan was used as experimental material and the cDNA fragment ofUFGTgene was obtained by homologous cloning. Then, bioinformatics analysis ofUFGTgene and its deduced protein was done by using the related biological software. The results showed that length of UFGT is 1 440 bp, and it encodes 479 amino acids. The homology at amino acids level ofUFGTwith UFGT inPyruspyrifolia(AFQ92055)、Pyruscommunis(AGL81353)、Pyrusbretschneideri(AGZ15304)、Malusdomestica(XP_008357063) andPrunuscerasifera(AKV89253) are 99%, 96%, 94%,91% and 72%, respectively. The results of amino acid sequence analysis indicated that theUFGThad no signal peptide and trans-membrane domain, belonged to the non secreted protein and located in cytosol. The protein predication ofUFGTshowed that there were a function domains GT1_Gtf_Like and typical structure of GTB super family.
Pyruspyrifoliacv. Huobali;UFGT;gene cloning;bioinformatics

2015-05-12
云南省教育厅科学研究基金项目 (2012J050)资助;西南林业大学科研启动基金资助。
周军(1962—),男,博士,教授。研究方向:果树分子生物学与林木遗传育种的研究。Email:zhoujunbo@163.com。
10.11929/j.issn.2095-1914.2016.01.004
S718.46
A
2095-1914(2016)01-0021-07
第1作者:孟富宣(1989—),女,硕士,实习研究员。研究方向:林木遗传育种。Email:616967560@qq.com。

