板栗壳鞣质提取及其对DPPH自由基清除活性的研究
郑佳欣,李怡婧,汪晨阳,章嘉男,史玲玲,王建中
(北京林业大学生物科学与技术学院,北京 100083)
板栗壳鞣质提取及其对DPPH自由基清除活性的研究
郑佳欣,李怡婧,汪晨阳,章嘉男,史玲玲*,王建中*
(北京林业大学生物科学与技术学院,北京 100083)
本研究以板栗加工的废弃物板栗壳为原材料,以期得到板栗壳中鞣质的最佳提取工艺,并对其抗氧化活性进行考察。通过分析比较筛选出了板栗壳鞣质提取最佳溶剂为乙醇,较优提取方法为回流法,并在此基础上实施了乙醇浓度、料液比和提取时间三个单因素实验和以此为依据的正交实验。结果表明,回流法提取板栗壳鞣质的最佳工艺条件为:25%乙醇为提取溶剂,提取时间为2 h,料液比为1∶10.5(g∶mL),在该条件下,板栗壳鞣质的提取量为14.617 mg/g;DPPH实验结果表明板栗壳鞣质粗提物具有较强的清除DPPH自由基的能力,可以作为一种天然抗氧化剂予以开发。
板栗壳,鞣质,回流法,正交实验法,抗氧化活性
板栗(castaneamollissimaBlume)为壳斗科(Fagaccac)栗属(Castanea)乔木经济植物,俗称栗子,有“干果之王”的美称[1],我国年产板栗果实约165万t[2]。市场上多有以板栗果实为原材料开发的食品,板栗壳则被作为燃料或直接丢弃[3]。文献报道:板栗壳中含有酚类、有机酸、多糖、内酯、香豆素、鞣质、甾体和黄酮等有效成分[4],因此,板栗壳作为废弃物处理将导致板栗壳中大量的生物活性物质被浪费。
多酚是板栗壳的重要有效活性成分,具有较高的抗氧化能力[5-6],其包括低分子量的酚类成分和由这些低分子量成分经过聚合形成的高分子多酚——即鞣质类。近年来,鞣质类化合物作为一类新的活性物质,其研究日益受到人们的重视。约有70%以上的中草药中含有鞣质类化合物[7],研究报道鞣质类物质具有抑菌[8]、抗肿瘤[9]、抗脂质过氧化[10]等功效,对心脏和心血管也有一定效应[11-12]。目前虽然板栗壳中多酚类物质的提取研究有所报道[13-14],但板栗中鞣质提取的研究仅限于板栗栗苞、栗叶[15],板栗壳中鞣质的提取研究未见报道。本文采用正交实验法优化废弃物——板栗壳中总鞣质的提取工艺,并对其清除DPPH自由基的能力进行考察,旨在为板栗壳资源的充分利用提供实验依据。
1 材料与方法
1.1材料与仪器
板栗壳采自河北迁西;没食子酸对照品纯度≥99.0%,中国药品生物制品检定所;干酪素纯度:99.8%,北京奥博星生物技术有限责任公司;Ciocalteu’s phenol纯度:99.8%,上海北诺生物科技有限公司;Na2CO3纯度:99.95%,天津市光复科技发展有限公司;DPPH纯度:>97.0%,Japan,TCI试剂公司;Trolox纯度:97%,SIGMA-ALDRICH试剂公司;甲醇分析纯,北京化工厂。
UV-2102C型紫外可见分光光度计尤尼柯仪器有限公司;FA2004A型电子分析天平上海精天电子仪器有限公司;SXKW型数显电热套北京中兴伟业仪器有限公司;RE-52A型旋转蒸发仪上海亚荣生化仪器厂。
1.2实验方法
1.2.1总鞣质的测定
1.2.1.1对照品及样品溶液的配制精密称取没食子酸对照品25 mg,置于50 mL棕色容量瓶中,用蒸馏水溶解,定容,摇匀即得对照品溶液。
精密称取样品干物质(提取得到的浸膏经冻干得到干物质)20 mg,置200 mL容量瓶中,用蒸馏水溶解,定容,即得0.1 mg/mL的样品溶液。
1.2.1.2线性关系的考察精密吸取没食子酸对照品溶液2.0、3.0、4.0、5.0、6.0 mL,分别置于25 mL棕色容量瓶中,分别加Ciocalteu’s phenol试液1.0 mL,依次精密加蒸馏水13 mL,用浓度为29%的Na2CO3溶液定容至刻度,摇匀,室温避光放置30 min。以蒸馏水作为空白,分别测定其在760 nm处的吸光度(A),以A为纵坐标,以质量浓度为横坐标,绘制标准曲线,其线性回归方程为y=87.445x+0.0584(R2=0.9940),没食子酸在0.2~12.8 mg/L与A呈良好的线性关系。
1.2.1.3鞣质含量测定参考文献[16],总酚含量的计算:量取样品溶液3.0 mL,置于25 mL棕色容量瓶中,按方法1.2.1.2测定吸光度(A),根据标准曲线计算其质量浓度;
不被吸附的多酚含量:预先称取0.1 g干酪素置于100 mL具塞锥形瓶中,精密量取样品溶液25 mL至上述锥形瓶中,用塞密封,将锥形瓶置于30 ℃水浴中保温1 h,期间不断振荡,取出后放至室温,摇匀,过滤,倒掉初滤液,采集续滤液,量取2.0 mL续滤液置于25 mL棕色容量瓶中,按方法1.2.1.2测定吸光度(A),根据标准曲线计算其质量浓度。
鞣质含量测定公式如下:
鞣质含量=总酚含量-不被吸附的多酚含量
1.2.2板栗壳鞣质提取方法和提取溶剂的筛选实验影响板栗壳鞣质提取的因素主要有提取方法、提取溶剂、提取时间和料液比等。为了筛选最佳提取方法和提取溶剂,本文分别采用了超声提取法、冷浸提取法、回流提取法三种提取方法和纯乙醇、甲醇、丙酮三种提取溶剂进行了筛选实验。
1.2.2.1提取方法的筛选实验精密称取干燥板栗壳粉末30 g,以甲醇作为提取溶剂(200 mL),分别采用回流法(1 h)、超声法(50 ℃,0.5 h)及冷浸法(室温,24 h)进行提取,过滤后用旋转蒸发仪蒸干得到浸膏,经冻干得到干物质,按方法1.2.1.3测定鞣质含量。
1.2.2.2提取溶剂的筛选实验精密称取干燥板栗壳粉末30 g,置于500 mL圆底烧瓶中,分别加入甲醇、乙醇、丙酮200 mL进行回流提取1 h,其余步骤同1.2.2.1,按方法1.2.1.3测定鞣质含量。
1.2.3板栗壳鞣质回流法提取的单因素实验精密称取30 g板栗壳粉末,用75%的乙醇溶液、料液比1∶9(g∶mL)、回流提取1.5 h。当研究某一因素时,其他条件保持不变。得到的提取物质,按照标准曲线处理方法,测定其在波长760 nm处的吸光度,见方法1.2.1.3,以比较提取的效果。
按方法1.2.1.3,以板栗壳鞣质提取量为考察指标,采用回流法,通过单因素实验分别考察提取溶剂(乙醇浓度分别为0,25%,50%,75%,100%)、回流提取时间(0.5,1,1.5,2,3 h)和料液比(g∶mL)(1∶6,1∶7.5,1∶9,1∶10.5,1∶12)对板栗壳鞣质提取的影响,初步确定这几个因素的相应水平范围。
1.2.4板栗壳鞣质回流法提取的正交实验设计板栗壳鞣质的提取过程受多个因素的影响,为了得到板栗壳鞣质的较科学的提取工艺,研究在上述1.2.3单因素实验结果的基础上,以乙醇和水的不同比例混合物作为提取溶剂,采用回流法,设计了以乙醇浓度、提取时间和料液比为考察对象的三因素三水平的正交实验,因素水平见表1;正交设计实验表为L9(34),对板栗壳鞣质的提取工艺进行优化。
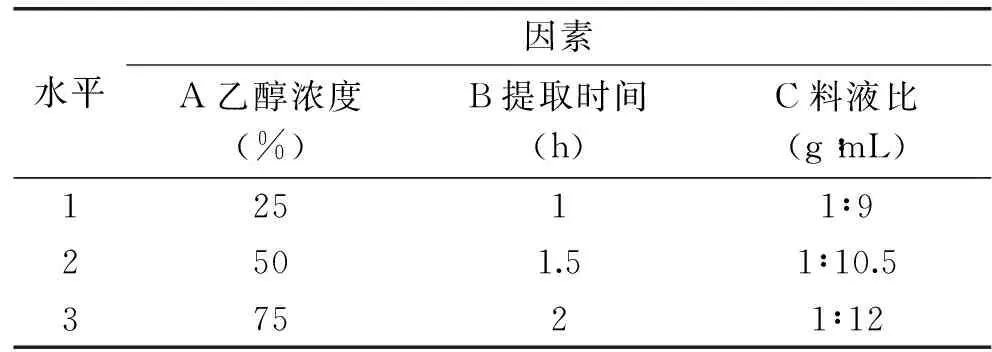
表1 板栗壳中总鞣质提取工艺正交实验因素水平Table 1 Orthogonal factors table of tannin extraction technology from Chestnut shell
1.2.5DPPH自由基清除测定体外评价物质抗氧化活性的方法有DPPH法、ABTS法、ORAC法、FRAP法等。与其他方法相比,DPPH法具有稳定性好、灵敏度高、操作简单等优点[17-19]。故本文采用DPPH自由基清除法评价板栗壳鞣质的抗氧化活性。
板栗壳鞣质粗提物的准备:在上述1.2.4得出的提取优化工艺条件下,将提取得到的浸膏冻干,得到板栗壳鞣质粗提物。
自由基清除测定:以甲醇为溶剂,将板栗壳鞣质粗提物配制成0.1、0.2、0.3、0.4、0.5 mg/mL的溶液。分别取0.1 mL样品溶液,加入2.0 mL甲醇以及0.25 mL浓度为1 mmol/L的DPPH溶液。混匀后室温避光放置30 min,以甲醇为空白,分别测定其在517 nm处的吸光度值;以Trolox(水溶性维生素E)作为阳性对照,计算板栗壳鞣质提取物对DPPH自由基的清除能力[20]。
DPPH自由基清除计算公式为:
式中:A对照:未加样品溶液的DPPH自由基吸光度值;A样品:加入样品溶液反应后的DPPH自由基吸光度值。
1.3数据统计方法
实验采用3组平行,所得数据取平均值,采用SPSS18 软件进行方差分析。采用excel进行显著性分析。
2 结果与分析
2.1板栗壳鞣质提取方法和提取溶剂的选择
2.1.1提取方法的选择如图1可知,回流法(1h)对板栗壳鞣质提取效果最佳,不仅耗时短,而且鞣质提取量高;回流法、冷浸法和超声法三种提取方法的鞣质提取量差异分别达到了显著(p<0.05)水平。
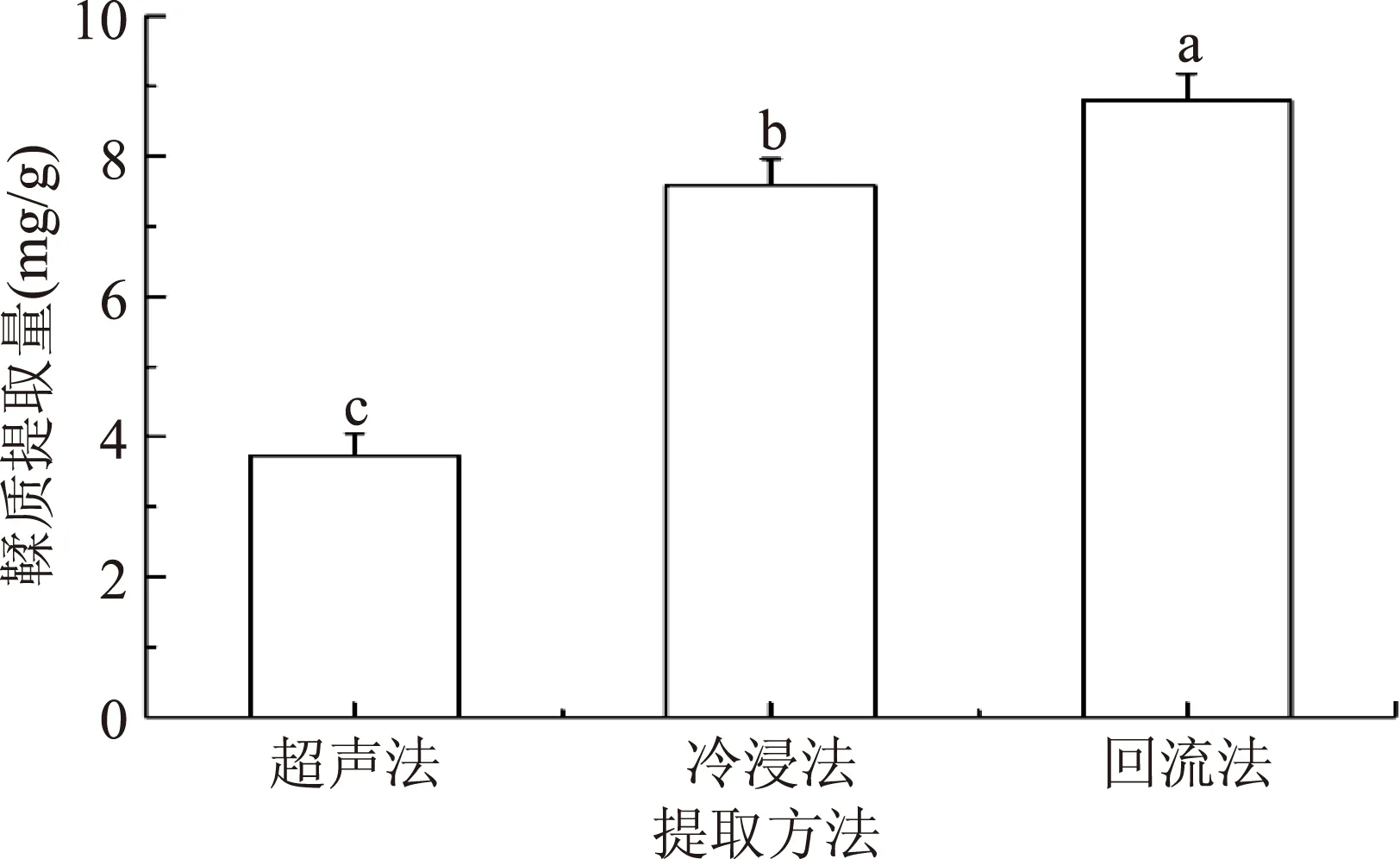
图1 不同提取方法对鞣质含量的影响Fig.1 Effect of different extraction method on the content of tannin注:字母不同表示差异显著,p<0.05,图2同。
近几年来针对鞣质提取的研究也有不少,最为常用的方法有回流法[11]、超声波辅助[21]、微沸法[22]、冷浸法[23]等。本文选用传统的回流法(1 h)、超声法(50 ℃,0.5 h)和冷浸法(室温,24 h)三种提取方法进行筛选,最终确定了板栗壳鞣质的提取方法以回流法最佳。
2.1.2提取溶剂的选择结果如图2所示,乙醇的提取效果最佳,明显优于甲醇和丙酮,三种溶剂的鞣质提取量差异均达到了极显著水平(p<0.01)。其中丙酮的提取效果最差,甲醇提取的鞣质含量也显著低于乙醇。
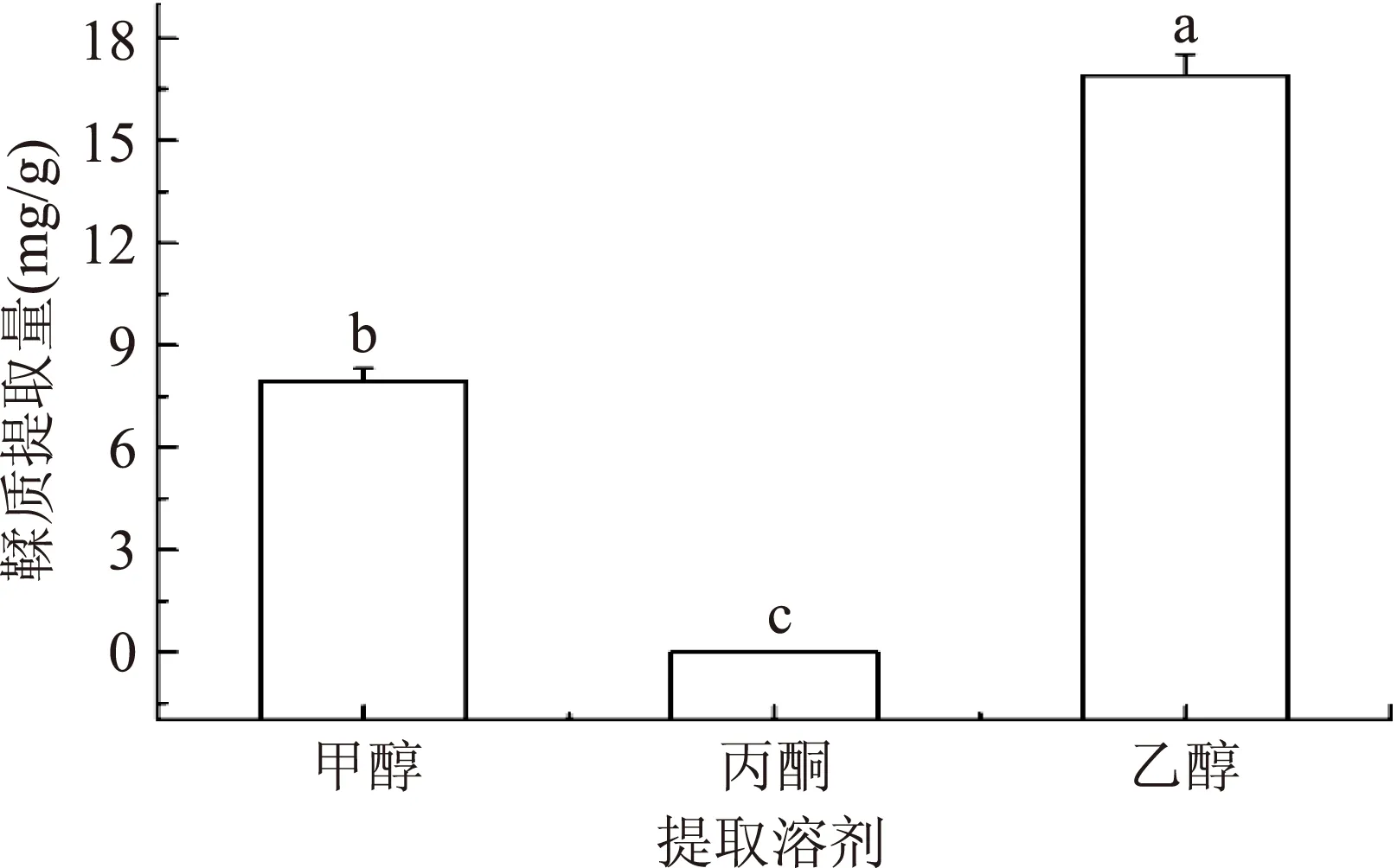
图2 不同提取溶剂对鞣质含量的影响Fig.2 Effect of different extraction on the content of tannin
关于鞣质提取溶剂,有研究报道荔枝核中鞣质提取溶剂为丙酮时,提取效果最佳[24]。同时,也有研究报道没食子中总鞣质提取溶剂效果最好的为甲醇[25]。而本研究中以丙酮作为提取溶剂时,板栗壳鞣质的提取量并不高,甲醇的提取效果也显著低于乙醇,乙醇的提取效果最佳。根据化学结构,鞣质分为可水解鞣质、缩合鞣质和复合鞣质,其中复合鞣质是在板栗所属——壳斗科植物中首次分离得到的;不同溶剂对板栗壳中鞣质提取的效果不同,是否与板栗壳中鞣质存在的结构形式有关还有待于进一步研究。此外,有机溶剂和水的复合体系在提取鞣质时使用更为普遍[26],所以本研究后续的鞣质提取溶剂采用乙醇及其与水的不同百分比的混合物。
2.2单因素实验结果
2.2.1乙醇浓度对板栗壳鞣质提取量的影响由图3可知,乙醇浓度对板栗壳鞣质的提取量影响比较显著,当乙醇浓度为0~100%范围内时,随着乙醇浓度的增大,鞣质提取量逐渐增大而后又呈现出下降的趋势,当乙醇浓度为50%时,鞣质提取量达最大值,为11.753 mg/g;当乙醇浓度继续增大时,鞣质提取量呈现了显著下降的趋势。由于提取溶剂的极性、粘度随着乙醇浓度的变化也发生变化,进而影响到板栗壳中鞣质的提取速度和溶出度。适当的乙醇浓度有利于鞣质的浸出,因此,乙醇浓度应选取50%左右为宜。
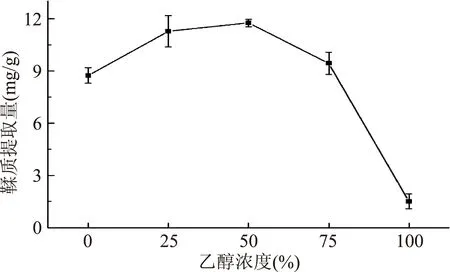
图3 乙醇浓度对板栗壳鞣质提取量的影响Fig.3 Effect of ethanol concentration on the extraction amount of tannin from chestnut shell
2.2.2提取时间对板栗壳鞣质提取量的影响由图4可知,回流提取时间在0.5~3 h之间时,随着回流时间的增加,鞣质提取量呈现逐渐增大,经过一个平缓期继而又减小的趋势,回流时间为1.5 h时,鞣质的提取量最大,为13.649 mg/g;继续延长回流时间,鞣质的提取量变化不大,有一个平稳期;当回流时间超过2 h,鞣质的提取量迅速下降,这可能是由于回流时间过长从而使多酚类结构遭到破坏,因此,板栗壳鞣质的回流提取时间应控制在1.5 h左右。
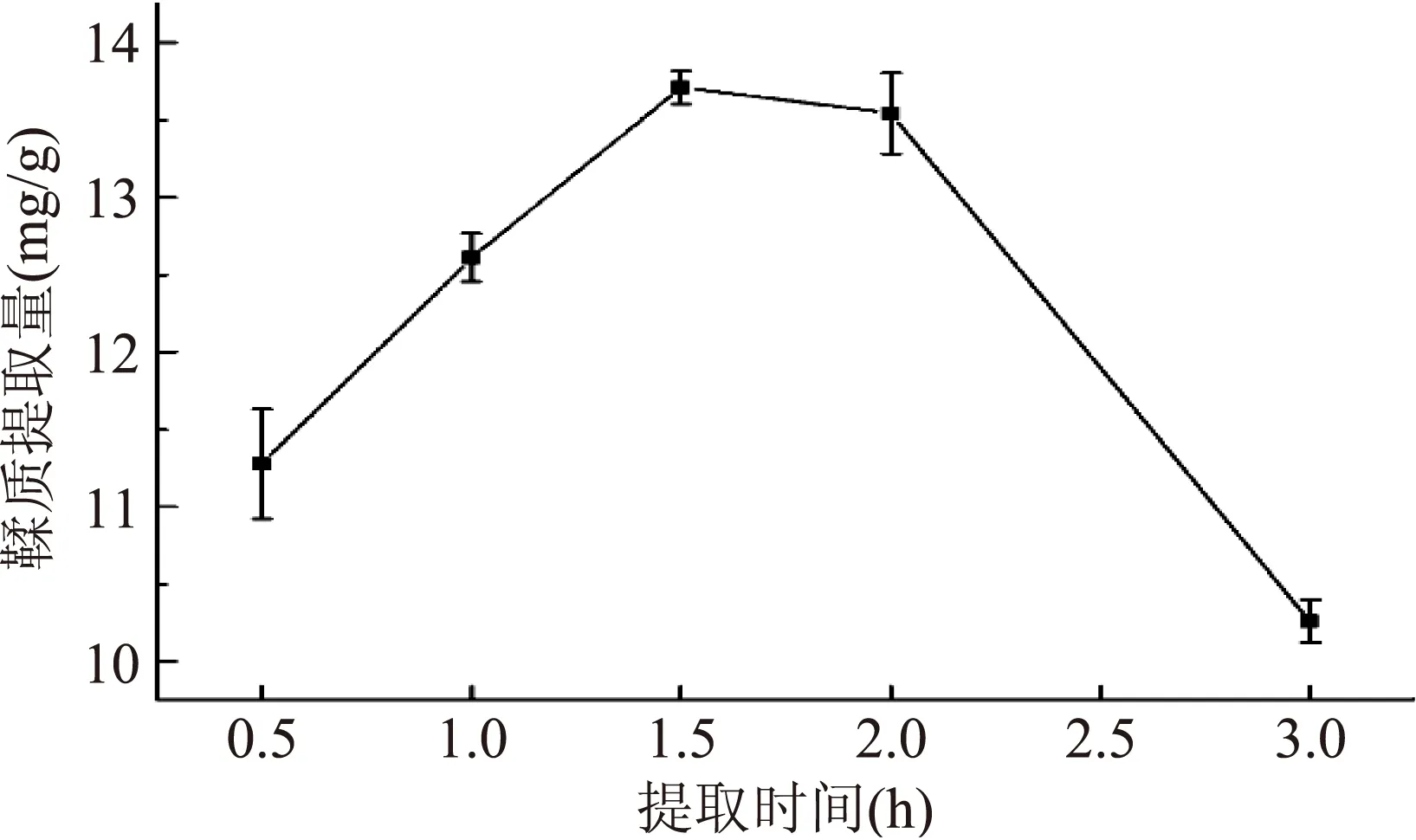
图4 提取时间对板栗壳鞣质提取量的影响Fig.4 Effect of extraction time on the extraction amount of tannin from chestnut shell
2.2.3料液比对板栗壳鞣质提取量的影响由图5可知,当提取过程中料液比在1∶6~1∶12(g∶mL)范围内时,随着料液比的增高鞣质提取量也随之增大,当料液比为1∶10.5(g∶mL)时,鞣质提取量达最大值,为13.712 mg/g;之后继续增加溶剂用量,鞣质的提取量变化不明显。当板栗壳粉末的量一定时,提取溶剂的量越大,粉末与溶剂的接触面内外浓度差越大,鞣质的提取速度和溶出度越大,越容易提取;当溶剂用量达一定值时,由于板栗壳中鞣质类物质含量逐渐降低,溶出度也越来越低,提取得率也趋于稳定。此外,从经济角度考虑,溶剂用量也是越少越好。因此,板栗壳鞣质提取的料液比在1∶10.5(g∶mL)左右为宜。
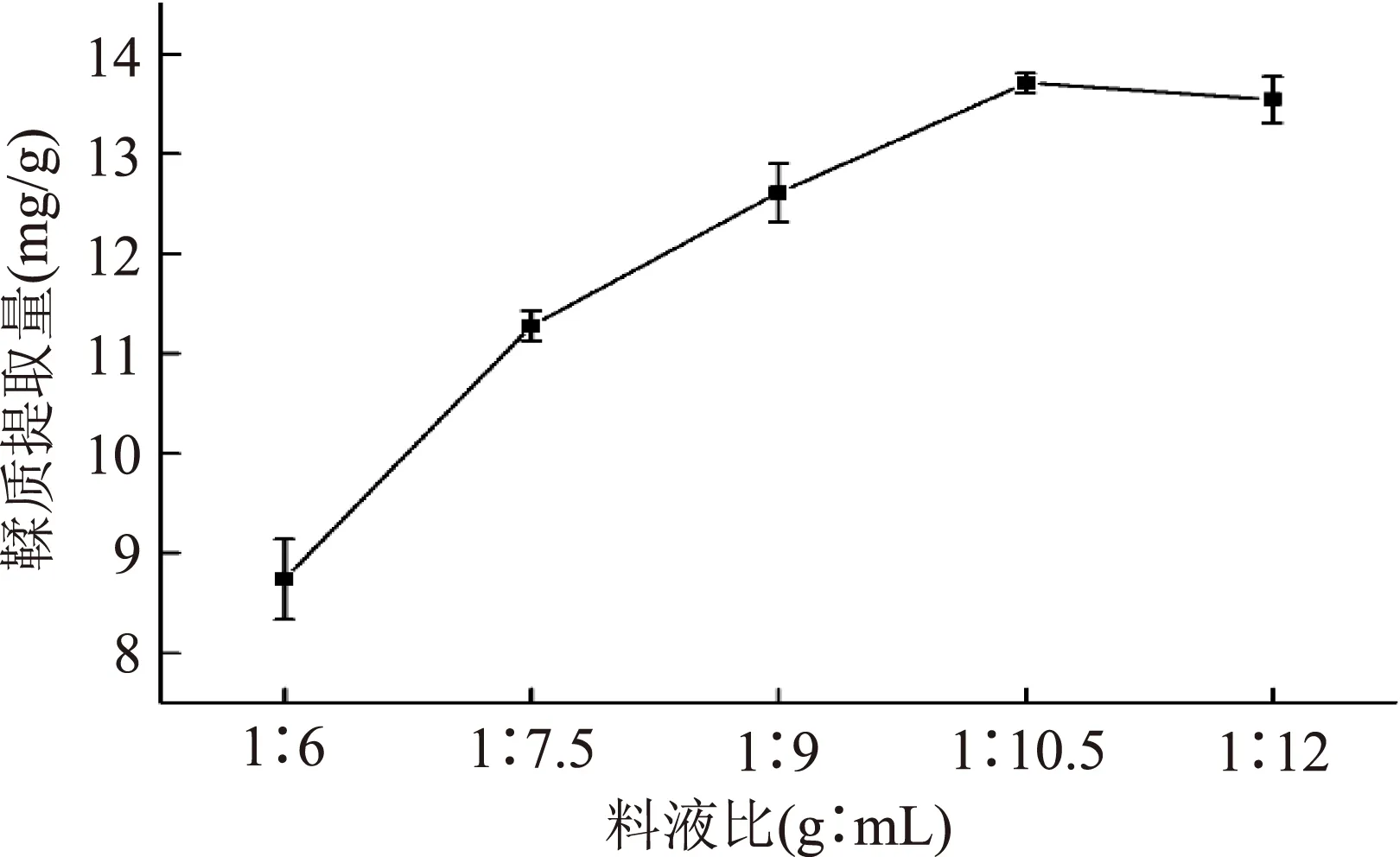
图5 料液比对板栗壳鞣质提取量的影响Fig.5 Effect of solid/liquid ratio on the extraction amount of tannin from chestnut shell
2.3板栗壳鞣质提取的正交实验及结果分析
正交实验设计及结果见表2,方差分析见表3。
根据表2中极差R值直观分析可知,乙醇浓度、提取时间和料液比是影响板栗壳鞣质提取量的主要因素,其主次关系是B>A>C,即提取时间>乙醇浓度>料液比。乙醇浓度、提取时间和料液比对板栗壳鞣质提取量均具有极显著影响。确定板栗壳鞣质的最佳提取工艺条件为A1B3C2,即板栗壳中添加10.5倍量25%乙醇溶液,回流提取2 h。
2.4最佳提取工艺验证性实验
为了验证上述方法得到的最佳提取工艺条件是否合理可行,精密称取板栗壳粉末3份,进行验证性实验,结果见表4。实验结果表明在此工艺条件下板栗壳鞣质的平均提取量为14.617 mg/g(RSD=0.435%)。
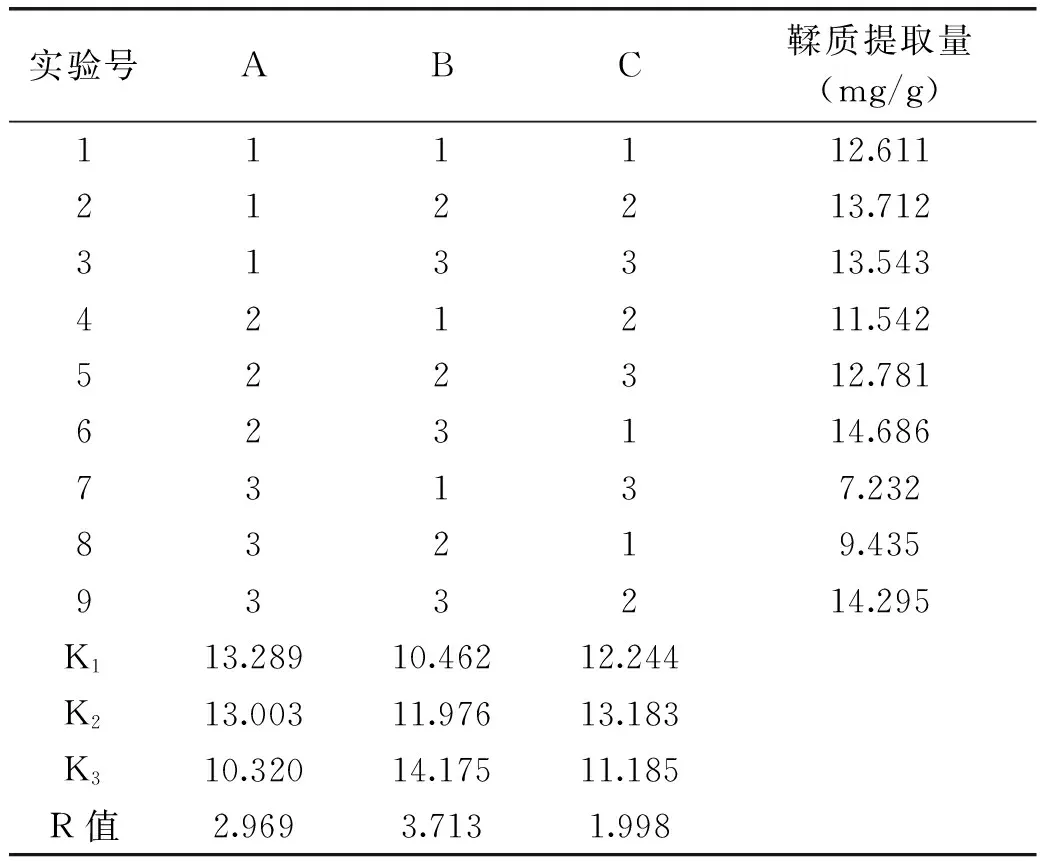
表2 板栗壳鞣质提取正交实验结果Table 2 Orthogonal experiment results of tannin extraction technology from Chestnut shell
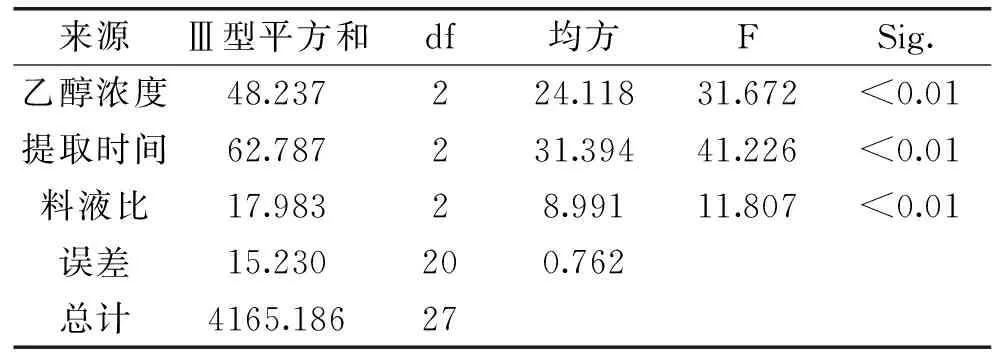
表3 方差分析表Table 3 Variance analysis of orthogonal test

表4 最佳提取工艺验证性实验Table 4 Verification experiment of the optimum extraction process
2.5DPPH自由基清除能力实验
由图6可知,板栗壳鞣质粗提物和Trolox均具有较强的DPPH自由基清除能力,并且随着溶液浓度的增加,其对DPPH自由基的清除能力越来越强。当溶液浓度为0.3 mg/mL时,板栗壳鞣质粗提物和Trolox对DPPH自由基的清除率均达到85%以上,表明板栗壳鞣质粗提物具有较强的抗氧化活性,可以作为一种天然的抗氧化剂进行开发。
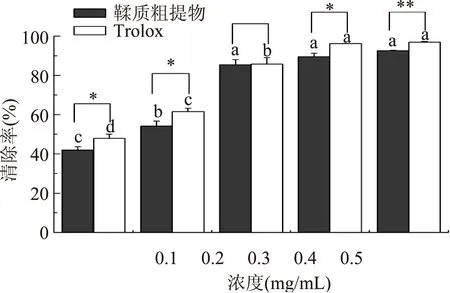
图6 板栗壳鞣质粗提物溶液 与Trolox溶液抗氧化能力的比较Fig.6 Comparison of antioxidant ability on tannin crude extracts from chestnut with Trolox注:字母不同表示同一样品不同浓度间差异显著, **表示不同样品间差异极显著(p<0.01), *表示显著(0.01 本文采用回流法从板栗壳中提取了鞣质类物质,通过单因素实验和正交实验法优化了其提取工艺,结果如下:提取溶剂为25%乙醇溶液,提取时间为2 h,料液比为1∶10.5(g:mL),这3个因素对板栗壳鞣质提取量的影响程度由大到小依次为提取时间>乙醇浓度>料液比。在此优化工艺条件下,鞣质提取量可达14.617 mg/g;进一步对板栗壳鞣质粗提物进行了抗氧化活性的考察,结果表明当板栗壳鞣质粗提物浓度为0.3 mg/mL时,其对DPPH自由基的清除率达85%以上。研究结果表明,板栗壳中鞣质含量较高,并且在优化工艺条件下提取的鞣质粗提物具有较高的DPPH自由基抗氧化活性。 [1]周丹,洪珊茹,赵巧娇,等.板栗栗蓉的制作研究[J].食品科技,2014,39(3):61-64. [2]康海生,苏萍.甲醛用量对板栗壳色素-甲醛树脂性质和吸附重金属性能的影响[J].安徽农业科学,2015,DOI:10.13989/j.cnki.0517-6611.2015.10.095. [3]李颖.板栗壳棕色素的提取及其相关性质研究[J].食品与机械,2009,25(4):86-88,106. [4]赵德义,高文海,花成文,等.板栗壳化学成分的初步研究[J].陕西林业科技,2003(2):1-3,47. [5]刘莉,唐新玥,张欣珂,等.板栗壳中多酚的提取纯化及其抑制α-葡萄糖苷酶活性的研究[J].食品工业科技,2015,36(6):265-268. [6]Morana A,Maurelli L,Ionata E.Chestnut Shell:Not Only A Source of Antioxidant Compounds[J].Journal of Biotechnology,2010,150:S325-S325. [7]尹胜利,浦益琼,杨骏,等.中药鞣质成分的研究进展[J].中国医药导刊,2009,12(1):165-167. [8]栗世婷,张晓霞,吴蓉瑛.鞣质药理活性的研究新进展 [J].疾病监测与控制杂志,2010,4(7):395-397. [9]朱玥,金哲雄. 鞣质类化合物的研究进展[J].黑龙江医药,2015,28(1):23-25. [10]曾伟成,蔡钦榕,杨辉,等.虎杖鞣质抗脂质过氧化作用研究[J].中药药理与临床,2002,18(6):18-19. [11]樊珍珍,热娜·卡斯木,王晓梅,等.正交实验优选罗布麻叶中总鞣质提取工艺[J].中国实验方剂学杂志,2013,19(7):13-16. [12]孙雪飞,张鸿雁,夏青,等.藏药余甘子药材及其鞣质部位的指纹图谱评价研究[J].中国中药杂志,2014,39(7):1173-1178. [13]李金凤,段玉清,马海乐,等.板栗壳中多酚的提取及体外抗氧化性研究[J].林产化学与工业,2010,30(1):53-58. [14]鲁晓翔,赵晨光,连喜军.板栗壳多酚提取条件及其抗氧化性研究[J].食品研究与开发,2008,29(3):32-36. [15]张小琴,冯永庆,杨柳,等.板栗鞭质的提取及其功能研究[J].园艺学报,2011,38(增刊):2494. [16]国家药典委员会.中华人民共和国药典一部[S].北京:中国医药科技出版社,2010:附录63. [17]金杰,李志西,张锋,等.桑椹醋提取物对二苯代苦味酰基自由基(DPPH·)的清除作用[J].西北农林科技大学学报:自然科学版,2006,34(3):135-137. [18]Ozcelik B,Lee J H,Min D B.Effects of light,oxygen and pH on the absorbance of 2,2-diphenyl-1-picrylhydrazyl[J].Journal of Food Science,2003,68(2):487-490. [19]Eklund P C,Langvik O K,Warna J P,et al.Chemical studies on antioxidant mechanisms and free radical scavenging of lignans[J].Organic and Biomolecular Chemistry,2005,3(18):3336-3347. [20]韦献雅,殷丽琴,钟成,等.DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322. [21]王添敏,孙晓丽,彭雪,等.胡桃楸的根、茎枝、叶和果皮中总鞣质的含量测定[J].中国中药杂志,2011,36(1):32-36. [22]李钧敏,金则新,朱小燕.夏蜡梅营养器官总鞣质含量的比较[J].广西植物,2007,27(6):944-947. [23]陈斯玮.地榆鞣质的渗滤提取工艺研究[J].安徽农业科学,2012,40(14):8159-8160. [24]钟世顺,郭洁文,陈剑梅,等.荔枝核中鞣质类型分析及其提取方法研究[J].今日药学,2011,11(21):672-674. [25]范晓红,治建,拉甫,等.没食子中没食子酸含量的测定及总鞣质提取方法的研究[J].时珍国医国药,2011,22(5):1119-1121. [26]丁明玉,倪为为.大黄中鞣质成分的分离与液相色谱/质谱联用分析[J].色谱,2004,22(6):605-608. Study on tannins extraction process from Chestnut shell and scavenging effects of DPPH free radical ZHENG Jia-xin,LI Yi-jing,WANG Chen-yang,ZHANG Jia-nan,SHI Ling-ling*,WANG Jian-zhong* (College of Biological Sciences and Biotechnology,Beijing Forestry University,Beijing 100083,China) The aim of the study was to obtain the optimum extraction method of tannins and study its scavenging effects of DPPH free radical from chestnut shell,which is a kind of waste in chestnut production. It was determined that the optimum extraction method was refluxing method and the optimum extraction solvent was ethanol by screening experiments. On the basis,single factor experiments and orthogonal experiments were carried out. The effects of different volume fractions of ethanol,extraction time and solid-liquid ratio were explored. And the optimum extraction conditions were that 25% aqueous ethanol solution as the best extraction solvent,the solid/liquid ratio of 1 to 10.5 and extraction time 2 h. Under these conditions,the extraction ratio for the chestnut shell tannin reached 14.617 mg/g. The antioxidant activity of tannin crude extracts was investigated by DPPH method,and the results showed that tannin crude extracts from chestnut shell had strong antioxidant effect and it could be explored as a kind of natural antioxidants. chestnut shell;tannin;refluxing method;orthogonal experiment;DPPH 2015-06-05 郑佳欣(1994-),女,本科,研究方向:食品科学与工程,E-mail:zhengjx2016@163.com。 史玲玲(1981-),女,在读博士,中级实验师,研究方向:植物资源加工与利用,E-mail:linglingshi2005@163.com。 王建中(1951-),男,硕士,教授,研究方向:植物资源加工与利用,E-mail:w62338221@163.com。 国家林业公益性行业科研专项(201204401)北京市级项目:北京林业大学“北京市大学生科学研究与创业行动计划”项目(S201410022042) 。 TS201.1 B 1002-0306(2016)03-0211-05 10.13386/j.issn1002-0306.2016.03.0363 结论

