甲磺酸去铁胺减轻大鼠肝脏低温保存期缺血损伤的实验研究*
苏松,宋建生,罗德,刘江,贺凯,李波,夏先明
(西南医科大学附属医院肝胆外科,四川泸州646000)
甲磺酸去铁胺减轻大鼠肝脏低温保存期缺血损伤的实验研究*
苏松,宋建生,罗德,刘江,贺凯,李波,夏先明
(西南医科大学附属医院肝胆外科,四川泸州646000)
目的:探讨甲磺酸去铁胺(DFO)对大鼠离体肝脏低温保存期损伤的影响。方法:80只SD大鼠,随机分为4组,每组20只:HTK液保存组(HTK组),另外3组在HTK保存液中加入不同浓度的DFO,分别为25 umol/L(D25组)、50 umol/L(D50组)、100 umol/L(D100组)。游离取出肝脏后,分别置入各组保存液4℃保存24 h,冷保存结束后进行肝脏酶学检查,病理学观察,台盼蓝灌注,细胞凋亡以及丙二醛(MDA)检测。结果:与HTK组相比,D50与D100组ALT、AST、LDH等酶学指标均明显降低(P<0.05),肝脏台盼蓝染色时间均明显缩短(P<0.05),细胞凋亡水平均明显下降(P<0.05),MDA含量均降低(P<0.05),同时D100组与HTK组相比,病理学评分明显降低(P<0.05)。而D25组与HTK组,以及加入DFO的各实验组的组间比较无统计学差异。结论:在HTK保存液中加入DFO能有效减轻大鼠肝脏的冷缺血损伤,其保护机制可能与DFO减少了冷缺血期间氧自由基生成以及细胞凋亡程度有关。
铁螯合剂;肝脏移植;器官保存;缺血损伤;氧自由基
器官保存是肝脏移植过程中的重要环节[1],而冷保存是器官转运过程中最常用的保存方式。尽管在冷保存条件下,肝脏组织通过降低代谢程度可以减轻细胞损伤的作用,但研究证实在较长时间的冷缺血条件下,组织器官仍会受到一定损害。而这些损害是导致肝移植术后原发器官无功能,胆管狭窄,慢性排斥反应等一系列并发症的重要原因[2]。同时,肝脏冷缺血损伤也是制约边缘供体或心脏死亡供体使用的重要因素之一[3]。因此,进一步研究肝脏冷缺血损伤机制并探索有效的拮抗手段已成为移植研究重要的方向。我们前期通过细胞学研究发现,使用铁离子螯合剂-去铁胺(desferrioxamine,DFO)可以减轻肝脏细胞的冷缺血损害[4],为进一步探索DFO的保护作用,我们拟通过动物模型进行更深入的探讨。
1 材料与方法
1.1 材料,试剂及仪器
雄性SD大鼠80只(250±30 g),购于西南医科大学动物实验中心。主要试剂与药物有:注射用甲磺酸去铁胺(NOVARTIS,瑞士),HTK保存液(DR. FRANZ KOEHLER CHEMIE公司,德国),丙二醛(MDA)试剂盒(上海信裕生物制剂公司),TUNEL试剂盒(Sigma公司,美国)。主要仪器有752-分光光度仪(上海医疗器械厂),微量泵(上海标仪实验仪器设备公司),自动生化分析仪(HITACHI公司,日本)。
1.2 方法
1.2.1 分组
大鼠随机分为4组,每组20只。其中3组在HTK保存液中分别添加不同浓度的DFO,分别为25 umol/L(D25组)、50 umol/L(D50组)、100 umol/L的DFO(D100组),对照组HTK保存液中不添加DFO(HTK组)。冷保存结束后,每组随机抽取10只进行台盼蓝灌注实验,其余10只进行其他相关实验。
1.2.2 模型制备
模型根据我们前期研究结果制备[5],手术前大鼠禁食12 h,禁饮2 h。氯胺酮麻醉后取仰卧位,腹部弧形切口,显露肝下腔静脉,离断右肾静脉。结扎,离断肝动脉后,游离出门静脉远端并予结扎。经门静脉插管并将4℃的各类保存液行供肝原位低压重力灌洗。同时剪开肝上下腔静脉驱血,至肝脏颜色变淡呈均匀灰黄色。遂将肝脏置于各保存液中在4℃条件下保存24 h。冷保存结束后,根据实验要求,部分肝脏行台盼蓝灌注实验,其余肝脏取标本后分别行冰冻保存以及10%甲醛固定后制成蜡块。
1.3标本收集及检测
李青海交代:“我在这个位置上,钱来得太容易。我当时已经不满足小打小闹,希望得到更多的钱。”长期担任镇党委一把手,李青海把五棵树镇当成了自己的“后花园”,重大决策、重大项目安排、大额资金使用基本由其个人决定,有项目必定雁过拔毛,没项目创造项目也要贪,其敛财方式简单粗暴,可以用“疯狂”来形容。
1.3.1 ALT及LDH检测
冷保存结束后分别取各组的保存液2 mL,在自动生化仪上进行丙氨酸氨基转移酶(ALT)、乳酸脱氢酶(LDH)水平检测。
1.3.2 微循环检测(台盼蓝溶液灌注)
本实验通过经离体肝脏门静脉插管处灌注台盼蓝溶液,记录大鼠肝脏左外叶自灌注开始到均匀蓝染的时间。通过肝脏蓝染的时间,可估计肝脏组织的微循环通畅情况。具体方法根据Wu等[6]的方法改进,冷保存结束后,门静脉插管处静脉留置针连接微泵并灌注0.4%台盼蓝溶液,自微泵启动开始计时,记录大鼠肝脏左外叶完全均匀蓝染所需时间。结果用秒(S)表示。
1.3.3 病理形态观察
冷保存结束后,组织标本制成蜡块。标本HE染色后行光镜下观察。采用Rauen等[7]建立的缺血再灌注肝脏病理半定量评分标准进行评分(见表1),每份标本评分由两名病理科医师盲法评判并取平均值。

表1 肝脏病理组织学评分标准
1.3.4 细胞凋亡检测
将冷保存后标本行石蜡切片并采用TUNEL法行肝脏细胞凋亡检测,具体操作按照试剂盒说明书进行。每张切片随机选择3个高倍光镜视野(x 400),通过Image-Pro Plus 6.0软件计算每个视野凋亡细胞密度(cell number/mm2)后取平均值。
冷保存结束后收集各组冰冻组织标本,制备肝组织匀浆,采用硫代巴比妥酸法(TBA)法测定MDA含量,检测过程按照试剂盒说明书进行。
1.4 统计学分析
采用SPSS 19.0软件进行统计分析,计量资料以x±s进行描述,采用单因素方差分析进行统计推断,如结果有统计学差异则采用LSD及SNK法进行事后检验以比较两两之间的差异,P<0.05表示结果有统计学差异。
2 结果
2.1 保存液ALT及LDH水平
肝脏冷缺血保存24 h后,HTK组、D25组、D50组、D100组保存液内LDH水平分别为:(331.42± 72.18)U/L、(305.94±41.58)U/L、(246.01±42.52)U/ L、(239.53±41.03)U/L。而各组ALT水平分别为(120.16±14.40)U/L、(108.84±13.56)U/L、(91.28 ±12.99)U/L、(92.46±13.61)U/L。四组LDH及ALT水平存在明显差异(F=7.81,P<0.001;F=10.32,P<0.001),其中D50、D100组LDH和ALT水平较HTK组以及D25组明显升高,差异有统计学意义(P<0.05),而D25组与HTK组差异无统计学意义(P>0.05)。D50与D100组间比较无统计学差异(P>0.05)。

表2 冷缺血24 h保存液LDH、ALT水平比较(x±s)(U/L)
2.2 病理学观察
光镜下观察见各组肝组织结构基本正常,HTK组及D25组可见肝细胞肿胀,肝窦间隙轻度增宽,较多空泡变性,并可见较多肿胀变形之肝窦内皮细胞;D100组及D50组细胞肿胀及空泡变性明显较HTK组及D25组减轻,见图1。

图1 各组肝脏冷保存24 h后组织病理学改变(HE×400)
肝组织病理评分分别为HTK组:1.95±0.55;D25组:1.87±0.21;D50组1.67±0.66;D100组:1.66±0.25。四组肝组织病理评分存在统计学差异(F=3.45,P=0.04)。其中,D100组与HTK组相比,病理学评分明显降低,并具有统计学意义(P= 0.03)。其余各组组间比较无统计学差异。见表3。

表3 冷缺血24 h后病理评分(x±s)
2.3 肝脏微循环变化
研究通过经门静脉灌注台盼蓝溶液,并观察其染色速度判断肝脏的微循环功能[5]。肝脏冷保存24 h后经门静脉插管注入0.4%台盼蓝溶液,各组肝脏左外叶达到均匀蓝染所需的时间存在明显差异(F =7.07,P=0.001)。其中D100组、D50组分别为(64.5±8.6)S和(69.1±6.9)S,明显短于HTK组(79.9±6.6)S、D25组(74.3±9.2)S(P<0.05)(表4)。图2可见台盼蓝溶液灌注60 s后肝脏染色情况,其中D100和D50组的染色明显较HTK与D25组弥散、均匀。

表4 台盼蓝溶液灌注检测微循环改变(x±s)
2.4 细胞凋亡观察
冷保存结束后,各组肝脏细胞均存在凋亡现象(棕黄色颗粒),且各组凋亡情况存在统计学差异(F =9.25,P<0.001)。添加了DFO的试验各组其凋亡现象明显较HTK组减轻(图2)。定量分析的结果提示,HTK组与D25组凋亡细胞密度分别为(33.9± 3.9)cell number/mm2、(30.2±4.9)cell number/mm2其明显高于D50组(25.7±5.1)cell number/mm2及D100组的(23.8±4.9)cell number/mm2(P<0.05)(表5)。

表5 冷缺血24 h凋亡细胞密度(x±s)细胞数/mm2

图2 冷保存12 h后各组肝脏细胞凋亡情况(TUNEL×400)
2.5 MDA含量比较
冷保存结束后,HTK,D25、D50、D100各组中肝组织内MDA含量存在统计学差异(F=77.94,P<0.001),分别为(2.55±0.25)nmol/mgprot,(2.40± 0.27)nmol/mgprot,(1.49±0.15)nmol/mgprot以及(1.35±0.25)nmol/mgprot。随着DFO浓度的升高,肝组织内MDA含量呈下降趋势。D100、D50组与HTK组及D25组比较差异均有统计学意义(P< 0.05);D25组与HTK组之间及D100、D25组之间比较差异无统计学意义(P>0.05)。见表6。
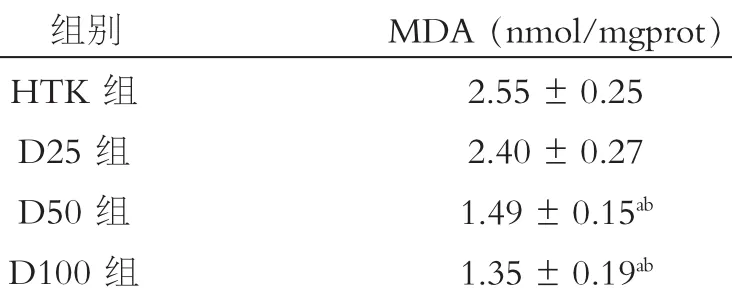
表6 冷缺血24 h后肝组织内MDA含量(x±s)(nmol/mgprot)
3 讨论
通过本研究我们发现,在添加DFO的器官保存液中,肝细胞损伤明显减轻,肝脏冷保存后的微循环状态得到明显改善,同时中浓度和高浓度的DFO含量较低浓度有着更为明显的保护作用,而在中浓度和高浓度之间,这种差异并不明显。
低温保存(4℃)是肝移植供体保存的最主要手段。尽管低温状态下降低了组织器官的代谢程度,但是冷缺血导致的能量耗竭,细胞水肿,酸中毒等仍是造成组织损害的重要因素[8]。目前临床上常使用的UW液,HTK液,Celsor液等离体器官保存液通过添加能量底物,胶体物质,缓冲液等成分对减轻供体器官的冷缺血损伤可以起到积极的作用[8-9]。然而,作为缺血耐受作用较差的器官,肝脏的冷保存效果仍不是十分满意,目前肝脏的冷保存安全时限仍限制在12 h左右[9]。近年来有研究发现,冷保存过程细胞内有大量可螯合状态铁(chelatable iron)生成,而这类铁离子超载在器官冷保存期间可通过催化Haber-Weiss反应诱导如OH-,Fe-O2等氧自由基(ROS)产物产生。这些ROS产物可引起线粒体膜通透性改变,诱发细胞凋亡,从而造成组织损伤[4,10-11]。因此,降低冷保存期间此类可螯合状态铁水平,减少ROS损害,是提高保存器官冷缺血耐受的重要途径。
DFO是一种高选择性的铁螯合剂,对游离铁离子有较强的络合能力。目前临床上,此类药物主要用于治疗急性铁中毒以及血色素沉积等疾病方面。而近年来,有研究发现DFO对缺血性损伤也明显的保护作用,比如Chan等[12]采用大鼠心肌梗塞模型发现,注射DFO的大鼠较注射生理盐水的对照组,心肌梗塞面积明显减轻,同时心肌组织内氧自由基水平也显著下降;Bernardi等[13]联合使用N-乙酰半胱氨酸和DFO也明显降低了肾缺血再灌注模型中大鼠的血清肌酐以及组织内ROS产物水平,同时肾脏组织的病理损伤也明显减轻。因此,我们考虑选用在冷保存期间添加DFO,从而螯合超载的游离铁离子,以达到进一步减轻离体肝脏冷缺血损害的目的。
我们的前期已通过细胞学试验发现,在冷保存期间添加DFO可以减少冷缺血状态下的肝细胞凋亡[4]。在本实验中,我们采用能更好模拟临床过程的动物实验,进一步证实了DFO对离体保存的肝脏供体具有积极的保护作用。同时研究还发现,在添加DFO的实验组中,肝脏组织的MDA含量也明显降低,这提示DFO的保护效能极有可能是通过络合超载铁离子,从而减少ROS产物生成而引起。同时,DFO的保护效果有剂量依赖性倾向,与低浓度组比较,高~中浓度组中,保存供肝的损伤情况明显减轻。但在高~中浓度组间,各研究指标比较无统计学差异,我们推测可能是由于DFO是水溶性铁络合剂,其对细胞膜渗透能力有限,在DFO在细胞外达到到一定浓度后,难以继续进入细胞内,从而导致胞内DFO水平不能继续增加所导致[14]。因此,在接下来的研究中,我们拟考虑选用或联合使用对细胞膜渗透能力更强的脂溶性的铁螯合剂,以进一步增强对肝细胞内游离Fe3+的络合作用,从而更好的改善肝脏组织的冷保存效果。
综上,本研究模拟临床肝脏冷保存过程,探讨了去铁胺对肝脏冷缺血损伤的保护作用及机制,该发现为继续提高肝脏的冷保存效果提供了新的思路。但本研究也发现,尽管去铁胺保护作用有剂量依赖性倾向,但是在达到一定浓度后,并不能显著增加其保护效果,因此在接下来的研究中,在选择更为适宜的铁螯合剂或是多种铁螯合剂的联合应用是我们下一步的研究方向。
1.Latchana N,Peck JR,Whitson BA,et al.Preservation solutions used during abdominal transplantation:Current status and outcomes.World J Transplant[J].2015,5(4):154-164.
2.Liu Q,Bruns H,Schultze D,et al.HTK-N,a modified HTK solution,decreases preservation injury in a model of microsteatotic rat liver transplantation[J].Langenbecks Arch Surg,2012,397(8):1323-1331.
3.Jiménez-Castro MB,Gracia-Sancho J,Peralta C.Brain death and marginal grafts in liver transplantation[J].Cell Death Dis,2015,4(6):e1777.
4.苏松,向证文,贺凯,等.铁离子螯合剂对肝细胞冷缺血再灌注损伤的保护机制研究[J].中国现代医学杂志, 2014,31(24):21-25.
5.贺凯,苏松,邹庆伟,等.大鼠“二袖套法”原位肝移植模型的手术体会[J].中国医药导报,2010,7(26):39-41.
6.Wu S,Wohlschlaeger J,de Groot H,et al.Evaluation of a modified HTK solution containing the new iron chelator LK 614 in an isolated rat liver perfusion model[J].J Invest Surg,2009,22(5):340-347.
7.Rauen U,de Groot H.Mammalian cell injury induced by hypothermia-the emerging role for reactive oxygen species [J].BiolChem,2002,383:477-488.
8.Latchana N,Peck JR,Whitson BA,et al.Preservation solutions used during abdominal transplantation:Current sta-tus and outcomes[J].World J Transplant,2015,5(4): 154-164.
9.Cameron AM,Barandiaran Cornejo JF.Organ preservation review:history of organ preservation[J].Curr Opin Organ Transplant,2015,20(2):146-151.
10.Rauen,U,de Groot,H.New insights into the cellular and molecular mechanisms of cold storage injury[J].J Investig Med,2004,52(5):299-309.
11.宋建生,夏先明.肝脏缺血再灌注损伤机制的研究进展.泸州医学院学报,2013,36(4):409-412.
12.Chan W,Taylor AJ,Ellims AH,et al.Effect of iron chelation on myocardial infarct size and oxidative stress in ST-elevation-myocardial infarction[J].Circ Cardiovasc Interv,2012,5(2):270-278.
13.Bernardi RM,Constantino L,Machado RA,et al.N-acetylcysteine and deferrioxamine protects against acute renal failure induced by ischemia/reperfusion in rats[J].Rev Bras Ter Intensiva[J].2012,24(3):219-223.
14.Radovits T,Lin LN,Zotkina J,et al.Endothelial dysfunction after long-term cold storage in HTK organ preservation solutions:effects of iron chelators and N-alphaacetyl-L-histidine[J].J Heart Lung Transplant,2008,27(2):208-216.
(2016-05-13收稿)
Desferrioxamine in HTK solution attenuates the cold ischemic injury of preserved rat liver graft
Su Song,Song Jiansheng,Luo De,Liu Jiang,He Kai,Li Bo,Xia Xiangming
Department of Hepatobiliary Surgery,the Affiliated Hospital of Southwest Medical University,Luzhou, Sichuan Province,646000,China
Objective:To investigate the effect of Desferrioxamine(DFO)on isolated rat liver graft in cold preservation.Methods:Eighty SD rats were divided into four groups,which were HTK preservation group(HTK group),25 umol/L DFO group(D25 group),50 umol/L DFO group(D50 group),and 100 umol/L DFO group(D100 group).All grafts were subjected to 24 hours cold preservation at 4℃with the aforementioned 4 solutions separately.Liver enzymes(ALT,AST,LDH),hepatic histological damage,Typan blue perfusion,apoptosis and malondialdehyde(MDA)levels were analyzed.Results:Compared with HTK group,the grafts in D50 group and D100 group showed significant lower levels of enzymes,shorter Typan blue perfusion time,lower rate of apoptosis and lower MDA levels(allP<0.05).Furthermore,compared with HTK group,the samples in D100 group showed significant lower histological damage score(P<0.05).No statistical significance of any variables was found in DFO group when compared to the HTK group.Conclusion:DFO in HTK solution attenuates the cold ischemia injury during cold preservation,which may be attributed to its anti-oxidative and anti-apoptotic effects.
Iron chelator;Liver transplantation;Organ preservation;Ischemia injury;Free radical
R657.3
A
10.3969/j.issn.1000-2669.2016.06.010
*四川省人事及社会保障厅归国留学人才择优资助项目(2010-1021);四川省科技厅科研资助项目(2014JY0068)
苏松(1978-),男,博士,副主任医师
夏先明(1961-),男,硕士,主任医师。E-mail:13882778554@163.com

