慢性间歇性低压低氧对大鼠离体肺动脉环舒张功能的影响*
李 燕,李思雪,王立轩,刘 敏,王亚萍,马慧娟
1)河北医科大学第二医院血管外科 石家庄 050017 2)河北医科大学2011级七年制临床医学班 石家庄 050017 3)河北医科大学组织胚胎学教研室 石家庄 050017 4)河北医科大学生理学教研室 石家庄 050017 5)河北省实验动物重点实验室 石家庄 050017
慢性间歇性低压低氧对大鼠离体肺动脉环舒张功能的影响*
李燕1),李思雪2),王立轩3),刘敏4),王亚萍4),马慧娟4,5)#
1)河北医科大学第二医院血管外科 石家庄 0500172)河北医科大学2011级七年制临床医学班 石家庄 0500173)河北医科大学组织胚胎学教研室 石家庄 0500174)河北医科大学生理学教研室 石家庄 0500175)河北省实验动物重点实验室 石家庄 050017
慢性间歇性低压低氧;血管舒张;eNOS;PI3K;大鼠
目的:探讨慢性间歇性低压低氧(CIHH)对大鼠离体肺动脉环舒张功能的影响及其机制。方法:成年雄性SD大鼠随机分为对照组、CIHH组、对照+阻断剂组和CIHH+阻断剂组。CIHH大鼠给予每天6 h模拟海拔5 000 m的低压低氧处理,对照置于常压常氧环境同期饲养,28 d后处死大鼠,制备肺动脉环,加阻断剂组给予终浓度为10 μmol/L MEK特异性阻断剂PD98059或PI3K阻断剂LY294002处理20 min。采用灌流实验记录乙酰胆碱诱导的肺动脉的舒张活动;应用Western blot法检测肺动脉组织中eNOS的表达水平。结果:CIHH处理可增强乙酰胆碱引起的肺动脉舒张,提高肺动脉组织中eNOS的表达(P<0.05);PD98059共孵育对CIHH的作用无影响(P>0.05),LY294002共孵育可部分阻断CIHH的作用(P<0.05)。结论:CIHH处理可能通过PI3K途径活化血管内皮eNOS,增强乙酰胆碱诱导的大鼠肺动脉舒张。
近年大量研究[1-2]显示,慢性间歇性低压低氧(chronic intermittent hypobaric hypoxia, CIHH)对机体具有多种有益作用,如:对抗心脏缺血/再灌注损伤、抗心律失常、改善冠心病患者的血脂异常等;并且可以产生神经、肝脏保护作用。CIHH具有对机体不利影响小、经济、简便、安全等优点,已被临床用作非药物性辅助治疗措施[3]。肺动脉在维持肺循环和正常心脏功能中起着至关重要的作用。肺动脉高压可以引起肺血管阻力增加,出现肺水肿和右心室肥厚,最终引起右心衰竭[4]。有研究[5]报道,CIHH具有抗高血压作用,可明显降低自发性高血压大鼠的动脉血压。研究[6-7]还证实CIHH对大鼠的基础动脉血压无影响,但可以对抗病理性动脉血压变化,并能异化压力感受性反射。血管平滑肌的舒缩活动在动脉血压的形成和维持中发挥重要作用。一氧化氮(nitric oxide,NO)是血管内皮细胞分泌的内皮衍生舒张因子,是心血管系统重要的生理性调节因子。该研究通过离体血管环灌流实验,观察CIHH 对大鼠肺动脉环舒张功能的影响,并探讨其可能的NO相关作用机制。
1 材料与方法
1.1主要试剂苯肾上腺素(phenylephrine,PE)、乙酰胆碱(acetylcholine,ACh)、PI3K阻断剂LY294002、MEK特异性阻断剂PD98059均购自美国Sigma公司。PE和ACh溶于水。LY294002、PD98059溶于DMSO。eNOS抗体、PI3K抗体购自美国Abcam公司。GAPDH抗体购自美国CST公司。
1.2实验动物及分组健康雄性SD大鼠,体重250~320 g,由河北医科大学实验动物中心提供,随机分为对照组、CIHH组、对照+阻断剂组和CIHH+阻断剂组,每组12只。CIHH大鼠置于低压氧舱,给予模拟海拔5 000 m高原(大气压为53.732 kPa,氧分压为11.172 kPa)的低压低氧处理,每天6 h,其余时间处于常氧环境。未行CIHH处理的大鼠置于常压常氧环境同期饲养。动物自由摄取食物和水。28 d后大鼠腹腔注射戊巴比妥钠(50 mg/kg)麻醉,迅速开肺,取肺动脉,置于盛有冰K-H 液的培养皿内,去除血管周围组织,将肺动脉剪成长3~4 mm的动脉环备用。K-H液成分(mmol/L):NaCl 118.0、KCl 4.7、CaCl22.5、MgSO41.2、NaHCO325.0、KH2PO41.2、葡萄糖11.0,pH 7.4。将直径约0.1 mm的不锈钢三角形环钩小心穿入上述制备的肺动脉环,置于盛有5 mL K-H液的恒温(37 ℃)浴槽内,持续通入体积分数95% O2和5%CO2的混合气体。动脉环通过不锈钢丝和细线与张力换能器连接,用BL-420E+生物机能实验系统(成都泰盟科技有限公司)记录张力,平衡20 min后,调节血管基础张力至5.8×10-3N后,加阻断剂组给予终浓度为10 μmol/L PD98059[8]或LY294002[9]处理20 min,然后进行1.3中实验。
1.3ACh诱导的离体肺动脉环舒张功能的测定上述各组大鼠肺动脉环预先给予10-6mol/L PE诱发血管环的最大收缩,后以累加给药法给予ACh(10-9~10-5mol/L),记录血管舒张曲线。以舒张幅度占最大收缩幅度的百分比表示血管舒张状态。
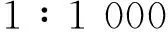
1.5统计学处理应用SPSS 16.0处理数据。采用析因设计的方差分析观察CIHH和阻断剂处理对大鼠肺动脉eNOS蛋白表达的影响,检验水准α=0.05。
2 结果
2.1CIHH和PD98059处理对离体肺动脉环舒张功能的影响结果见图1,由图1可知,CIHH可增强ACh引起的肺动脉舒张,PD98059不影响各组大鼠肺动脉的舒张效应。
2.2CIHH和PD98059处理对肺动脉组织中eNOS蛋白表达的影响结果见图2、表1。
2.3CIHH和LY294002处理对离体肺动脉环舒张功能的影响结果见图3。由图3可知,CIHH可增强ACh引起的肺动脉舒张,LY294002孵育可以阻断CIHH对肺动脉的舒张效应。
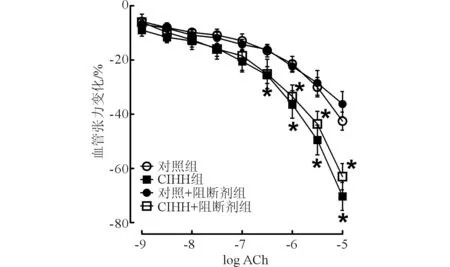
图1 CIHH和PD98059处理对离体肺动脉环舒张功能的影响

1:对照组;2:CIHH组;3:对照+阻断剂组;4:CIHH+阻断剂组。图2 CIHH和PD98059处理对肺动脉组织中eNOS蛋白表达的影响

表1 CIHH和PD98059处理对肺动脉组织中eNOS蛋白表达的影响(n=6)
FCIHH=85.056,P<0.001;FPD98059<0.001,P>0.999;F交互=0.549,P=0.467。
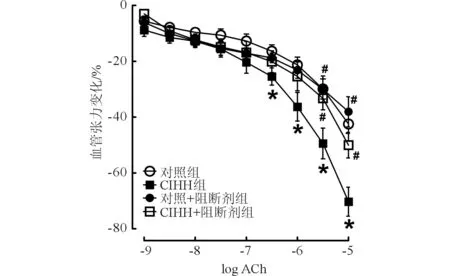
图3 CIHH和LY294002处理对离体肺动脉环舒张功能的影响
2.4CIHH和LY294002处理对肺动脉组织中eNOS表达的影响见图4、表2。

1:对照组;2:CIHH组;3:对照+阻断剂组;4:CIHH+阻断剂组。图4 CIHH和LY294002处理对肺动脉组织中eNOS表达的影响
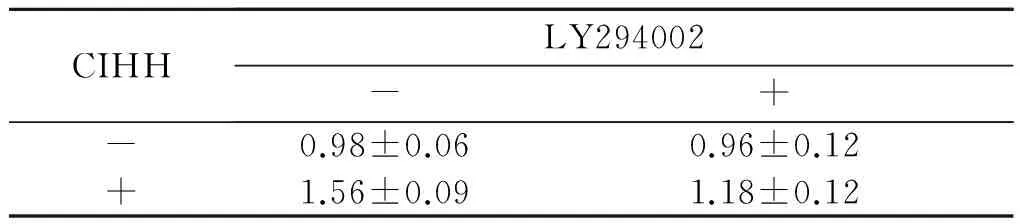
表2 CIHH和LY294002处理对肺动脉组织中eNOS表达的影响(n=6)
FCIHH=94.388,P<0.001;FLY294002=23.538,P<0.001;F交互=8.140,P<0.001。
3 讨论
CIHH对人体的有益作用逐渐引起关注,而其抗高血压作用也越来越引起人们的重视[5]。该研究结果显示,与对照组相比,CIHH组大鼠肺动脉舒张功能增强,证明CIHH可以增强ACh诱导的肺动脉的舒张功能。
NO是血管内皮细胞分泌的一种内皮衍生舒张因子,是心血管系统重要的生理性调节因子。NO可以激活血管平滑肌细胞的可溶性鸟苷酸环化酶,导致胞内cGMP水平升高,再通过经典的cGMP途径使蛋白激酶活化,进而引发血管舒张[10],降低血管张力。有研究[11]表明,eNOS可降低肺动脉高压,延缓肺动脉高压的发展和肺血管的重塑。该研究结果证实CIHH处理后,大鼠肺动脉中eNOS的表达明显增强,提示CIHH可以通过激活eNOS,提高局部组织中NO的水平,增强肺血管的舒张功能。
组织中存在不同的分子途径可以活化eNOS,如:MEK途径、PI3K途径、cAMP/PKA途径等[12]。为了进一步明确CIHH激活eNOS的分子机制,作者应用MEK特异性阻断剂PD98059孵育肺动脉,结果显示PD98059不影响CIHH的作用,提示CIHH激活的eNOS可能不依赖MEK途径。
PI3K 是一种胞内磷脂酰肌醇激酶,作为一种重要的信号酶,可以通过酪氨酸激酶受体途径和G-蛋白偶联受体途径活化Akt[13]。研究[14]显示内皮细胞中的Akt能够促进eNOS的磷酸化并增加 NO的含量,提高 NO 的活性及增加 eNOS mRNA 的稳定性。该研究结果显示,CIHH处理后,大鼠肺动脉eNOS蛋白的表达增加;PI3K特异性阻断剂LY294002孵育可以阻断CIHH的舒血管效应,并明显抑制CIHH大鼠肺动脉组织中eNOS的表达。这些结果证实了CIHH处理可通过PI3K途径增强大鼠肺动脉eNOS的表达,提高组织中NO水平,进而引起肺动脉舒张。
综上所述,该研究证实CIHH可显著增强ACh诱导的大鼠肺动脉舒张效应,该作用可能与PI3K途径激活、增加肺动脉中eNOS的表达,进而提高血管中NO的水平有关。
[1]ZHANG Y,YANG HT,ZHOU ZN.The cardioprotection of intermittent hypoxic adaptation[J].Sheng Li Xue Bao,2007,59(5):601
[2]ZHU XH,YAN HC,ZHANG J,et al.Intermittent hypoxia promotes hippocampal neurogenesis and produces antidepressant-like effects in adult rats[J].J Neurosci,2010,30(38):12653
[3]SEREBROVSKAYA TV,NOSAR VI,BRATUS LV,et al.Tissue oxygenation and mitochondrial respiration under different modes of intermittent hypoxia[J].High Alt Med Biol,2013,14(3):280
[4]胡莹,焦海霞,王瑞幸,等.三七皂苷R1对肺高压大鼠模型肺动脉的舒张作用[J].中国药理学通报,2013,29(11):1572
[5]MANUKHINA EB,SMIRIN BV,LYAMINA NP,et al.Role of nitric oxide in adaptation to hypoxia and adaptive defense[J].Physiol Res,2000,49(1):89
[6] ZHANG Y,ZHONG N,GIA J,et al.Effects of chronic intermittent hypoxia on the hemodynamics of systemic circulation in rats[J].Jpn J Physiol,2004,54(2):171
[7] XU P,CAO XB,GAO L,et al.Inhibition of carotid sinus baroreflex in neonatal rats exposed to chronic intermittent hypobaric hypoxia[J].Chin J Physiol,2014,57(6):343
[8]NING WH,ZHAO K.Propionyl-L-carnitine induces eNOS activation and nitric oxide synthesis in endothelial cells via PI3 and Akt kinases[J].Vascul Pharmacol,2013,59(3/4):76
[9]SCHMIDT K,GIBRAEIL HD,MAYER B.Lack of involvement of extracellular signal-regulated kinase (ERK) in the agonist-induced endothelial nitric oxide synthesis[J].Biochem Pharmacol,2002,63(6):1137
[10]GOULOPOULOU S,HANNAN JL,MATSUMOTO T,et al.Reduced vascular responses to soluble guanylyl cyclase but increased sensitivity to sildenafil in female rats with type 2 diabetes[J].Am J Physiol Heart Circ Physiol,2015,309(2):H297
[11]冯晓丽,朱晓波,陈欧,等.腺病毒介导eNOS转染高肺血流肺动脉高压大鼠模型的研究[J].山东大学学报(医学版),2010,48(1):70
[12] LIU H,WANG L,MA H,et al.Coumestrol inhibits carotid sinus baroreceptor activity by cAMP/PKA dependent nitric oxide release in anesthetized male rats[J].Biochem Pharmacol,2015,93(1):42
[13]WEIGERT C,BRODBECK K,KLOPFER K,et al.Angiotensin Ⅱ induces human TGF-beta 1 promoter activation: similarity to hyperglycaemia[J].Diabetologia,2002,45(6):890
[14]KIMMOUN A,LOUIS H,AL KATTANI N,et al.β1-adrenergic inhibition improves cardiac and vascular function in experimental septic shock[J].Crit Care Med,2015,43(9):e332
(2015-11-02收稿责任编辑徐春燕)
Effects of chronic intermittent hypobaric hypoxia on pulmonary vasodilatation of rats
LIYan1),LISixue2),WANGLixuan3),LIUMin4),WANGYaping4),MAHuijuan4,5)
1)DepartmentofVascularSurgery,theSecondHospital,HebeiMedicalUniversity,Shijiazhuang0500172)ClassofSeven-YearClinicalMedicineRegisteredin2011,HebeiMedicalUniversity,Shijiazhuang0500173)DepartmentofHistologyandEmbryology,HebeiMedicalUniversity,Shijiazhuang0500174)DepartmentofPhysiology,HebeiMedicalUniversity,Shijiazhuang0500175)HebeiKeyLaboratoryofExperimentalAnimal,Shijiazhuang050017
chronic intermittent hypobaric hypoxia;vasodilatation;eNOS;PI3K;rat
Aim: To investigate the effects of chronic intermittent hypobaric hypoxia(CIHH)on the vasodilatation of isolated pulmonary artery in rats and the underlying mechanism. Methods: Adult male SD rats were randomly allocated into 4 groups: control group, CIHH group, control+blocking agent group and CIHH+blocking agent group. The rats in CIHH groups were exposed to hypoxia simulating 5000 m high altitude in a hypobaric chamber for 28 d, 6 h each day. The rats in control group were maintained in a normoxic environment for a corresponding period. The rats in groups treated with blocking agent were given 10 μmol/L MEK inhibitor PD98059 or PI3K inhibitor LY294002 for 20 min.The vasodilatation of pulmonary artery was recorded by using organ bath technique. The protein expression level of eNOS in pulmonary artery tissue was measured by Western blot. Results: CIHH could remarkably augment the acetylcholine(ACh) induced vasodilatation of pulmonary artery and increase the expression of eNOS in pulmonary artery tissue(P<0.05). Incubated with PD98059 did not affect the effects of CIHH on pulmonary artery. Incubation of LY294002 blocked the effects of CIHH(P<0.05). Conclusion: The data demonstrate that CIHH treatment may enhance ACh induced vasodilatation of pulmonary artery by activating eNOS via PI3K pathway.
10.13705/j.issn.1671-6825.2016.05.008
*国家自然科学基金资助31100832;河北省自然科学基金资助C2013206183,C2013206174;国家级大学生创新实验资助项目201310089004
,女,1973年11月生,博士,副教授,研究方向:心血管生理学,E-mail:ankang006@126.com
Q463