不同糖耐量人群血清25(OH)D3水平及与胰岛β细胞功能的关系
王涛 张洁 祁范范 刘岩 庞建华 周慧敏 周亚茹
·论著·
不同糖耐量人群血清25(OH)D3水平及与胰岛β细胞功能的关系
王涛 张洁 祁范范 刘岩 庞建华 周慧敏 周亚茹
目的比较不同糖耐量人群血清25(OH)D3水平,分析其与胰岛β细胞功能的关系。方法共纳入131例受试者,包括新诊断2型糖尿病患者(T2DM组)50例,糖调节受损者(IGR组)45名和糖耐量正常者(NGT组)36名。收集临床资料并检测相关生化指标,采用酶联免疫吸附法测定空腹血清25(OH)D3水平。结果NGT组、IGR组和T2DM组血清25(OH)D3水平依次下降(F=25.984,P<0.05)。血清25(OH)D3与体重指数、腰围、臀围、腰臀比、空腹血糖、口服葡萄糖耐量试验2 h血糖(2 hPG)呈负相关(r=-0.600~-0.175,P均<0.05),与空腹胰岛素(FINS)、胰岛素曲线下面积、稳态模型评估-胰岛β细胞功能指数、早相胰岛素分泌指数(ΔINS30/ΔG30)呈直线正相关(r=0.296~0.693,P均<0.05)。多元逐步回归分析显示,2 hPG、ΔINS30/ΔG30是血清25(OH)D3水平的独立相关因素(β=0.204, -0.178,P均<0.05)。结论IGR者与T2DM患者25(OH)D3水平降低。血清25(OH)D3与胰岛素分泌功能呈正相关,与肥胖、血糖水平呈负相关。
25(OH)D3;维生素D;2型糖尿病;胰岛素分泌
传统意义上认为,维生素D的主要作用为调节钙、磷代谢和影响骨质形成。然而,近年来越来越多的研究发现,维生素D受体存在于包括免疫细胞、胰腺、甲状旁腺等多种细胞和组织中,因此,维生素D还可作用于免疫、内分泌等多系统组织。大量动物实验及人体观察结果表明,维生素D缺乏在糖尿病的发生、发展中起一定作用。已有临床研究显示,维生素D缺乏可增加2型糖尿病(T2DM)的患病率[1]。本研究通过测定不同糖耐量人群血清25(OH)D3水平,分析其流行病学特征,进一步探寻25(OH)D3与胰岛β细胞功能的相关性,以期对高危人群早期干预,延缓T2DM的发生、发展。
1 对象与方法
1.1 研究对象 选取2013年3月至2013年11月就诊于河北医科大学第三医院内分泌科、并行口服葡萄糖耐量试验(OGTT)者。最终入选131名,根据1999年WHO制定的糖尿病诊断及分型标准,将受试对象分为3组:糖耐量正常组(NGT组)36名(男18名,女18名)、糖调节受损组(IGR组)45名(男24名,女21名)、T2DM组50例(男31例,女19例)。排除标准:(1)1型糖尿病和其他特殊类型糖尿病患者。(2)糖尿病急性并发症者,如糖尿病酮症酸中毒、高血糖高渗状态。(3)严重的心、肝、肾功能不全者。(4)肿瘤及自身免疫性疾病、结缔组织病患者。(5)甲状腺、甲状旁腺功能不全者。(6)患骨质疏松、代谢性骨病、骨折者。(7)服用可能影响维生素D水平的药物者,如抗癫痫药、糖皮质激素。(8)连续3个月服用维生素D及其衍生物和钙剂者。(9)受试前1周内有阳光暴晒史者。(10)饮用咖啡、浓茶者。本研究已获得医院伦理委员会批准,受试者均签署知情同意书。
1.2 方法 (1)由专人测量身高、体重、腰围、臀围、血压,并计算体重指数及腰臀比。(2)采集空腹静脉血,检测血糖、血脂、25(OH)D3水平。(3)行75 g OGTT,于空腹、服糖半小时、1 h、2 h、3 h分别采集肘静脉血,测定各个时间段血糖及胰岛素水平。(4)应用全自动生化分析系统,酶法测定胆固醇、甘油三酯、高密度脂蛋白-胆固醇(HDL-C)、低密度脂蛋白-胆固醇(LDL-C)、脂蛋白a水平;葡萄糖氧化酶法测定血糖水平;放射免疫法测定胰岛素水平。采用近似梯形面积的方法计算胰岛素曲线下面积(AUCINS, mIU·L-1),计算稳态模型评估-胰岛素抵抗指数(HOMA-IR)、稳态模型评估-胰岛β细胞功能指数(HOMA-β)以及早相胰岛素分泌指数(ΔINS30/ΔG30)。25(OH)D3浓度测定采用酶联免疫吸附法[美国Biovendor公司人血清25(OH)D3试剂盒],操作步骤严格按照说明书进行,批内差异<9%,批间差异<15% (1 μg/L=2.5 nmol/L)。

2 结果
2.1 一般临床资料及生化指标的比较 NGT组、IGR组及T2DM组间性别、年龄、收缩压、舒张压、胆固醇、甘油三酯、LDL-C、脂蛋白a、空腹胰岛素、HOMA-IR差异无统计学意义(P均>0.05)。T2DM组体重指数、腰围、臀围、腰臀比显著高于NGT组、IGR组(P均<0.05),NGT组和IGR组之间体重指数、腰围、臀围、腰臀比无显著差异(P均>0.05)。IGR组和T2DM组的HDL-C水平明显低于NGT组(P<0.01),IGR组和T2DM组之间HDL-C水平无显著差异(P>0.05)。T2DM组空腹血糖、OGTT 2 h血糖(2 hPG)水平显著高于NGT组、IGR组,IGR组空腹血糖、2 h PG水平显著高于NGT组(P均=0.000)。T2DM组AUCINS显著低于NGT组、IGR组(P=0.000),NGT组和IGR组之间差异无统计学意义(P>0.017)。T2DM组HOMA-β显著低于NGT组和IGR组(P=0.001),NGT组和IGR组之间HOMA-β差异无统计学意义(P>0.017)。T2DM组ΔINS30/ΔG30显著低于NGT组、IGR组(P<0.017),IGR组显著低于NGT组(P<0.017),见表1。
2.2 血清25(OH)D3水平的比较 NGT组、IGR组及T2DM组血清25(OH)D3水平逐渐降低,分别为(27.92±0.79) μg/L、(24.72±0.55) μg/L、 (22.00±0.42) μg/L,差异具统计学意义(F=25.984,P<0.05)。
2.3 血清25(OH)D3水平与其他指标的相关性分析 血清25(OH)D3与体重指数、腰围、臀围、腰臀比、空腹血糖、2 hPG呈负相关(r=-0.304, -0.273, -0.246, -0.175,-0.494, -0.600,P均<0.05),与空腹胰岛素、AUCINS、HOMA-β、ΔINS30/ΔG30呈正相关(r=0.296, 0.490, 0.541, 0.693,P均<0.05)。多元逐步回归分析显示2 hPG、ΔINS30/ΔG30是血清25(OH)D3水平的独立相关因素(β=0.204, -0.178,P均<0.05),见表2。
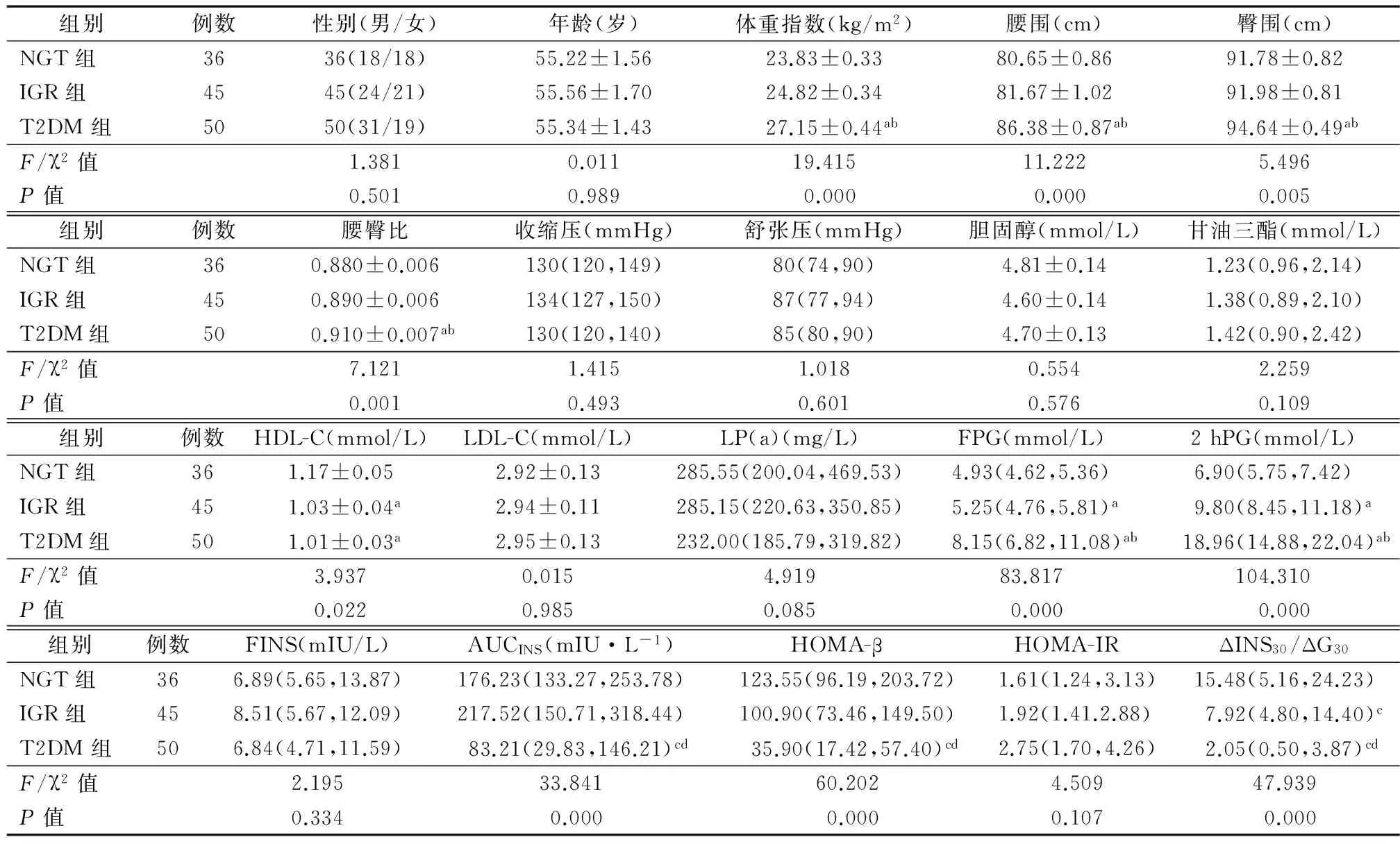
表1 3组间一般临床资料和生化指标的比较
注:NGT:糖耐量正常;IGR:糖调节受损;T2DM:2型糖尿病; HDL-C:高密度脂蛋白-胆固醇;LDL-C:低密度脂蛋白-胆固醇;LP(a):脂蛋白a;FPG:空腹血糖;2 hPG:口服葡萄糖耐量试验2 h血糖;FINS:空腹胰岛素;AUSINS:胰岛素曲线下面积;HOMA-β:稳态模型评估-β细胞功能指数;HOMA-IR:稳态模型评估-胰岛素抵抗指数;ΔINS30/ΔG30:早相胰岛素分泌指数;与NGT组相比,aP<0.05;与IGR组相比,bP<0.05;与NGT组相比,cP<0.017;与IGR组相比,dP<0.017;1 mmHg=0.133 kPa
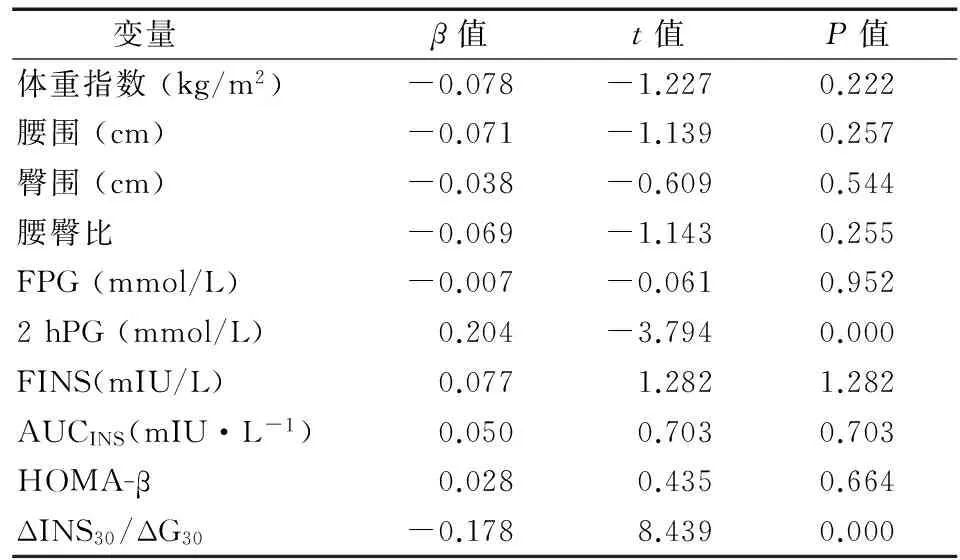
表2 血清25(OH)D3与其他指标的多元逐步回归分析
注:FPG:空腹血糖;2 hPG:口服葡萄糖耐量试验2 h血糖;FINS:空腹胰岛素;AUSINS:胰岛素曲线下面积;HOMA-β:稳态模型评估-β细胞功能指数;ΔINS30/ΔG30:早相胰岛素分泌指数
3 讨论
25(OH)D3是维生素D在血液中的主要存在形式,是评价体内维生素D水平的公认指标。目前国际上普遍认同25(OH)D3在人体内的正常水平为30 μg/L左右,维生素D不足和缺乏分别被界定为血清25(OH)D3水平在20~30 μg/L和<20 μg/L[3]。
据现有资料估计,全球约有10亿人存在维生素D缺乏或不足。欧洲大部分区域健康人群平均25(OH)D3水平低于50 nmol/L(20 μg/L)[4]。由于地区、季节和人群的不同,我国维生素D营养状况差异很大。在上海随机选取的2 588名成年人,其血清维生素D的平均水平为20.9 μg/L,有84%的男性和89%的女性存在维生素D不足和缺乏(<30 μg/L)[5]。Yin等[6]对济南地区601名成年人的调查显示,人群血清维生素D的平均水平为26.91 μg/L,其中维生素D不足(20~30 μg/L)和维生素D缺乏(<20 μg/L)者所占比例分别为37.6%和 28.6%。目前虽然尚无全国较大范围统一的维生素D水平的数据,但上述调查结果表明,我国南、北方维生素D不足的现象均较普遍。本研究中,人群血清维生素D水平均值为24.56 μg/L,NGT组、IGR组及T2DM组血清25(OH)D3水平依次下降。其中维生素D不足(20~30 μg/L)和维生素D缺乏者(<20 μg/L)分别占73.3%(96/131)和14.5%(19/131),维生素D水平正常者仅占12.2%(16/131)。
西班牙的1项前瞻性研究对1 226名受试者进行了为期4年的随访,结果显示,与维生素D≤18.5 μg/L的人群相比,血清维生素D>18.5 μg/L的人群患T2DM的风险显著降低[1]。另一项观察性研究表明,维持肥胖绝经后女性正常糖代谢的血清25(OH)D3阈值为26 μg/L,低于该水平的女性体脂含量、血糖、胰岛素及甘油三酯水平均升高[7]。提示维生素D与胰岛功能密切相关,可能预测了糖尿病的发生、发展。
研究发现,腰围大于正常个体25(OH)D3缺乏的风险是腰围正常个体的3.3倍(P=0.022),可能与25(OH)D3在脂肪中蓄积,生物利用度下降有关[8]。一项关于肥胖与25(OH)D3关系的荟萃研究发现,体重指数每升高1 kg/m2,25(OH)D3水平就随之下降1.15%(P=6.52×10-27)[9]。本研究显示,血清25(OH)D3与体重指数、腰围、臀围、腰臀比呈负相关,与上述研究结果一致。因而,控制体重有望成为改善维生素D缺乏的有效干预措施。
Talaei等[2]给予100例T2DM患者每周口服50 000 U的维生素D,共8周,其空腹血糖、空腹胰岛素及HOMA-IR均显著下降,提示补充维生素D可以改善胰岛素抵抗。维生素D改善胰岛素抵抗的机制可能有以下几方面:维生素D与靶组织上的受体结合后,通过增加靶细胞内钙离子浓度,促进胰岛素受体底物磷酸化,启动胰岛素信号转导,改善胰岛素敏感性。此外,维生素D可抑制核因子-κB的转录和翻译,减少一氧化氮在胰岛细胞中的过度表达,下调炎性反应因子白细胞介素-6、肿瘤坏死因子、干扰素-α等的表达,抑制炎性反应的发生、发展[10-11]。本研究观察到,25(OH)D3与空腹血糖呈显著正相关,与HOMA-IR无关(3组间HOMA-IR虽然有逐渐增加的趋势,但差异无统计学意义),与Talaei等[6]的研究不一致。可能的原因是,入选样本量有限,影响统计学效能。还需进一步扩大样本量进行研究。
研究发现,维生素D可增加前胰岛素mRNA水平,并通过影响胰岛β细胞钙离子依赖性肽酶,促进前胰岛素分裂,使其转换为胰岛素,增加胰岛素的合成[12]。此外,维生素D可以通过抑制巨噬细胞中toll样受体2、toll样受体4蛋白及mRNA的表达,减少细胞因子的释放,抑制炎性反应和免疫反应,抑制胰岛β细胞凋亡,保护胰岛功能[13]。本研究显示,血清25(OH)D3水平与血糖水平呈负相关,与胰岛分泌功能呈正相关。多元逐步回归分析中2 hPG、ΔINS30/ΔG30进入回归方程,提示高糖负荷后血糖水平及胰岛早相分泌功能是25(OH)D3的独立相关因素。
综上所述,在糖尿病及糖尿病前期人群中,维生素D不足/缺乏的现象普遍存在,且随着糖耐量降低,25(OH)D3水平逐渐下降。血清25(OH)D3与胰岛素分泌功能呈正相关,与肥胖、血糖水平呈负相关,25(OH)D3可能在T2DM的发生、发展中起一定作用。
[1] González-Molero I, Rojo-Martínez G, Morcillo S,et al. Vitamin D and incidence of diabetes: a prospective cohort study[J].Clin Nutr,2012,31(4):571-573. DOI: 10.1016/j.clnu.2011.12.001.
[2] Talaei A, Mohamadi M, Adgi Z. The effect of vitamin D on insulin resistance in patients with type 2 diabetes[J].Diabetol Metab Syndr,2013,5(1):8. DOI: 10.1186/1758-5996-5-8.
[3] Holick MF. Vitamin D deficiency[J].N Engl J Med,2007,357(3):266-281.
[4] Wahl DA, Cooper C, Ebeling PR,et al. A global representation of vitamin D status in healthy populations[J].Arch Osteoporos,2012,7:155-172. DOI: 10.1007/s11657-012-0093-0.
[5] Lu HK, Zhang Z, Ke YH, et al. High prevalence of vitamin D insufficiency in China: relationship with the levels of parathyroid hormone and markers of bone turnover[J].PLoS One,2012,7(11):e47264. DOI: 10.1371/journal.pone.0047264.
[6] Yin X, Sun Q, Zhang X,et al. Serum 25(OH)D is inversely associated with metabolic syndrome risk profile among urban middle-aged Chinese population[J].Nutr J,2012,11:68. DOI: 10.1186/1475-2891-11-68.
[7] Sorkin JD, Vasaitis TS, Streeten E,et al. Evidence for threshold effects of 25-hydroxyvitamin D on glucose tolerance and insulin resistance in black and white obese postmenopausal women[J].J Nutr,2014,144(5):734-742.DOI: 10.3945/jn.114.190660.
[8] Theuri G, Kiplamai F. Association between vitamin D levels and central adiposity in an eastern Africa outpatient clinical population[J].Dermatoendocrinol,2013,5(1):218-221.DOI: 10.4161/derm.24654.
[9] Vimaleswaran KS, Berry DJ, Lu C,et al. Causal relationship between obesity and vitamin D status: bi-directional Mendelian randomization analysis of multiple cohorts[J].PLoS Med,2013,10(2):e1001383. DOI: 10.1371/journal.pmed.1001383.
[10] Gysemans C, Van Etten E, Overbergh L,et al. Treatment of autoimmune diabetes recurrence in non-obese diabetic mice by mouse interferon-beta in combination with an analogue of 1alpha,25-dihydroxyvitamin-D3[J].Clin Exp Immunol,2002,128(2):213-220.
[11] Ojaimi S, Skinner NA, Strauss BJ,et al. Vitamin D deficiency impacts on expression of toll-like receptor-2 and cytokine profile: a pilot study[J].J Transl Med,2013,11:176.DOI:10.1186/1479-5876-11-176.
[12] Chiu KC, Chu A, Go VL,et al. Hypovitaminosis D is associated with insulin resistance and beta cell dysfunction[J].Am J Clin Nutr,2004,79(5):820-825.
[13] Sadeghi K, Wessner B, Laggner U,et al. Vitamin D3down-regulates monocyte TLR expression and triggers hyporesponsiveness to pathogen-associated molecular patterns[J].Eur J Immunol,2006,36(2):361-370.
Relationshipbetweenserum25(OH)D3levelandisletβcellfunctioninindividualswithdifferentglucosetolerance
WangTao*,ZhangJie,QiFanfan,LiuYan,PangJianhua,ZhouHuimin,ZhouYaru.
*DepartmentofCardiology,TheThirdHospitalofHebeiMedicalUniversity,Shijiazhuang050051,China
Correspondingauthor:ZhouYaru,Email:zhouyaru_hc@163.com
ObjectiveTo compare the level of serum 25(OH)D3in individuals with different glucose tolerance and explore the relationship between serum 25(OH)D3and islet β cell function.MethodsA total of 131 subjects including patients with newly diagnosed type 2 diabetes (T2DM group,n=50), individuals with impaired glucose regulation (IGR group,n=45) and individuals with normal glucose tolerance (NGT group,n=36) were included in this study. Clinical data and biochemical parameters were collected. Serum 25(OH)D3was measured by enzyme linked immunosorbent assay.ResultsCompared with NGT group, the levels of serum 25(OH)D3were decreased in IGR group and T2DM group. The level of serum 25(OH)D3was negatively correlated with body mass index, waist circumference, hip circumference, waist-to-hip ratio, fasting plasma glucose and oral glucose tolerance test 2 hour plasma glucose (2 hPG) (r=-0.600 to -0.175,allP<0.05), and was positively correlated with fasting insulin, insulin area under curve, homeostasis model assessment β-cell function and early phase insulin secretion (ΔINS30/G30) (r=0.296 to 0.693, allP<0.05). Multiple stepwise regression analysis showed that 2 hPG, ΔINS30/ΔG30were independent related factors of the level of serum 25(OH)D3(β=0.204, -0.178, allP<0.05).ConclusionsThe level of serum 25(OH)D3is decreased in patients with IGR and T2DM. Serum 25(OH)D3is positively correlated to insulin secretion, and negatively correlated to obesity and blood glucose.
25(OH)D3; Vitamin D; Type 2 diabetes mellitus; Insulin secretion
河北省医学适用技术跟踪项目(GL201340)
10.3760/cma.j.issn.1673-4157.2016.04.04
050051 石家庄,河北医科大学第三医院心内科(王涛),内分泌科(张洁,祁范范, 刘岩, 庞建华,
周亚茹);050051 石家庄,河北医科大学第一医院内分泌科(周慧敏)
周亚茹,Email:zhouyaru_hc@163.com
FundprogramHebei Medical Technology Program(GL201340)
2015-09-02)

